持久性有机污染物的海洋动物胚胎毒理学研究进展
2010-03-15周海龙韦双双郑继平薛钦昭
周海龙,曲 莹,董 方,苏 文,韦双双,郑继平,薛钦昭
(1.中国科学院 烟台海岸带可持续发展研究所,山东 烟台 264003;2.海南大学 农学院,海南 海口570228;3.中国科学院海洋研究所,山东青岛266071;4.中国科学院研究生院,北京100049)
持久性有机污染物(persistent organic pollutants,POPs)是指具有高毒性、持久性、生物蓄积性、半挥发性及长距离迁移性等特性的天然或人工合成的有机污染物[1]。它可通过空气、水、土壤、食物链进行广泛传播,甚至能经母乳传递给婴儿[2]。无论是在空气、水体、土壤、生物体中,还是在南极、北极都发现了 POPs的存在[3]。大量研究表明 POPs在食物链传递过程中具有生物富集和生物放大效应[4],已严重威胁人类健康,例如:POPs对人的脑[5]、听力[6],免疫[7]、生殖[8]、神经[9]等系统均有损害作用,POPs引发的环境污染问题已引起国际社会广泛关注。
就海洋环境而言,POPs可通过河流、陆源、污染排放、溢油及大气沉降等途径进入海洋,导致海洋生态系统日趋恶化。POPs可直接对海洋动物胚胎产生急性或慢性毒理效应,特别是低等海洋动物,早期胚胎以浮游形式直接暴露于海洋环境,易受环境污染的影响。这对海洋动物种群繁衍、群落结构以及海洋生态系统等产生重要影响。胚胎期是海洋动物整个生命周期中对POPs最敏感、最脆弱的一个时期,故研究POPs对海洋动物的胚胎毒理不仅为揭示POPs在海洋动物体中的生物富集和毒理机理具有重要的理论意义,而且在海洋动物保护和繁育以及海洋生态环境恢复等领域具有重要的指导价值。本工作将对 POPs在海洋动物胚胎中的分布、毒理效应和分子毒理响应机制等方面进行综述和探讨,为揭示POPs生态毒理效应和海洋生态系统健康评价提供一定的科学依据。
1 POPs在海洋动物胚胎中的分布
POPs属于亲脂疏水性物质,在生物体内难降解,并呈现出生物富集和沿食物链生物放大效应,其含量在机体组织内的分布与脂肪含量呈正相关[10]。中国学者对国内几种主要的贝类和鱼类[10~13]研究表明,贝类体内总多氯联苯(Polychlorinated biphenyls,PCBs)、六六六(hexachlorocyclohexane,HCH)、滴滴涕(dichlorodiphenyltrichloroethane,DDT)质量(湿质量)比分别为:0.04~11.6 ng/g,5.70~30.2 ng/g,0.70~22.60 ng/g;鱼体内 PCBs质量(湿质量)比为:1.25~16.4 ng/g。贝类和鱼类POPs含量均低于海产品安全限量,其食用价值尚未受到影响。
POPs在海洋动物胚胎中同样存在富集作用,且存在时空性。Mäenpä ä等[14]利用五氯苯酚(pentachlorophenol,PCP,0.051~0.056μmol/L)对鲑鱼受精卵的生物富集试验表明,PCP在鲑鱼胚胎内的分布和代谢与胚胎发育阶段具有密切联系。胚胎发育晚期比早期多富集量多,这可能与胚胎发育晚期呼吸频率和代谢活动的加强有关。Broyles等[15]利用 2,3,4,5-四氯联苯醚 (2,5,2′,5′-tetrachlorobiphenyl,TCB,500μg/L)对湖鳟进行暴露实验。结果表明,当在胚胎期进行暴露时,鲑鱼卵黄囊富集TCB的能力最强;但当胚胎发育到卵黄囊仔鱼阶段才进行暴露时,结果发现70%的 TCB分布在机体组织中,而不在卵黄中,这说明 TCB在组织中的分布还与暴露的时期有关。Broyles等[16]利用2,4,5,2′,4′,5′-六氯联苯(2,4,5,2′,4′,5′-hexachlorobiphenyl,HCB)对湖鳟卵黄囊仔鱼进行暴露试验,暴露3个月后,一部分 HCB从仔鱼体内消失。在第3个月时,大量的HCB分布于消化器官。总之,POPs在海洋动物胚胎中的分布与胚胎发育阶段和胚胎暴露的时间,以及各组织器官(可能与脂肪含量有关)等因素有关,其分布规律有待进一步研究。
另外,POPs物质在海洋动物体内的分解代谢是一个非常复杂的过程,受多种因素的影响,包括动物的种类,POPs物质的类型,代谢途径等。目前,科学家们虽已对 POPs的降解进行了大量的探索,但还没找到一种理想的POPs降解办法。值得注意的是海洋多毛类动物(如沙蚕)对多环芳烃(polycyclic aromatic hydrocarbons,PAHs)等 POPs物质具有很强的富集能力,Jørgensen等[17]报道,它们不含有芳香烃受体(aryl hydrocarbon receptor,AHR)同源物,说明它们对POPs物质的代谢存在不同的机制;对这一机制开展深入研究,或许是人类攻克 POPs污染问题的一个新突破口。
2 POPs的胚胎毒性
海洋动物胚胎多数在海水中生长发育,且对POPs物质非常敏感[18]。目前,主要就2,3,7,8-四氯二苯并二恶英(2,3,7,8-Tetrachlorodibenzo-pdioxin,TCDD)、DDT、PCB、苯并[a]芘 (Benzo[a]pyrene,B[a]P)、PAHs等POPs物质对斑马鱼、贻贝等模式动物的胚胎发育毒性进行了大量的研究,主要体现在胚胎形态及其心血管系统毒性作用等方面。虽然这些研究主要是针对少数模式动物,但对海洋动物胚胎毒理的研究仍具有重要的指导意义。
2.1 对胚胎形态的毒性作用
POPs对胚胎形态具有严重的损害作用,主要表现为胚胎水肿、出血、局部贫血和生长发育延缓,心血管发育和功能受损,颌畸形、死亡等现象[19];另外,Teraoka等[20]报道,TCDD对斑马鱼(Danio rerio)胚胎下颌软骨的生长发育也有影响。Antkiewicz等[21]报道将斑马鱼胚胎暴露于 TCDD,通过三维立体测量发现:受精后72 h(hours post-fertilization,hpf)心脏组织体积显著减小,特别是在受精后48 h时,心脏细胞总数量显著减少,这说明心脏是 TCDD作用的一个重要靶器官。Kammann[22]和 Helder等[23]进一步研究发现,TCDD的胚胎毒性还存在着明显的剂量效应关系,低质量浓度(0.1 ng/L)时导致生长延缓,进一步影响早期生长发育;高质量浓度(10 ng/L)时导致水肿甚至死亡。
另外,就胚胎毒性敏感性而言,不同的海洋动物之间也不同,十足类动物对杀虫剂的毒性比海胆,海鞘更为敏感[24],真鲷(Pagrosomus major)对 TCDD最为敏感[25]。值得注意的是,滴滴伊(DDE)393 mmol/L,苯并[a]芘(B[a]P)13.2 mmol/L对两栖类动物爪蟾的胚胎毒性不大,此浓度下其死亡率<10%,研究表明,这与它们的溶解度有关[26],而与TCDD被胚胎快速清除没有关系[27]。导致胚胎毒性敏感性差异的原因,目前尚不清楚。
2.2 对心血管系统的毒性作用
心血管系统是胚胎发育毒性的第一个靶器官[28],心血管毒性除了与POPs的种类、剂量水平等因素有关外,还与海洋动物自身的物种、性别、发育阶段等因素密切相关,呈现一种非线性关系[13]。Lema等[29]用多溴二苯醚47(Polybrominated diphenyl ethers,PBDEs 47)对斑马鱼胚胎进行毒性试验发现:受精后20 h左右,会产生发育毒性;48 h,导致心肌细胞数减少,心脏体积变小,同时还会出现胚胎浮肿、出血等次级效应;96 h,发现心动过速,这由于房室传导阻滞导致心率失常,说明胚胎不同发育阶段其胚胎毒性作用不同。另外,Handley-Goldstone等[30]进一步研究表明,细胞色素氧化酶 P4501A(Cytochrome p450 1A,CYP1A),细胞色素氧化酶P4501B(Cytochrome p450 1B,CYP1B)及其它AHR通道基因也参与了 TCDD的毒理调控过程,通过改变肌钙蛋白 T2和各种肌球蛋白的表达,从而导致扩张型心肌病。同时,脂肪酸和类固醇类物质代谢酶,核糖体和信号转导蛋白均参与了 TCDD的胚胎期心血管毒性作用。
3 胚胎毒理机制的探索
胚胎毒理主要是由AHR通道基因及其相关信号通道相互协同作用调控的,其中AHR通道对于POPs的胚胎毒理调控具有重要作用。
3.1 A HR通道
对鲑鱼[31]、大西洋鲑[32]、海豹[33]等多种海洋动物A HR基因结构和基本功能的研究表明,TCDD、HAH(halogenated aromatic hydrocarbons)、PAH等POPs毒性效应大都通过 AHR通道进行调节[34~36]。
在AHR调控通路过程中,A HR主要对CYP1和CYP2进行调控;其中CYP1A是一种外源性代谢酶,它往往被POPs所诱导。当 TCDD、PA H等物质进入细胞质后与AHR结合,然后A HR从热休克蛋白90(heat shock protein 90,Hsp90)[37],X相关蛋白2(X-associated protein 2,XAP2)[38]和 23-ku的共伴侣分子(23-ku co-chaperone protein,p23)[39]组成的复合物解离,从细胞质转移到细胞核中,与芳香烃受体核转位蛋白(AHR nuclear translocator protein,ARN T)结合形成AHR/ARNT异二聚体,最后作用于CYP1A等靶基因的异物应答元件(xenobiotic response elements,XREs)序列,从而诱导靶基因的表达。同时,芳香烃受体抑制子(Aryl Hydrocarbon Receptor Repressor,AHRR)具有抑制A HR功能活性的作用,从而二者形成一个调控反馈回路[40](图1)。虽然 TCDD诱导异物代谢酶(xenobiotic metabolizing enzymes,XMEs)的机理研究已很清楚,但像畸胎发生,免疫抑制等生物学效应A HR是如何参与调控的有待进一步研究。可以肯定 TCDD的毒性作用是通过AHR通道激活靶基因所致[40]。
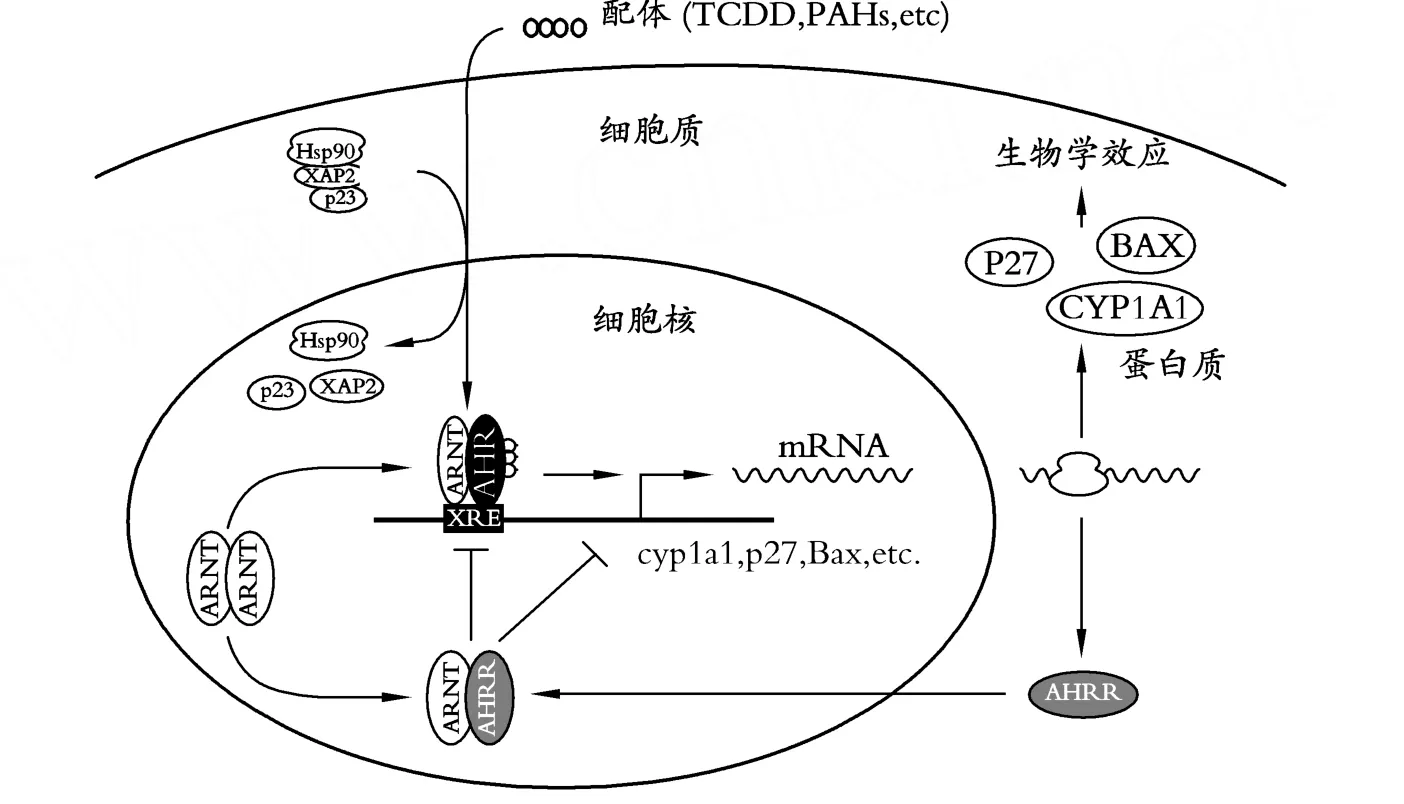
图1 AHR通道的调控机制[40]
3.2 AHR对胚胎毒性的调控作用
A HR通道是海洋动物胚胎对 POPs物质毒性调控的一个重要通道,且不同基因型其作用大小不同。Carney等[41]对斑马鱼进行研究发现它具有AHR1(zebrafish aryl hydrocarbon receptor 1)和AHR2(zebrafish aryl hydrocarbon receptor 2)两个基因,其中,zfAHR2具有转录活性,在调节 TCDD的胚胎毒性的过程中发挥主要作用,而zfAHR1不具有调节功能。如果被TCDD过度激活表达则会导致心脏形态和功能的改变,甚至死亡。另外,Yamauchi等[25]利用 TCDD对真鲷胚胎毒性试验发现:rsAHR2(red seabream AHR2)mRNA表达的水平与 TCDD存在剂量效应关系,且rsAHR2和CYP1A mRNA间存在显著正相关;而 rsAHR1(red seabream A HR1)的表达不受影响,rsAHR1和CYP1A间也没有这种关系。故可以看出,AHR2在海洋动物胚胎毒性调控过程中发挥重要作用,而AHR1的作用相对较小。Carney等[42]进一步研究发现,斑马鱼胚胎毒性主要由zfARNT1(zebra fish aryl hydrocarbon receptor nuclear translocator 1)和zfA HR2进行调节,而zfAHR1和zfARN T2不具有调节功能,并且胚胎毒性不是通过zfCYP1A基因表达的增加来调节的。
另外,据 Mimura等[40]报道,AHRR基因通过与ARNT形成异二聚体体与XREs作用,从而竞争性抑制AHR基因的活性。但是,最近 Evans等[43]发现,虽然AHRR与靶基因异物应答元件会有助于抑制AHR的功能;但不是通过与ARNT结合或与XREs结合来抑制AHR基因功能,这里可能存在另外一种作用机制来反转抑制(transrepression)AHR的功能,即通过蛋白与蛋白相互作用的方式来进行抑制AHR基因的功能。究竟是通过何种机理抑制的,这可借助于吗啉寡聚核苷酸(morpholino oligonucleotides)等基因敲除技术来进一步探索AHRR在胚胎毒理过程中的作用。那么胚胎又是如何应对来自POPs物质的毒害作用呢?Welker等[44]研究表明,细胞色素 P4501A(CYP1A)和血红素加氧酶1(hmox1)基因产物在胚胎发育过程中对于抵抗这类外源毒性物质的毒性具有重要作用。
综上可知,A HR通道在海洋动物胚胎毒性调控过程中发挥着重要作用,但不同基因型在胚胎毒理调控过程中具有不同的作用,在海洋动物胚胎中AHR和ARNT分别由AHR2和ARNT1基因型来进行调控,而A HRR哪种基因型的作用更大以及其它动物是否遵循相同的胚胎毒理调控机理目前还不清楚,有待更进一步的研究。
3.3 毒性的协同作用
POPs的毒理调控是一个非常复杂的过程,除了与海洋动物种类,POPs物质种类,作用的时空性有关外,AHR受体还可与雌激素受体、低氧诱导受体、核因子B以及视网膜母细胞瘤蛋白等信号通道相互作用[45];进而改变细胞增殖,细胞周期阻滞或细胞凋亡的方向[46],最后表现特定的胚胎毒理效应。Ramakrishnan等[47]利用双酚-A对青鳉胚胎暴露24 h,发现胚胎发育,孵化和成熟时间提前,这是由于双酚-A通过甲状腺激素通道改变了胚胎全局发育进程。当暴露24~96 h时,发现CYP1A活性的抑制导致代谢的改变或增加A HR激动剂的半衰期,从而增强AHR的活性,揭示出AHR与甲状腺激素通道间存在协同作用。另外,Timme-Laragy等[48]利用PAHs同系物对斑马鱼胚胎作用,发现 PAHs同系物同时作用增加了胚胎毒性作用。综上可知,在海洋动物胚胎POPs毒理调控过程中,不仅AHR受体与其它信号通道之间存在相互作用,而且 POPs同系物之间还存在协同作用。
4 展望
目前,POPs对海洋动物胚胎毒理的研究,主要集中在胚胎形态毒性,以及相关酶类的生理生化方面,其胚胎毒理机制研究较少。分子机理研究主要利用受到POPs污染的污水、沉积物和有害气体这一类复合物作为研究对象;且集中于A HR通道的单个或少数几个基因。实际上,POPs胚胎毒性作用会影响一系列相关毒理基因的表达,从而产生胚胎毒性作用,最终表现出胚胎畸形或死亡。究竟哪些基因参与这一表达调控过程,以及它们相互之间的时空表达关系又是如何作用的,这一系列问题可望随着分子生物学和分子生物技术的发展而不断得到解决。
另外,中国海产品由于 POPs物质含量超标导致出口创汇受阻时有发生,解决这一问题的关键在于要对海水水质进行早期的有效监控,这一问题需要从源头抓起,而海洋动物(如贻贝)胚胎是一种非常灵敏有效的环境污染生物指示物,将其用来监测海水水质具有独特的优势(胚胎量大,易获取,检测周期短,灵敏有效,且不受伦理观念约束等)。同时,它还可用于毒性物质的筛选以及药物的临床前筛选研究。已有研究表明,用牡蛎胚胎对废水或海水进行毒性遗传分析,是一种评价海洋环境风险的有效方法[49]。这些应用都离不开胚胎毒理机制的研究,故持久性有机污染物对海洋动物胚胎毒理的研究具有重要意义。
[1]David O.什么是持久性有机物染物?[A].持久性有机污染物控制研讨会论文集 [C].北京:国家环保局,2001.9.
[2]Swain W R.Human health consequences of consumption of fish contaminated with organochlorine compounds[J].Aquatic Toxicology,1988,11(3-4):357-377.
[3]李霜,李朝林,吴维皑.多氯联苯与人体健康 [J].中华劳动卫生职业病杂志,2005,23(4):316-319.
[4]朱才众,熊鸿燕.环境持久性毒物研究进展概述 [J].疾病控制杂志,2005,9(4):331-335.
[5]Kimura-Kuroda J,Nagata I,Kuroda Y.Disrupting effects of hydroxy-polychlorinated biphenyl(PCB)congeners on neuronal development of cerebellar Purkinje cells:A possible causal factor for developmental brain disorders?[J].Chemosphere,2007,67(9):412-420.
[6]Herr D W,Goldey S E,Crofton K M.Developmental exposure to aroclor 1254 produces low-frequency alterations in adult rat brainstem auditory evoked responses[J].Fundamental and Applied Toxicology,1996,33(1):120-128.
[7]Davila D R,Davs D P,Campbell K.Role of alterations in Ca2+-associated signaling pathways in the immunotoxicity of polycyclic aromatic-hydrocarbons[J].Journal of Toxicology and Environmental Health,1995,45(2):101-126.
[8]Den Besten P J,Herwig H J,Smaal A C,et al.Interference of polychlorinated biphenyls(Clophen A50)with gametogenesis in the sea star,Asterias rubensL.[J].Aquatic Toxicology,1990,18(4):231-246.
[9]Kodavanti P R S.Neurotoxicity of persistent organic pollutants:possible mode(S)of action and further considerations[J].Dose-Response,2005,3(3):273-305.
[10]甘居利,贾晓平,李纯厚,等.南海北部陆架区3种鱼类多氯联苯含量分布特征 [J].热带海洋学报,2007,26(2):69-73.
[11]刘仁沿,吴世培,王斌.长江口以北沿海主要经济贝类中有机氯农药和多氯联苯的分布及评价 [J].海洋环境科学,1996,3:29-35.
[12]杨永亮,潘静,李悦,等.青岛近海沉积物PCBs的水平与垂直分布及贝类污染 [J].中国环境科学,2003,23(5):515-520.
[13]Yang R Q,Yao Z W,Jiang G B,et al.HCH and DDT residues in molluscs from Chinese Bohai coastal sites[J].Marine Pollution Bulletin,2004,48(7,8):795-799.
[14]Mäenpä äK A,Penttinen O P,Kukkonen J V K.Pentachlorophenol(PCP)bioaccumulation and effect on heat production on salmon eggs at different stages of development[J].Aquatic T oxicology,2004,68(1):75-85.
[15]Broyles R H,Noveck M I.Uptake and distribution of 2,5,2′,5′-tetrachlorobiphenyl in developing lake trout[J].Toxicology and Applied Pharmacology,1979,50(2):291-298.
[16]Broyles R H,Noveck M I.Uptake and distribution of 2,4,5,2′,4′,5′-hexachlorobiphenyl in fry of lake trout and Chinook salmon and its effects on viability[J].Toxicology and Applied Pharmacology,1979,50(2):299-308.
[17]Jørgensen A,Giessing A M B,Rasmussen L J,et al.Biotransformation of polycyclic aromatic hydrocarbons in marine polychaetes[J].Marine Environmental Research,2008,65(2):171-186.
[18]Lange M,Gebauer W,Markl J,et al.Comparison of testing acute toxicity on embryo of zebrafish,Brachydanio rerio and RTG-2 cytotoxicity as possible alternatives to the acute fish test[J].Chemosphere,1995,30(11):2 087-2 102.
[19]Goldstone H M H,Stegeman J J.Molecular mechanisms of 2,3,7,8-tetrachlorodibenzo-p-dioxin cardiovascular embryotoxicity[J].Drug Metabolism Reviews,2006,38(1,2):261-289.
[20]Teraoka H,Dong W,Ogawa S,et al.2,3,7,8-tetrachlorodibenzo-p-dioxin toxicity in the zebrafish embryo:Altered regional blood flow and impaired lower jaw development[J].Toxicological Sciences,2002,65(2):192-199.
[21]Antkiewicz D S,Burns C G,Carney S A,et al.Heart malformation is an early response to TCDD in embryonic zebrafish[J].Toxicological Sciences,2005,84(2):368-377.
[22]Kammann U,Vobach M,Wosniok W.Toxic effects of brominated indoles and phenols on zebrafish embryos[J].Archives of Environmental Contamination and Toxicology,2006,51(1):97-102.
[23]Helder T.Effects of 2,3,7,8-tetrachlorodibenzodioxin(TCDD)on early life stages of rainbow trout(Salmo gairdneriRichardson)[J].Toxicology,1981,19(2):101-112.
[24]Bellas J,Beiras R,Marińo-Balsa J C,et al.Toxicity of organic compounds to marine invertebrate embryos and larvae:A comparison between the sea urchin embryogenesis bioassay and alternative test species[J].Ecotoxicology,2005,14(3):337-353.
[25]Yamauchi M,Kim E Y,Iwata H,et al.Toxic effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)in developing red seabream(Pagrus major)embryo:An association of morphological deformities with AHR1,AHR2 and CYP1A expressions[J].Aquatic Toxicology,2006,80(2):166-179.
[26]Saka M.Developmental toxicity of p,p′-dichlorodiphenyltrichloroethane,2,4,6-trinitrotoluene,their metabolites,and benzo[a]pyrene in xenopus laevis embryos[J].Environmental Toxicology and Chemistry,2004,23(4):1 065-1 073.
[27]Philips B H,Susman T C,Powell W H.Developmental differences in elimination of 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)during Xenopus laevis development[J].Marine Environmental Research,2006,62:34-37.
[28]Andreasen E A,Spitsbergen J M,Tanguay R L,et al.Tissue-specific expression of AHR2,ARNT2,and CYP1A in zebrafish embryos and larvae:Effects of developmental stage and 2,3,7,8-tetrachlorodibenzo-p-dioxin exposure[J].Soc Toxicology,2002,68(2):403-419.
[29]Lema S C,Schultz I R,Scholz N L,et al.Neural defects and cardiac arrhythmia in fish larvae following embryonic exposure to 2,2′,4,4′-tetrabromodiphenyl ether(PBDE 47)[J].Aquatic Toxicology,2007,82(4):296-307.
[30]Handley-Goldstone H M,Grow M W,Stegeman J J.Cardiovascular gene expression profiles of dioxin exposure in zebrafish embryos[J].Toxicological Sciences,2005,85(1):683-693.
[31]Hansson M C,Wittzell H,Persson K,et al.Characterization of two distinct aryl hydrocarbon receptor(AhR2)genes in Atlantic salmon(Salmo salar)and evidence for multiple AhR2 gene lineages in salmonid fish[J].G ene,2003,303:197-206.
[32]Hansson M C,Wittzell H,Persson K,et al.Unprecedented genomic diversity of AhR1 and AhR2 genes in Atlantic salmon(Salmo salarL.)[J].Aquatic Toxicology,2004,68(3):219-232.
[33]Kim E Y,Hahn M E.cDNA cloning and characterization of an aryl hydrocarbon receptor from the harbor seal(Phoca vitulina):a biomarker of dioxin susceptibility?[J].Aquatic Toxicology,2002,58(1-2):57-73.
[34]Billiard S M,Timme-Laragy A R,Wassenberg D M,et al.The role of the aryl hydrocarbon receptor pathway in mediating synergistic developmental toxicity of polycyclic aromatic hydrocarbons to zebrafish[J].Toxicological Sciences,2006,92(2):526-536.
[35]Hahn M E.The aryl hydrocarbon receptor:A com-parative perspective[J].Comparative Biochemistry and Physiology Part C:Pharmacology,Toxicology and Endocrinology,1998,121(1-3):23-53.
[36]Mandal P K.Dioxin:a review of its environmental effects and its aryl hydrocarbon receptor biology[J].Journal ofComparative Physiology B:Biochemical,Systemic,and Environmental Physiology,2005,175(4):221-230.
[37]Perdew G H.Association of the Ah receptor with the 90-kDa heat shock protein[J].Journal of Biological Chemistry,1988.263(27):13 802-13 805.
[38]Carver L A,Bradfield C A.Ligand-dependent Interaction of the aryl hydrocarbon receptor with a novel immunophilin homolog in Vivo[J].Journal of Biological Chemistry,1997,272(17):11 452-11 456.
[39]Kazlauskas A,Poellinger L,Pongratz I.Evidence that the Co-chaperone p23 regulates ligand responsiveness of the dioxin(aryl hydrocarbon)receptor[J].Journal ofBiological Chemistry,1999,274(19):13 519-13 524.
[40]Mimura J,Fujii-Kuriyama Y.Functional role of AhR in the expression of toxic effects by TCDD[J].Biochimica et Biophysica Acta(BBA)-G eneral Subjects,2003,1 619(3):263-268.
[41]Carney S A,Chen J,Burns C G,et al.Aryl hydrocarbon receptor activation produces heart-specific transcriptional and toxic responses in developing zebrafish[J].Molecular Pharmacology,2006,70(2):549-561.
[42]Carney S A,Prasch A L,Heideman W,et al.Understanding dioxin developmental toxicity using the zebrafish model[J].Birth Defects Research Part a-Clinical and Molecular Teratology,2006,76(1):7-18.
[43]Evans B R,Karchner S I,Allan L L,et al.Repression of aryl hydrocarbon receptor(AHR)signaling by AHR repressor:Role of DNA binding and competition for AHR nuclear translocator[J].Mol Pharmacol,2008,73(2):387-398.
[44]Welker D,Stetefeld N,Schirmer K,et al.The role of cyp1a and heme oxygenase 1 gene expression for the toxicity of 3,4-dichloroaniline in zebrafish(Danio rerio)embryos[J].Aquatic Toxicology,2008,86(1):112-120.
[45]Carlson D B,Perdew G H.A dynamic role for the Ah receptor in cell signaling[J].J Biochem Mol Toxicol,2002,16:317-325.
[46]Marlowe J L,Puga A.Aryl hydrocarbon receptor,cell cycle regulation,toxicity and tumorigenesis[J].J Cell Biochem,2005,96:1 174-1 184.
[47]Ramakrishnan S,Wayne N L.Impact of bisphenol-A on early embryonic development and reproductive maturation[J].Reproductive Toxicology,2008,25(2):177-183.
[48]Timme-Laragy A R,Cockman C J,Matson C W,et al.Synergistic induction of AHR regulated genes in developmental toxicity from co-exposure to two model PAHs in zebrafish[J].Aquatic Toxicology,2007,85(4):241-250.
[49]Wessel N,Rousseau S,Caisey X,et al.Investigating the relationship between embryotoxic and genotoxic effects of benzo[alpha]pyrene,17 alpha-ethinylestradiol and endosulfan onCrassostrea gigasembryos[J].Aquatic Toxicology,2007,85(2):133-142.
