红球藻藻株对光强适应及在工程培养中的应用
2010-03-14韩春梅刘建国
韩春梅,刘建国 ,张 勇
(1.大连工业大学,辽宁大连 116034; 2.中国科学院 海洋研究所,山东青岛 266071; 3.云南爱尔发生物技术有限公司,云南楚雄 675000)
虾青素具有多种生物活性,尤其具有极高的抗氧化性,其还原能力是类胡萝卜素的10倍、维生素E的100~550倍[1],在医药、保健、化妆品、食品以及饲料添加剂等方面都有广泛的应用前景[2]。雨生红球藻能积累其干质量1%以上的虾青素,是目前已知虾青素含量最高的生物来源,被认为是天然虾青素的浓缩品[3],其虾青素构型以 3S,3′S为主[4],与动物体内需求的虾青素构型基本一致,生物吸收效果较好。因此,培养红球藻生产虾青素是国际上藻类学当前研究与开发关注热点。
虽然雨生红球藻研究已日臻完善且已经开展规模化生产,但国外只有美国夏威夷 Aquasearch Inc.,Cyanotech Corporation Hawaii,Micro Gaia Inc.Hawaii和瑞典AstaCarotene AB等少数公司从事红球藻天然虾青素批量生产,远不能满足市场对天然虾青素需求。国内实验室研究相对成熟,规模化生产正在起步。众所周知,室内实验研究与实际生产存在很大差异,前者多侧重阐述科学技术问题,实验规模很小,培养条件比较容易控制,产业化规模通常较大,光照和温度等关键培养条件难于经济而有效地控制,故需要因地制宜筛选适宜于当地自然环境变化的藻株。作者结合云南爱尔发公司具体情况,选取3株分别原产中国、瑞典和挪威的红球藻,针对云南楚雄地区光温季节性变化开展了相关研究,目的提供筛选适宜于规模化生产的红球藻藻株的基础数据,促进该产业在中国发展。
1 材料与方法
1.1 实验藻种和培养基
雨生红球藻(Haematococcus pluvialis)藻株共 3株,分别编号为H0、H2、H3,全部来自中国科学院海洋研究所藻类与藻类生物技术实验室。
培养基为MCM的修正配方[5]。
1.2 培养条件方法
将雨生红球藻接种到5 L的三角烧瓶中,在温室车间通气培养,按照2.50 L/min气量通入0.55% CO2加富空气,补充 CO2消耗和搅拌藻液,以自然漫散光为光源,光照时间随季节变化,光照强度随入射光线角度不同而出现变化,光强相当于直射光能的30%~55%。实验场地位于北纬25.0°、东经101.5°,海拔1 900 m,根据楚雄当地气象部门统计其主要气候资料如表1所示,年均气温为15 ℃±2 ℃。
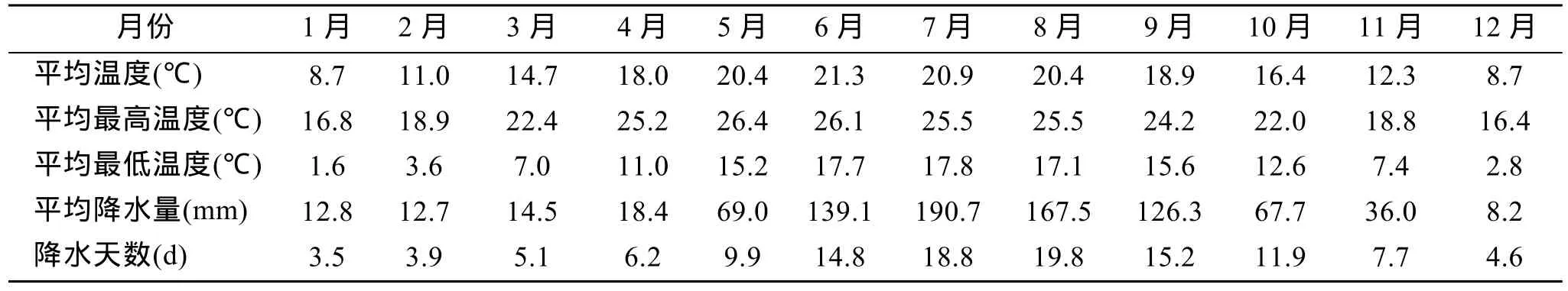
表1 实验地区云南楚雄的基础气象资料(30年平均)Tab.1 The meteorologic data of Chuxiong,Yunnan during 1971~2000
1.3 细胞数量、细胞大小和比生长速率的计算
在培养期间定时取样,用血球计数板显微计数。每一处理至少 2 个样本,每个样本重复显微计数20 次,以平均值±标准差表示。细胞大小利用测微尺测定,每个样本测定20次,取平均值±标准差表示。
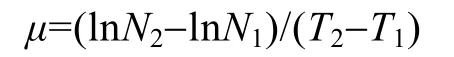
其中,μ为比生长速率,N2是时间T2时的细胞密度,N1是时间T1时的细胞密度。
1.4 叶绿素和虾青素含量的测定
取一定体积藻液于离心管中,离心后弃上清液,藻渣中加入100%的丙酮研磨。再次离心,将上层色素溶液转移到容量瓶中,藻渣按上述方法重新萃取,直到藻体成白色为止,色素溶液汇合并定容。采用722S 型分光光度计和 1 cm 光径的比色杯,分别测定 480、645、663 nm 波长下色素提取液的光吸收值(A值)。依据 Lichtenthaler[6]和 Davies[7]的方法计算虾青素质量浓度,公式如下:

1.5 叶绿素连续荧光动力学测定
细胞生长主要发生在游动细胞阶段,而虾青素积累是在不动细胞阶段进行的,细胞转化是游动细胞向不动细胞转化和虾青素累积的关键转变点,观察不同类型藻株在细胞转化过程中的光化学特性与光能分配差异,可以很好地解释为什么不同藻株对不同环境条件变化的适应存在差异。为此,选择绿色游动细胞、刚进行细胞转化还未积累虾青素的绿色不动细胞、以及已经积累虾青素的红色不动细胞进行了对比实验。
分别取不同株系不同发育阶段(绿色游动细胞、绿色不动细胞和红色不动细胞)红球藻藻液 2 mL于测量瓶中,以灭菌培养液为对照,黑布遮光黑暗适应15 min。然后利用英国Hansatech公司Handy Pea便携式植物效率分析仪,以650 nm波长红光为光源,按照预先设计的程序测定活藻体连续激发荧光的动力学曲线,共测定 16个光照点,每点光照持续时间2 s,闪烁光强梯度依次为10、20、30、40、50、75、100、150、200、300、400、500、750、1000、1500、2000 μmol /(m2·s),每点光照之间黑暗10 s,每株红球藻样品处理重复 3次,记录从微秒-毫秒到秒级荧光强度变化,得到OJIP曲线[8,9]。
依Biolyzer软件对OJIP曲线进行数据分析获得红球藻株系的相关光合反应参数。其中:Fm为所有反应中心完全关闭时的荧光,即暗适应后最大荧光强度; PSⅡ最大光化学效率代表可变荧光强度与最大荧光强度的比率;Vj反映了照光2 ms时有活性的反应中心PSⅡ的关闭程度;Vi代表照光30 ms时有活性的反应中心 PSⅡ的关闭程度;T=0时,电子传递量子产额以ET0/ABS表示; ABS/RC代表单位反应中心PSⅡ吸收的光能; TR0/RC代表T0时单位反应中心PSⅡ捕获的用于还原QA的能量; ET0/RC为T0时单位反应中心捕获的用于电子传递的能量; DIo/RC指在T0时单位反应中心耗散掉的能量; DI/ABS为热耗散能量占吸收能量的比率; PI(abs)为T0时以吸收光能为基础的性能指数[10]。

表2 不同雨生红球藻藻株细胞生长的年际变化Tab.2 Year-round changes in cell growth of different strains of H.pluvialis
2 结果与讨论
2.1 藻株生长速率的年际变化
对比不同藻株培养过程中细胞大小、细胞数目、叶绿素含量和吸光度等一系列生长指标(表 2),从中可以看出,在旺盛生长的游动细胞阶段不同藻株之间大小变化没有明显规律,细胞直径一般在 24 μm左右,随季节交替出现一定幅度波动,在大多数时间(5~11月份共7个月)内,H3细胞直径相对而言略大些,但在统计学上差别不很明显,这可能与该藻细胞分裂速度相对较慢有一定关系。
其他不同指标显示生长方面虽然也存在一定差异,但总体上相互之间呈现很好的正相关性。为更简单明确地比较藻株生长速率的年际变化规律,仅选取细胞数目指标进行分析。表 2结果表明,不仅不同藻株生长速率变化很大,而且同一藻株年际变化也很大。其中比生长速率最快时超过 0.6,即每周生物量净增加26倍; 而比生长速率最慢时不足0.12,每周生物量只增加 1倍多。生长速率最高的藻株在不同的月份中出现的频率不一样,其中藻株 H0相对生长较快的时间出现较多,在 1~5月、9月、11~12月份共8个月中藻株H0生长速率都是最高的; 在其余的6~8月和10月份共4个月中,生长较快的藻株为H2; 而藻株H3生长速度在任何时间段都没有表现出比其他2株红球藻快。
因此,在生产上春、秋季和冬季选用藻株 H0预期可获得最大生物量,而在上述季节中(除4~5月外),无论光照还是温度在全年中都相对偏弱(表 1),比较适宜于该藻株生长。而在夏季选用藻株H2可获得更多的红球藻生物量,夏季虽然属于多雨季节但光照和温度是全年最高的时期,H2藻株相对而言更适宜在较高温度和光照条件下生长。
进一步对比温度和光照资料(表 1),不难发现从4月到9月份,气温较高而日照时间长(降水天数少),为什么4~5月藻株H0生长较快,而6~8月份藻株H2生长较快?进一步分析降雨资料就可以看出,4~5月份阴天日数和降雨量相对都偏少,因此推测 4~5月份的光、温数据值应该相对稳定,不存在反复无常的巨大变化; 相反在 6~8月份阴天日数和降雨量都偏多,也就意味着光、温数据值随天气变化时常呈现很大幅度变动,在晴天时极端高温应更高、光线更强,相反在阴雨天温度相应较低。从这点讲 H2藻株比H0对不断变化的高温和高光强适应能力更强。
2.2 不同藻株累积虾青素的年际变化
雨生红球藻累积虾青素的年际变化(图1)结果表明,3株红球藻都是能累积虾青素的藻株,尽管不同月份季节藻株间虾青素含量存在一定差别,但其变化趋势却存在普遍性的共同增加或减少。对比不同月份各藻株虾青素含量可以发现,藻株 H0虾青素含量出现较高的频率最多(全年中有7个月),其次为H2藻株,其虾青素含量最高有 3个月,而藻株 H3虾青素含量最高的月份比较少(全年只有2个月)。
在藻株H0积累虾青素含量最高的1~2月、4月、9月、11~12月,也是藻株H0相对生长较快的时期(表2),在藻株H2虾青素积累量最高的7~8月和10月份,也是该藻细胞生长较快的季节(表 2),即细胞生长速率与虾青素含量呈正相关,该吻合表明藻株细胞生长速率快慢主要决定着红球藻生产虾青素多少。而在 3月、5月,藻株 H3虾青素含量最高但其细胞生长速率并不快,表明此期该株藻单位细胞内累积的虾青素量最高。故可以认为藻细胞累积虾青素能力是决定产量的另一关键因素,其重要性仅次于细胞生长速率。
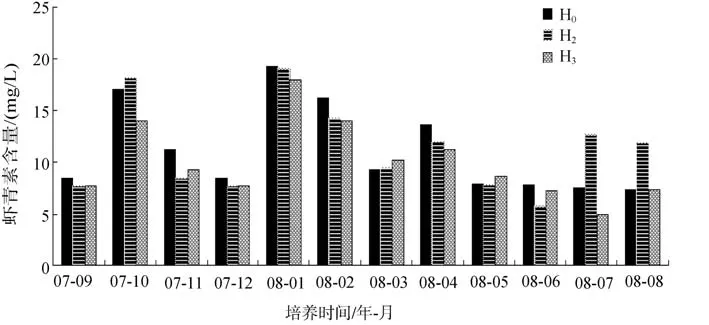
图1 不同藻株虾青素质量浓度的年际变化Fig.1 Year-round changes of astaxanthin contents in 3 trains of H.pluvialis
2.3 藻株间及藻株不同发育阶段对光适应的差异
不同藻株在不同发育阶段对光的需求结果(表3)表明,红球藻各藻株之间以及不同发育阶段光合作用对光的需求量存在一定差异。其中,在游动阶段(特别是 H2)的绿色游动细胞光合作用对光需求普遍较高,H0、H2和H3光饱和点分别为750、1000、750 μmol /(m2·s); 不动细胞阶段绿色细胞时期,不同藻株光合作用对光需求减小,该阶段藻株H0、H2和H3绿色不动细胞的光饱和点分别为750、750、500 μmol/(m2·s); 而不动细胞阶段的红色细胞 H0、H2和 H3对光需求相对最弱,其藻株的光饱和点分别为500、750、500 μmol /(m2·s)。因此,不同藻株光合作用对光的需求顺序是 H2>H0>H3,同一藻株不同发育阶段光合作用对光需求的顺序:绿色游动细胞>绿色不动细胞>红色不动细胞。
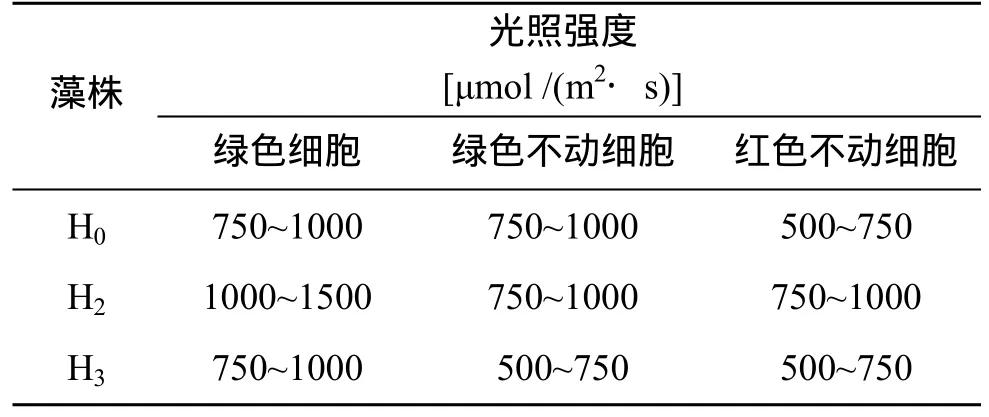
表3 实验藻株不同发育阶段的光饱和范围Tab.3 Light saturation points for cells at different development stages in 3 strains of H.pluvialis
对比表1和3数据,不同藻株对光的需求与实际培养过程细胞生长的结果是一致的,藻株 H2光合作用可以在更高的光强下进行,因此相对而言在光线较强(或因云层不断变换导致光照强度瞬间出现大幅度变化)、以及多阴雨的夏季生长较好(表2)。对藻株H0而言,光合作用需求光照相对适中,在全年大多数季节(春、秋和冬季)生长相对较快(表 2)。而藻株H3,由于光合作用对光需求比较弱,不适宜在自然强光下生长,生长速率在全年之中很少表现较快(表2),相反,过多的光能势必产生系列危害(如强光下大量产生过量活性氧自由基和诱发膜脂过氧化发生等),为此藻株 H3细胞采取积累大量虾青素的策略,消耗过剩光能、淬灭活性氧自由基,屏蔽性吸收光线保护细胞器,这可解释为什么藻株 H3在某些月份(3月、5月)细胞生长速率虽不快,但产生的虾青素却最多(图 1)。
2.4 红球藻细胞转化过程中的光化学特性与光能分配
红球藻(以 H0为例)不同发育阶段的连续荧光动力学 OJIP曲线如图 2所示,从中可以看出,红色不动细胞的暗适应后最大荧光强度Fm最高(图2A-3),而绿色游动细胞的Fm最低(图 2A-1),绿色不动细胞的Fm介于二者之间(图2A-2)。因此,绿色游动细胞最大光化学效率<绿色不动细胞<红色不动细胞,依次分别为0.666,0.716和0.768。从图2B中还可以看出,相对于游动细胞而言,不动细胞特别是绿色不动细胞荧光曲线在2 ms时出现明显上升(图2B-2和图2B-3),同样在照光30 ms时绿色不动细胞曲线(图2B-2)也存在明显变化,上述荧光强度Vj或Vi差异均表明在红球藻从游动细胞向不动细胞转化过程中,其有活性反应中心 PSⅡ的关闭程度发生了很大变化。绿色游动细胞最大荧光出现的时间比不同细胞早,随后在500 ms处呈现快速下降(图2B),意味着在游动细胞中,捕获能量经反应中心 PSⅡ转化并进入电子传递链后的流通过程是非常顺畅的。
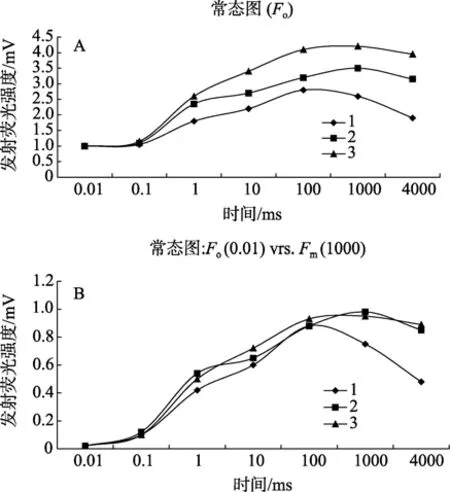
图2 藻株 H0不同发育阶段细胞的连续荧光动力学 OJIP曲线Fig.2 The continuous fluorescence kinetic OJIP curves of different cells of H.pluvialis strain Ho
依 Biolyzer软件对图 2进行数据分析获得光化学反应参数和能量分配模式(图 3)。To时,单位反应中心 PSⅡ吸收的光能(ABS/RC)在不同类型红球藻细胞中存在差异,即以绿色游动细胞最多(图 3-1A),绿色不动细胞次之(图 3-2A),而红色不动细胞最少(图3-3A)。就单位反应中心PSⅡ捕获的用于还原QA的能量TR0/RC而言,在不同类型红球藻中的趋势同ABS/RC基本一致,差别相对不明显(图 3-1A,3-2A,3-3A),在反应中心以热量形式耗散能量(DI0/RC)中绿色游动细胞>绿色不动细胞>红色不动细胞。被反应中心捕获然后用于电子传递能量参数也是绿色游动细胞>绿色不动细胞>红色不动细胞。该结果可进一步说明表 2绿色细胞光合作用需要更多的光线,而红色不同细胞光合作用对光线需求最低。

图3 藻株H0不同发育阶段细胞光化学反应参数和能量分配模式Fig.3 The photochemical parameters and their energy pipeline models of H.pluvialis strain H0 at different developmental stages
图3结果还表明,不同类型细胞在单位面积被反应中心 PSⅡ捕获能量(TR/ABS)存在一定差异(图3-1B,3-2B,3-3B),最大光化学效率从绿色游动细胞转化到绿色不动细胞,然后累积虾青素的红色不动细胞依次上升,分别为0.666,0.716和0.768。上述不同类型细胞的最大光化学效率并不存在巨大的差异,但是由于绿色游动细胞中有活性的反应中心PSⅡ很少,仅是红色不动细胞的19%(图3-1B,3-3B),大部分(约 91%)反应中心 PSⅡ失活; 在绿色不动细胞中也只有90%反应中心PSⅡ存在活性(图3-2B)。因此To时单位面积捕获的光能用 TR0/CS0和用于电子传递的能量(ET0/CS0)在绿色游动细胞中都非常少(图3-1C)。同样,相对于不动细胞而言,Tm时绿色游动细胞单位面积捕获的光能(TR0/CSm)和用于电子传递的能量(ET0/CSm)也都非常少(图3-1D)。
从光能以热量消耗角度分析,无论单位光合中心 PSⅡ耗散的热能(DI0/RC)还是散失热能占吸收光能的比率(DI0/ABS),都是绿色游动细胞>绿色不动细胞>红色不动细胞(图3-A和3-B)。但是,当光能被光合中心 PSⅡ捕获和转化进入电子传递以后,绿色细胞单位面积以热辐射形式散失的能量都小于不动细胞(图3-C和3-D)。上述结果说明,绿色游动细胞过多热量耗散发生在光量子到达光合反应中心 PSⅡ之前。
雨生红球藻是一种单细胞淡水绿藻,在雨生红球藻生长的过程中,如果遇到胁迫条件,如高光强、高温、营养盐(氮、磷)饥饿、盐胁迫等,绿色游动细胞会转化为不动细胞并积累大量虾青素而变红。这种形态转变并伴随有虾青素积累有其重要生理生态意义,作者认为可从以下角度分析:
其一,按照 McCord和 Fridovich[11]提出的自由基伤害学说,在胁迫条件下,植物体内的自由基和产生自由基的物质含量增加,导致自由基的产生和清除系统之间的平衡被破坏。在大规模利用自然光培养过程中,日光强度通常达到2000 μmol /(m2·s)以上(在云南楚雄直射光强度一般在 2000~3000 μmol/(m2·s)超过细胞光和作用需要的光照强度数倍(表3),即使光线在本实验过程中被屏蔽掉30%~55%相对于光合需求而言仍然过高,因此过多的光线不可避免地导致植物体内大量积累活性氧自由基。过量的自由基与质膜和生物大分子反应,导致脂质过氧化,蛋白质降解,DNA突变和链的断裂以及蛋白质的损伤[12],从而对生物体造成伤害。Liu等[13]利用甲基紫精(MV)诱导产生 O2—,通过测定抗氧化酶系统包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(ASA-POD),以及分析丙二醛(MDA)含量变化窥测膜脂过氧化程度,比较了不同类型雨生红球藻细胞内保护酶系统和虾青素的抗氧化能力。确定雨生红球藻有两种抗氧化机制,一种是绿色游动细胞中的抗氧化酶,另一种是红色细胞中的抗氧剂虾青素。在其生活周期中,随着细胞转化由一种防御系统转变为另一种防御系统来抵御环境氧化胁迫。绿色游动细胞主要依靠保护酶系统来清除活性氧,而不动细胞主要依靠虾青素发挥作用。虾青素的抗氧化作用远远超过保护酶系统[13]。
其二,红球藻虾青素积累通常发生在胁迫条件下,这时产生过多的能量以虾青素形式储存起来,以备后用,而不是以热形式释放造成局部温度过高,看来也是细胞一种非常经济有效的适应策略。该结果从能量模型中分配给光合能量中可获得印证,红球藻不动细胞所捕获和用于电子传递的能量以及最大光化学效率都比游动细胞高(图3)。
另外,作者认为虾青素累积在脂质小体中,包围在细胞核周围和叶绿体类囊体片层等重要细胞器外面,形成屏障过滤光线,可降低强光以及紫外线等对上述细胞结构和功能发生杀伤作用[14]。如果如此,红色不动细胞散失热能占吸收光能比率(DI0/ABS)和单位光合中心 PSⅡ耗散的热能(DI0/RC)应最大。事实相反,DI0/ABS 和DI0/RC大小顺序为绿色游动细胞>绿色不动细胞>红色不动细胞(图 3-A和图 3-B),本结果看似没有支持本假说,但进一步考虑到叶绿素荧光分析使用的光源为单色光,波长在 660 nm,虾青素在此波长下并没有任何吸收,因此目前还不能否定该假设,如果换以波长更短的紫色或蓝色光进行实验,结果就可能支持本假设。
3 结论
(1) 雨生红球藻在不同发育阶段光合作用对光需求最大的为绿色游动细胞阶段,其次为绿色不动细胞,对光需求最小的为红色不动细胞,且不同藻株间光合作用对光需求存在差异性,其中H2>H0>H3。
(2) 在云南地区规模化生产中,建议秋末、冬、春和夏初季节选择藻株 H0,而在夏季和秋初选用藻株 H2培养可获得虾青素含量更高的雨生红球藻藻粉。
[1]Kang C D,Sim S J.Selective Extraction of Free Astaxanthin from Haematococcus Culture Using a Tandem Organic Solvent System[J].Biotechnol Prog,2007,23:866-871.
[2]Domínguez-Bocanegra A R,Ponce-Noyola T,Torres-Muñoz J A.Astaxanthin production byPhaffia rhodozymaandHaematococcus pluvialis:a comparative study[J].Appl Microbiol Biotechnol,2007,75:783-791.
[3]Ping He,James Duncan,James Barber.Astaxanthin accumulation in the green algaHaematococcus pluvialis:Effects of cultivation parameters[J].Journal of Integrative Plant Biology,2007,49 (4):447-451.
[4]Domínguez-Bocanegra A R,Ponce-Noyola T,Torres-Muñoz J A.Astaxanthin production byPhaffia rhodozymaandHaematococcus pluvialis:a comparative study[J].Appl Microbiol Biotechnol,2007,75:783-791.
[5]张京浦,刘建国.营养盐对雨生红球藻光合作用影响的研究[J].工业微生物,1997,27(4):14-17.
[6]Lichtenthaler H K.Chlorophylls and carotenoids:pigments of photosynthetic biomembranes[A].Packer L,Douce R.Methods in enzymology[C].San Diego,California:Academic Press,1976.350-382.
[7]Davies B H.Carotenoids[A].Goodwin T W.Chemistry and biochemistry of plant pigments[C].London:Academic Press,1976.38-166.
[8]Krause G H,Weis E.Chlorophyll fluorescence and photosynthesis:the basics[J].Annu Rev Plant Physiol Plant Mol Biol,1991,42:313-349.
[9]Strasser R J,Srivasatava A G.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria [J].Photochemistry and Photobiology,1995,61:32-34.
[10]Strasser R J,Srivastava A,Tsimilli-Michael M.The fluorescence transient as a tool to characterize and screen photosynthetic samples[M].London:Taylor and Francis Press,2000.445-483.
[11]McCond P L,Fridorich B.The role of oxygen free radicals in biological process[J].Biol Chem,1969,244:6049-6055.
[12]Asada K.Production and action of active oxygen in photosynthetic tissue[M].Boca Raton:CRC Press,1994.77-104.
[13]Liu J G,Zhang X L,Sun Y H,et al.Antioxidative capacity and enzyme activity inHaematococcus PluvialisCells exposed to superoxide free radicals[J].Chinese journal of Oceanology and Limnology,2010,28(1):1-9.
[14]范晓,张士璀,秦松,等.海洋生物技术新进展[M].北京:海洋出版社,1999.212-239.
