P矩阵化学计量法测量饮用水中Cd2+含量
2010-03-07周姣唐书泽腾久委罗勇
周姣,唐书泽,腾久委,罗勇
(暨南大学 理工学院,广东 广州 510632)
饮用水安全日益受到人们关注.供水系统具有先天的脆弱性,恐怖袭击等突发事件是饮用水安全的潜在隐患[1].镉是一种神经性毒素,可造成急、慢性中毒和致畸、致癌、致突变,是常见的人工投毒物之一[2].镉中毒主要源自食物和水体中含量过高的Cd2+污染,中国有93%的河流已被污染[3],因此,对水中Cd2+含量进行检测尤为重要.Cd2+含量的检测方法目前主要有原子吸收光谱法和分光光度法.前者测量数据准确,专一性强,但样品前处理繁琐,难以满足基层单位快速检测的要求;后者操作简单,灵敏度高,检测极限低,但易受到环境条件和显色剂专一性的限制.Cd2+与Cu2+、Zn2+在水体中通常同时存在,由于性质极为相似,Cu2+、Zn2+的存在会对Cd2+的测定造成严重干扰.如何避免Cu2+、Zn2+的干扰成为检测Cd2+准确性的关键.
赵桦萍[4]采用 2-(5-溴-2-吡啶偶氮)-5-二乙氨基酚(2-((Bromo-2-pyridyl)-azo)-5-diethyl- aminophenol,5-Br-PADAP)与Cd2+反应,在pH 9.0、Triton X-100、β环糊精体系下实现对 Cd2+的测定,加入 10 g/L KCN溶液0.5 mL、20 g/L乙二胺溶液0.5 mL、5 g/L酒石酸钾钠溶液2 mL和20 g/L 六偏磷酸钠溶液2 mL,可掩蔽18 μg Mn2+、13 μg Pb2+、10 μg Cu2+、8 μg Ni2+、8 μg Co2+、5 μg Fe2+,但未提及Zn2+的掩蔽.文献报道[5]中一般采用硫脲来掩蔽Cu2+,但掩蔽剂量低,极不稳定.笔者拟通过化学计量法中的P矩阵校正测量饮用水中Cu2+、Zn2+、Cd2+的含量,在不进行化学分离的情况下用光谱方法对共存金属离子的干扰进行校正,对饮用水中Cd2+的含量变化进行测定,以预防饮用水突发公共安全事件.
1 材料与方法
1.1 材 料
主要化学试剂有氯化镉、硫酸铜、硫酸铁氨、七水合硫酸锌、氯化铵、氨水、氯化锰、氯化钙、硝酸铅、氯化汞、焦磷酸钠(均购自广州化学试剂厂)、Triton X-100(sigma)、5-Br-PADAP(天津化学试剂厂)、无水乙醇(大茂化学试剂厂).试剂均为分析纯.试验用水为双蒸去离子水.
主要仪器为UV-1800分光光度计(北京瑞利分光仪器厂)、pH-3C((上海雷磁仪器厂)、电子天平(梅特勒·托利多公司).
1.2 方 法
1.2.1 试剂配制
按饮用水重金属测定方法[6]配制各种金属离子储备液,储备液质量浓度1 mg/mL,临用前分别稀释至10 μg/mL和1 μg/mL;显色剂5-Br-PADAP质量浓度0.1 g/L,无水乙醇溶解;Triton X-100溶液质量浓度5 g/L;NH4Cl-NH3·H2O缓冲溶液(pH 9.0)的配制为5.4 g NH4Cl加水溶解,氨水调pH至9.0,定容于100 mL容量瓶;焦磷酸钠质量分数5 %.
1.2.2 测定方法
于25 mL比色管中分别加入适量的Cu2+、Zn2+、Cd2+标准溶液,3 mL pH 9.0 NH4Cl-NH3·H2O缓冲液,2 mL Triton X-100溶液,适量5-Br-PADAP溶液,用蒸馏水稀释至刻度,摇晃混匀,静置5 min,以试剂空白作为参比溶液,在400~700 nm扫描吸收光谱.
1.2.3 预测模型
在化学量测模型中,响应矩阵即吸光度矩阵Y与浓度矩阵X之间存在线性关系,在与Y矩阵交换位置后,浓度矩阵X和响应矩阵Y之间也具有线性关系[7]:

式中E为随机误差矩阵,P为X与Y线性关系的系数矩阵.这一方程式即为P矩阵的预测模型.利用校正集浓度阵和相应的量测响应矩阵求出系数矩阵P后,用该模型可测定未知样品的浓度.
1.2.4P矩阵的求法
根据最小二乘法,对式X n·m=Yn·p Pp·m+E n·m求P:Pp·m=(YTp·n Yn·p)YTp·nX n·m(n≥p).其中,p,n分别为测量通道数(波长数)和校正集样本数[8-9].P矩阵校是建立在线性模型上的一种校正技术,对光度分析而言,由于受入射光源单色性的影响,线性模型并非在任何波长都可满足,同时,P矩阵校正要求各组分的吸收光谱在研究的波长有显著的区别,所以,选取合适的分析波长才可以获得良好的校正效果.波长选择参考文献[8].通过迭代运算,优选出p个分析波长.
取9个25 mL比色管,按照U9(9)均匀设计表,分取不同含量的Cu2+、Zn2+、Cd2+标准溶液构成标准混合试样,如试验方法显色.在选定的p个分析波长下测定吸光度,构成校正集吸光度矩阵.将此吸光度矩阵A和标准样品的浓度矩阵C代入程序中,得出吸光度系数矩阵P.
1.2.5 预测样品中Cu2+、Zn2+、Cd2+含量的测量
若有s个未知样本,Xs·m=Ys·p Pp·m.重新配制5个样品在p个波长处测量吸光度矩阵Ys·p,采用Matlab 7.0进行程序运算[10],利用上面得出的系数矩阵P得Xs·m,即得样品中Cu2+、Zn2+、Cd2+的质量浓度.
2 结果与分析
2.1 吸光波长的选择
质量浓度均为0.4 mg/L的Cu2+、Zn2+、Cd2+3种溶液显色后,测其吸收光谱如图1.由图1可知,在pH 9.0下,3种金属离子的吸收曲线有较大不同,最大吸收峰出现在560 nm处.在400~490 nm下,Zn2+和Cu2+的吸收曲线重叠,所以,校正集吸光矩阵的波长应选取490~600 nm.

图1 3种金属离子在pH 9.0时的吸收光谱Fig .1 Absorption spectrum of the three metal ions at pH 9.0
2.2 显色剂5-Br-PADAP的用量
质量浓度均为0.2 mg/L的Cu2+、Zn2+、Cd2+混合溶液,在pH 9.0下,用不同量的5-Br-PADAP溶液显色, 于560 nm处测吸光度.试验结果表明,显色剂用量为0.5~1.0 mL时,吸光值增加最快;显色剂用量为2 ~3 mL时,吸光值最大,且趋于稳定,所以显色剂用量以2 mL为宜.
2.3 共存离子的干扰
试验结果表明,在质量浓度均为 0.2 mg/L的Cu2+、Zn2+、Cd2+混合溶液中,相对误差不大于5%的情况下,下列离子不干扰测定:Hg+(4.0 mg/L)、K+(2.0 mg/L)、Na+(4.0 mg/L)、NH4+(2.0 mg/L)、Ca2+(0.8 mg/L)、Al3+(0.72 mg/L)、Pb2+(0.8 mg/L),而Fe3+、Fe2+、Mn2+在浓度为1倍目标金属浓度时严重干扰测定,采用浓度为 5%的焦磷酸钠能有效掩蔽0.8 mg/L的 Fe3+、Fe2+、Mn2+.
2.4 单个组分回归参数比较
配制一系列的Cu2+、Zn2+、Cd2+单个标准溶液,按最优试验条件显色后,分别在560 nm下进行测定,每个标准溶液测量3次,取平均吸光值.由表1可见,3种离子都有良好的线性范围.最低检测限根据 IUPAC认定的校正曲线的截距来估算检测限或判断限:yx=0.095=b+t0.05·Sb,yx=0.095为95%置信度时的截距值,b为校正曲线方程中的截距,t0.05为t-分布在自由度(r)等于n-2时的单尾t值.

表1 Cu2+ 、Zn2+、Cd2+溶液的回归方程参数Table1 Regression equation parameter of Cu2+,Zn2+ and Cd2+
2.5 波长选择
预先配制好质量浓度均为0.4 mg/L的Cu2+、Zn2+、Cd2+3种溶液,根据吸收光谱曲线特点,在400~ 600 nm,每隔6 nm选取1个点,得到吸光值,经过矩阵迭代,每一轮迭代都将灵敏度(矩阵条件数)最低的那个波长删除.为避免过少的波长造成模型失真,最后选取494、518、536、566、580、589、600 nm为最佳波长组合.
2.6 校正集浓度矩阵、吸光度矩阵和检验集样品浓度矩阵、吸光度矩阵的确定
在显色试验条件下,测定9种溶液的吸光度(表2)组成校正集吸光度矩阵.采用U9(9)均匀设计表设计的校正集质量浓度见表3.由表4数据确定检验集样品浓度矩阵和吸光度矩阵,利用所建立的校正模型对5组不同浓度的3组分混合预报组溶液进行浓度测定,根据P矩阵算法,得出预测浓度(表5)矩阵t.
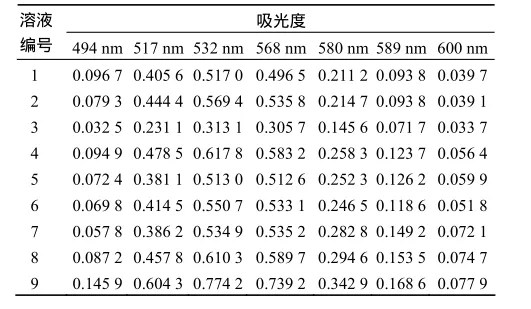
表2 校正集吸光度Table 2 Absorbance of calibration samples

表3 校正集质量浓度Table 3 Concentration matrix of the calibration samples

表4 预测集吸光度Table 4 Absorbance of verification samples

表5 P矩阵法对3种金属离子的预测结果Table 5 Determination of the three ions by P-matrix method
由表 5可见,Cu2+的回收率为 100.3%~105.7%.Zn2+回收率除加入质量浓度0.04 mg/L下为47.3%外,其余为90.3%~102.7%,说明该模型在Zn2+浓度较低时预测偏差大,但在Zn2+质量浓度大于0.08 mg/L时基本符合预测要求.在Cu2+和Zn2+质量浓度很小时,Cd2+回收率为95.8%~104.0%;在Cu2+和Zn2+质量浓度很大而Cd2+质量浓度很小时,Cd2+回收率仅为 78.9%,可见,该模型能较好地预测饮用水中Cd2+的含量变化.
3 结 论
在3 mL NH4Cl-NH3·H2O缓冲溶液(质量分数5.4%,pH 9.0),2 mL 0.1 g/L 5-Br-PADAP显色剂,2 mL 5 g/L Triton X-100溶液条件下,在最大吸收峰560 nm 处,Cu2+、Zn2+、Cd2+的吸光值分别在0.12~0.60、0.04~0.52、0.04~0.60 mg/L成线性.在此质量浓度线性范围内,选取494、518、536、566、580、589、600 nm为测定波长构建校正模型,Cu2+的回收率接近100%;当Cu2+和Zn2+浓度很小时,Cd2+回收率为 95.8%~104.0%,因此,用P矩阵模型可以准确而快速地测量饮用水中Cd2+的含量.
[1] Peter H G.Water and terrorism[J]. Water Policy,2006(8):481-503.
[2] Stanley E,Manahan.Environment Chemistry[M].New York:Spinger-Verlag,1994:380-383.
[3] 迟橙,龙岳林.水生植物修复城市富营养化污水的研究进展[J].湖南农业大学学报:自然科学版,2009,35(1):51-54.
[4] 赵桦萍,赵丽杰,白丽,等.5-Br-PADAP-Triton X-100-β-环糊精体系分光光度法测定电镀废水中镉[J].冶金分析,2007,27(10):47-49.
[5] 肖新峰,王照丽,罗娅君.流动注射分光光度法测定镉的研究与应用()[J]Ⅱ .化学研究与应用,2007,19(8):911-913.
[6] GB5750—1985,饮用水标准检验法[S].
[7] 许禄,邵学广.化学计量学方法 [M].2版. 北京:科学出版社,2004:179-190.
[8] 王勇,倪永年.多元校正-多波长分光光度法同时测定水样中锌、镉和钴[J].南昌大学学报:理科版,2007,31(1):82-84.
[9] 倪永年.最小二乘分光光度法用于多组分分析[J].岩矿测试,1989,8(4):258-261.
[10] 许国根,许萍萍.化学化工中的数学方法及MATLAB实现[M].北京:化学工业出版社,2008:117-126.
英文编辑:罗文翠
