炎症性肠病血清相关抗体检测的临床价值
2010-01-25杨冬,王贞
杨 冬,王 贞
(1.大连医科大学附属第一医院 消化内科,辽宁 大连 116011;2.大连医科大学附属第一医院 检验科,辽宁 大连 116011)
炎症性肠病(inflammatory bowel disease,IBD)是一组病因尚不十分明确的慢性非特异性肠道炎症,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)。目前已知肠道粘膜免疫系统异常在IBD发病中起重要作用,一些与其相关的自身免疫性抗体逐步被人们发现和认识。其中核周型抗中性粒细胞胞浆抗体 (perinuclear anti-neutrophil cytoplasmic antibody,pANCA)、抗小肠杯状细胞抗体(anti-intestinal goblet cell antibody,GAB)、抗胰外分泌腺抗体(anti-pancreatic antibody,PAB)和抗酿酒酵母菌抗体(anti-saccharomyces cerevisiae antibody,ASCA)是比较有代表性的几个抗体,通过联合检测这些血清学标志物,在IBD的诊断和鉴别诊断中可能具有重要的临床价值。目前国内有关的报道和资料较少,为此本文通过检测2006年8月~2009年2月在大连医科大学附属第一医院住院的IBD及部分其他肠道疾病患者血清中上述4种抗体的表达情况,探讨炎症性肠病血清相关抗体在IBD诊断中的应用价值。
1 资料与方法
1.1 研究对象及分组
1.1.1 IBD组:大连医科大学附属第一医院2006年8月~2009年2月住院的IBD患者71例。其中,UC组54例,男27例,女27例,平均年龄(44.9±13.8)岁;CD组17例,男9例,女8例,平均年龄(43.9±18.8)岁,均接受结肠镜及病理组织学检查,其中CD患者均接受小肠X线造影检查,采用2001年全国慢性非感染性肠道疾病学术研讨会拟订的诊断标准。
1.1.2 肠道疾病对照组:26例,男女各13例,平均年龄(52.1±15.9)岁,其中慢性结肠炎患者21例(接受结肠镜检查),结肠癌患者5例(接受结肠镜检查并行手术病理证实)。
1.1.3 正常对照组:健康体检者5例,男3例,女2例,平均年龄(42.6±19.0)岁。
1.2 方 法
1.2.1 标本采集:晨空腹采静脉血2 mL,离心收集血清。
1.2.2 抗体测定:采用间接免疫荧光薄片法,试剂盒购自德国欧蒙公司(EUROMMUN)。生物薄片中的基质分别为:乙醇固定的中性粒细胞、酿酒酵母菌、猴小肠组织和猴胰腺组织。按照说明书步骤,取25 μL用PBS缓冲液稀释的血清于加样平板的每一反应区,覆上生物薄片,室温孵育30 min后取出生物薄片,用PBS冲洗,立即放入PBS中浸泡5 min。将20 μL荧光标记的抗人球蛋白加样至另一反应平板的反应区,从PBS中取出生物薄片,按要求覆于反应平板上,室温孵育30 min。取出生物薄片,予PBS冲洗后立即放入PBS中浸泡5 min,封片,荧光显微镜观察。
1.3 统计学方法
采用SPSS 13.0软件包进行统计学处理。样本率的检验采用卡方检验,P<0.05为差异有显著性意义。
2 结 果
2.1 4种抗体在各组血清中表达的阳性率
(1)pANCA:UC组阳性率为44.4%,明显高于疾病对照组(3.8%)和正常对照组(0%),其差异有统计学意义(P<0.01);CD组阳性率为5.9%,与UC组比较差异有显著性意义(P<0.01),而与疾病对照组及正常对照组比较差异无显著性意义(P>0.05)。
(2)GAB:UC组阳性率为35.2%,高于疾病对照组(7.7%)及正常对照组(0%),与后两组比较差异有显著性意义(P<0.05);CD组阳性率为23.5%,与UC组、疾病对照组及正常对照组比较差异无显著性意义(P>0.05)。
(3)ASCA:CD组阳性率为17.6%,略高于UC组(1.9%),但两组比较差异无显著性意义(P>0.05),与疾病对照组(0%)及正常对照组(0%)比较差异均无显著性意义(P>0.05)。
(4)PAB:各组无一例阳性表达。
(5)联合检测(即其中任何一个为阳性):UC组、CD组、疾病对照组及正常对照组的阳性率分别为61.1%、35.3%、11.5%和0%。见表1。
2.2 4种抗体对IBD诊断的敏感性、特异性和阳性阴性预测值比较
单一检测4种抗体对IBD诊断的敏感性均不高,联合检测可以提高敏感性至54.9%。各指标对IBD诊断的特异性较高,均在90%以上,其中PAB和ASCA虽达100%,但其敏感性低。联合检测其敏感性、特异性和阳性阴性预测值优于单一检测。见表2。
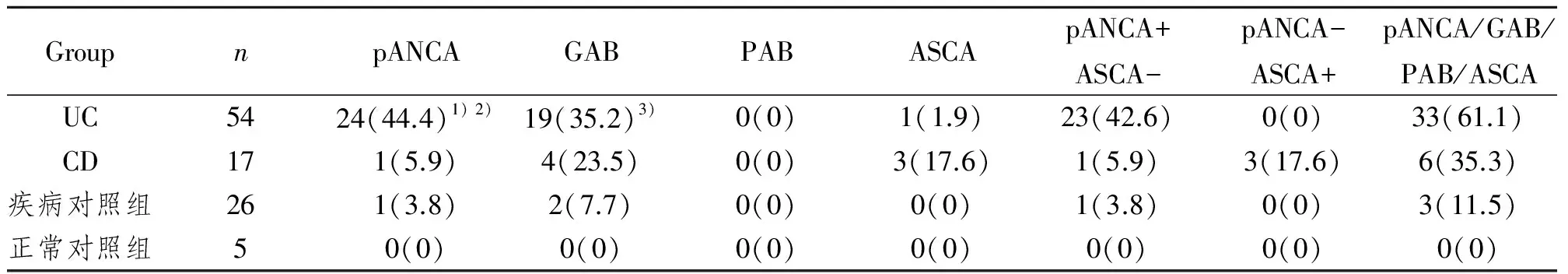
表1 pANCA、GAB、PAB及ASCA在各组血清中表达的阳性率Tab 1 The positive rate of pANCA,GAB,PAB and ASCA in different groups n(%)
1)与疾病组对照和正常对照组比较,P<0.01;2)与CD组比较,P<0.01;3)与疾病对照组和正常对照组比较,P<0.05
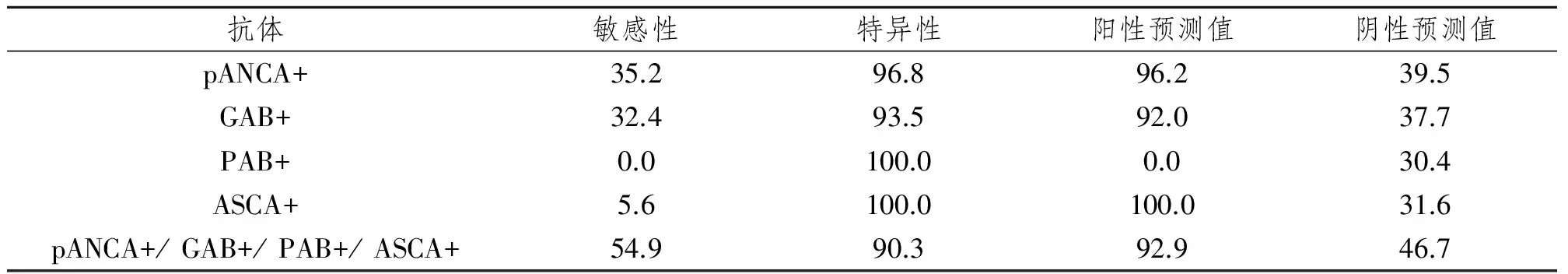
表2 pANCA、GAB、PAB及ASCA对IBD诊断的敏感性、特异性和阳性阴性预测值Tab 2 The sensibility,specificity,positive and negative predictive value of pANCA,GAB,PAB and ASCA for the diagnosis of IBD (%)
2.3 4种抗体对UC和CD鉴别诊断的敏感性、特异性和阳性阴性预测值比较
通过比较,4种抗体中pANCA和GAB对于诊断UC的敏感性及特异性高于CD,尤其是pANCA;ASCA对于诊断CD的敏感性及特异性高于UC。联合检测指标中,pANCA+、ASCA-/ UC组的敏感性和特异性分别达到42.6%和94.1%,对于鉴别二者较有意义;pANCA-、ASCA+/ CD组的特异性较高,达到100%,但敏感性只有17.6%。见表3。
2.4 pANCA及GAB在不同程度UC血清中表达的阳性率
pANCA及GAB在UC 中的表达明显高于其他各组,但是在不同程度UC中阳性率比较差异无显著性意义(P>0.05),其表达与疾病严重程度无关。见表4。
3 讨 论
目前,对于IBD的诊断主要依据临床表现、实验室检查、内镜及病理学检查,并在排除其他原因引起的肠道炎症基础上作出的。随着IBD免疫学机制的深入研究,多种与其相关的免疫特异性抗体逐渐被人们发现,为临床开展非创伤性诊断及鉴别诊断提供了新的途径。近几年,炎症性肠病血清自身抗体检测已开始应用到临床,但有关检测意义的统计分析报道较少。本实验选取4种有代表性抗体,通过对71例IBD患者的检测结果显示,几种抗体对疾病诊断的敏感性均不高,但特异性较高,均大于90%,联合检测可以明显提高诊断敏感性,其敏感性、特异性和阳性阴性预测值分别为54.9%、90.3%、92.9%和46.7%,联合检测有一定价值。

表3 pANCA、GAB及ASCA对UC和CD鉴别诊断的敏感性、特异性和阳性阴性预测值Tab 3 The sensibility,specificity,positive and negative predictive value of pANCA,GAB and ASCA for the differential diagnosis of UC and CD n(%)

表4 pANCA及GAB在不同程度UC血清中表达的阳性率
多数研究表明,pANCA主要存在于UC,而ASCA高表达于CD 中。pANCA在UC患者的阳性率为40%~70%,而在CD中仅为4%~18%;相反,ASCA在CD阳性率为22%~71%,而在UC仅为0%~14%[1-6]。pANCA和ASCA的上述特点吸引了许多研究者的兴趣。不少学者提出可将两者作为UC和CD鉴别诊断的血清学标志。Saibeni等[2]检测53名UC和93名CD患者显示,ASCA对CD患者的敏感性、特异性及阳性阴性预测值分别为59.1%、98.1%、98.2%和57.8%;pANCA对UC患者的敏感性、特异性及阳性阴性预测值分别为39.6%、92.5%、75.0%和72.9%;ASCA+/pANCA-对诊断CD的敏感性、特异性及阳性阴性预测值分别65.6%、98.1%、98.4%和61.9%;ASCA-/pANCA+对诊断UC的敏感性、特异性及阳性阴性预测值分别37.7%、96.8%、87.0%和72.3%。Kilic等[4]报道检测80名UC和61名CD患者,ASCA+/pANCA-诊断CD的敏感性和特异性分别是32%和97.5%;ASCA-/pANCA+诊断UC的敏感性和特异性分别是44.2%和97.5%,提出这两项血清学指标有助于IBD的鉴别诊断。另有部分研究认为,pANCA和ASCA还可能作为IBD临床确诊前的预测性指标或评估预后的指标[7,8]。
本研究结果pANCA在UC阳性率为44.4%,且表达与UC严重程度无关,pANCA+/ASCA-对 UC的敏感性和特异性分别达到42.6%和94.1%,与国外报道结果一致。ASCA在CD阳性率为17.6%,虽高于其它组,但与 UC组和对照组比较差异无显著性意义,pANCA-/ASCA+对CD的特异性较高,达到100%,但敏感性只有17.6%,此结果有别于国外报道。其较低的敏感性应与低阳性率有关,根据本研究结果,ASCA显然不能作为诊断和鉴别诊断CD的主要指标。国内高翔等[9]的研究报道CD患者ASCA阳性率为11.8%,亦低于国外水平,与对照组比较差异无显著性意义。分析出现国内外差异的可能原因为:① 种族遗传差异:亚洲与欧美患者遗传背景的不同可能造成彼此血清自身抗体的显著差异,此可能为主要原因;② 样本选择:本实验CD患者样本量相对偏少,有待增大样本量进一步研究证实;③ 实验室实验技术手段不同。由于pANCA和ASCA在不同研究机构获得的数据有所不同,故其临床价值仍存在争议。
有关PAB和GAB检测的临床意义国内外报道相对较少。部分研究认为PAB主要在CD中检出,UC阳性率较低。Desplat等[10]应用间接免疫荧光法检测109名CD患者血清PAB阳性率为36.7%,认为该法检测PAB可作为诊断CD的特异性标志物。但近年有研究发现UC患者PAB阳性率有增高现象,可达到24%左右,从而认为PAB应视作IBD而非CD 的特异性指标[11,12]。本实验结果与国外报道有很大差异,所检测的102例样本无一例PAB阳性,据此结果PAB不能作为诊断IBD的血清学指标,此结论有待扩大样本量进一步证实。GAB作为IBD的血清学标志物,其特异性较高,但敏感性低。本实验GAB在UC阳性率为35.2%,明显高于疾病对照组及正常对照组(P<0.05),但表达与病情严重程度无关,其诊断IBD的敏感性和特异性分别为32.4%和92.3%;在CD阳性率为23.5%,与对照组比较无差异。故考虑GAB可作为诊断UC的特异性指标。
各炎症性肠病相关抗体检测的特异性较高,但敏感性均低,不宜用于疾病筛查,联合检测能明显提高敏感性,对于IBD的诊断较有意义。4种抗体中,pANCA和GAB对于诊断和鉴别诊断UC较有价值,但与疾病严重程度无关;而ASCA和PAB的阳性率远低于国外报道,其原因可能与种族遗传背景和样本选择有关。根据本结果,这两种抗体对于诊断IBD患者意义不大。pANCA联合ASCA、GAB检测,对于UC和CD的鉴别诊断有一定临床价值。
[1] Vind I,Riis L,Jespersgaard C,et al.Genetic and environmental factors as predictors of disease severity and extent at time of diagnosis in an inception cohort of inflammatory bowel disease,Copenhagen County and City 2003 2005[J].J Crohn's Colitis,2008,2(2): 162-169.
[2] Saibeni S,Folli C,de Franchis R,et al.Diagnostic role and clinical correlates of anti-Saccharomyces cerevisiae antibodies (ASCA) and anti-neutrophil cytoplasmic antibodies (p-ANCA) in Italian patients with inflammatory bowel diseases[J].Dig Liver Dis,2003,35(12): 862-868.
[3] Sostegni R,Daperno M,Ercole E,et al.Detection of anti-saccharomyces cerevisiae antibodies in Crohn's disease: is it a reliable diagnostic and prognostic marker?[J].Dig Liver Dis,2001,33(9): 755-761.
[4] Kili ZM,Tun B,Ayaz S,et al.Antineutrophil cytoplasmic autoantibodies and anti-Saccharomyces cerevisiae antibodies in inflammatory bowel diseases[J].Turk J Gastroenterol,2004,15(4): 238-242.
[5] Zholudev A,Zurakowski D,Young W,et al.Serologic testing with ANCA,ASCA,and anti-Ompc in children and young adults with Crohn's disease and ulcerative colitis: diagnostic value and correlation with disease phenotype[J].Am J Gastroenterol,2004,99(11): 2235-2241.
[6] Lawrance IC,Hall A,Leong R,et al.A comparative study of goblet cell and pancreatic exocine autoantibodies combined with ASCA and pANCA in Chinese and Caucasian Patients with IBD[J].Inflamm Bowel Dis,2005,11(10): 890-897.
[7] Israeli E,Grotto I,Gilburd B,et al.Anti-Saccharomyces cerevisiae and antineutrophil cytoplasmic antibodies as predictors of inflammatory bowel disease[J].Gut,2005,54(9): 1232-1236.
[8] H ie O,Aamodt G,Vermeire S,et al.Serological markers are associated with disease course in ulcerative colitis.A study in an unselected population-based cohort followed for 10 years[J].J Crohn's Colitis,2008,2(2): 114-122.
[9] 高翔,胡品津,何瑶,等.炎症性肠病患者血清中自身抗体检测的临床意义[J].中华内科杂志,2005,44(6): 428-430.
[10] Desplat-Jégo S,Johanet C,Escande A,et al.Update on Anti-Saccharomyces cerevisiae antibodies,anti-nuclear associated anti-neutrophil antibodies and antibodies to exocrine pancreas detected by indirect immunofluorescence as biomarkers in chronic inflammatory bowel diseases: Results of a multicenter study[J].World J Gastroenterol,2007,13(16): 2312-2318.
[11] Joossens S,Vermeire S,Van Steen K,et al.Pancreatic autoantibodies in inflammatory bowel disease[J].Inflamm Bowel Dis,2004,10(6): 771-777.
[12] Koutroubakis IE,Drygiannakis D,Karmiris K,et al.Pancreatic autoantibodies in Greek patients with inflammatory bowel disease[J].Dig Dis Sci,2005,50(12): 2330-2334.
