IL-15对人γδT细胞杀伤结核杆菌感染THP-1细胞的影响*
2010-01-24金齐力姜丽娜姚春艳李柏青
金齐力,韦 莉,姜丽娜,姚春艳李柏青
IL-15对人γδT细胞杀伤结核杆菌感染THP-1细胞的影响*
金齐力1,2,,韦 莉2,3,姜丽娜2,4,姚春艳1,2,李柏青1,2
目的 建立结核杆菌(M tb)感染单核细胞THP-1细胞系模型;用流式细胞术检测人γδT细胞对M tb感染THP-1细胞的细胞毒活性;并观察IL-15对人γδT细胞杀伤 M tb感染 THP-1细胞的细胞毒活性的影响。方法M tb以10∶1的比例感染佛波醇酯(PMA)分化的THP-1细胞,建立M tb感染细胞模型。人外周血单个核细胞用M tb耐热性低分子多肽类抗原刺激优势扩增γδT细胞,作为效应细胞用于细胞毒活性实验。用羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)标记 M tb感染THP-1细胞,作为靶细胞。效应细胞和靶细胞以不同比例孵育4 h,用碘化丙啶(PI)染色后在流式细胞仪上检测,CSFE和PI双阳性细胞为被杀伤靶细胞。IL-15作用于γδT细胞24 h后,再检测γδT细胞对 M tb感染 THP-1细胞的细胞毒活性。结果
人γδT细胞与 M tb感染 THP-1细胞以1∶1至50∶1的比例作用4 h后,人γδT细胞对结核杆菌感染的 THP-1细胞的细胞毒活性从22.5%增加至80.7%;而γδT细胞与未感染 M tb的 THP-1细胞的细胞毒活性为16.1%至47.2%。IL-15作用γδT细胞后的细胞毒活性(64.06%)与对照组(46.81%)相比明显增加(P<0.05)。结论人γδT细胞对 M tb感染 THP-1细胞的杀伤活性明显高于对未感染M tb的THP-1细胞的作用,杀伤活性随效靶比的增加而增加。IL-15可以增强人γδT细胞对 M tb感染巨噬细胞的细胞毒活性。
IL-15;结核杆菌;γδT细胞;THP-1细胞;细胞毒活性
结核病是由结核分枝杆菌(M ycobacterium tuberculosis,M tb)感染引起的一种慢性传染病,结核分枝杆菌亦简称结核杆菌,其入侵的宿主细胞主要是巨噬细胞,并在一定的条件下可在巨噬细胞内存活以及增殖。但活化的巨噬细胞也可销毁吞噬的M tb,并将其降解成多肽后将抗原信息传递给 T细胞,引起特异性的免疫反应。以往的研究表明,M tb感染宿主后可诱导CD4+和CD8+T细胞的特异性免疫应答,并激活巨噬细胞发挥免疫效应,在抗M tb感染中发挥主导作用〔1〕。近年来的研究证明,γδT细胞在抗感染免疫,特别是在抗 M tb感染免疫中同样发挥重要作用〔2〕。
γδT细胞对 M tb感染巨噬细胞细胞毒活性在研究γδT细胞的抗结核免疫中有重要的意义。本研究建立CFSE/PI双标记的流式细胞仪检测技术检测人γδT细胞对 M tb感染巨噬细胞的细胞毒活性,为深入阐明γδT细胞杀伤 M tb感染巨噬细胞的机理打下基础。近年来,IL-15在胞内菌感染的免疫应答中的作用得到越来越多的重视。有研究表明IL-15可通过增强CD8+T细胞的免疫应答发挥抗M tb作用〔3〕,本实验则观察了 IL-15作用后γδT 细胞对M tb感染巨噬细胞的细胞毒活性,以探讨 IL-15对γδT细胞抗M tb感染免疫作用的调节作用。
1 材料与方法
1.1 菌株与细胞株 结核分枝杆菌 H37Ra株:购于中国生物制品检定所北京菌种保藏中心,批号:9302025;人单核细胞系 THP-1细胞购自美国A-merican Type Culture Collection公司,用含10%小牛血清的RPM I-1640培养基传代培养。
1.2 试剂和仪器 异硫氰酸荧光素(fluorescein is othiocyanate,FITC)和二甲基亚砜(dimethyl sulfoxide,DM SO)购自 M erck公司;培养基 RPM I1640,GIBCO公司产品;新生牛血清(NBS)购于杭州四季青生物公司;淋巴细胞分离液(Ficoll-Hypaque),天津 TBD生物技术发展中心产品;重组人白细胞介素2(rh IL-2),长春长生基因药业公司产品;重组人白细胞介素15(rh IL-15),Pep ro Tech公司产品;二乙酸荧光素(Fluorescein diacetate,FDA)和CFSE购自 Invitrogen;PMA和 PI购自 Sigma公司;抗人CD3-FITC,天津协科生物技术有限公司产品;抗人 TCRγδ-PE,BD公司产品;流式细胞仪FACSCalibur为美国BD公司产品;超声细胞粉碎机JY-Ⅱ型为宁波新芝生物科技有限公司产品;光学显微镜(日本Nikon)。
1.3 M tb菌悬液的制备 见参考文献〔5〕。
1.4 建立M tb感染PMA分化的 THP-1细胞模型
将冻存的 THP-1细胞复苏后,置37℃,5%CO2孵箱中培养,收获指数生长期细胞,以1×106/孔接种于6孔细胞培养板中、每孔2 m L细胞悬液,加入PMA,终浓度为40 ng/m L,24 h后细胞发生巨噬细胞样变化(贴壁生长,形态不规则,有伪足伸出),此时的THP-1细胞已分化为巨噬细胞。吸去培养液,加入预温的完全培养液轻轻吹去未贴壁及贴壁不紧的细胞,以10∶1的比例加入 M tb或M tb-FITC悬液,37℃,5%CO2孵育箱孵育过夜,抗酸染色观察巨噬细胞对M tb吞噬活性,流式细胞术检测巨噬细胞的吞噬率。
1.5 流式细胞术检测γδT细胞对M tb感染巨噬细胞的细胞毒活性
1.5.1靶细胞的标记 收集靶细胞(巨噬细胞和M tb感染后的巨噬细胞),调整靶细胞浓度为1×106/m L,用终浓度为 0μmol/L、2μmol/L、4μmol/L、8μmol/L的CFSE标记靶细胞,37℃,5%CO2孵箱内放置10 m in。用完全培养基洗3次去除残余的染料,并悬浮于完全培养基中;37℃、5%CO2孵箱内放置4 h后,上流式细胞仪检测。
1.5.2 效应细胞的准备 常规方法获取健康成人外周血单个核细胞(PBMC),用含50 m l/L NBS 50 m l/L人自体血清的RPM I1640培养液调整细胞浓度为(1-2)×106/m L,植入24孔细胞培养板中,每孔1mL。加入 M tb.Ag(终浓度5μg/m L)和rh IL-2(终浓度50 U/m L),用于诱导和扩增γδT细胞。当M tb.Ag活化的 T细胞生长到第10天时,流式细胞仪检测γδT细胞的百分率,γδT细胞的百分率>85%的用于γδT细胞对 M tb感染巨噬细胞的细胞毒活性实验。
1.5.3 效应细胞与靶细胞活力的测定 调整效应细胞和靶细胞浓度为1×106/m L,取100μL细胞悬液,加入FDA溶液,使其终浓度为50 ng/m L,混匀,室温下作用5 min,流式细胞仪进行检测,FDA阳性细胞为活细胞,CELLQuest或W inMD I 2.8软件分析。用于实验的细胞活力>90%。
1.5.4 细胞毒试验 效应细胞和靶细胞混合放入U型96孔板中,反应体系为200μL。设置3个平行复孔,每孔加入8 000个靶细胞,效靶比(效应细胞∶靶细胞,E∶T)分别为50∶1,20∶1,10∶1,5∶1及1∶1。120 g离心2 min。37℃,5%CO2孵育4 h。吸出细胞悬液加入流式管,PBS洗3次。加入4μL PI(100μg/m L),置冰上5 min后 ,60 min内用流式细胞仪分析,用 CellQuest或 WinMD I 2.8软件获取和分析数据。FL1荧光通道检测CFSE的荧光强度,FL 3荧光通道检测 PI的荧光强度。先以CFSE阳性标记的靶细胞设门为 R1,收集2000个靶细胞。在PI和CFSE双标记的散点图中,进一步分析R1门中的靶细胞,其中 PI和CFSE双标记的细胞为死亡的靶细胞。
1.5.5 IL-15对γδT细胞杀伤 M tb感染巨噬细胞的作用 收集培养的γδT细胞,调细胞浓度为1×106/mL,24孔板中每孔加入1 m L细胞悬液,再加入rh IL-15,终浓度为20 U/m L,作用24 h后收集γδT细胞。效应细胞与靶细胞的作用比例为10∶1,流式细胞仪检测 IL-15作用后γδT细胞对 M tb感染巨噬细胞的细胞毒活性。
2 结 果
2.1 感染模型的建立 M tb与 THP-1细胞或PMA分化的 THP-1细胞共孵育过夜后,流式细胞仪检测PM A分化的 THP-1细胞对 M tb的吞噬率达90%以上,见图1。抗酸染色显微镜观察的结果显示,感染后90%以上的PM A分化的 THP-1细胞内有3-5个以上的 M tb;而未分化的 THP-1细胞的吞噬率在小于10%,感染后仅有少数 THP-1细胞内有少量的 M tb。

图1 流式细胞术检测THP-1细胞在分化前后对 M tb的吞噬率A:未分化的 THP-1细胞对 M tb的吞噬率B:PMA分化后的 THP-1细胞对M tb的吞噬率Fig.1 Phagocytosis rate of THP-1 cells and PM A differentiated THP-1 cells detected by FACS A:Phagocytosis rate of THP-1 cells to Mtb B:Phagocytosis rate of PMA differentiated THP-1 cells to M tb
2.2 不同浓度CFSE标记的靶细胞 靶细胞浓度一定时,以不同浓度的CFSE标记靶细胞,标记4 h后上流式细胞仪检测,流式分析结果见图3。CFSE浓度在2μmol/L时,CFSE阳性细胞的峰值在102处,CFSE浓度在4μmol/L时,CFSE阳性细胞的峰值在102-103处,CFSE浓度在8μmol/L时,CFSE阳性细胞的峰值在103处,可以与效应细胞分开,此时的CFSE浓度为实验用浓度。
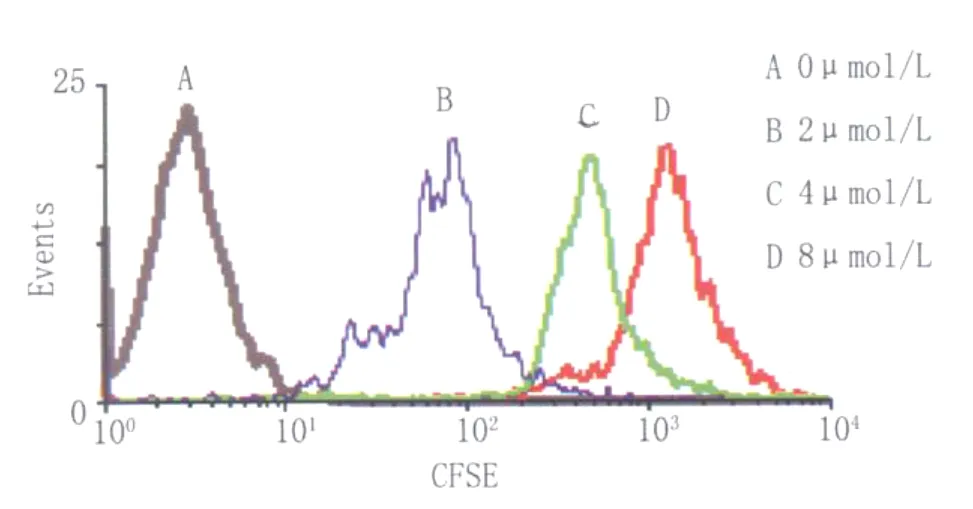
图2 不同浓度CFSE标记的靶细胞Fig.2 CFSE labeled target cellsat different concentrations
2.3 效应细胞与靶细胞存活率的检测 PBMC经M tb.Ag诱导和扩增后,γδT细胞比例增加,当培养到第10d左右,流式细胞仪检测γδT细胞比例,选择人γδT细胞比例达85%以上的用于细胞毒活性检测,实验前检测细胞存活率达90%以上。THP-1细胞和PM A分化后的 THP-1细胞的存活率也可达90%以上,如图3所示。
2.4 人γδT细胞对巨噬细胞和 M tb感染后巨噬细胞的细胞毒活性 从图5可以看出人γδT细胞对巨噬细胞和M tb感染后巨噬细胞均有细胞毒活性,且人γδT细胞对两者的杀伤活性均随效靶比的增加而增加;在效靶比相同的条件下人γδT细胞对M tb感染后巨噬细胞的杀伤活性高于对未感染巨噬细胞的杀伤活性。不加效应细胞组,M tb感染后的巨噬细胞发生部分凋亡,其自然死亡率高于未用M tb感染的巨噬细胞。
2.5 IL-15对人γδT细胞杀伤 M tb感染 PM A分化 THP-1细胞的影响 IL-15刺激人γδT细胞后,效应细胞与靶细胞以10∶1的比例作用,人γδT细胞对M tb感染后的PMA分化 THP-1细胞的杀伤活性为(64.06±4.07)%,IL-15刺激前人γδT细胞对M tb感染后的 PMA分化 THP-1细胞的杀伤活性为(46.81±2.04)%,差异有统计学意义(P<0.05)。
3 讨 论
THP-1细胞来源于人急性单核细胞白血病细胞,其细胞表型和分化更能完整的代表实验中人单核巨噬细胞系统的功能趋势,ST细胞比动物细胞能更真实地反映人类实验模式,因此是目前运用较多的用以研究单核巨噬细胞分化及功能的细胞模型。THP-1细胞在 PMA分化前后对 M tb的吞噬能力有很大差异。THP-1细胞对 M tb的吞噬能力较低;PMA分化后的 THP-1细胞变得具粘附、贴壁、特性形态不规则,此时的THP-1细胞可认为是巨噬细胞,对M tb的吞噬能力变强。我们用流式细胞术以及抗酸染色后显微镜检的方法 M tb感染巨噬细胞的模型加以验证,两种方法检测的结果一致,但用流式细胞术检测单核巨噬细胞对 M tb的吞噬作用,方法简便、快速、客观、重复性好。

图3 γδT细胞与靶细胞活力检测A:M tb A T中γδT细胞百分率;B:γδT细胞的活力;C:M tb感染的巨噬细胞的活力;D:未感染巨噬细胞的活力Fig.3 The vitality of gammadelta T cellsand target cells A:The percentage of gammadelta t cells in M tb A T;B:The viability of gammadelta T cells;C:The viability of M tb infected macrophages;D:The viability of uninfected macrophages
本实验用经 PMA诱导分化后的 THP-1细胞作为 Mtb感染对象,建立和完善了体外研究 M tb与巨噬细胞相互作用的模型。用CFSE/PI双标记的流式细胞术检测γδT细胞对 M tb感染巨噬细胞的细胞毒活性。传统检测γδT细胞细胞毒活性的方法是51Cr释放实验,虽然这种方法重复性好,操作简单,但它仍有几个缺点,如标记的细胞51Cr自发释放率高;细胞杀伤的实际情况和51Cr标记的细胞内蛋白释放入上清液有时间延迟;在总体水平检测细胞的裂解,而不是在单细胞水平上;需处理放射性同位素等等。流式细胞术检测细胞毒的方法基于单细胞水平,克服了上述方法的缺陷,实验原理是先用第一种荧光染料CFSE标记靶细胞,用以区分效应细胞和靶细胞。再用第二种DNA荧光染料 PI来区分细胞膜已破坏的靶细胞并计算其百分率。此方法中CFSE标记靶细胞的浓度很关健,我们通过多次实验发现,靶细胞浓度在1×106/m l的条件下,终浓度8μmol/L的 CFSE是较理想的标记浓度,此时CFSE阳性靶细胞的峰值在103处,可以很好的区分效应细胞和靶细胞,且对靶细胞的活性没有影响。
实验显示人γδT细胞对巨噬细胞和 M tb感染巨噬细胞均有细胞毒活性,且随着γδT细胞与靶细胞比例的增加,人γδT细胞对靶细胞的细胞毒活性亦增强。在相同效靶比的情况下,人γδT细胞对M tb感染巨噬细胞的细胞毒活性强于对未感染巨噬细胞的细胞毒活性,这可能与 M tb感染后巨噬细胞表面分子表达发生变化,人γδT细胞易于识别有关。γδT细胞表面可以表达C型凝集素家族跨膜蛋白N KG2D,可以识别 M HC-I类链相关分子 A(M HC class I chain-related molecules A,MCIA),M ICA应激性表达在一些肿瘤细胞或病原体感染细胞的表面。有研究显示N KG2D-M ICA相互作用可以直接活化 Vγ9Vδ2细胞〔6〕,而 IL-15可以增加人γδT细胞N KG2D的表达,在加强抗 M tb感染的保护性免疫应答中发挥一定的作用〔7〕。我们在实验中发现 IL-15刺激后的人γδT细胞对 M tb感染巨噬细胞的细胞毒活性增强。现有研究证明人γδT可以通过颗粒酶和穿孔素途径杀伤 M tb感染巨噬细胞〔8〕,人γδT细胞是否通过N KG2D途径杀伤结核杆菌感染巨噬细胞有待进一步的实验证明。


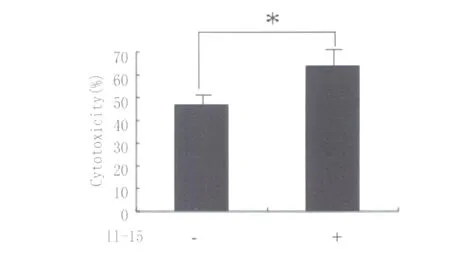
图6 IL-15对人γδT细胞杀伤 M tb感染巨噬细胞的影响Fig.6 The influence of cytotoxicities of gdT cellsagainst M tb infected macrophages
在过去十多年的研究中,国内外众多学者对γδT细胞在抗结核感染中的作用作了大量的研究,使我们对γδT细胞参与结核感染时的作用机制及γδT细胞与其它细胞亚群之间的相互作用有了一定认识,但由于γδT细胞表现型的多样性和分泌细胞因子的复杂性,使得其对抗原识别的分子机理、参与调节免疫应答、免疫耐受的确切机制等问题尚不甚明了,还有很多现象难以解释,甚至出现了一些前后矛盾的结果。但有一点已经得到广大学者的肯定,那就是γδT细胞在结核感染免疫中能对宿主提供保护作用。在抗感染方面,国外已经开展针对 IL-15的基因治疗,而国内这方面研究比较少,开展针对IL-15的研究可为防治胞内病原体感染提供新的思路和策略。
〔1〕Wang J,Santosuosso M,Ngai P,et al.Activation of CD8+T cells by mycobacterial vaccination p rotects against pulmonary tuberculosis in the absence of CD4+T cells〔J〕.J Immunol,2004,173(7):4590-4597.
〔2〕Dieli F,Troye-Blomberg M,Ivanyi J,et al.Vg9/Vd2T lymphocytes reduce the viability of intracellular M ycobacterium tuberculosis〔J〕.Eur J Immunol,2000,30(5):1512-1519.
〔3〕Yajima T,Yoshihara K,Nakazato K,et al.IL-15 regulates CD8+T cell contraction during primary infection 〔J〕.J Immunol,2006,176(1):507-515.
〔4〕Umemura M,Nishimura H,Hirose K,et al.Overexpression of IL-15 in vivo enhances protection against Mycobacterium bovis bacillus Calmette-Gurin infection via augmentation of NK and T cytotoxic 1 responses〔J〕.J Immunol,2001,167(2):946-956.
〔5〕金齐力,姜丽娜,姚春艳,等.流式细胞术检测单核巨噬细胞吞噬荧光素标记结核分枝杆菌的方法学探讨〔J〕.蚌埠医学院学报,2008,33(5):505-508.
〔6〕von Lilienfeld-Toal M,Nattermann J,Feldmann G,et al.Activated gammadelta T cells express the natural cytotoxicity receptor natural killer p44 and show cytotoxic activity against myeloma cells〔J〕.Clin Exp Immunol,2006,144(3):528-533.
〔7〕Boom WH,Balaji KN,Nayak R,et al.Characterization of a 10-to 14-kilodalton protease-sensitive Mycobacterium tuberculosis H37Ra antigen that stimulates human gammadelta T cells〔J〕.Infect Immun,1994,62(12):5511-5518.
〔8〕Dieli F,Troye-Blomberg M,Ivanyi J,et al.Granulysin-dependent killing of intracellular and extracellular Mycobacterium tuberculosis by Vγ9/Vδ2 T lymphocytes〔J〕.J Infect Dis,2001,184(8):1082-1085.
Effect of interleukin 15 on the cytotoxicity of humanγδT cellsagainst Mycobacterium tuberculosis infected THP-1 cells
JIN Qi-li,W EILi,JIANG Li-na,YAO Chun-yan,L IBai-qing
(1.Department of Imm unology,Bengbu M edical College;2.Anhui Key Laboratory of Infection and Immunity at Bengbu Medical College;3.Department of Pathogen Biology,Bengbu Medica l College;4.Department of Pathophysiology,Bengbu Medical College 233030,China)
To establish themodel of M ycobacterium tuberculosis(M tb)infected THP-1 cells,THP-1 cellswere infected by Mtbat a 10∶1 ratio for 18 h.And to establish themethod for detection of cytotoxicity of human gd T cells against M tb infected THP-1 cells,peripheral blood mononuclear cells(PBMC)from normal human subjects were stimulated with Mtb.Ag to generate M tb.Ag activated T cells(M tb.A T)that wereγδ T cellsp redominantly and as the effector cells(E).And the Mtb infected THP-1 cells labeled with CFSE as target cells(T).The effector cellsand target cells were cocultured for 4 h with different proportions,and both CFSE and PIpositive cells analyzed by flow cytometry as the killed target cells were stained with PI.While human gd T cells and THP-1 cells were cocultured for 4 h at the proportions from 1∶1 to 50∶1,the cytotoxicities of humanγδT cells increased from 16.1%to 47.2%.As humangd T cells and M tb infected THP∶1 cells were cocultured for 4 h at the proportions from 1 ∶1 to 50 ∶1,the cytotoxicities of humanγδT cells increased from 22.5%to 80.7%.It’s concluded that the cytotoxicities of humanγδT cells against Mtb infected THP∶1 cells are higher than uninfected THP-1 cells.Furthermo re,the cyto toxicities increase when E/T proportions increase and IL-15 could enhance the cytotoxicities of humanγδ T cells against M tb infected macrophages.
IL-15;M ycobacterium tuberculosis;γδ T cells;THP-1 cell;cytotoxicity
2.安徽省感染与免疫重点实验室,蚌埠233030;3.蚌埠医学院病原生物学教研室,蚌埠 233030;4.蚌埠医学院病理生理学教研室,蚌埠 233030
R378
A
1002-2694(2010)10-0926-05
*国家科技重大专项基金课题(2008ZX10003011),安徽省省级重点实验室重点科研项目(2004 sys008),蚌埠医学院院级科研项目(BY0918))
李柏青,Email:baiqingli@bbmc.edu.cn
1.蚌埠医学院免疫学教研室,蚌埠 233030;
2009-12-21;
2010-03-24
