高产生物表面活性剂菌株的紫外诱变选育
2010-01-11周理志刘建勋常泽亮杜国丰梅晓丹
周理志,刘建勋,常泽亮,谢 英,杜国丰,赵 静,梅晓丹*
(1.中石油塔里木油田分公司新疆库尔勒塔里木指挥部油气工程研究院,新疆库尔勒 841000;2.大连百奥泰科技有限公司研发中心,辽宁大连 116025)
1 材料与方法
1.1 材料
1.1.1 供试菌株 从新疆塔里木油田样品中分离纯化的产表面活性剂的菌株B IT-TLM1。
1.1.2 培养基(g/L) ①无机盐培养基:NH4Cl 2.0,K2HPO41.5,KH2PO43.0,MgSO40.1,CaCl20.01,葡萄糖10,pH 7.5;②蓝色凝胶培养基:牛肉膏1,葡萄糖20,蛋白胨5,酵母膏0.2,琼脂18,十六烷基三甲基溴化铵0.2,亚甲基蓝0.01。
1.2 方法
1.2.1 B IT-TLM1菌株生长曲线的测定 从平板上挑取B IT-TLM1菌株的单菌落,接种到无机盐培养基中,40℃、150 r/min振荡培养20 h,测定发酵液的表、界面张力,每隔2 h取4 mL发酵液在600 nm波长下测其OD值,绘制该菌的生长曲线。
1.2.2 紫外线诱变 取在40℃下振荡(150 r/min)培养20 h的B IT-TLM1的培养液(OD600=1.580)进行梯度稀释10-1、10-2、10-3、10-4、10-5、10-6、10-7,取100μL涂布于蓝色凝胶平板[6],40℃静置培养20 h,选取平板上菌落数为200~300个的稀释浓度作为最佳的稀释浓度。以最佳的稀释浓度进行平板涂布后将培养皿置于与紫外灯(40 W)相距40 cm处分别照射10、20、30、40、50 s,照射之后立即将平板放置暗处避光2 h,另设未经紫外光照过的B IT-TLM1平板作为对照组,将对照组与试验组平板均于40℃静置培养20 h,观察对照组与试验组平板菌落数,试验组再生菌落计数为B,对照组再生菌落计数为A,计算诱变致死率[7]:

1.2.3 诱变菌株的筛选 ①初筛:将菌株B ITTLM1紫外诱变后的再生菌落接种于蓝色凝胶平板,40℃培养20 h,选取蓝色凝胶平板蓝色晕圈直径比原始菌株B IT-TLM1大的菌株进一步复筛;②复筛:将初筛后的菌株接种于无机盐培养基中,在40℃、150 r/min下振荡培养20 h。将发酵液8 000 r/min离心20 min除去菌体,上清液用浓HCl调pH至2.0,出现絮状沉淀,4℃静置过夜,10 000 r/min离心30 min收集沉淀,用pH 2.0的酸溶液洗涤1次,将该沉淀溶于NaOH溶液,使最终pH值为7.0,干燥后得到浅褐色疏松状固体的表面活性剂粗品。纯化时,将粗品置二氯甲烷中抽提,旋转蒸发后于稀NaOH溶液中溶解,形成多泡液体,滤纸过滤后,滤液再次加HCl调pH至2.0,将得到的沉淀离心,该沉淀物去除残留水分后即为纯品[8],称重,计算发酵液中每克菌体表面活性剂的产量,与对照组相比,筛选出高产表面活性剂的诱变菌株。
1.2.4 诱变菌株遗传稳定性测定 将筛选出的高产表面活性剂菌株在液体培养基中连续培养7代,于第1代、第4代、第7代测定其产表面活性剂的能力,考察诱变菌株产表面活性剂性能的稳定性。
1.2.5 碳源对诱变菌株产表面活性剂的影响在无机盐培养基中分别添加1%的糖蜜、蔗糖、葡萄糖、可溶性淀粉、半乳糖、固体石蜡6种不同的碳源,在40℃、150 r/min条件下培养20 h,测定培养液中表面活性剂的产量,并以原始菌株B ITTLM1为对照,比较诱变前后菌株利用不同碳源产生物表面活性剂的能力[9]。
1.2.6 氮源对诱变菌株产表面活性剂的影响在无机盐培养基中分别添加0.2%的蛋白胨、牛肉膏、尿素、KNO3、NH4Cl、NH4NO36种不同的氮源,在40℃、150 r/min条件下培养20 h,测定发酵液中表面活性剂的含量,并以原始菌株B ITTLM1为对照,比较诱变前后菌株利用不同氮源产生物表面活性剂的能力[10]。
最后,在表6的各个模型中我引入了最后一个变量——公民性,该变量是本次研究中的一个创新,旨在探究公民的社会责任感与社会距离之间的关系。通过因子分析发现,在研究之初所选择的4个指标中,由“您对地方人大的日常工作和决策的关注程度”和“您对居民/村民委员会日常工作和决策的关注程度”这两个最高负荷的题项所构成的测度比开始所选择的4个题项构成的测度更加可信。因此用这两个题项构成了一个新的变量“公民性”,用来测量城市居民社会责任感的高低,如表5所示。
1.2.7 盐度对诱变菌株产表面活性剂的影响将菌株按照5%的接种量接种于不同盐度的无机盐培养基中,分别为0、1%、2%、3%、4%、5%、8%NaCl,在40℃、150 r/min条件下培养20 h,测定发酵液中表面活性剂的含量,并以原始菌株B IT-TLM1为对照,比较诱变前后盐度对菌株产生物表面活性剂的影响。
1.2.8 pH对诱变菌株产表面活性剂的影响 将诱变菌株按照5%的接种量接种于不同pH值的无机盐培养基中,pH分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0,在40℃、150 r/min条件下培养20 h,测定发酵液中表面活性剂的含量,并以原始菌株B IT-TLM1为对照,比较诱变前后不同酸碱度对菌株产生物表面活性剂的影响。
2 结 果
2.1 BIT-TLM 1菌株生长曲线
B IT-TLM1菌株生长延滞期较短,10 h即可进入对数生长期,在20 h以后达到稳定期,测定此时发酵液的表、界面张力分别为29.29和0.61 mN/m,可见20 h为B IT-TLM1的最佳培养时间(图1),该研究用培养20 h的B IT-TLM1发酵液进行诱变。
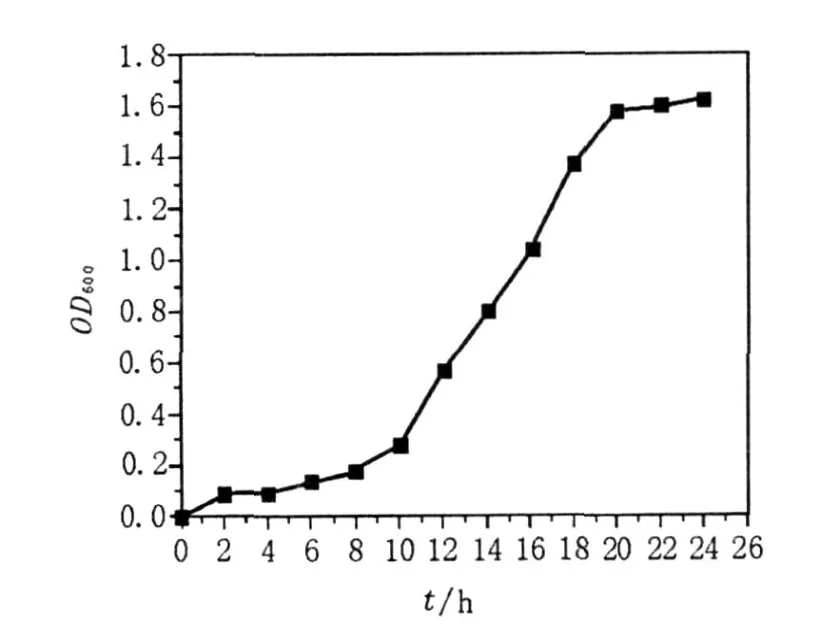
图1 BIT-TLM1菌株生长曲线Fig.1 Growth curve for strain B IT-TLM1
2.2 紫外诱变BIT-TLM1再生株致死率曲线
利用紫外线对B IT-TLM1菌株进行诱变处理,其致死率与照射时间的关系曲线见图2。从图2可以看出,紫外线的处理时间与致死率之间存在明显的正效应关系,随着紫外线处理时间的延长,致死率逐渐升高。紫外线分别处理30 s和40 s时,致死率分别为78.3%和92.6%,处理50 s时,致死率为98.5%。因此,紫外线处理的时间控制在40 s可达到预期的致死率。

图2 BIT-TLM1菌株紫外诱变的致死曲线Fig.2 Lethal curve ofUV mutagenesis for strain B IT-TLM1
2.3 高产表面活性剂菌株的筛选
将紫外诱变(紫外光照射40 s,致死率为92.6%)后的B IT-TLM1再生菌株(图3、图4)接种于蓝色筛选培养基,40℃培养20 h,选取在筛选培养基上蓝色晕圈直径比原始菌株B IT-TLM1大的菌株共10株进入复筛(图5)。
图5 紫外诱变后的菌落形态Fig.5 Colonial morphology after UV mutagenesis
将初筛后的10株诱变菌株在40℃、150 r/min条件下培养20 h,按照1.2.3中②的方法计算表面活性剂产量,得到3株产量提高的菌株,标号为UV-6、UV-8、UV-10。
2.4 遗传稳定性实验
为了检测诱变菌株UV-6、UV-8、UV-10产表面活性剂的性状是否稳定,将上述3株菌与原始菌B IT-TLM1分别接入液体培养基中,连续培养7代,分别测定其表面活性剂产量(表1)。
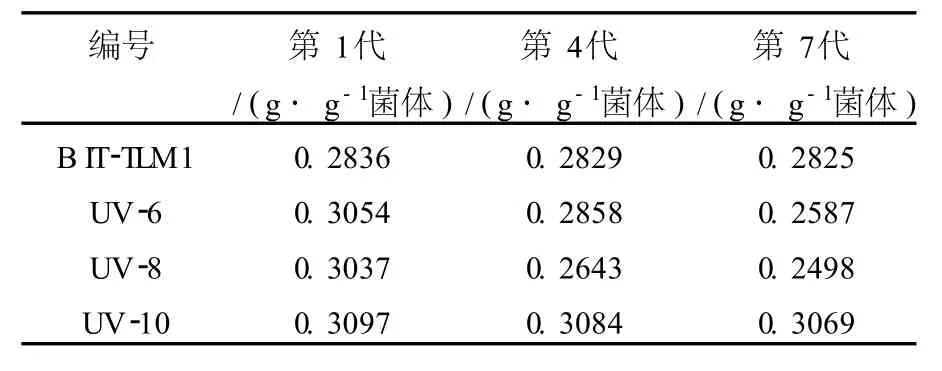
表1 诱变菌株的遗传稳定性测定结果Table 1 Genetic stability determination results ofmutant strains
由表1可知,UV-6与UV-8在连续传代培养后产量不稳定,而UV-10的遗传性能比较稳定。
2.5 碳源对诱变菌株UV-10产表面活性剂的影响
从图6中可以看出,以糖蜜、蔗糖及固体石蜡为碳源时,诱变菌株UV-10表面活性剂产量均比B IT-TLM1高,其中糖蜜和葡萄糖是较佳的碳源,产量比BIT-TLM1分别提高了9.74%和9.22%,表明单糖比二糖及多糖对菌株代谢产表面活性剂的能力要好,诱变菌株UV-10能利用固体石蜡产表面活性剂,其能力与蔗糖相当,为高含蜡油藏利用微生物增产提供了保障。
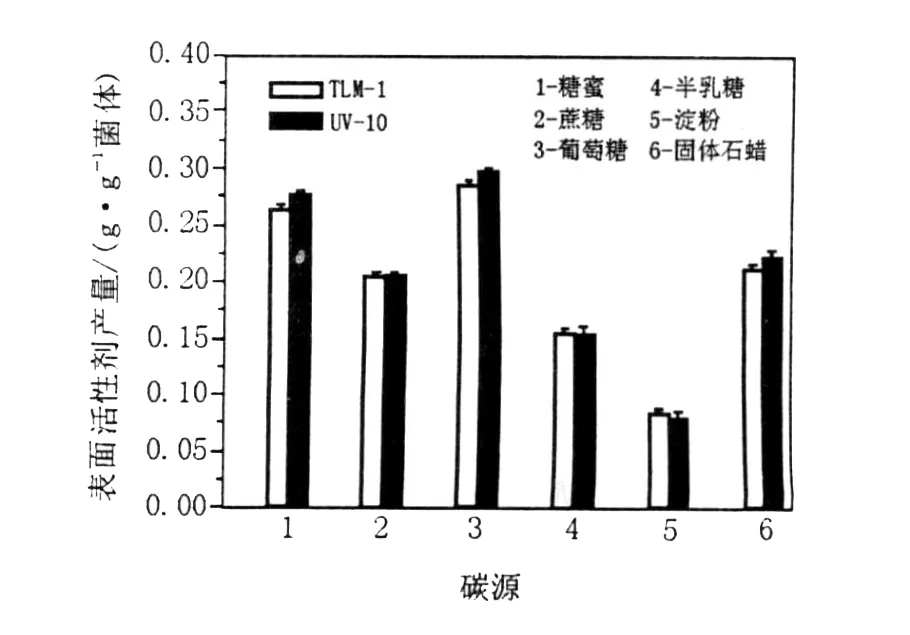
图6 碳源对诱变菌株UV-10表面活性剂产量的影响Fig.6 Effects of carbon sources on the surfactant production of mutant strain UV-10
2.6 氮源对诱变菌株UV-10产表面活性剂的影响

图7 氮源对诱变菌株UV-10表面活性剂产量的影响Fig.7 Effects of nitrogen sources on the surfactant production of mutant strain UV-10
从图7中可以看出,添加不同的氮源,诱变菌株UV-10表面活性剂的产量均比B IT-TLM1高。其中以硝酸钾为氮源时,产量提高了5.66%;以无机氮源氯化铵为氮源时诱变菌株UV-10的表面活性剂产量为0.309 7 g/g菌体,比采用牛肉膏、蛋白胨、酵母浸粉在相同条件下更经济,为在采油领域大规模应用提供了实验依据;以有机氮源尿素为氮源时表面活性剂产量较低,但也比原始菌株产量(0.135 g/g菌体)提高了7.41%。
2.7 盐度对诱变菌株UV-10产表面活性剂的影响
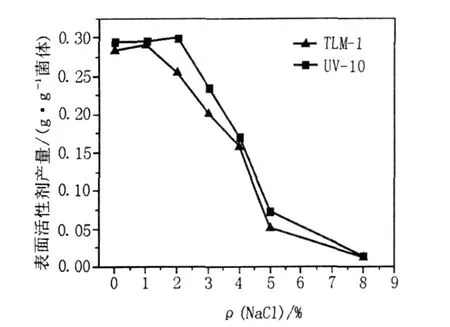
图8 NaCl浓度对诱变菌株UV-10表面活性剂产量的影响Fig.8 Effects of NaCl concentration on the surfactant production of mutant strain UV-10
从图8可以看出,原始菌株B IT-TLM1在1%NaCl浓度下表面活性剂的产量达到最大,为0.278 6 g/g菌体,而诱变菌株UV-10在2%NaCl下表面活性剂产量达到最大,比原始菌株BITTLM1提高了17.21%,表明诱变菌株UV-10最佳耐受的盐度为2%,继续添加盐会影响产量,NaCl浓度超过2%产量急剧下降,盐浓度超过5%时,菌几乎不生长,高浓度的盐会使微生物细胞脱水,代谢终止。随着环境盐度的改变,微生物要适应这种环境必须对外界的渗透压做出相应的反应[11],推测诱变后的菌株UV-10在5%的盐度下仍能生存,是因为它通过对自身的基因调控分泌了某些渗透压保护剂,这可以从诱变后表面活性剂产量看出来。
2.8 pH对诱变菌株UV-10产表面活性剂的影响
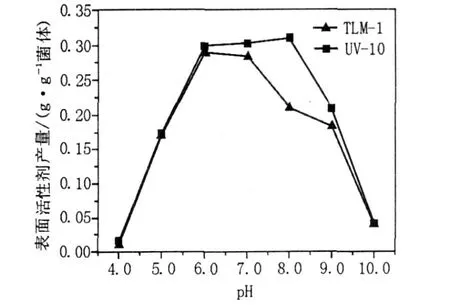
图9 pH对诱变菌株UV-10表面活性剂产量的影响Fig.9 Effects of pH value on the surfactant production of mutant strain UV-10
从图9可以看出,诱变前后的菌株在5.0~9.0的pH值范围内均生长,且在pH 7.0左右产表面活性剂的能力最强,原始菌株B IT-TLM1在pH 6.0时表面活性剂的产量为0.289 1 g/g菌体,而诱变菌株UV-10的产量在弱碱性pH 8.0下达到最佳,为0.309 7 g/g菌体,比诱变前提高了47.48%,经过紫外诱变,菌株可在弱碱性条件下代谢产表面活性剂,但pH达到10.0时表面活性剂产量仅为0.040 9 g/g菌体。
以上结果表明诱变菌株虽然能够耐受一定范围的pH波动,但是pH过高过低会导致溶液中渗透压发生变化,从而导致微生物细胞内外环境的渗透压平衡遭到破坏,进而对微生物的生长代谢产生抑制,严重的导致细胞死亡。因此,pH 8.0为诱变菌株最适产表面活性剂条件。
2.9 诱变菌株UV-10产表面活性剂的初步定性分析
利用1.2.3中②的方法,将原始菌株B ITTLM1、诱变菌株UV-10的代谢产物进行酸沉[12],提纯后经薄层色谱(TLC)分析,UV-10所产生的生物表面活性剂与茚三酮剂作用后显紫红色(结果未示)[13],与标准品结果相对照,初步判定诱变菌株UV-10所产生的是一类脂肽类的生物表面活性剂。
3 讨 论
为筛选出生物表面活性剂高产菌株,本试验对1株产表面活性剂的菌株B IT-TLM1进行了紫外诱变选育,在蓝色凝胶平板上通过两步筛选及遗传稳定性研究得到1株高产表面活性剂的诱变菌株UV-10,在150 r/min,pH 8.0,40℃培养20 h,其最大产量达到0.309 7 g/g菌体,比原始菌株B IT-TLM1的产量(0.283 6 g/g菌体)提高了9.2%。此前,Lin等[14]在Bacillus lichenifor m isJF-2培养液中加入诱变剂,通过一系列的筛选,最后得到1株变异株Bacillus lichenifor m isKGL11,它产生的生物表面活性剂浓度为390 mg/L,是Bacillus lichenifor m isJF-2产生的生物表面活性剂浓度的12倍,而且生物表面活性剂种类相同。本实验采用紫外诱变选育,获得了较好的效果,若结合其他诱变方法的使用,菌株产表面活性剂的能力有待于进一步提高,同时这株从新疆塔里木筛选出来的菌株,其理化性质、分类地位、所产生物表面活性剂的种类,对新疆微生物菌群分布研究也有重要意义,其相关的内容尚需进一步研究。
[1] Arvisf G,Johnsonm J.A glycolipid produced by Pseudomonas aeruginosa[J].J Am Chem Soc,1949,71:4124-4126.
[2] Gabriel a seydlova,Jaroslava svobodova.Review of surfactin chemical properties and the potential biomedical applications[J].Central European Journal of Medicine,2008,3(2):123-133.
[3] KappeliO,Walther P,Mueller M,et al.Structure of cell surface of the Yeast and its relation to hydrocarbon transport[J].Arch Microbiol,1984,138:279-282.
[4] Kim HS,Yoon BD,Choung DH,et al.Characterization of a biosurfactant,mannosylerythritol lipid produced from Candidasp.SY16[J].Applied Microbiological Biotechnology,1999,52:713-721.
[5] 宋绍富,张忠智,雷光伦,等.高效驱油菌Ⅰ的选育与室内岩心模拟驱油研究[J].石油化工高等学校学报,2003,16:31-35.
[6] 沈薇,杨树林,宁长发,等.蓝色凝胶平板法筛选生物表面活性剂产生菌[J].南京理工大学学报,2005,29(4):486-490.
[7] 王慕华,孙文敬,郭金权,等.紫外诱变原生质体选育D-核糖生产菌株[J].工业微生物,2005,(1):24-27.
[8] 张翠竹,张心萍,梁凤来,等.1株地衣芽胞杆菌产生的生物表面活性剂[J].南开大学学报(自然科学版),2000,23:41-45.
[9] 卢国满,刘红玉,曾光明,等.生物表面活性剂产生菌犁头霉菌(Absidia orchidis)的筛选及发酵条件优化[J].环境科学学报,2006,26(9):1426-1432.
[10] 严平,朱永光,吴斌,等.降解炼油废水菌株0297发酵条件的研究[J].环境科学与技术,2006,29(4):22-24.
[11] Wood J M.Osmosensing by bacteria:signals and membranebased sensors[J].Microbiol Mol Biol Rev,1999,63(1):230-262.
[12] Peypoux F,Bonmatin J M,Labbe H,et al.[Ala4]surfactin,A novel isoform from Bacillus subtilisstudied by mass and NMR spectroscopies[J].European Journal of Biochemistry,1994,224:89-96.
[13] 周俊,谭宁华.植物环肽的薄层化学识别新方法及其在植物化学研究中的应用[J].科学通报,2000,45(10):1047-1051.
[14] Lin SC,MintonMA,SharmaMM,et al.Structural and immunological characterization of a biosurfactant produced byBacillus lichenifor m isJF-2[J].Appl Environ Microbiol,1994,60(1):31-38.
