通过p R1aS导肽提高植物中绿色荧光蛋白的激发强度
2010-01-06李小红王爱英沈海涛祝建波
王 辉,李小红,王爱英,沈海涛,祝建波
(石河子大学生命科学学院/石河子大学农业生物技术重点实验室,石河子832003)
通过p R1aS导肽提高植物中绿色荧光蛋白的激发强度
王 辉,李小红,王爱英,沈海涛,祝建波
(石河子大学生命科学学院/石河子大学农业生物技术重点实验室,石河子832003)
绿色荧光蛋白在植物细胞胞质表达中对转化植物细胞的再生存在不利的影响,为增强绿色荧光蛋白在植物细胞中的表达,在 mgf p的5’端连接了p R1aS信号肽序列,同时在3’末端引入滞留在内质网中的特异序列 KDEL,成功构建了植物表达载体pBL G-p R1aS-gfp,经转基因烟草表达分析,结果表明:转化体植株显著增加了绿色荧光蛋白在烟草中的表达,同时消除了绿色荧光蛋白对植物潜在的光毒害。这为植物转基因转化频率的研究和转基因植物安全性评价提供了一种有利的工具。
p R1aS导肽;绿色荧光蛋白;激发强度;烟草
绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。它由 gf p基因编码,具有238个氨基酸残基的多肽单体,分子量约为27kD[1]。GFP有2个吸收峰,最大吸收峰在395nm处,在475nm处还有1个吸收峰,前者由紫外光激发,后者由蓝光激发。发射光谱也具有2个峰值,分别为509nm、540nm,在前一峰处呈现绿色或黄绿色荧光[2]。GFP在植物体中形成生色团,发射绿色荧光,仅需要分子氧的存在,不需任何底物和外源辅助因子的参与。GFP荧光较为稳定,较抗光漂白,在植物体中能够稳定存在。GFP作为报告基因,能够代替GUS的作用,监测基因在生物体内的表达和蛋白质的定位[3]。其不需要破环细胞结构和化学染色而直接成像,检测极为方便。转基因植物中有较高水平的 GFP表达时,在长波紫外灯的直接照射下,可对转基因植物进行筛选[4]。
由于 GFP激发荧光没有放大作用,在很多的转基因植物中,直接观察仍很困难,甚至在某些植物细胞中存在不表达现象[5,6]。此外,GFP含量高时,转化细胞再生能力下降,表明 GFP可能对细胞仍然具有一定的毒害作用,从而影响到细胞的分化[7]。GFP可定位到细胞核、线粒体等细胞器[6,8,9]。细胞核是较大的细胞器,能积聚大量蛋白,而且细胞核中自发荧光物质少,又与细胞壁分开,将 GFP定位到细胞核能增强检测的灵敏性[6]。而Mankin等[10]研究发现,增加ER定位能减少光毒害。
本研究以p CMBIA1304上的m GFP5为模板,在其N端连接定位在内质网的信号肽,并通过PCR引物在C端引入 KDEL特异的氨基酸序列,在确保GFP编码框完整的基础上,以期解决 GFP在细胞质内存着潜在的毒性问题。
1 材料与方法
1.1 材料
烟草为栽培品种nc89;大肠杆菌菌株DH5α和农杆菌菌株GV3101为石河子大学农业生物技术重点实验室保存;各种限制性内切酶和其他工具酶等,如 T4DNA连接酶,DNA回收试剂盒、x-Gal、IPTG均购于 Promega公司;p BL G植物表达载体、PCAMBIA-1304、p M G-T-Ubinitin-p R1aS载体由本实验室提供或构建;p M G-T Easy和p MD-T载体购于Promega公司。
1.2 方法
1.2.1 p MD-T-p R1aS载体构建
上游 P1:5′-GGATCCACCATGGGATTTGTTCT CTTTTCAC-3;
下游 P2:5′-TCTA GA GGCACGGCAA GA GT GGGA T-3′。
根据本实验克隆的烟草p R1aS信号肽设计引物。在上下引物的5′端分别引入BamH I和Xba I酶切位点。碱裂解法小量提取p MG-T-Ubinitin-p R1aS质粒(本实验室构建)[11],以此为模板进行 PCR,反应体系:质粒模板 0.5mL,10×PCR buffer 2mL,MgCl21mL 10mmol/L dNTPs 0.3mL,引物 p R1aS up、down引物 (20mmol/L)各0.5mL,Taq DNA聚合酶(1U/mL)0.3mL,H2O 14.9mL。PCR反应条件为:94℃预变性5min;94℃变性30s,58℃退火30 s,68℃延伸30s,30个循环;72℃8min。
扩增完毕,用1%琼脂糖凝胶电泳检测。扩增片段用DNA凝胶回收试剂盒纯化。将经纯化的扩增片段与p MD-T载体直接连接,连接产物转化用的是CaCl2法制备的大肠杆菌DH5α感受态细胞。在含有氨苄青霉素(Amp),IPTG和X-gal的LB平板上挑选白色菌落,抽提质粒筛选出重组子。
1.2.2 pMD-T-gfp载体构建
根据p CMBIA1304质粒上 mgf p5基因的序列,利用 Premier5.0设计合成 PCR两端引物。并在引物的上下游分别引入Xba I和Sac I酶切位点。同时在 mgf p4编码区的3’端引入内质网滞留信号KDEL(见下游引物下划线部分)。引物序列如下:
gfp up,5′-TCTA GA A TG GTA GA T CTG ACT A GT AAA GG-3′;
gfp dow n,5′-GTCGAC TTA GA G CTC GTC TTT GTA TA G TTC A TC C-3′。
碱裂解法小量提取p CMBIA1304质粒,以此为模板进行 PCR,反应体系:质粒模板 0.5mL,10×PCR buffer 2mL,MgCl21mL,10mmol/L dNTPs0.3mL,引物 gfp up、down引物 (20mmol/L)各 0.5mL,Taq DNA聚合酶(1U/mL)0.3mL,H2O 13.4mL。PCR反应条件为:94℃预变性5min;94℃变性30s,55℃退火40s,72℃延伸40s,30个循环;72℃8min。扩增完毕,用1%琼脂糖凝胶电泳检测。扩增片段用DNA凝胶回收试剂盒纯化。将经纯化的扩增片段与p MD-T载体直接连接,连接产物转化用的是CaCl2法制备的大肠杆菌DH5α感受态细胞。在含有氨苄青霉素(Amp),IPTG和X-gal的LB平板上挑选白色菌落,抽提质粒筛选出重组子。
1.2.3 pMD-T-p R1aS-gfp载体构建
用碱裂解法小量提取p MD-T-p R1aS和p MDT-gfp质粒,用Bam H I/Xba I和 Xba I/Sac I酶切,分别回收p R1aS和gfp目的片段。10mL连接反应体系中加入p R1aS∶gf p=3∶1的比例量,1单位T4DNA连接酶,16℃放置10h左右。对上述连接产物进行PCR,分别用p R1aS上游引物和gfp下游引物进行PCR,反应体系:连接产物模板1mL,10×PCR buffer 2mL,MgCl21mL 10mmol/L dNTPs 0.3mL,引物p R1aS上游和gfp下游引物(20mmol/L)各0.5mL,Taq DNA聚合酶(1U/mL)0.3mL,H2O 13.4mL。PCR反应条件为:94℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸45s,30个循环;72℃8min。PCR反应结束后,1.0%琼脂糖凝胶电泳分析,回收 PCR产物,并在10mL连接反应体系中加入3∶1比例量的插入片段和p MD-T载体片段,1单位 T4DNA连接酶,16℃放置10h左右。转大肠杆菌感受态,挑白斑 PCR、酶切鉴定,将鉴定为阳性的克隆送去测序。
1.2.4 植物表达载体p BLG-p R1a S-gfp构建
碱裂解法小量提取pBL G和p MD-T-p R1asgfp的质粒,用Bam HⅠ/SalⅠ分别进行双酶切,回收p BL G的大片段和p MD-T-p R1aS-gfp约844bp的目标片段,将回收片段按大片段∶小片段=1∶3的比例16℃连接10h。连接后转大肠杆菌感受态,经PCR筛选和酶切鉴定,提取阳性克隆质粒,采用冻融法转化农杆菌 GV3101,进行菌落PCR鉴定。
1.2.5 烟草的遗传转化及植株再生
接种 GV3101转化菌单菌落于含有抗生素的2mL LB液体培养基中,28℃培养1~2d,转接入40mL液体培养基中,28℃继续培养至OD600约0.5;取叶片全展开的无菌烟草叶,用剪刀剪成小块放入灭菌的MS液体培养基稀释过的农杆菌中,侵染10~15min,其间不断轻摇几次;取出材料,用无菌滤纸吸去多余菌液,于MS固体培养基中28℃暗培养2d;将材料转入MS1分化及筛选培养基中,在14h光照,10h黑暗的光周期和室温条件下培养,使其形成愈伤组织并分化出芽,其间每隔15d在相同的培养基上继代1次;将长至2~3cm的芽转入生根培养基MS2上诱导生根,得到完整再生植株。
1.2.6 转基因植物的PCR鉴定与荧光检测
选生根良好的转基因烟草,取1.5mL一致大小的叶片,用改良的SDS法提取烟草的DNA,将上述提取的转烟草总DNA进行PCR鉴定,用p R1aSup和gfp down引物进行 PCR,反应体系和条件同1.2.3。再生烟草植株中 GFP荧光观测使用OL YMPUS 1×71荧光倒置显微镜,分别用紫外或蓝色激发光观察烟草叶片压片或茎切片。
2 结果
2.1 植物表达载体pBLG-p R1aS-gfp构建
利用设计的烟草p R1aS信号肽引物,以本实验室构建的p MG-T-Ubinitin-p R1as为模板,通过 PCR方法获得的p MD-T-p R1aS阳性克隆,通过BamHⅠ/XbaⅠ双酶切验证,切出大小约90bp条带,与预期大小一致(图1)。利用mgf p5基因序列设计的引物,以提取的p CMBIA1304质粒为模板,通过 PCR方法获得的p MD-T-gfp阳性克隆,通过Xba I/Sac I双酶切鉴定,切出大小约754bp条带,大小与预期的一致(图2)。p MD-T-p R1aS和p MD-T-gfp双酶切的回收的p R1aS和gfp目标产物,体外直接连接后,利用p R1aS的上游引物和gfp的下游引物进行 PCR扩增,产物与p MD-T连接,获得的阳性克隆经 PCR鉴定,目标条带约844bp,与预期一致(图3),碱裂解法小量提取pBL G和 p MD-T-p R1aS-gfp 的质粒 ,用 Bam HⅠ/SalⅠ进行双酶切,回收pBLG的大片段和p MD-T-p R1aS-gfp约844bp的小片段,体外直接连接后,获得pblgpr1aS-gfp的阳性克隆经BamHⅠ和SalⅠ进行双酶切鉴定,目的条带约844bp。测序分析结果(图4)表明:重组基因碱基序列与原模板拼接后序列结果完全一致。
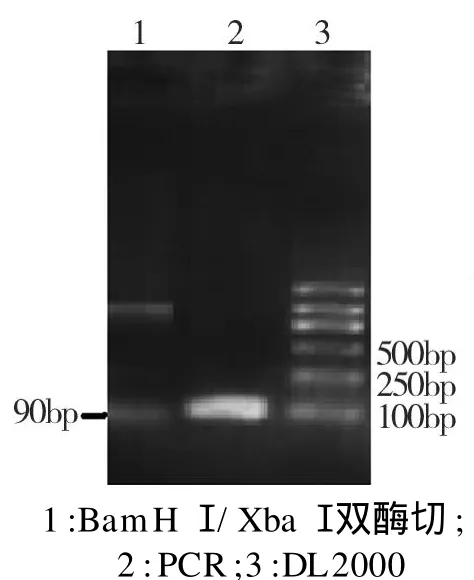
图1 pMD-T-p R1aS酶切结果Fig.1 Endonuclease digestion result of pMD-T-p R1aS

图2 pMD-T-gfp酶切结果Fig.2 Endonuclease digestion result of pMD-T-gfp

图3 pMD-T-p R1aS-gfp PCR结果Fig.3 PCR result of pMD-T-p R1aS-gfp

图4 pBLG-p R1aS-gfp酶切结果Fig.4 Endonuclease digestion result of pMD-T-p R1aS-gfp
2.2 转基因植物的PCR鉴定与荧光检测
将构建的pBL G-p R1aS-gfp载体经农杆菌介导法转化烟草叶片,经愈伤组织诱导成苗,获得再生苗约200株。随机选10株再生苗,各取叶片约0.1g,分别提取总DNA,用设计的 GFP引物进行PCR检测。在检测的10株再生烟草中有7株得到了预期大小的特异性的扩增条带,与阳性对照p BL G-p R1aS-gfp质粒扩增出的条带完全相同,而非转基因烟草的阴性对照未扩增出相应的条带(图5)。

图5 转pBLG-p R1aS-gfp基因烟草PCR鉴定Fig.5 PCR restult of transferring pBLG-p R1aS-gfp into tabacco
2.3 转基因烟草的荧光检测
检测结果见图6~12。剪取检测阳性的转基因烟草叶片,加少许水匀浆,取1滴在玻片上,在倒置显微镜下观察蓝光激发下gfp的匀浆的荧光表达情况见图6、图7。观察发现,在蓝光激发下转p BL G-p R1aS-gfp烟草绿色荧光最强,转pBL G-gfp烟草次之,正常烟草最弱。剪取检测阳性的转基因烟草叶片去除叶片的经脉,将叶肉分别在倒置荧光光显微镜自然光与蓝光激发观察转基因烟草叶片与正常烟草叶片(图8、图9、图12)。在蓝光激发下转p BL G-p R1aS-gfp烟草绿色荧光最强,转pblg-gfp烟草次之,正常烟草最弱。剪薄检测阳性的转基因烟草茎,将其分别在倒置荧光光显显微镜下观察(图10,图11)。转p BL G-p R1aS-gfp烟草的荧光最强,而转pblg-gfp烟草与正常烟草荧光强度差不多。

图6 转pBLG-p R1aS-gfp结构烟草匀浆在蓝光激发下的荧光Fig.6 Transgenic tobacco homogenate(pBLG-p R1aS-gfp)at fluorescence excitation of figure

图7 转pBLG-gfp结构烟草匀浆自然光和蓝光下的荧光Fig.7 Transgenic tobacco Homogenate(pBLG-gfp)under natural light and blue-ray fluorescence

图8 转pBLG-p R1aS-gfp结构烟草叶片在自然光和蓝光下的荧光Fig.8 Transgenic tobacco leaves(pBLG-p R1aS-gfp)under natural light and blue-ray fluorescence map

图9 转pBLG-gfp结构烟草叶片在自然光和蓝光下的荧光Fig.9 Transgenic tobacco leaves(pBLG-gfp)under natural light and blue-ray fluorescence

图10 转pBLG-p R1aS-gfp结构烟草茎在自然光和蓝光下的荧光Fig.10 Transgenic tobacco stem sections(pBLG-p R1a S-gfp)under natural light and blue-ray fluorescence

图11 转pBLG-gfp结构烟草茎在自然光和蓝光下的荧光Fig.11 Transgenic tobacco stem sections(pBLG-gfp)under natura light and blue-ray fluorescence

图12 普通烟草叶片在自然光和蓝光下的荧光Fig.12 Normal tobacco leaves under natural light and blue-ray fluorescence
3 讨论
原始的 GFP产生于水母的发光细胞中,并且必须经一系列翻译后的成熟步骤来产生能发出荧光的蛋白。翻译后 GFP成熟包括2个步骤,首先折叠脱辅基蛋白成活性构象,而后进行环化和氧化反应产生发光团。GFP的折叠是温度敏感性的,在异源系统中,较高的温度不利于 GFP的表达。经证实,GFP成熟过程的温度敏感性可以被氨基酸的替换所抑制。一般来说,体积大的氨基酸替换成小的氨基酸有利于 GFP蛋白的折叠。而本实验所使用的m GFP5是在m GFP4的基础上进行少数几个碱基突变,它编码的蛋白有V163A、I167T、S175G这些突变即有利于降低 GFP折叠时温度的敏感性,有利于蛋白的折叠。为了更有利于在植物中表达,m GFP5进一步消除 GFP编码序列中的隐蔽性内含子,将推测的5’端剪接位点和分支位点的识辨序列(381~462bp的碱基)进行了变异,并且有意识地降低了内含子的AU含量,保证 GFP在植物上的正确表达,它所编码的蛋白与野生型 GFP蛋白几乎相同。成熟蛋白的正确折叠保持了荧光特性和保护发光团免受溶剂的影响。
本研究前期构建的pBin438-GFP载体经多次农杆菌叶盘法转化烟草时发现,很难再生出正常植株,在诱导愈伤过程中总是会出现因黄化、白化现象,不能诱导出芽,即使诱导出芽,最终得不到正常的转基因植株。这可能是由于 GFP在细胞质中积累过多,对植物产生毒害作用引起的。因此,为了让转 GFP植物组织能够正常再生,本研究以p CMBIA1304上的m GFP5为模板,在其N端连接信号肽,通过引物在C端引入 KDEL特异的氨基酸序列,确保 GFP在内质网中蛋白的转移。新构建的植物表达载体pBL G-p R1aS-gfp通过农杆菌转化,能够获得正常再生的烟草和荧光增强的转基因阳性植株。
本研究通过倒置显微镜可观测到转p BL G-p R1aS-gfp的烟草激发荧光的强度较pBL G-gfp强,加入导肽可增加其在细胞里的表达。通过定位改造gf p可以快速检测gf p在烟草中的表达量,为分析其它载体在植物中表达分析提供依据。
这种定位改造的 GFP能够在植物中激发出较强的荧光,并有效解决 GFP胞质表达对植物再生的潜在的毒害作用,因此,用它作为报告基因来研究转基因植物的转化频率和进行转基因植物的安全性评价均是一种极为有利的工具。
[1]刘祖强,胡 敏,齐义鹏.绿色荧光蛋白的结构、发光机制及其应用研究[J].武汉大学学报(自然科学版),2000,46(2):211-214.
[2]周盛梅,孟凡国,黄大年,等.绿色荧光蛋白及其应用[J].生物工程进展,1999,19(2):56-59.
[3 张 峰,任 掩,陆长德.绿色荧光蛋白及其应用[J].生命科学,1999,11(2):61-65.
[4]刘默芳,王恩多.绿色荧光蛋白[J].生物化学与生物物理进展,2000,27(3):238-243.
[5]Hu W,Cheng C L.Expression of Aequorea green fluorescent protein in plant cells[J].FEBS Lett,1995,369(2-3):331-334.
[6]Haseloff J,Siemering K R,Prasher D C,et al.Removal of a cryptic intron and subcellular localization of green fluorescent protein are required to mark transgenic Arabidop sis plants brightly[J].Proc Natl Acad Sci U S A,1997,94(6):2122-2127.
[7]王兴春,杨长登.转基因植物生物安全标记基因[J].中国生物工程杂志,2003,23(4):19-22.
[8]Grebenok RJ,Pierson E,Lambert GM,et al.Green-fluorescent protein fusions for efficient characterization of nuclear targeting[J].Plant J,1997,11:573-586.
[9]Kohler R H,Zipfer W R,Webb W W,et al.The green fluorescent protein as a marker to visualize plant mitochondria in vivo[J].Plant J,1997,11:613-621.
[10]Mankin SL,Thompson W F.New green fluorescent protein genes for plant transformation:Intron-containing,ER-localized,and soluble-modified[J].Plant Molecular Biology Reporter,2001,19:13-16.
[11]史芳芳,周 鹏,武冬梅,等.泛素和 PR1a信号肽融合基因植物表达载体的构建[J].石河子大学学报(自然科学版),2006,24(3):266-269.
To Increase GFP Provocation Strength Through the Introduction of Peptide p R1aS
WANG Hui,LI Xiaohong,WANG Aiying,SHEN Haitao,ZHU Jianbo
(College of Life Science/Key Laboratory of Agricultural Biotechnology,Shihezi University,Shihezi 832003,China)
In the cytoplasm it play an adverse role GF Pregeneration of transformed plant cells.To enhance expression of GFPin plant cells,we successfully constructed the plant expression vector pBLG-p R1aS-gfp,in which mGF Pintroduces a signal peptide sequence of p R1aSat the 5 end and a special sequence of KDEL at the 3’end.The result confirmed that GFPwas significantly increased in transgenic tobacco,and simultaneously eliminated the potential light toxicity to plants.It provides a convenient tool for the study on transformation frequency and safety evaluation of the trans genic plants.
peptide pR1aS;modified green fluorescent protein;provocation strength;tobacco
Q933
A
1007-7383(2010)01-0001-05
2009-03-20
国家转基因重大专项(2009ZX08011-002),新疆兵团博士基金项目(2006jc07)
王 辉(1982-),男,硕士生,专业方向为植物基因工程技术应用;e-mail:xiaofei4700@163.com。
祝建波(1967-),男,副研究员,从事植物基因工程技术应用研究;e-mail:zjbshz@126.com。
