紫球藻溶气气浮法采收条件研究*
2010-01-05高莉丽江怀真刘天中
高莉丽,江怀真,刘天中
(1.中国海洋大学,山东青岛266003;2.中国科学院青岛生物能源与过程研究所,山东青岛266101)
紫球藻溶气气浮法采收条件研究*
高莉丽1,江怀真1,刘天中2**
(1.中国海洋大学,山东青岛266003;2.中国科学院青岛生物能源与过程研究所,山东青岛266101)
探讨溶气气浮法采收紫球藻细胞的可行性,较为详细地研究了气浮操作参数对气浮采收效果的影响,确定合适的紫球藻细胞溶气气浮采收工艺条件。结果表明,通过调节p H值,能够获得藻细胞絮体,从而为无絮凝剂添加的紫球藻细胞气浮采收创造了条件。确定的最佳溶气气浮工艺为:p H值10.1,溶气压力0.6 MPa,溶气时间17 h,溶气水进水流量60 L/h,溶气水/原料藻液体积比1.0。在此条件下,紫球藻的采收效果很好,细胞采收率可达到90%以上,浓缩倍数可达到4左右。培养液藻细胞浓度的增加对细胞采收率影响不大,但会降低浓缩倍数。
紫球藻;溶气气浮;气浮工艺条件;采收率;浓缩倍数
紫球藻是多种天然产物的来源,其生长过程中合成大量的藻胆蛋白、多不饱和脂肪酸(如AA和EPA)和藻多糖等生物活性物质[1],这些高价值活性物质除了作为食品和工业原料外,还可应用于医药、化妆品、精细化工等高附加值产业,具有广阔的应用前景和巨大的潜在市场,因而紫球藻具有很高的经济价值[2]。目前,紫球藻的规模培养和生物活性物质的提取工艺已经有了较为成熟的研究[3-5],但是由于紫球藻培养液的浓度较低,藻体密度与水相近,藻细胞形体微小,很脆弱,易受到损伤破裂,而传统的动力离心、过滤等采收技术能耗大、成本高、放大困难、对细胞的损伤明显,不太适用于紫球藻采收,也不利于降低紫球藻产品的生产成本,成为制约紫球藻开发利用的主要问题之一[6]。所以开发适用于紫球藻培养体系的细胞高效低能耗低成本采收分离技术显得越来越重要。
气浮分离技术形成于1940年代,是1种人为地向水体中导入细小气泡,使其黏附于絮粒上形成“气泡—絮粒”聚集体以降低絮粒体整体密度,并借气泡上升的浮力强行使絮粒体上浮形成浮渣层,由此实现固液快速分离的新型固液分离技术[7]。溶气气浮常用于对那些密度接近或小于水的细小颗粒的分离,如用于低浊、富含难以沉淀悬浮颗粒(如油类、纤维、活性污泥、生物膜、动植物或微生物细胞)的水体净化[8]。目前气浮法已被广泛应用于给排水、废水处理、石油化工、食品工业、生物发酵液分离等诸多领域,具有良好的分离效能、相对低廉的投资和操作运营成本。有关气浮法用于微藻细胞的分离采收,近来已有一些研究报道,如盐藻、小球藻、螺旋藻等的气浮采收,已可达到较高的采收率[9-11]。然而对于紫球藻,由于其在培养过程中容易分泌出胞外多糖,体系黏度相对较大,有关气浮法用于紫球藻的采收鲜有报道。
本文以紫球藻为研究对象,通过对藻细胞采收率R和浓缩倍数E的测定,考察了藻液p H值、溶气压力、溶气时间、溶气水进水流量、溶气水/原料藻液体积比、藻液浓度等对紫球藻细胞气浮采收效果的影响,初步确定了其气浮采收的操作条件。
1 材料与方法
1.1 材料、仪器
1.1.1 藻种 紫球藻(Porphyridium cruentum)藻种由中国海洋大学水产学院朱葆华老师提供,原始藻种储存于中国海洋大学藻种库。
1.1.2 仪器 PHS-2F型p H计(上海精密科学仪器有限公司);WFJ7200型分光光度计(上海尤尼柯仪器有限公司);LZB-4玻璃转子流量计(江阴市科达仪表厂)。
1.2 气浮分离装置与实验方法
气浮分离实验装置如图1所示,其主要由空气压缩机、贮气罐、饱和溶气罐、流量计和气浮分离塔等部分组成。其中,由碳钢制成的空气贮罐有效容积为100 L,操作压力为0~1.0 MPa;由不锈钢制成的饱和溶气罐有效容积为5 L,操作压力为0~1.0 MPa;气浮分离塔由有机玻璃制成,其内径为30 mm,高度为500 mm。
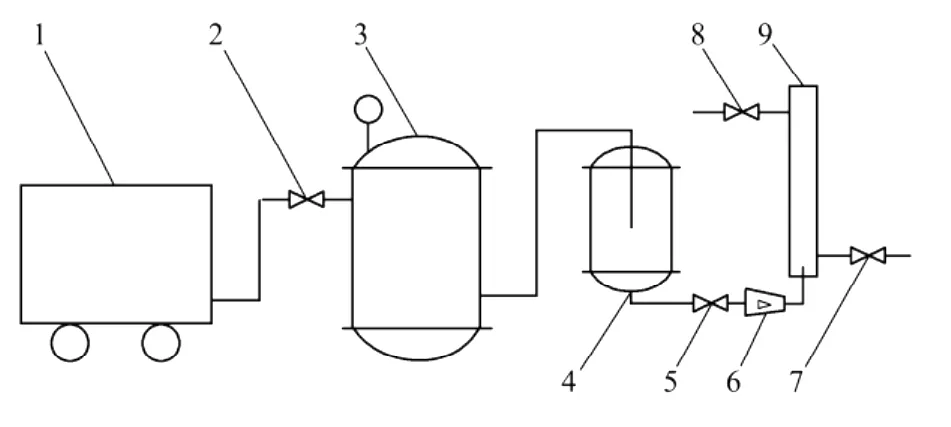
图1 气浮分离装置Fig.1 Schematic of dissolved air flotation device
气浮实验流程为:实验前,先向饱和溶气罐中一次性通入大约4 L水,打开空气压缩机向贮气罐内灌气,保持一定的溶气压力和溶气时间以制备溶气水。用1.0 mol/L的HCL和1.0 mol/L的NaOH溶液,将100 m L紫球藻培养液调节到一定的p H值后,一次性从分离塔上部倒入,然后从塔底迅速引入溶气水,控制其进水流量和进水体积。藻细胞开始气浮。待气浮完全后,分别计量采收残余液和浓缩液的体积,并测定残余液的藻细胞浓度,计算采收率和浓缩倍数,如下式所示[9]:

其中Cf—采收浓缩液的藻细胞浓度(以OD值表示),C0—原藻液藻细胞浓度,Cr—采收残余液藻细胞浓度,Vf—浓缩液体积;V0—原藻液体积;Vr—采收残余液体积。
藻液细胞浓度的测量是以空白培养液为对照,在分光光度上测定藻液在604 nm的光吸收值(OD604)来表示[12]。考虑到浓缩液中藻细胞易发生黏壁,且其OD值也过高,测定误差较大,因此采收浓缩液的藻细胞浓度cf是先测定采余残液的体积和藻细胞浓度(OD),再通过物料衡算来确定的,如下式所示。
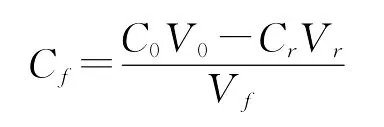
2 结果与讨论
2.1 藻液p H值对气浮采收效果的影响
实验研究了藻液调节到不同p H值对气浮采收效果的影响。取100 m L紫球藻液(初始藻液OD604为0.4),用1.0 mol/LHCl和1.0 mol/LNaOH调节到特定p H值后倒入采收塔内,按藻液体积与溶气水体积比1∶1通入预先在0.6 MPa平衡的溶气水,5 min后测定气浮采收率和浓缩倍数,结果如图2所示。
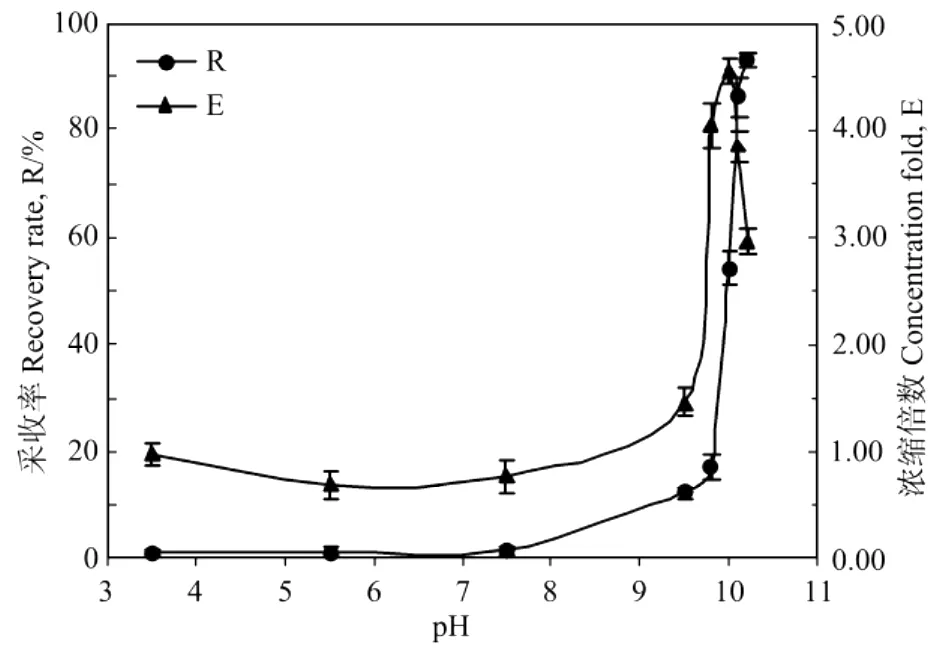
图2 pH值对紫球藻细胞培养液采收率和浓缩倍数的影响Fig.2 Effect of pH of Porphyridium broth on the recovery rate(R)and concentration fold(E)
可以看出,在低p H下紫球藻细胞几乎不能气浮采收。只有当藻液p H>9.5后,藻液中才开始出现少量的泡絮结合体,随着p H值的增大,藻细胞采收率和浓缩倍数迅速增大,在p H值达到10.1时达到最大,此时其采收率高达92%,对应的采收浓缩液的浓缩倍数约为4.5。之后,当继续调高p H达到10.3时,紫球藻细胞受碱损伤严重,出现少量自溶,絮片含水量增大,絮体反而悬浮在液体中,无法浮出水面,浓缩倍数也降低。因此对于该紫球藻细胞,其最适气浮采收p H值为10.1左右。事实上,许多文献的研究表明,细胞(颗粒)适度絮凝形成一定尺寸的絮粒是实现溶气气浮采收的必要条件[13-15]。对紫球藻,由于其没有纤维素构成的典型细胞壁结构,细胞表面是一层由可溶性多糖组成的黏质鞘,使其在水溶液中表现出负电性,所以可以通过调节溶液p H值的方法来中和其细胞表面的电荷,使藻细胞与溶液中的微小化合物结核相互聚合,产生脱稳现象,从而实现细胞的自絮凝。与螺旋藻和盐藻采收相似[9-10],这种采收方法不需要添加絮凝剂或者活性剂,既降低了生产成本,又简化了后续处理工艺,且有可能实现连续培养和连续采收的工艺耦合。但是由于最佳p H范围较窄,因此在操作上应注意准确控制其p H值。
2.2 溶气压力对气浮采收效果的影响
溶气气浮的原理是利用溶解于水中的气体在突然减压的释气过程中产生大量细小气泡,这些气泡与藻细胞絮体结合成泡絮结合体,因其比重略小于水而随气泡上浮,从而实现细胞与水体的分离。因此溶气水中溶解的气体量大小对于随后的释气过程产生气泡量的多少密切相关。理论上,溶气水中溶解的气体越多,产生的细小气泡也就越多,因此气浮带走的藻细胞也就越多,气浮采收率也会提高。显然对于气体的溶解而言,按照亨利定律,气体在水中的溶解度与其压力成正比,溶气压力越大,溶气水中溶解的空气量越大。为考察溶气压的影响,分别用不同溶气压力(0.2,0.4,0.6,0.8 MPa)经17 h平衡后的溶气水进行气浮实验。所用的紫球藻细胞培养液的OD604为0.394,调p H值为10.1,结果如图3所示。
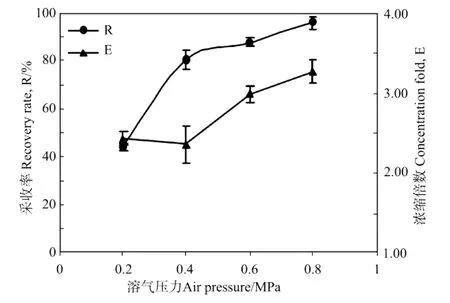
图3 溶气压力对紫球藻细胞培养液采收率和浓缩倍数的影响Fig.3 Effect of air pressure on the recovery rate(R)and concentration fold(E)from Porphyridium broth
可以看出,紫球藻细胞的气浮采收率R和浓缩液浓缩倍数E都随着溶气压力的增加而增大。同时在实验中还观察到,随着溶气压力的增加,溶气水产生的气泡更小,更加均匀,这与对溶气释气过程的热力学分析结果一致[16]。从实验结果中也可以看出,当溶气压力达到0.6 MPa以后,采收率和浓缩倍数变化不大,这说明在溶气气浮过程中,并不是所有的气泡都参与气浮,这可能是由于部分气泡未与微藻絮体发生碰撞结合的缘故。从另一个角度讲,虽然提高溶气压力可改善气浮效果,但是增大溶气压力会使采收成本增加。有研究表明溶气系统可占整个气浮分离系统投资和能耗的50%以上[17],所以综合考虑后本实验选用的溶气压力为0.6 MPa。
2.3 溶气时间对气浮采收效果的影响
空气属难溶气体,其在水中溶解度很小,一般的溶气水制备是将压缩空气直接打入预贮水的密封罐中,很少有搅拌。因此空气在水中的溶解基本上属于分子扩散过程,平衡时间很长。如果溶气时间不够,则溶气水中的气体含量偏小,释气时无法产生足够的气泡[18]。为此,本文考察了溶气压力0.6 MPa,不同溶气时间(13,15,17,19,21和23 h)对气浮采收效果的影响。实验选取的初始紫球藻液OD604为0.306,体积为100 m L、p H调节为10.1。通入溶气水量为100 m L,溶气水进水流速为60 L/h。实验结果见图4。
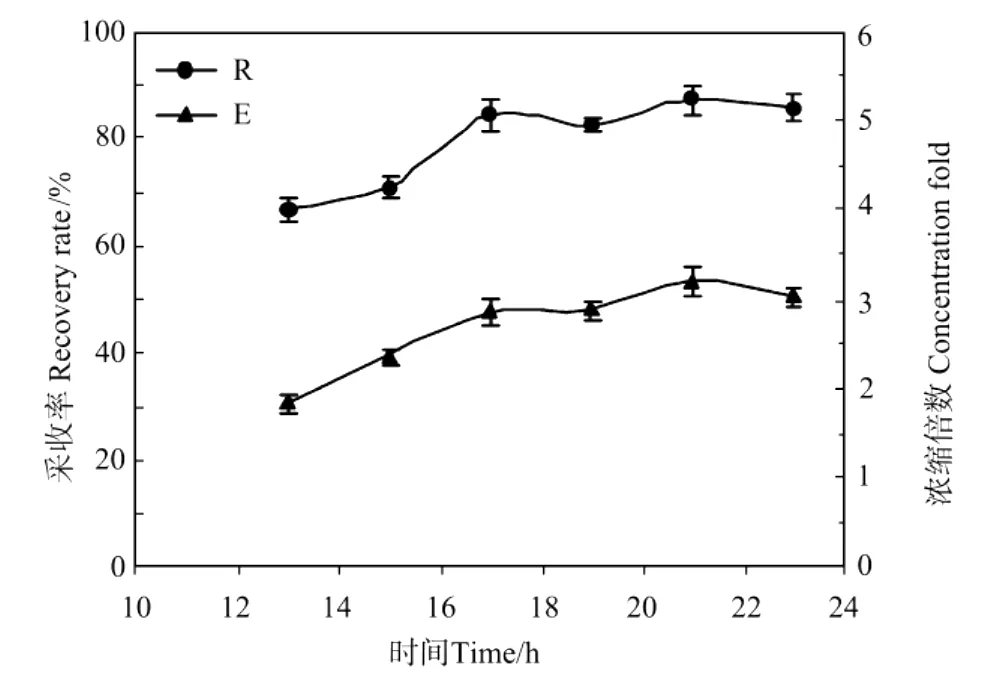
图4 溶气时间对紫球藻细胞培养液采收率和浓缩倍数的影响Fig.4 Effect of dissolved time on the recovery rate(R)and concentration fold(E)from Porphyridium broth
从图4中可以看出,随着溶气时间的增加,藻细胞采收率R和浓缩倍数E都有所增加。但当溶气时间达到17 h后,R和E基本上不再增大,达到最大值。这表明在本实验条件下的最佳溶气时间为17 h。当然,对于不同的溶气罐结构与操作方式,可能需要的饱和溶气时间各不相同。从效率来看,通过加设一些强化溶解扩散的内构件来缩短溶气时间是非常有利的。近年来,1种新型的多相泵-溶气泵已在一些气浮水处理工程中开始得到应用。这种溶气泵可以直接同时吸入水和空气,通过泵的高速离心旋转,实现溶气水的迅速混合与平衡,泵出的水就已经达到饱合溶气-俗称“白水”,完全省去了传统的溶气罐溶气过程,效率很高。采用这种溶气泵来制备溶气水将是微藻气浮采收的发展趋势。
2.4 溶气水进水流量对采收效果的影响
溶气水释气产生气泡与藻体结合形成泡絮结合体的上浮是一个比较缓慢的过程。由于泡絮结合体的密度与水非常接近,泡絮结合体上升的浮力很小。引入的溶气水流速过快,动能增加,很容易使藻液产生循环流[19],从而使泡絮结合体受到液体流动的扰动因惯性作用而改变方向,停止上浮,甚至下沉(泡絮结合体因流体动压而压缩使密度增大,或扰动剪切动使气泡破裂而解体)。为确定合适的溶气水流速,实验考察了溶气水进水流量分别为20,40,60,80和100 L/h下的气浮效果。实验采用的藻液体积为100 m L,OD604=0.46,p H值10.1,通入0.6 MPa经17 h平衡的溶气水100 m L,实验结果如图5所示。
可见,采收率R随着进水流量的增大先增大后减少,浓缩倍数则在40 L·h–1之后即呈现1个比较平缓的趋势。这是因为在较低的溶气水流速时,溶气水须经比较长的释放时间才能达到预定的溶汽水/藻液体积比,溶解在水中的空气达不到骤然减压释放的效果。随溶气水流速的增大,湍流程度加剧,有利于改善释气气泡与藻絮体的混合,使形成的泡絮结合体机会增多。但当达到一定流速后,溶气水流速的进一步增大会使体系产生循环流,反而带动泡絮结合体循环,无法气浮,从而降低了细胞采收率[16]。因此在本实验条件下合适的溶气流速范围是60 L·h-1。
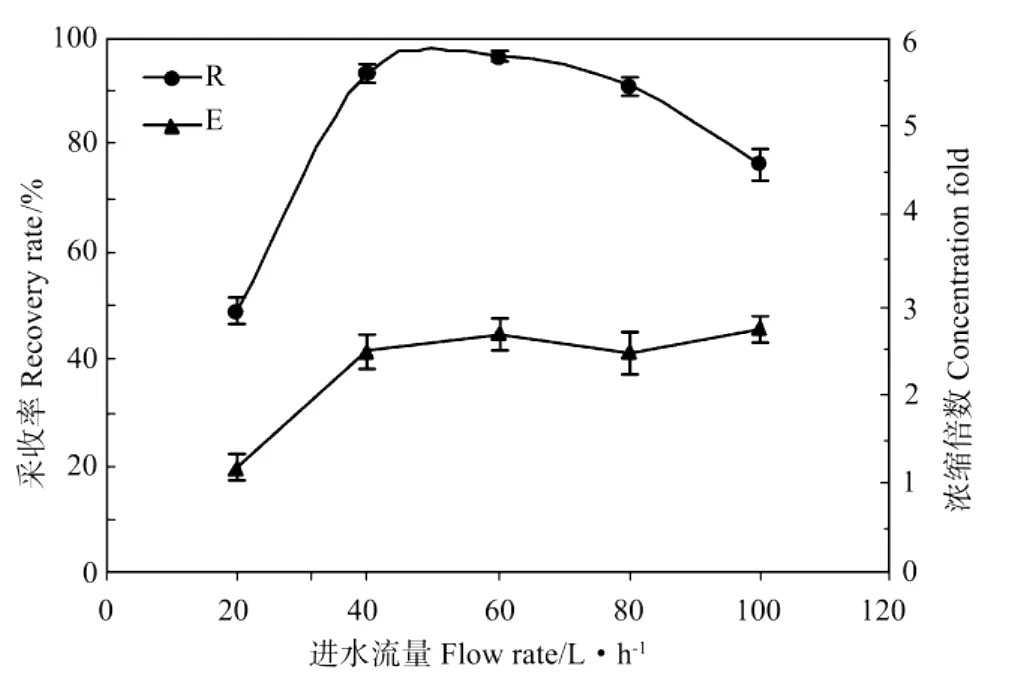
图5 溶气水进水流量对紫球藻培养液采收率和浓缩倍数的影响Fig.5 Effect of flow rate on the recovery rate(R)and concentration fold(E)from Porphyridium broth
2.5 溶气水/藻液体积比(α)对气浮采收效果的影响
取体积为100 m L、OD604=0.36的紫球藻液,将其p H调节为10.1后倒入采收塔内,然后分别通入经17 h饱和溶气处理的溶气水50,75,100,125,150,175和200 m L(对应的溶气水/藻液体积比α分别为0.5,0.75,1.0,1.25,1.5,1.75和2.0)。实验结果见图6。
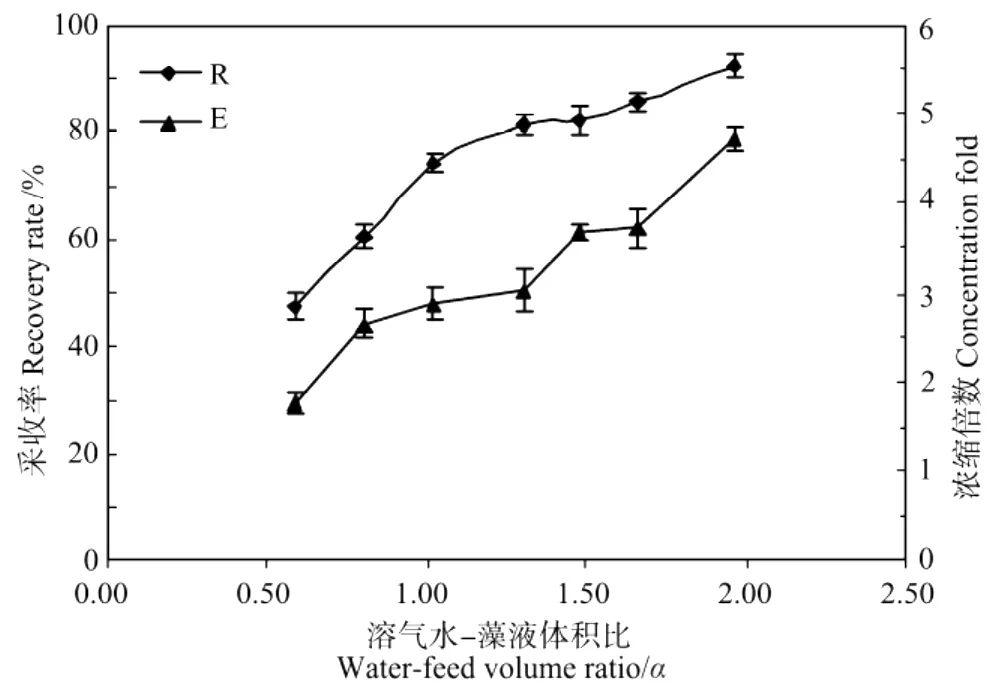
图6 水液比对采收率和浓缩倍数的影响Fig.6 Effect of water-feed volume ratio on the recovery rate(R)and concentration fold(E)from Porphyridium broth
随着溶气水-藻液体积比α的增大,R和E也增大,这是因为随着α的增大,溶气水的体积增多,所能释放的气泡数量增多,泡絮结合体更多,单位质量的细胞絮凝体可以捕获更多的气泡,泡絮结合体密度更小,其所受的浮力也就更大,因而有利于更好的气浮,采收效果更佳。但是较多的溶气水需要消耗更多的能耗,所以本实验确定的溶气水/藻液体积比α为1.0,相较于文献报道[20],本实验的数值偏大,这是由于在实验过程中,一部分残留在管道中的水也会进入分离塔,增加了溶汽水的体积,而本实验的规模偏小,所以使得有效溶气水所占的比例偏小,进而增大了溶气水的需求量。
2.6 藻液浓度对气浮采收效果的影响
取体积为100 m L、OD604分别为0.4,0.5,0.6,0.7,0.8和0.9的紫球藻液,将其p H调节为10.1后倒入采收塔内,然后通入经17 h饱和溶气处理的溶气水100 m L,实验结果见图7。
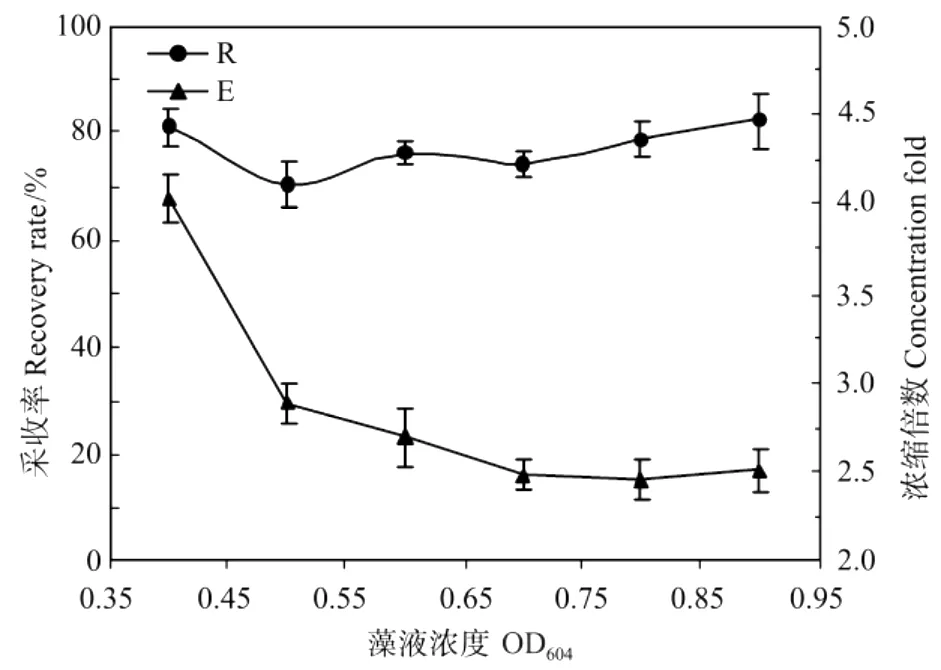
图7 浓度对采收率和浓缩倍数的影响Fig.7 Effect of concentration on the recovery rate(R)and concentration fold(E)from Porphyridium broth
随着藻液浓度的增加,E不断减少,R基本保持稳定。这是因为在特定的p H条件下,藻细胞的絮凝状态一致,产生的絮凝体占藻细胞总量的比例相同,浓缩液状态比较稳定,所以随着原藻液浓度的增加,采收率并未发生大的波动。而由于浓缩液的浓度并未随原藻液浓度的增加而增大,所以原藻液浓度越高,浓缩倍数就越小。这表明,溶气气浮法采收作为1种新型固液分离技术,对紫球藻高密度培养的要求不高,比较适宜于处理浓度比较低的体系,这也正是其区别于其它常规固液分离手段的特性和优势所在,所以本文中采用的实验对象均为OD604在0.4左右的紫球藻液。
3 结论
细胞高效低能耗采收是降低紫球藻工业生产成本的重要环节。本文研究了溶气气浮法从紫球藻细胞培养液中采收紫球藻细胞的工艺条件,得到以下结论:
(1)利用调节p H的方法能够得到较好的絮凝效果,有助于气浮分离过程。确定的最佳溶气气浮条件为:p H=10.1,溶气压力0.6 MPa,溶气时间17 h,溶气水进水流量60 L/h,溶气水/原料藻液体积比1.0。在此条件下,紫球藻的采收效果很好,细胞采收率可达到90%以上,浓缩倍数可达到4左右。
(2)增大藻液浓度并不会相应提高细胞采收率,相反还会降低浓缩倍数。
[1] Rebolloso Fuentes M M,Acie An Ferna Andez G G.Biomass nutrient profiles of the microalga Porphyridium cruentum[J].Food Chemistry,2000,70:345-353.
[2] 王长海,李叙凤,鞠宝,等.紫球藻及其应用研究[J].海洋通报,1996,17(3):79-84.
[3] 陈必链,黄健,梁世中.紫球藻的研究进展[J].2002,21(5):75-81.
[4] Jorge B,Marco R.Simplified two-stage method to B-phycoerythrin recovery from Porphyridium cruentum[J].Journal of Chromatography B,2006,844:39-44.
[5] Arnaud M,Roland L.Benefits and linitations of modeling for optimization of Porphyridium cruentum cultures in an annular photobioreactor[J].Journal of Biotechnology,2003,103:153-163.
[6] 王明兹,施巧琴,郑梅清,等.紫球藻的培养与利用[J].亚热带植物科学,2001,30(2):66-69.
[7] 曾文炉,李宝华,蔡昭铃,等.微藻细胞的连续气浮法采收[J].水生生物学报,2007,27(5):507-511.
[8] Zabel T.The advantage of dissolved air flotation for water treatment[J].Journal of the American Water Works Association,1985,77(5):42-46.
[9] 崔景芹,郑毅,丛威,等.溶气气浮法采收盐藻细胞[J].过程工程学报,2003,3(20):151-155.
[10] 曾文炉,李浩然,丛威,等.微藻细胞的气浮法分离[J].海洋通报,2002,21(3):55-61.
[11] 郑必胜,张国权,蔡妙颜,等.利用气浮法采收小球藻的生物量[J].海湖盐与化工,1999,28(6):8-11.
[12] 王长海,鞠宝,欧阳藩.紫球藻的培养条件[J].化工冶金,1999,20(2):167-172.
[13] Hyde R A,Miller D G,Packham R F.Water clarification by flotation[J].American Water Works Association,1977,69(7):369-374.
[14] Ives K J.The significance of surface electric charge on algae in water purification[J].Biochem Microbiol Technol Eng,1959,1(1):37-47.
[15] 谭天伟,沈忠耀.细胞絮凝技术及其在生物产品分离中的应用[J].生物工程进展,1995,15(5):53-56.
[16] 王立新,欧阳藩.溶气式泡载分离器内减压成泡过程[J].化工学报,1995,46(2):167-173.
[17] Fukushi K,Tambo N,Matsui Y.A kinetic model for dissolved air flotation in water and wastewater treatment[J].Water Science and Technology,1995,31(3/4):37-47.
[18] 王广丰,张国忠,李文华.溶气水饱和度对气浮净水溶气效率的影响[J].青岛建筑工程学院学报,2002,23(3):45-48.
[19] Maens L,Lennart J,Jan D.Experimental studies of the fluid dynamics in the separation zone in dissolved air flotation.Wat Res,2000,34(1):21-30.
[20] Schofield T.Dissolved air flotation in drinking water production[J].Water Sci Technol,2001,43(8):9-18.
Recovery Conditions of Porphyridium cruentum Cells by Dissolved Air Flotation
GAO Li-Li1,JIANG Huai-Zhen1,LIU Tian-Zhong2
(1.School of Food Science and Engineering,Ocean University of China,Qingdao 266003,China;2.Qingdao Institute of Bioenergy and Bioprocess Technology,Chinese Academy of Sciences,Qingdao 266101,China)
Porphyridium is a kind of important valuable microalgal species.It produces many active substances such as phycobiliprotein,polyunsaturated fatty acids(AA/EPA)and algal polysaccharide,which can be used as healthcare and pharmaceutical agents.However,high cost of its harvesting by conventional centrifugation always limits its profits in industrial scale production.The paper focused upon the feasibility of Porphyridium cruentum cells harvesting by air dissolved flotation.It was investigated that all operation factors such as the p H value of the culture medium,air saturation pressure(P)and saturation time(T)for the preparation of air dissolved water,flow rate(V)of air dissolved water and water-feed volume ratio(α)would influence the efficiency of air dissolved flotation.The suitable conditions were determined as pH 10.1,P 0.6 MPa,T 17 h,V 60 L/h,andα1.0,under which the recovery rate and concentration fold of Porphyridium cells could approach about 90%and 4,respectively.Increasing the concentration of Porphyridium cells in the culture medium has no obvious effect on the recovery rate,but lowers the concentration fold.These results indicated that the method of changing pH to recover Porphyridium cells was feasible,and provided important parameters for future design on practical scale of harvesting Porphyridium cells using air dissolved flotation.techniques.
Porphyridium;dissolved air flotation;operation factors;recovery rate;concentration fold
S985.4
A
1672-5174(2010)11-062-05
国家支撑计划“海洋微藻高效培养工程化技术集成示范”子课题(2006BAD09A12)资助
2009-05-08;
2009-06-16
高莉丽(1985-),女,硕士生,食品科学与工程专业,Tel:0532-82031360,E-mail:gll_115@163.com
**通讯作者:Tel:0532-80662735,E-mail:Liutz@qibebt.ac.cn
责任编辑 于 卫
