全硫代反义寡核苷酸对卵巢癌细胞生长抑制作用
2009-05-06刘学单伟曾瑞霞房艳李德华秦书俭
刘 学 单 伟 曾瑞霞 房 艳 李德华 秦书俭
【摘要】 目的 采用针对人端粒酶hTR基因的反义寡聚脱氧核苷酸,探讨端粒酶反义寡聚脱氧核苷酸(antisense oligodeoxy nucleotides,ASODN)对卵巢癌HO-8910细胞端粒酶活性及细胞增殖的影响。方法 ①将实验分为空白对照组、脂质体对照组、端粒酶全硫代正义寡聚脱氧核苷酸(Phosphorathioate sense oligodeoxy nucleotides,PS-SODN)组和不同剂量的全硫代反义寡聚脱氧核苷酸(Phosphorat-hioate antisense oligodeoxy nucleotides,PS-ASODN)组;②脂质体介导的细胞转染后,PS-ASODN和PS-SODN分别作用于卵巢癌HO-8910细胞后并培养24、48、72 h,分别采用酶联免疫吸附法(ELISA)、吖啶橙染色法、四甲基偶氮唑蓝比色法(MTT)、流式细胞术检测HO-8910细胞的端粒酶活性、细胞形态、体外增殖、细胞凋亡和细胞周期的改变。结果 ①ELISA法检测结果显示端粒酶PS-ASODN作用卵巢癌HO-8910细胞72 h后端粒酶活性表达为阴性,说明端粒酶PS-ASODN能够抑制端粒酶活性;②吖啶橙染色观察细胞形态:PS-ASODN作用的卵巢癌HO-8910细胞有明显凋亡现象,凋亡细胞体积缩小,染色质浓缩,说明PS-ASODN能够促进卵巢癌HO-8910细胞凋亡;③MTT实验:PS-ASODN明显抑制卵巢癌HO-8910细胞的增殖(P<0.0l ),并呈一定剂量和时间依赖关系;④流式细胞仪检测细胞凋亡和周期:与空白对照组比较,PS-ASODN组G0/G1期细胞明显增多,差异显著(P<0.01);在G0/G1期前出现亚二倍体凋亡峰,表明细胞被阻止在G1/S期。结论 ①PS-ASODN作用于卵巢癌HO-8910细胞后,卵巢癌HO-8910细胞增殖受到明显抑制,并出现凋亡;②PS-ASODN对端粒酶活性的抑制率与PS-ASODN的浓度和作用时间呈依赖关系,即抑制率随着反义寡核苷酸的浓度和作用时间的增加而增大;③以端粒酶RNA模板区为靶点的PS-ASODN明显抑制卵巢癌HO-8910细胞的增殖,其机制可能是通过降低细胞的端粒酶活性而诱发细胞的凋亡,PS-ASODN对卵巢癌的治疗具有重要价值。
【关键词】
端粒酶全硫代反义寡聚脱氧核苷酸;卵巢癌HO-8910细胞;端粒酶;细胞凋亡
Effects of telomerase antisense oligodeoxy nucle-otides on HO-8910 ovary carcinoma cell
LIU Xue,SHAN Wei,ZENG Rui-xia,et al.Department of Anatomy,Liao Ning Medical College,Jinzhou 121001,China
【Abstract】 Objective In this study,we apply Oligonucleotide aimed directly at human telomerase RNA(hTR),To study the effects of telomerase Phosphorathioate antisense oligodeoxy nucleotides (PS-ASODN) on telomerase activity and proliferation of HO-8910 ovary carcinoma cell.Methods ①HO-8910 ovary carcinoma Cell was transfected by PS-ASODN,Phosphorathioate sense oligodeoxy nucleotides(PS-SODN)mediated by Lipotap Liposomal Transfection Reagen.The experiments were classified into normal group、PS-ASODN groups at varied concentrations 、PS-SODN group and oligofectamineTM alone.②The proliferation activity of HO-8910 ovary carcinoma cell line was determined by using methyl thiazolyl tetrazolium assay.The telomerase activity was determined by using enzyme-linked immunosorbent assay.The cell morphology was observed by fluorescence microscope stained with acridine orange.Flow cytometry was adopted to examine apoptotic rate and cell cycle.Results ①With ELISA,Telomerase of HO-8910 ovary carcinoma cell was repressed by telomerase PS-ASODN after 72 h later,it showed that telomerase PS-ASODN could lead inhibition of telomerase activity.②The cell morphology was observed by fluorescence microscope stained with acridine orange:Apoptotic morphological characteristic of HO-8910 ovary carcinoma cell transfected by antisense oligonucleotides was observed.Moreover,the apoptotic cell physical volume contracts.The HO-8910 ovary carcinoma cell growth was inhibited by Phosph-orathioate antisense Oligonucleotide and appeared the apoptosis.③PS-ASODN caused significant (P<0.01) inhibition of cell growth,and the rate of inhibition has the discrepancy between the different dose and different time (P<0.01 and P<0.01).④The apoptotic peak was detected with FCM and cells were stayed in G1/S stage and a sub-Gl stage cell apoptotic peak appear in front of GO/G1 stage(P<0.01).Typical apoptotic morphologic feature was discovered under light microscope.Conclusion ①The HO-8910 ovary carcinoma cell growth was inhibited by Phosphorathioate antisense Oligonucleotide and appeared the apoptosis.②It showed that the rate of inhibition has the discrepancy between the different dose and different time.In other words,the rate of inhibition enhance along with the augment of the dose and time.③PS-ASODN inhibits strongly the proliferation of HO-8910 ovary carcinoma cell by inhibiting telomerase activity which induce cell apoptosis.PS-ASODN might be a new target to ovary carcinoma therapy.
【Key words】
Telomerase phosphorathioate antisense oligodeoxy nucleotides; HO-8910 ovary carcinoma cell; Telomerase; Cellapoptosis
目前随着人类生存环境污染的加剧,生活方式的改变,癌症已成为威胁人类健康和生命的主要杀手。卵巢癌作为我国最常见的恶性肿瘤之一 [1]。卵巢癌的发生和进展涉及多种癌基因和/或抑癌基因的异常改变以及几个遗传基因的遗传失稳[2]。然而除了这些分子生物学变化之外,卵巢癌可能还有另外一个非常重要的生物学特性,即以细胞的永生化来维持它的无限生长[3]。研究表明这种永生化的维持主要是依赖肿瘤细胞中的端粒酶被激活后,使得端粒的长度维持到一定程度,从而使细胞获得无限增殖的能力[4]。
端粒(Telomere)是真核细胞染色体末端含有串联重复的DNA序列,其功能为体细胞分裂时端粒的末端会随每次的复制被逐渐缩短,当缩短到一定程度不能维持染色体的稳定时细胞最终死亡。端粒长度保持在延长和缩短的动态平衡中,在这个平衡体系中端粒酶是关键因素[5]。有关研究报告在多种肿瘤细胞中都可能有端粒酶的活性[6]。端粒酶由蛋白催化亚基和指导端粒合成的RNA模板组成,即为具有逆转录酶特性的核蛋白酶[7]。端粒酶几乎在所有恶性肿瘤组织中都有强阳性表达,而在正常体细胞及良性肿瘤组织中表达为阴性[8],因此端粒酶已成为新的肿瘤标志物 [9] 。
端粒酶的三个主要组成成分:端粒酶RNA (human telomerase RNA,hTR )、端粒酶相关蛋白质(telomerase protein 1,TP1/TLP1)及端粒酶催化亚单位(human telomerase reverse transcriptase,hTRT/hTERT)己经被阐明,基因序列也已经被克隆[10]。设想应用反义寡核苷酸封闭该模板区,就可以抑制端粒酶活性,阻止端粒序列的合成,使细胞退出增殖周期,达到治疗肿瘤的目的。所以端粒酶不但是特异性恶性肿瘤标志物,更是一个肿瘤治疗的理想靶点。
本实验设计了一段互补于hTR模板区(GenBank登陆号为:NR_001566)的反义核酸,用寡核苷酸脂质体(OligofectamineTM)介导,将互补于人端粒酶RNA模板区的反义寡核苷酸作用于体外培养的卵巢癌HO-8910细胞,采用酶联免疫吸附法及流式细胞学等技术观察反义hTR对卵巢癌HO-8910细胞端粒酶活性、细胞增殖、细胞凋亡及细胞周期的影响,旨在探讨端粒酶PS-ASODN在卵巢癌治疗中的价值。
1 材料与方法
1.1 材料
1.1.1 细胞来源 人HO-8910卵巢癌细胞,辽宁医学院科学实验中心。
1.1.2 主要试剂及药品达尔伯克必需基础培养基(Deubeccos minimum essential; medium,DMEM)培养基有GIBCO公司生产;小牛血清(fetal bovine serum,FBS)由Hyclone公司生产;胰蛋白酶由Hyclone公司生产;端粒酶全硫代反义寡核苷酸(phosphorathioate antisense oligonucleotide,PS-ASODN)及对照正义全硫代寡核苷酸(phosphorathioate sense oligonucleotide,PS-SODN)均由上海生物工程公司合成。端粒酶PS-ASODN序列为5′-CTCAGTTAGGGTTAGACA-3′;端粒酶PS-SODN序列为5′-TGTCTAACCCTAACTGAG-3′;端粒酶检测试剂盒由大连泛邦化工技术有限公司生产。恒温培养箱由美国Forma Scientific生产;流式细胞仪由美国BD公司生产。
1.2 方法
1.2.1 引物的合成 端粒酶全硫代反义寡核苷酸(PS-ASODN)及对照正义全硫代寡核苷酸(PS-SODN):均由上海生物工程公司合成。PS-ASODN序列为5'-CTCAGTTAGGGTTAGACA-3';PS-SODN序列为5'-TGTCTAACCCTAACTGAG-3'。
1.2.2 实验分组 实验分组:空白对照(Control)组; 浓度为3 μmol/L的脂质体对照组;浓度为3 μmol/L的PS-SODN组; PS-ASODN浓度分别为1、2及 3 μmol/L三个浓度组。
1.2.3 实验方法
1.2.3.1 细胞培养 卵巢癌HO-8910细胞以5×104/ml密度接种在含10%新鲜小牛血清、100 U/ml庆大霉素的RPMI-1640培养液中,置370C、5%CO2孵箱中培养,隔天换液一次,取对数生长期细胞用于实验。
(1)细胞传代:倒除原培养液,无菌PBS洗涤两次后加入0.25%的胰蛋白酶0.5 ml消化细胞,倒置显微镜下观察细胞变圆时倒掉胰酶,加入RPMI-1640培养液,用吸管轻轻吹打,制成细胞悬液,以适当细胞密度分装于几个培养瓶中,补加培养液,放入培养箱中培养。
(2)复苏冻存的细胞:从-80℃冰箱中取出冻存管,迅速放入37℃水浴箱中摇匀解冻后,在超净工作台中,用吸管吸出细胞悬液装入离心管,补加10 ml RPMI-1640培养液,混匀后以800转/分离心5 min,倒除上清,加入培养液1 ml吹匀,再移入培养瓶中,如入培养液适当稀释后,置培养箱培养,2 h后更换培养液一次,再继续培养。
1.2.3.2 细胞转染 先将装有10 OD干膜状寡聚脱氧核苷酸的EP管离心(10 000 g,10 s),然后加入550 μl双蒸水,充分振荡5 s,配成存储浓度为100 μmol/L寡聚脱氧核苷酸溶液,之后再对其进行稀释,使其存储浓度为20 μmol/L以后根据实验需求再稀释(PS-SODN为3 μmo1/L; PS-ASODN为1 、2及3 μmo1/L)。
脂质体介导的端粒酶反义寡聚脱氧核苷酸转染按说明书操作。实验分6组,每组设4个复孔。6组分别为终浓度为3、 2及1 μmol/L的PS-ASODN组、终浓度为3 μmol/L的脂质体对照组、终浓度为3 μmol/L的PS-SODN组以及空白对照组(仅加培养液)。用药后将小牛血清的浓度调至5%,以减少寡聚脱氧核苷酸的降解。24 h后弃去转染液,换新鲜培养液,并继续培养,收集细胞用于以下实验。
1.2.3.3 ELISA法检测端粒酶活性 ①细胞提取物的制备:取处理因素作用后的细胞5×104,PBS洗涤后离心去上清,加裂解液10 μl,冰浴放置30 min,4℃、1 5000 g离心10 min,取上清液保存于-800C,以备端粒酶活性检测。按试剂盒说明书操作,检测每组在450nm处的A值,并计算相应的端粒酶活性;②分组:本实验按ELISA试剂盒说明书共分为8即:
阴性对照组:阴性反应液+酶联反应物+底物A+底物B+终止液;
阳性对照组:阳性反应液+酶联反应物+底物A+底物B+终止液;
空白对照组:空白反应液+酶联反应物+底物A+底物B+终止液。作用时间为72 h的不同浓度PS-ASODN检测组(3、2、1 μmol/L)、脂质体对照组(3 μmol/L)和 PS-SODN(3 μmol/L)。各浓度提取物+酶联反应物+底物A+底物B+终止液;③实验操作:96孔培养板每组4个孔重复3次,(各组的实验条件都相同只有药物浓度不同)。待试剂混匀、平衡到室温(20~25℃)再进行实验操作。
①阳性对照组加入50 μl阳性对照液;阴性对照组加入50 μl阴性对照液;空白对照组加入50 μl空白对照液;各实验组分别加入50 μl不同浓度药物的提取物;②8组中每孔都加入50 μl酶联反应物,轻轻混匀,30 s后用自黏封孔盖箔封住板孔,37℃温育60 min;③洗板时甩尽板内液体,8组中每孔内分别加入洗涤液350 μl洗涤反应板,并去除水滴(在厚叠吸水纸上拍干),反复洗涤5次;④8组中每孔依次加入50 μl底物A和50 μl底物B;⑤8组中每孔加100 μl终止液轻轻混匀30 s,30 min内在450 nm处读OD值(再换算成A值)。
结果判断:检测组的A值与空白组的A值之比(index)≥1.00为阳性,在0.91~0.99之间为可疑阳性:≤0.90为阴性。
1.2.3.4 吖啶橙染色法观察细胞形态 取对数生长期细胞1×105/ml接种于24孔板中,细胞接种、转染和培养方法同上。10 mg吖啶橙溶解于100 ml pH值为6.8的PBS中,4℃避光保存。取转染3 μmol/L PS-ASODN 和3 μmol/L PS-SODN 72 h后的细胞,按照说明书操作,荧光显微镜观察细胞形态。
1.2.3.5 MTT法测定PS-ASODN对卵巢癌HO-8910细胞增殖的影响 细胞以5×104/ml密度接种在96孔培养板上,每孔100 μl,待细胞生长活跃时加处理因素,分组方法与细胞转染的方法一样,分别培养24、48、72 h后检测。检测方法:每孔加入5 mg/ml的MTT 20 μl,继续培养4 h,翻板倒掉液体,每孔加入二甲基亚砜(DMSO)150 μl,轻轻振荡10 min,用自动酶标仪检测 540nm 处的吸光度(A)值。
抑制率=(空白对照组平均A值-实验组平均A值)/空白对照组平均A值 ×100%
1.2.3.6 流式细胞仪检测细胞凋亡和细胞周期 ①PI染色:取对数生长期细胞1×105/ml细胞数接种于6孔培养板中,细胞接种、培养,转染方法同端粒酶检测实验。将转染72 h的细胞离心收集,PBS洗一次,离心弃PBS,用剩余的PBS充分混匀细胞,加入预冷的75%乙醇固定,混匀,用封口膜封口,4℃冰箱过夜。上机检测前弃乙醇,PBS清洗细胞,调整细胞浓度至1×106/ml,加入PI(50 μg/ml) 800 μl混匀,4℃避光染色1 h,300目尼龙网滤过,上机检测,进行DNA含量、细胞周期的分析,低于G1期DNA含量主峰(亚G1期峰)的细胞为凋亡细胞。每项实验重复3次;②AnnexinV-FITC/PI染色:将各组细胞用胰酶消化,再用PBS洗涤,调整待测细胞的浓度为1×106个/ml。取1 ml细胞,1000 g,4℃离心10 min,弃上清;用PBS洗3次后将细胞重悬于200 μl Binding Buffer;加入10 μl AnnexinV-FITC和5 μl PI,轻轻混匀,避光室温反应15 min;加入300 μl Binding Buffer,在1 h内上机检测
1.2.4 统计学方法 实验数据用(x±s)表示,用SPSS 11.5软件包处理,组间比较采用单因素方差分析。
2 结果
2.1 PS-ASODN对卵巢癌HO-8910细胞端粒酶活性的影响 检测72 h各组端粒酶活性阴阳性结果表明:3.0 μmol/L的PS-SODN和3.0 μmol/L脂质体对照组的端粒酶活性表现均为阳性;而浓度分别为1、2、3 μmol/L的PS-ASODN组端粒酶活性表现均为阴性,表明PS-SODN和脂质体对卵巢癌HO-8910细胞端粒酶活性无影响,而PS-ASODN 对卵巢癌HO-8910细胞端粒酶活性有抑制作用(见表1)。
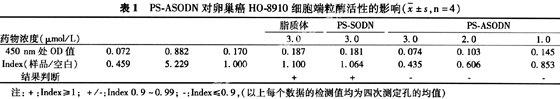
2.2 形态学观察结果 吖啶橙染色72 h后荧光显微镜下观察发现,空白对照组细胞呈圆形或椭圆形,胞浆丰富,胞核及分裂正常(见图 1) ;PS-ASODN组卵巢癌HO-8910细胞体积缩小,核皱缩并有细胞膜出芽,有明显凋亡现象,表明PS-ASODN具有促进卵巢癌HO-8910细胞凋亡的作用(见图 2)。
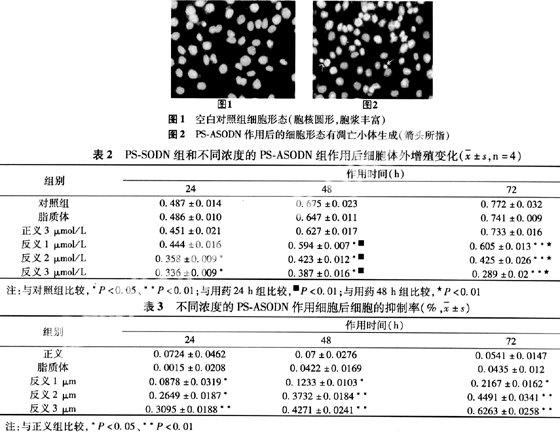
2.3 PS-ASODN对卵巢癌HO-8910细胞增殖的影响 与空白对照组比较,正义寡聚脱氧核苷酸组和脂质体组细胞增殖不显著(P>0.05);浓度分别为1、2、3 μmol/L反义寡聚脱氧核苷酸组均能显著抑制细胞增殖(P<0.05) 并呈一定的时间和剂量依赖关系(见表2)。
抑制率的计算结果表明,PS-ASODN各浓度组差异显著(P<0.05),并呈一定的时间和剂量依赖关系,即抑制率随着PS-ASODN的作用时间和剂量的增加而增大(见表3)。
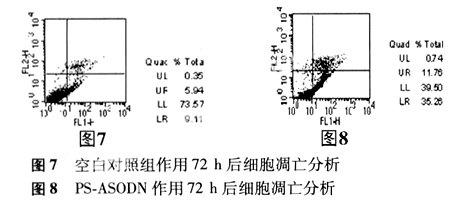
2.4 流式细胞仪检测结果 与空白对照组比较,浓度分别为1.0、2.0、3.0 μmol/L的PS-ASODN转染细胞72 h后,G0/G1期细胞明显增多,差异显著(P<0.01)(见表4),在G0/G1期前出现亚二倍体凋亡峰(见图3、4、5、6),表明细胞被阻止在G1/S期。

在双变量流式细胞仪的散点图上,转染72 h后空白对照组活细胞数量占73.57%,凋亡细胞数量占9.11%;浓度为3.0 μmol/L PS-ASODN组活细胞数量占39.50%,凋亡细胞数量占35.26%。表明PS-ASODN 能够明显促进细胞调亡(见图9、图10 )。
3 讨论
端粒是真核线形染色体末端结构,由端粒DNA和端粒结合蛋白组成。它由一端高度保守的重复序列(TTAGGG ) n组成,方向5'→3',长度约5~15 kb[11],端粒长度的维持需要端粒酶的激活。自身携带模板是端粒酶区别于一般的纯蛋白逆转录酶的主要特征之一。
端粒酶调节细胞分裂及细胞的寿命,参与细胞增殖、分化、衰老等活动,尤其与细胞的癌变密切相关,在正常人胚胎组织中,未分化的神经上皮细胞中有最高的hTR表达,大多数分化高的组织其表达缺乏或降低。成人组织中,睾丸细胞hTR高表达,淋巴小结中度表达,上皮细胞微弱表达,而且只限于特定的有丝分裂期细胞,神经系统和间质来源细胞无表达[12]。 1995年Feng[13]首次克隆了人端粒酶RNA (hTR)组分,发现反义或突变的RNA结构都可能影响端粒酶的活性,从而抑制肿瘤细胞增殖。
国外学者[14]对乳腺癌、卵巢癌、肺癌、膀胱癌、食管癌等进行广泛深入研究。研究证实反义寡聚脱氧核苷酸对癌细胞的端粒酶活性和细胞增殖均起到了抑制作用,并促进细胞周期改变和诱导细胞发生凋亡。其作用机制是:特定反义核酸分子与进入细胞质的mRNA上的特异位点杂交,形成DNA-RNA复合物,抑制mRNA与核糖体的结合,同时激活RNase H,RNase H能使mRNA降解,从而使特定的基因不能表达,相应的蛋白质合成受到抑制[15] 。但尚未发现反义寡聚脱氧核苷酸能对卵巢癌HO-8910细胞起同样作用的报道。
本实验采用反义hTR转染卵巢癌HO-8910细胞,为减少细胞对反义核酸的降解作用并增加其入胞效率,采用全硫代磷酸修饰其分子。 其中PS-ASODN是根据靶基因序列,以碱基互补配对方式设计而成,因此进入细胞后只能作用于靶基因,而不与非相关基因作用,故针对性强,特异性高且片段短,可以完全被细胞吸收进入细胞核,经硫代修饰后具有很强的抗核酶能力,再经寡聚脱氧核苷酸脂质体转染入卵巢癌HO-8910细胞。实验结果显示反义寡聚脱氧核苷酸转染细胞后,卵巢癌HO-8910细胞的增殖明显受到抑制、端粒酶活性明显降低,与空白对照组、脂质体组、正义寡聚脱氧核苷酸组比较,差异均有统计学意义(P<0.01),表明反义寡聚脱氧核苷酸是良好的端粒酶抑制剂。
另有研究结果表明,端粒酶活性与细胞增殖有关,因此,端粒酶抑制剂抑制了细胞端粒酶活性,自然也使其增殖受到抑制[16]。本实验结果也证实,端粒酶反义寡聚脱氧核苷酸抑制端粒酶活性,同时也抑制了细胞增殖。
Zhu等[17]研究发现,端粒酶活性是细胞周期依赖性调控。端粒酶在DNA复制期激活,以保持端粒延长,因此,在细胞周期中,端粒酶活性经G1/S期逐渐升高,S期最高,G2/M最低,G0/G1期几乎处于静止期。
本研究FCM检测提示:72 h后空白对照组细胞增殖旺盛,S期细胞占细胞周期的23.26%,但凋亡率为9.03%。PS-SODN处理组凋亡率仅为10.63%,两者差异无显著性(P>0.05)。而相同条件下PS-ASODN组FC-M检测发现能阻止HO-8910细胞进入DNA合成期,使S期细胞明显减少,降为5.47%,凋亡率为35.26%,表明细胞分裂增殖活动减弱,细胞被阻止在G1/S期。细胞凋亡时,细胞的DNA裂解,在流式细胞仪上呈现亚二倍体凋亡峰。表明反义寡聚脱氧核苷酸能够诱导卵巢癌HO-8910细胞凋亡并促使细胞周期发生改变。根据FCM检测结果推测PS-ASODN可能通过与端粒酶RNA模板的特异性结合而阻断其表达,从而有效地抑制S期端粒酶活性,端粒合成受到抑制,使染色体末端不稳定,肿瘤细胞阻滞于M2期,细胞周期检查点监控功能增强,激活了凋亡相关基因启动细胞程序性死亡,导致肿瘤细胞凋亡。
一些学者认为[18-20],端粒酶抑制剂对细胞的增殖抑制可能与诱导凋亡有关。而端粒酶抑制剂诱导细胞凋亡可能通过两条途径:①端粒酶活性被抑制导致端粒延伸障碍,端粒长度不能维持,当细胞分裂导致端粒缩短到一定程度,通过p53等凋亡调节蛋白[21],诱导细胞凋亡;②端粒酶活性被抑制导致一些已经处于极短的端粒不能维持功能,细胞染色体发生断裂、融合、DNA破坏,触发细胞凋亡[22]。本实验用吖啶橙染色转染反义核酸的卵巢癌HO-8910细胞,在荧光显微镜下可见,卵巢癌HO-8910细胞出现细胞膜出芽,细胞核皱缩、碎裂、凋亡小体等明显的凋亡形态学改变。
本实验结果表明:(1)互补于hTR模板区的反义寡聚脱氧核苷酸明显抑制卵巢癌HO-8910细胞的增殖及端粒酶活性,作用方式呈时间和剂量依赖性,即随着反义寡聚脱氧核苷酸浓度加大和培养时间延长,抑制作用逐渐增强。这主要是由于反义寡聚脱氧核苷酸封闭了hTR模板区,阻止了端粒酶合成端粒,从而有效地抑制了卵巢癌HO-8910细胞的增殖;(2)反义寡聚脱氧核苷酸转染卵巢癌HO-8910细胞后,端粒酶活性显著下降。笔者认为,很可能反义寡聚脱氧核苷酸本身不一定具有调节凋亡的作用,其对凋亡的调节可能是通过改变端粒长度所致,因为端粒长度的维持、染色体的稳定是凋亡的一个抑制因素,而端粒的缩短可触发细胞凋亡。以上结果说明反义寡聚脱氧核苷酸能够通过抑制hTR基因的表达,抑制卵巢癌HO-8910细胞端粒酶活性,从而达到抑制卵巢癌HO-8910细胞的增殖。这也为卵巢癌基因治疗提供了新的靶点,结合其他治疗方法有望提高卵巢癌基因治疗的成功率。
尽管端粒酶在几乎所有恶性肿瘤都有强阳性表达,而且反义hTR寡核苷酸制剂由于特异性封闭hTR模板区而抑制了端粒酶活性,在肿瘤的治疗方面显示出巨大的潜力。但对端粒酶阳性的生殖细胞和干细胞所带来的后果不得不引起我们的关注,尤其是生殖细胞,如果针对肿瘤细胞的端粒酶抑制剂同样可以进入人生殖细胞,使其端粒酶失活,后果将是一个种属的灭绝;但也有人持不同的观点,认为正常细胞的端粒较多数肿瘤细胞的长,并且原始干细胞较少进行有丝分裂,其端粒缩短的速度远低于肿瘤细胞,因此端粒酶抑制剂的疗程可在正常细胞的端粒酶耗尽前停止,当抑制端粒酶治疗结束后,正常细胞的端粒酶活性可得到修复。此外部分肿瘤细胞具有较长的端粒,而随细胞有丝分裂的进行,端粒的缩短是一个缓慢的过程,在这种情况下端粒酶抑制剂是否有效,尚待进一步研究。
参 考 文 献
[1] 李连弟,鲁凤珠,张思维,等. 1990-1992年中国恶性肿瘤死亡流行分布情况分析.中华肿瘤杂志,1996,18:403-407.
[2] Palmer JE,Sant Cassia LJ,Irwin CJ,et al.The prognostic and predictive value of syntactic structure analysis in serous carcinoma of the ovary.Int J Gynecol Pathol,2008,27(2):191-198.
[3] Zhang PN,Sun H.Expression of phosphatidylinositol-3 kinase in epithelial ovarian carcinoma.Zhonghua Fu Chan Ke Za Zhi,2007,42(3):196-200.
[4] Sun PM,Wei LH,Luo MY,et al.The telomerase activity and expression of hTERT gene can serve as indicators in the anti-cancer treatment of human ovarian cancer.Eur J Obstet Gynecol Reprod Biol,2007,130(2):249-257.
[5] Jiao XL,Chen ZX,Cen JN,et al.Expression of human telomerase reverse transcriptase and survivin gene in patients with myelodysplastic syndrome.Zhongguo Shi Yan Xue Ye Xue Za Zhi,2008,16(2):294-298.
[6] 卫建平,吴丽然,王晨,等.端粒酶hTERT蛋白与基因在人肿瘤细胞中表达的相分析.中国药物与临床,2004,4(3):187-190.
[7] Cairney CJ,Hoare SF,Daidone MG.et al.High level of telomerase RNA gene expression is associated with chromatin modification,the ALT phenotype and poor prognosis in liposarcoma.Br J Cancer,2008,98(8):1467-1474.
[8] Dasi F,Martinez-Rodes P,March JA,et al.Real-time quantification of human telomerase reverse transcriptase mRNA in the plasma of patients with prostate cancer.Ann N Y Acad Sci,2006,1075:204-210.
[9] Sun L,Wang F,Sun H,et al.Effects of c-myc antisense oligodeoxynucleotide on the telomerase activity and the induction of apoptosis in HL-60 cells.Zhongguo Shi Yan Xue Ye Xue Za Zhi,2006,13(4):605-609.
[10] Nakayama J,Tahara H,Tahara E,et al.Telomerase activity by hTRT in human normal fibroblasts and hepatocellular carcinomas.Nat Genet,1998,18:65-68.
[11] Shammas MA,Koley H,Batchu RB,et al.Telomerase inhibition by siRNA causes senescence and apoptosis in Barrett's adenocarcinoma cells:mechanism and therapeutic potential.Mol Cancer,2007,15(4):24.
[12] Zhang S,Dong M,Teng X,et al.Quantitative assay of telomerase activity in head andneck squamous cell carcinoma and other tissues.Arch Otolaryngol Head Neck Surg,2005,127(5):581-585.
[13] Feng 1,Walter DF,Wang SS,et al.The RNA component of human telomerase.Science,1995,269:1236-1240.
[14] Zorn KK,Jazaeri AA,Awtrey CS,et al.Choice of normal ovarian control influences determination of differentially expressed genes in ovarian cancer expression profiling studies.Clin Cancer Res,2003,9(13):4811-4818.
[15] Zamaratski E,Pradeepkumar PI,Chattopadhyaya J.A critical survey of the structure-function of the antisense oligo/RNA heteroduplex as substrate for RNAse H.J Biochenm Biophys Methods,2006,48(3):189-208.
[16] Chen Z.Koeneman KS.Corey DR.Consequences of telomerase inhibition and combination treatments for the proliferation of cancer cells Cancer Res,2005,63:5917-5925.
[17] Tonooka K,Kabashima T,Shibata T.et al.Facile Assay of Telomerase Activity Utilizing a DNA-detectable Chemiluminogenic Reagent.Anal Sci,2008,24(4):471-475.
[18] Chen M,Yang B,Zhang X.Effects of telomerase activity on carcinogenesis and survival in laryngeal carcinoma.J Int Med Res,2008,36(2):336-342.
[19] Wong SC,Yu H,Moochhala SM,et al.Antisense telomerase induced cell growth inhibition,cell cycle arrest and telomerase activity down-regulation in ovary and colon cancer cells.Anticancer Res,2003,23:465-469.
[20] Feng RH,Zhu ZG,Li JF,et al.Inhibition of human telomerase in MKN-45 cell line by antisense hTR expression vector induces cell apoptosis and growth arrest.World J Gastroenterol,2007,8(3):436-400.
[21] Yamaguchi K,Chijiiwa K,Torata N.et al.Telomerase activity,P53 mutation and Ki-ras codon 12 point mutation of the peripheral blood in patients with hepato pancreato biliary diseases.HPB (Oxford),2002,4(2):75-82.
[22] Glover L,Alsford S,Beattie C.et al.Deletion of a trypanosome telomere leads to loss of silencing and progressive loss of terminal DNA in the absence of cell cycle arrest.Nucleic Acids Res,2007,35(3):872-880.
