黄腰胡蜂油脂的抗炎抗氧化活性测试及GC-MS分析
2024-02-27常雅萍刘超贺张成桂杨银河杨大松
常雅萍, 刘超贺, 肖 怀, 张成桂, 杨银河, 杨大松
(大理大学云南省昆虫生物医药研发重点实验室, 大理 671000)
昆虫是自然界种类最多、数量最大的生物类群,是地球上尚未被充分开发与利用的巨大生物资源。据估算,全世界昆虫种类约有1 000万种,占自然界全部生物资源60%以上,目前已知可供人类食用的昆虫超过2 100种[1]。我国有悠久的食用昆虫历史,据统计,中国有324种与食品和饲料有关的昆虫[2]。胡蜂也称黄蜂或者马蜂,是膜翅目胡蜂科昆虫的总称,全球约5 445种,中国约有290种。胡蜂是云南重要的经济昆虫,其不同发育阶段都具有很高经济价值。蜂蛹富含蛋白质、必需氨基酸、不饱和脂肪酸和微量元素等营养成分而成为云南人喜爱的特色风味食品[3-4],而胡蜂酒是收载于《中华人民共和国药典》用于预防和治疗风湿性关节炎的经典民族验方。加上其生活环境多为树木茂密的山林,使其成为云南很多山区少数民族的重要经济来源[5]。
作为云南规模化养殖的特色食药用昆虫,胡蜂最常见的食用方式为油炸蜂蛹和成虫泡酒。已有研究表明蜜蜂蜂蛹中脂肪含量约26%,而胡蜂蜂蛹中脂肪含量约22%[4,6-7]。民间食用蜂蛹通常是油炸,脂肪酸尤其是不饱和脂肪酸作为低极性分子和多种香气物质的前体,在高温烹饪过程中,产生挥发性的香气分子,使蜂蛹具有独特的风味,同时丰富的脂肪也是蜂蛹独特口感的来源[4,6-7]。酒精炮制主要提取的也是胡蜂的中低极性成分,因此,油脂是胡蜂食药用的主要成分之一。已有关于胡蜂营养价值的研究,但主要关注其中蛋白质含量、必需氨基酸组成等方面[3,7],而对油脂的活性和成分研究较少。
氧化还原是人体正常的生理生化和免疫反应,如果机体的氧化还原系统失衡,不仅会影响人体的正常生理状态,还会加速衰老,导致炎症、肿瘤、糖尿病等疾病发生[8]。因此,食品中所含成分的抗氧化能力是其保健和营养价值的重要参考,DPPH法是抗氧化活性测试的代表性方法之一。
类风湿性关节炎病情反复发作,致残率高,临床上缺乏特异性治疗措施。胡蜂作为一种传统的民族药物,其药用价值在古今民族药著上都有记载,如《本草纲目》、《中国药用动物原色图鉴》、《中国民族药志要》等。位于云南省德宏州的景颇族有采用胡蜂泡酒来预防和治疗类风湿性关节炎的传统,暗示胡蜂中含有抗炎活性成分。巨噬细胞作为机体的免疫细胞,当其受到脂多糖(LPS)等刺激时会分泌出一氧化氮(NO)等炎症因子[9-10],因此,该模型可以用于评估胡蜂提取物的抗炎活性。
黄腰胡蜂作为云南代表性胡蜂品种之一,尽管其在民间已被广泛食用或者药用,而油脂作为其虫体的主要组分在油炸蜂蛹的特色风味和胡蜂酒药理活性中均发挥了重要作用,然而其化学成分和生物活性还缺乏现代系统研究,已成为影响其进一步开发利用的关键因素。鉴于此,本研究首先从黄腰胡蜂中提取油脂,并根据极性差异将其划分为3个部位。随后采用DPPH法对其抗氧化活性进行测试,同时采用LPS诱导的小鼠巨噬细胞炎症模型对其体外抗炎活性进行测试。为进一步阐明黄腰胡蜂油脂发挥活性的物质基础,本研究还采用GC-MS技术对其油脂的化学成分进行系统分析。
1 材料与方法
1.1 材料
1.1.1 样品信息
黄腰胡蜂样品采集于云南省保山市,经大理大学药学院杨自忠教授鉴定为膜翅目胡蜂科胡蜂属黄腰胡蜂Vespaaffinis(Linnaeus)[11],标本保存于云南省昆虫生物医药研发重点实验室,标本编号为YZZ20200923。
1.1.2 仪器与材料
气相色谱-质谱联用仪(7890A/5975C,美国Agilent Technologies公司);旋转蒸发仪(RE -5210A,上海亚荣生化仪器厂);电子天平(FA2004N,上海精密科学仪器有限公司);酶标仪(SpectraMax-M2,美国Molecular Devices公司);乙醇(汕滇药业有限公司);乙酸乙酯(天津福晨化学试剂有限公司);石油醚(汕滇药业有限公司);正己烷(天津市津东天正精细化学试剂厂);甲醇(美国TEDIA公司);柱层析硅胶(青岛海洋化工有限公司);GF254薄层层析硅胶板(青岛海洋化工有限公司);1,1-二苯基-2-三硝基苯肼(上海麦克林生化科技有限公司)。胎牛血清(批号2158738P,美国GIBCO公司);TNF-α(批号02182510821,Peprotech);LPS(批号026M4021V,美国Sigma公司); NO试剂盒(批号S0021S,碧云天生物技术公司)。
1.2 方法
1.2.1 油脂提取
黄腰胡蜂新鲜虫体称重,用95%乙醇(45 L)冷浸提取3次,过滤,合并滤液,减压浓缩获得总浸膏。按体积比1∶1加水混悬,用乙酸乙酯萃取4次,浓缩得到乙酸乙酯部位,采用硅胶柱色谱(300~400目)对其进行划段。
1.2.2 抗氧化活性测试[12]
精密称取黄腰胡蜂油脂样品E1~E3,用甲醇逐级稀释分别配成质量浓度为1、2、3、4、5和6 mg/mL的样品溶液。精密称取DPPH,用无水乙醇配制成浓度为0.125 mmol/L的溶液,现配现用。在96孔板中每孔加入20 μL样品溶液和180 μL DPPH溶液,室温避光反应30 min。使用酶标仪在517 nm波长处平行测定3次吸光值,取平均值,按如下公式计算待测样品对DPPH自由基的清除率[13]。
清除率= [1-(Ai-Aj)/A0] × 100%
式中:Ai为样品+DPPH的吸光度,A0为甲醇+DPPH的吸光度,Aj为样品+无水乙醇的吸光度。实验重复3次,取平均值。以样品浓度为横坐标,清除率为纵坐标作图。
1.2.3 抗炎活性测试[14]
细胞培养:RAW264.7细胞用含10%胎牛血清的完全培养基,在37 ℃、5% CO2下培养,每24 h传代一次,取对数生长期细胞进行实验。
NO检测:收集细胞,制成1×105mL-1的细胞混悬液。在96孔板中每孔100 μL,于37 ℃、5% CO2下培养,待细胞贴壁(约24 h)。用质量浓度为100 μg/mL的LPS刺激24 h后,将细胞分为4组:空白组、模型组(IFN-γ 20 ng/mL)、给药组(IFN-γ 20 ng/mL和E1~E3各250 μg/mL)和阳性药组(IFN-γ 20 ng/mL和甲氨蝶呤 50 μg/mL),实验重复3个复孔。加药后继续培养24 h,使用NO检测试剂盒测试细胞上清液在540 nm的OD值,根据标准曲线计算NO的表达水平。
1.2.4 GC-MS分析
称取E1~E3各10 mg于10 mL容量瓶中,加入适量正己烷溶解并定容至刻度,摇匀备用。色谱柱:Agilent气相毛细管色谱柱(19091S-433,30 m×250 μm×0.25 μm)。程序升温:初始温度70 ℃,保持3 min,以10 ℃/min升至180 ℃,再以1 ℃/min升至220 ℃,最后以20 ℃/min升至290 ℃。质谱条件:载气为高纯He;载气流速1.0 mL/min;进样量1.0 μL(分流比为10∶1)。EI离子源,离子源温度230 ℃;四级杆温度150 ℃;电离能量70 eV;质量扫描范围m/z: 50~550。
2 结果与分析
黄腰胡蜂新鲜虫体共15.7 kg,乙醇提取得总浸膏2.8 kg,经萃取浓缩得到乙酸乙酯部位350.8 g。乙酸乙酯部位采用硅胶柱色谱分离划段,以石油醚∶乙酸乙酯(200∶1至50∶3)梯度洗脱,结合薄层色谱(TLC)特征,将成分相似部位合并得到极性低(E1)、中(E2)、高(E3)3个油状馏分。
黄腰胡蜂3个油脂馏分清除DPPH自由基的测试结果如图1所示。从图1可以看出,在测试浓度范围内,油脂的中、低极性部位(E2和E1)没有显著的抗氧化活性;而大极性部位(E3)随着质量浓度升高,抗氧化活性逐渐增强,呈剂量依赖。
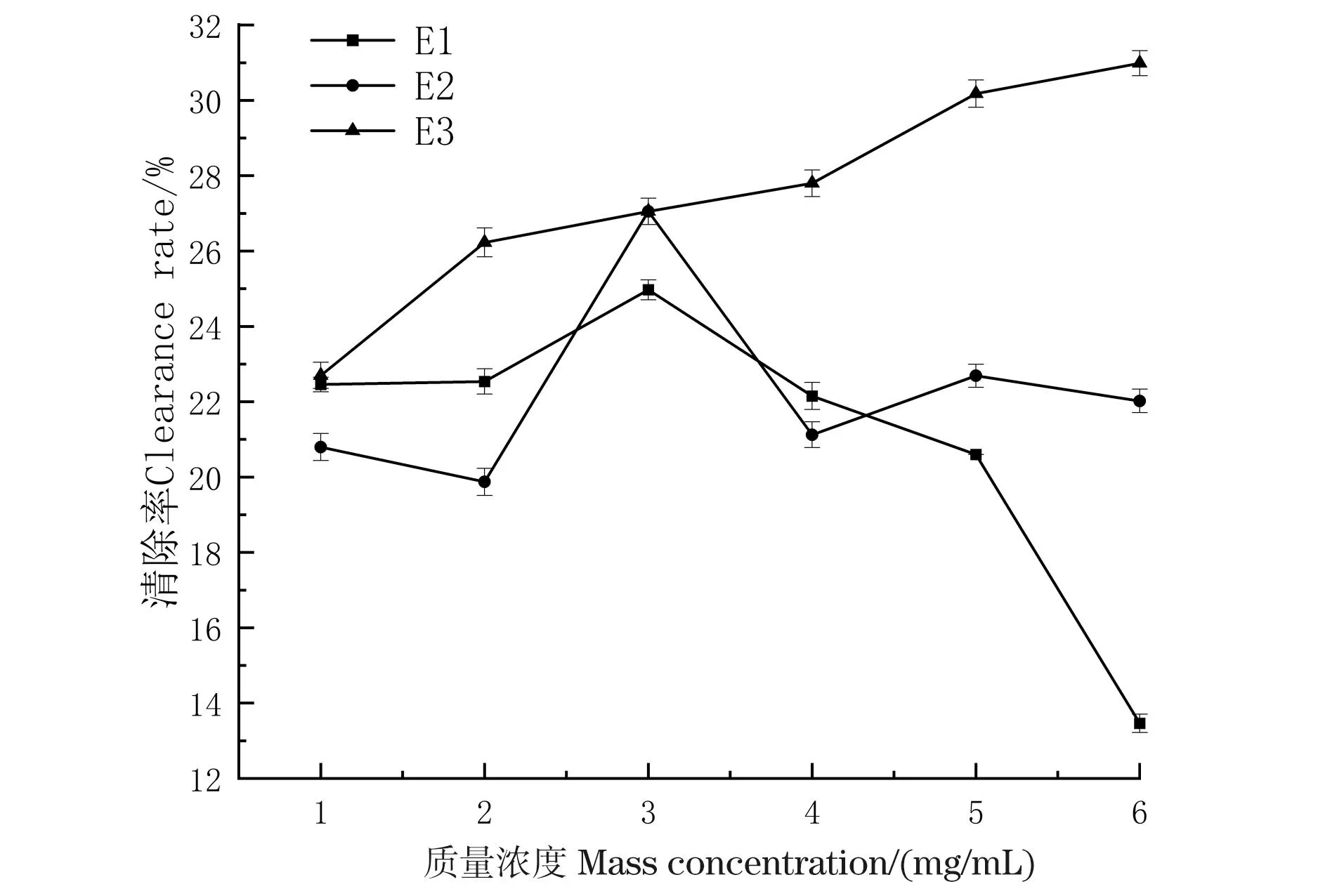
图1 黄腰胡蜂油脂类成分的抗氧化活性Figure 1 Antioxidant activity of oil components extracted from V.affinis
黄腰胡蜂3个油脂馏分对LPS诱导巨噬细胞产生NO的抑制率测试结果如图2所示。与空白组比较,模型组上清液NO含量显著升高;与模型组比较,阳性药组、黄腰胡蜂油脂给药组上清液中NO含量明显降低。其中,黄腰胡蜂油脂大极性E3部位的抗炎活性优于阳性药甲氨蝶呤。综上可知,黄腰胡蜂油脂的抗氧化和抗炎活性成分主要集中在大极性部位。
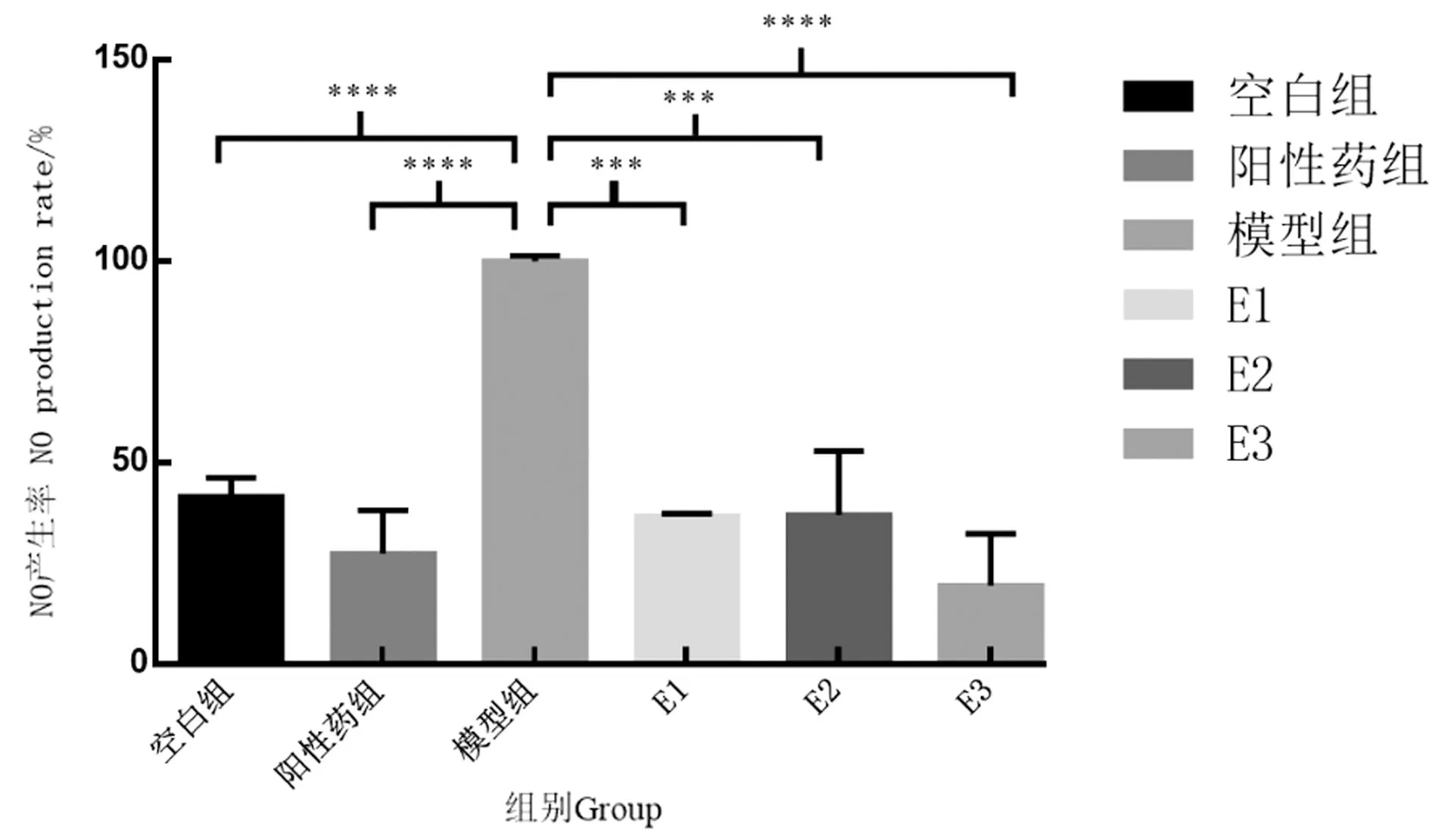
*** 为P<0.001;**** 为P<0.000 1。图2 黄腰胡蜂油脂类成分的抗炎活性Figure 2 Anti-inflammatory activities of oil components extracted from V.affinis
黄腰胡蜂油脂极性低(E1)、中(E2)、高(E3)等3个部位GC-MS总离子流图如图3所示。采用NIST11.L标准库检索。各成分相对百分含量采用归一化法进行计算,具体化学成分及其占比如图4所示。结果表明,E1部分共鉴定出21个化合物,占总峰面积的98.59%,其中,不饱和脂肪酸(酯)有12个,占总峰面积的74.63%,其余均为长链饱和脂肪酸酯;E2部分共鉴定出20个化合物,占总峰面积的98.73%,其中,不饱和脂肪酸(酯)有11个,占总峰面积的74.47%;E3部分共鉴定出化合物20个,占总峰面积的76.37%,不饱和脂肪酸(酯)有8个,占总峰面积的58.27%。从以上数据可看出黄腰胡蜂油脂中富含优质的不饱和脂肪酸,低极性部位中不饱和脂肪酸含量高达74%。
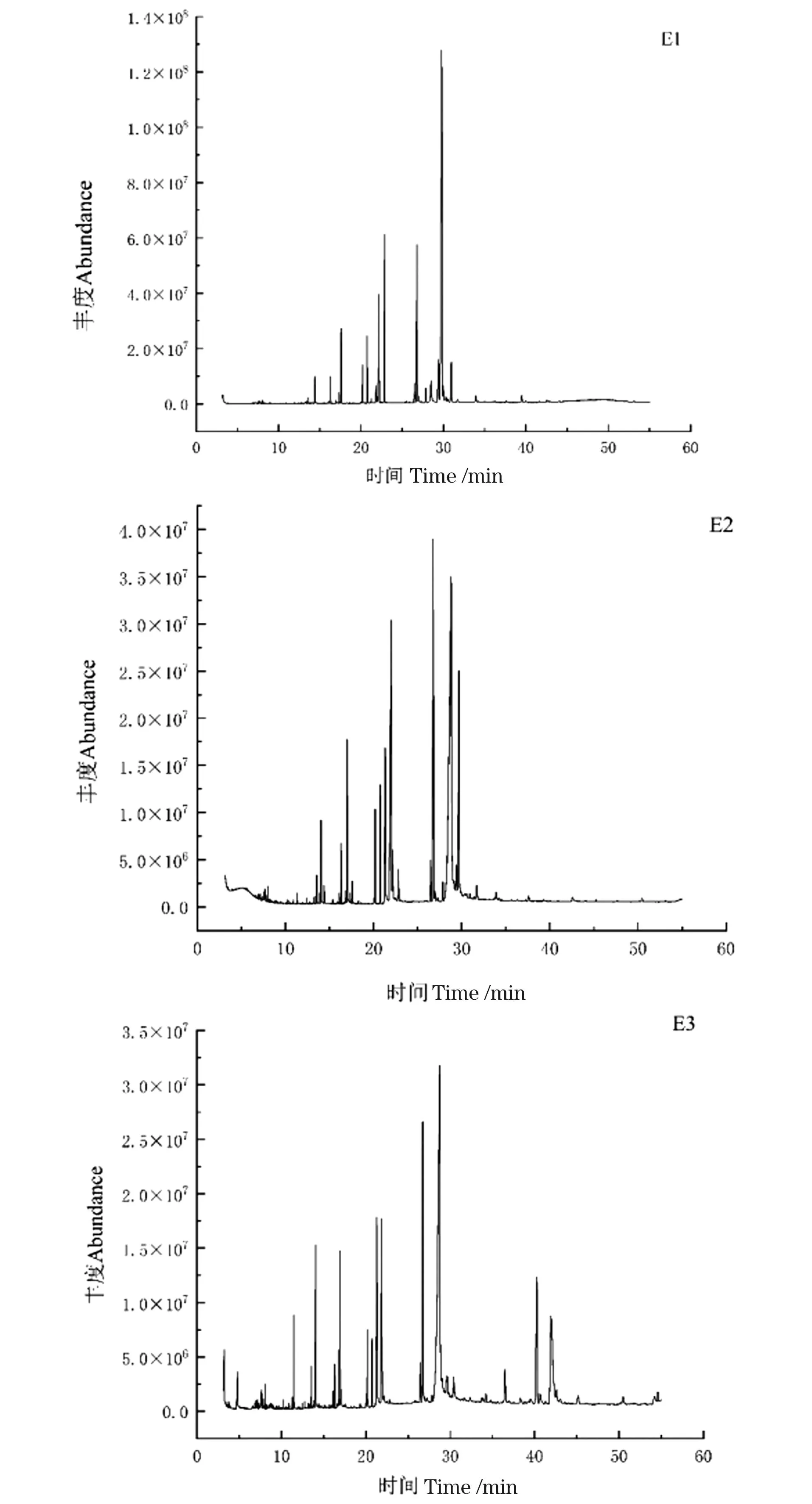
图3 黄腰胡蜂油脂成分的总离子色谱图Figure 3 Total ion chromatogram of oil components extracted from V.affinis
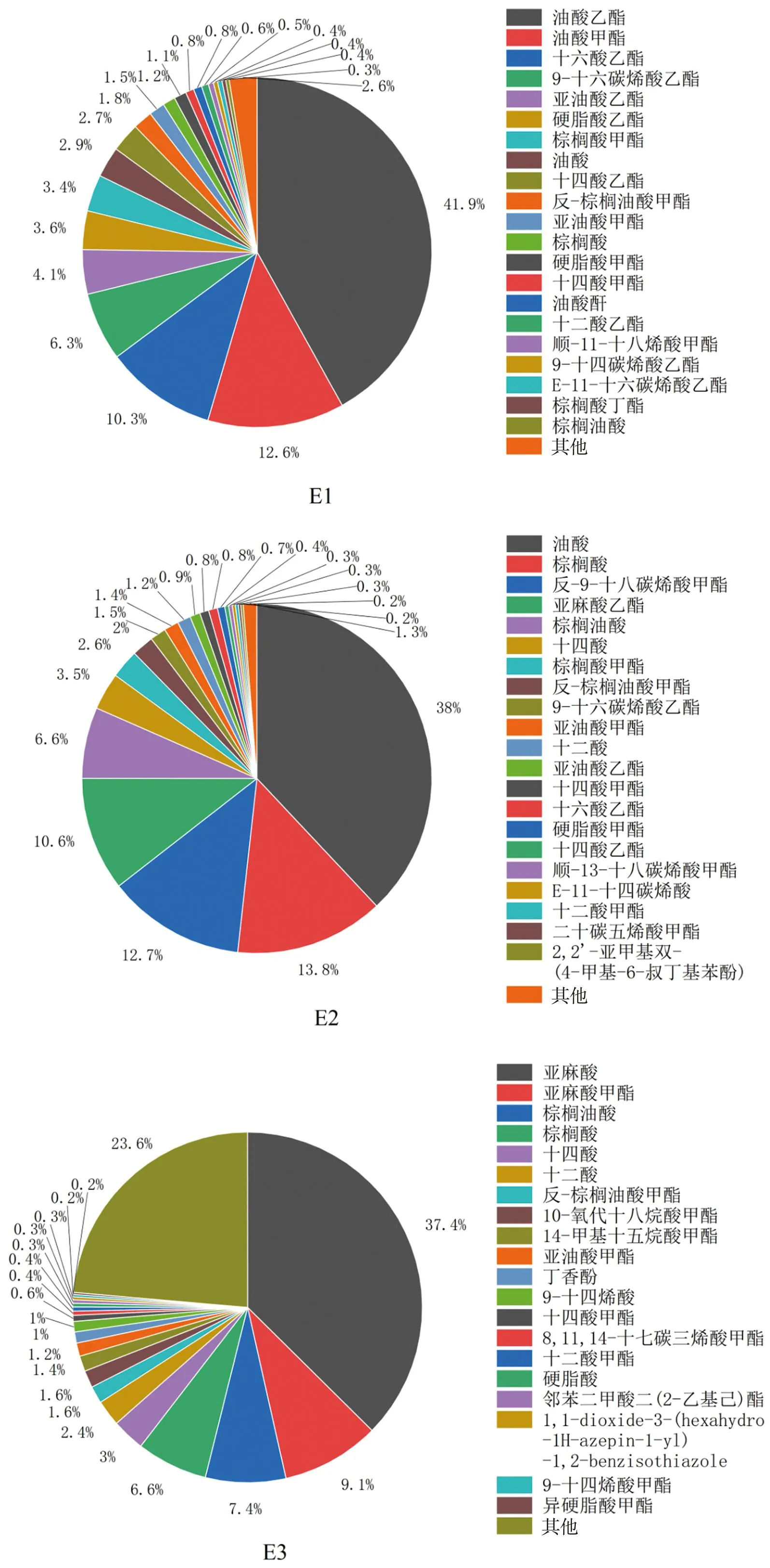
图4 黄腰胡蜂油脂成分占比图Figure 4 Percentage of oil components extracted from V.affinis
研究表明,不饱和脂肪酸在人体中发挥了重要作用,尤其在稳定细胞膜结构、维持脂蛋白平衡、调控基因表达、促进生长发育等方面都扮演了关键角色[15-16],是食物中优质的营养成分。此外不饱和脂肪酸是肉食香味的重要前体物质。在炒制或炸制等烹饪胡蜂过程中,胡蜂油脂中富含的亚油酸、亚麻酸等不饱和脂肪酸作为多种香气物质的前体,产生挥发性的香气分子[17],使胡蜂在食用过程中具有独特的风味,从而满足人们追求食品色香味俱全的现实需求。
3个极性部位中代表性成分(含量超过5%或具有代表性的活性官能团)的对比分析见表1。从表1可以看出黄腰胡蜂油脂的中等极性和低极性部位组成大致相近,主要区别在于脂肪酸碳链的长短以及是否成酯。而大极性部位E3中含有两个代表性成分:具有典型抗氧化活性官能团酚羟基的丁香酚,以及含量高达37%的亚麻酸,这在中低极性油脂中均未发现。结合E3部位与中低极性的E1和E2生物活性的差别,可以得知丁香酚和亚麻酸是黄腰胡蜂油脂发挥抗氧化和抗炎活性的主要和关键成分。
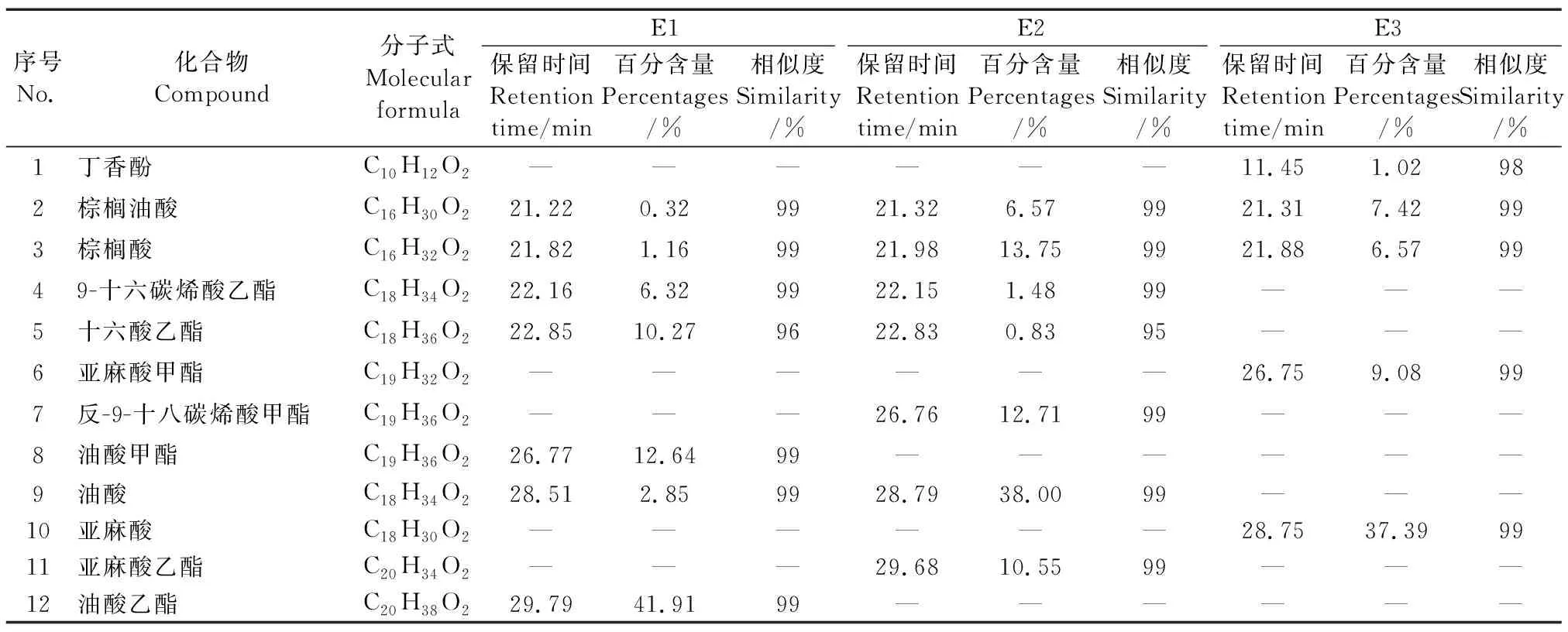
表1 黄腰胡蜂油脂代表性成分的GC-MS对比分析结果Table 1 Results of GC-MS analysis of oil components extracted from V.affinis
丁香酚可通过抑制环氧合酶-2的表达而发挥抗炎活性[18];通过抑制前列腺素E2而发挥镇痛活性[19];通过增加抗氧化酶活性、使用酚羟基捕获烷基过氧化基团等机理发挥抗氧化活性[20]。而亚麻酸也可以通过阻断NF-κB、MAPLs激活和抑制COX-2、TNF-α降低炎症介质的生成,减轻氧化应激水平而发挥抗炎和抗氧化作用[21-22]。
3 结论
(1)采用DPPH法和LPS诱导的巨噬细胞炎症模型对从黄腰胡蜂中提取得到的3个不同极性的油脂部位的抗氧化和抗炎活性进行测试,结果表明黄腰胡蜂油脂的抗氧化和抗炎活性成分主要集中在大极性部位。(2)采用GC-MS技术对黄腰胡蜂油脂的化学成分进行系统分析,结果表明黄腰胡蜂油脂中富含优质不饱和脂肪酸,尤其在中低极性部位中含量高达74%,是其食用过程中独特香味及口感的主要成分。(3)对黄腰胡蜂油脂的3个不同极性部位在抗氧化和抗炎活性以及化学成分上的差异做了对比分析,结果表明丁香酚和亚麻酸是黄腰胡蜂油脂发挥抗氧化和抗炎的主要和关键成分。
综上,本研究采用DPPH法和LPS诱导的巨噬细胞炎症模型对黄腰胡蜂油脂的抗氧化和抗炎活性进行测试;采用GC-MS技术对黄腰胡蜂油脂的化学成分进行系统研究;并结合相关领域研究进展对实验结果进行对比分析。本研究不仅丰富了对黄腰胡蜂油脂化学成分和生物活性的认识,还为其进一步现代化开发奠定基础。
