手性药物不对称催化合成:机遇与挑战并存
2023-12-29张生勇王平安聂慧芳张东旭
张生勇,姜 茹,何 炜,王平安,聂慧芳,姚 琳,张东旭
(陕西省手性药物工程技术研究中心,空军军医大学药学系,陕西 西安 710032)
德国本杰明·李斯特和美国戴维·麦克米伦由于在有机催化领域的杰出贡献而荣膺了2021年的诺贝尔化学奖。这样一来,在短短20年的时间中,不对称催化的三种基本方法[金属催化(2001年)、酶催化(2018年)和有机催化(2021年)]均得到了诺贝尔化学奖的青睐。这足以证明手性化合物(尤其是手性药物)的高效不对称催化合成具有重大的科学意义和研究价值,也彰显了不对称催化发展的欣欣向荣和勃勃生机。尽管这些获奖者的研究领域不同,但其本质属性都是化学,他们的开拓性成果都是通过立体选择的催化反应构建手性物质。本文结合手性药物不对称催化合成多年来的研究进展,对手性药物不对称催化合成的研究所面临的机遇和挑战进行了总结,对未来一段时间内手性药物不对称催化合成的研究要点进行分析展望。
1 手性的概念及手性药物的合成
何谓手性?手性是指实物与其镜像的一种关系。如同人的双手一样,左手的镜像是右手,二者相似但不能重叠。人们把这种实物与其镜像不能重叠的性质叫做手性。实际上,“手性”并不是一个新鲜的化学术语,早在1884年英国开尔文勋爵在一次讲座中就首次提出了“手性”这个概念,用于表述实物与其镜像不能重叠的属性。手性是自然界普遍存在的现象,从宇宙天体和行星运行,到微观分子如葡萄糖和金鸡纳生物碱;从微观分子氨基酸,到生物大分子酶、多肽、蛋白质和DNA以及海螺、蜗牛的螺旋结构,螺旋状缠绕在树干上的攀援植物等,处处都存在着手性的身影。
手性与人类生命健康和日常生活密不可分。临床上使用的数千种化学药物中就有52%的药物具有手性。在2019年世界畅销的前20种药物中,手性药物14种,占比高达70%。手性药物的构型不同,它们的药理活性、毒性和代谢过程也不尽相同,有时也会造成“我之蜜饯你之砒霜”的天壤之别。例如,非甾体类抗炎镇痛药(S)-萘普生是其对映体活性的35倍;普洛萘尔的两个异构体都有β受体阻滞作用,但(S)-异构体比其对映体的作用强100倍。20世纪60年代初发生的“反应停”事件是说明手性化合物性质差异的典型事例。当时,沙利度胺(商品名“反应停”)作为治疗妊娠反应药物能够有效地缓解孕妇的恶心呕吐,因此成为“孕妇的理想选择”(当时的广告用语)。但是,噩梦随之而来,在不到3年的时间里“反应停”就导致了12 000多例“海豹肢畸形”新生儿,成为医学史上的一大悲剧。悲剧发生的原因是由于没有除去“反应停”中的左旋体。“反应停”是手性化合物(图1),含有等量的左旋体和右旋体,其中的右旋异构体具有中枢镇静作用,而左旋异构体则由于妨碍了孕妇对胎儿的血液供应而具有强烈的致畸作用。
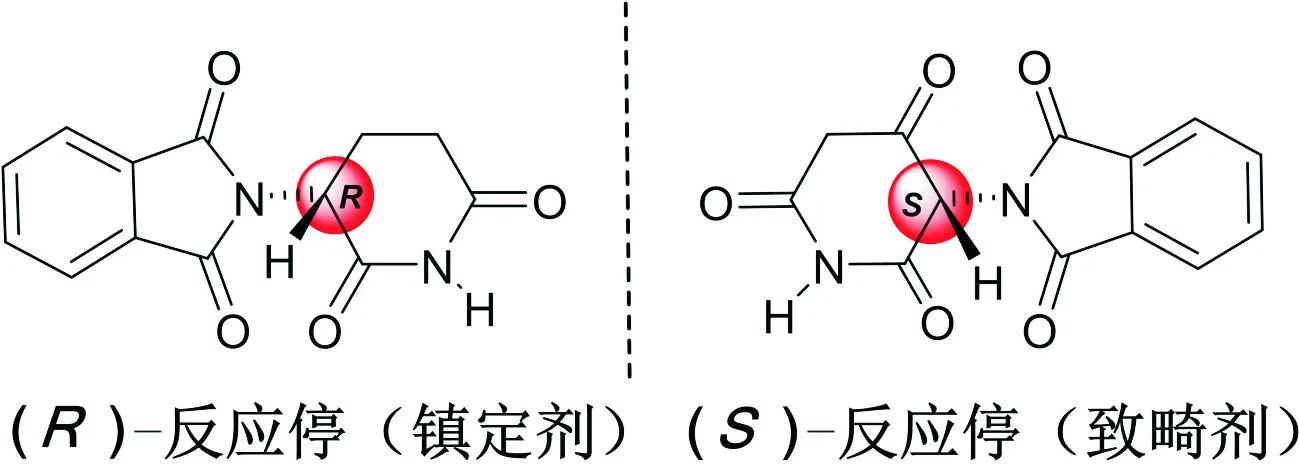
图1 “反应停”左旋体和右旋体的结构
手性药物主要是通过不对称催化反应合成的,目前主要有3种催化剂:酶、金属催化剂和有机催化剂。
2 酶和生物催化:优势与局限性
2.1 酶和人工定向酶
酶的本质是蛋白质,是由数百个氨基酸组成的生物大分子,即使是最简单的酶也含有200~300个氨基酸,因此酶的分子质量至少为10 000,大者可达1 000 000。绝大多数的酶是由活细胞产生的蛋白质。
酶是生物体内进行各种化学反应最重要的物质,它是由20种不同的氨基酸按一定排列顺序形成的肽链,这种如同一条长线的肽链,按照一定的规则弯曲、折叠形成一个比较松散的“线团”。但是,这个“线团”并不是杂乱无章的,而是按照一定的规则排布。因此,每一种酶都具有相同的结构和固定的形态。就是由于这种独特的结构使酶肽链中某些氨基酸的侧链形成一种固定的空间排布,构成具有催化能力的活性中心。酶的催化作用有赖于酶分子的一级结构及空间结构的完整。但是,通常高温、强酸、强碱或有机溶剂等能够破坏酶的结构,因此乱了套的“线团”(酶)就失去了催化活性。人们把这种现象叫作酶分子变性。
酶催化的化学反应叫作酶促反应。生物体内的化学反应绝大多数都属于酶促反应。酶促反应不限于天然产物,经过结构适当改造的酶也能催化非天然产物。
酶是一种蛋白质,是由20种不同氨基酸组成的生物大分子。基因决定了酶的氨基酸组成,因此只要修改编码酶的基因就能够改变酶的氨基酸组成,从而改变其催化性能。但是,传统的修改方法费时费力且效果也不佳。弗朗西斯·阿莫德另辟蹊径,对酶进行人工进化,高效地得到所希望的酶变体——人工定向酶。这一开拓性的成果使阿莫德荣获2018年诺贝尔化学奖[“通过定向进化的酶被用来制造从生物燃料到药品的各种产品”(2018年诺贝尔化学奖颁奖词)]。
2.2 酶催化
酶是一类重要的生物催化剂,由于其高效和高选择性的巨大优势,在手性药物合成和工业生产中具有广泛的应用,迄今已成功地用于紫杉醇、阿托伐他汀等手性药物的合成。
根据催化的反应类型,酶分为六大类:氧化还原酶、转移酶、水解酶、裂解酶、异构酶和连接酶。作为绿色、高效的催化剂,它们均在手性药物的合成中扮演着重要的角色。
Codexis和Merck公司利用ω-转氨酶将羰基直接转化为手性氨基的关键步骤成功实现了手性降糖药西他列汀的工业生产[1](图2)。
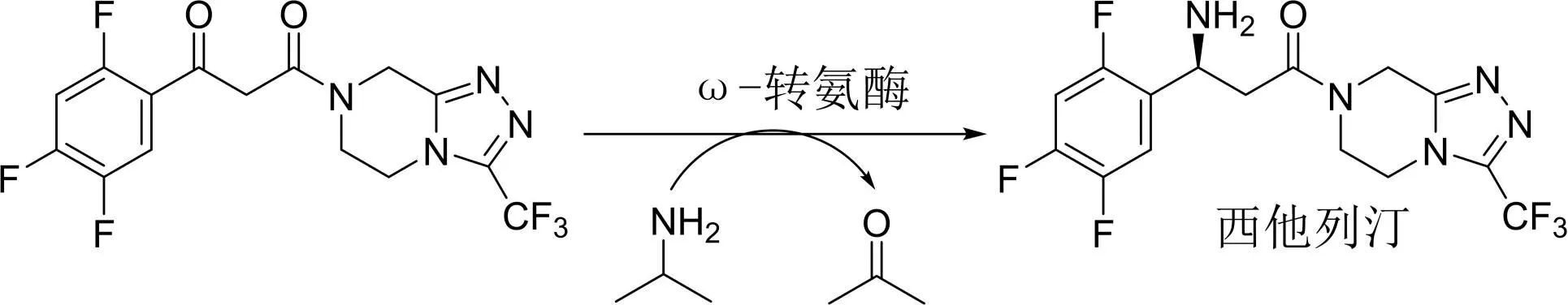
图2 手性降糖药西他列汀的工业生产
紫杉醇是广谱、高效、低毒的抗癌药,最初是从红豆杉树皮中提取的,目前临床上使用的紫杉醇基本上都是人工合成的(图3)。
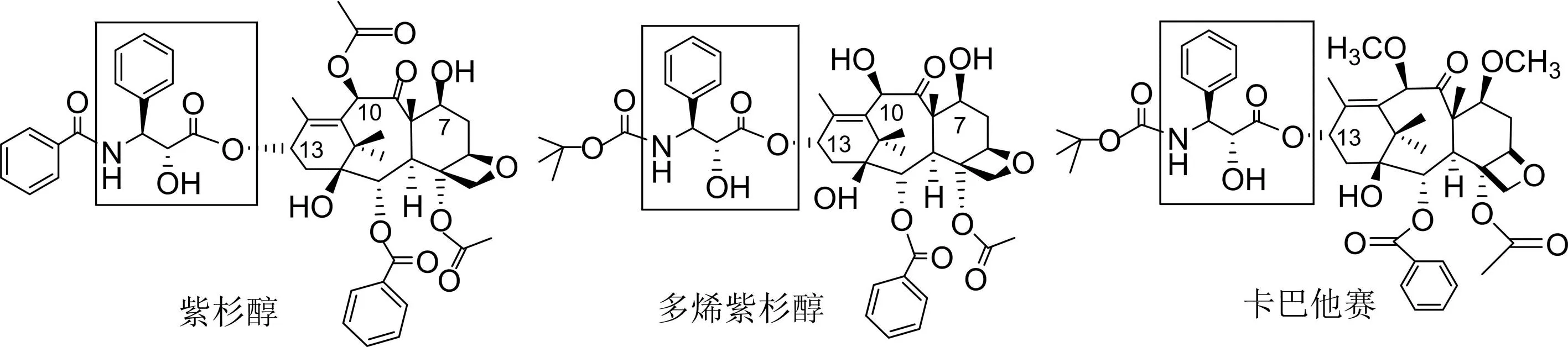
图3 目前临床上使用的紫杉烷类药物结构
苯基异丝氨酸是合成紫衫烷类抗癌药的重要手性砌块。目前,合成苯基异丝氨酸的主要方法之一就是生物法,即在ω-转氨酶的存在下,以α-苯基-β-羰基-α-羟基丙酸为原料,高效、高选择性地把羰基转化为手性氨基生成苯基异丝氨酸。后者与略经修饰的天然产物10-去乙酰基巴卡亭缩合即可得到紫杉醇(图4)。用类似的方法也可合成其他紫杉烷类抗癌药多西紫杉醇和卡巴他赛(图3)。
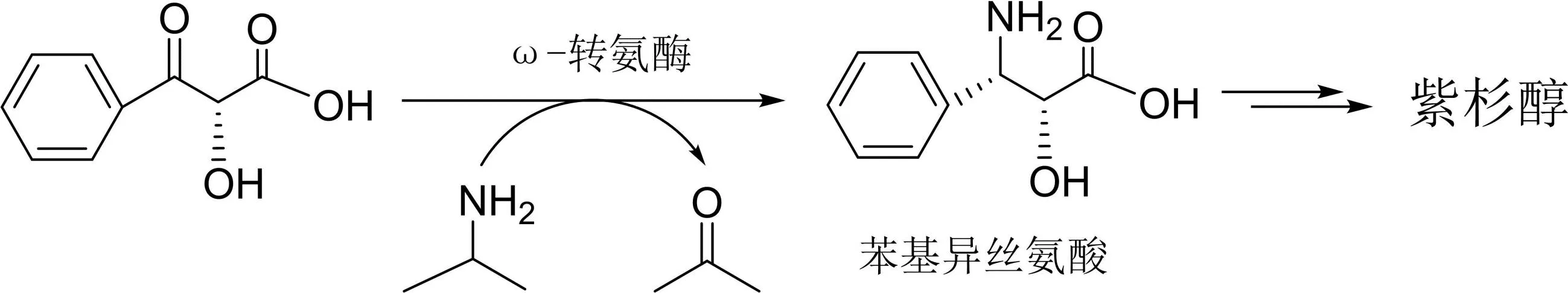
图4 酶催化合成紫杉醇的合成路线
阿托伐他汀、瑞舒伐他汀等他汀类药物是羟甲戊二酰辅酶还原酶抑制剂,能够有效抑制胆固醇合成,已广泛应用于临床。
合成阿托伐他汀钙的关键是手性中间体6的合成,手性中间体6约占阿托伐他汀钙原料成本的1/2,因此掌握该关键中间体的先进合成技术,也就掌握了阿托伐他汀钙的核心技术。
在中间体6的合成过程中,有三步反应涉及酶催化,一是1→2和4→5这两步反应是在辅酶Ⅰ的参与下,还原酶把羰基还原为手性仲醇,二是脱卤酶催化碳-卤键的断裂,生成新的碳-碳键(2→3)和卤离子(图5)。

图5 通过化学-酶法合成阿托伐他汀钙的反应路线
酶是一类重要的生物催化剂,其催化条件温和,在常温、常压下即可进行催化反应。酶对其底物具有高度特异性和高度催化效能,酶促反应的速率最高可达非酶催化速率的10~12倍,同时还具有优秀的选择性。酶主要通过在过渡态时与底物的多重相互作用,有效控制底物构象,并降低过渡态的活化能,达到高选择性和高活性。
酶的主要局限性是作用过于专一,选择性难以调节,稳定性差,价格昂贵,某些酶还需要辅酶或培养基。
3 金属催化:突破与瓶颈
过渡金属配合物催化的不对称均相反应是合成手性药物的重要方法。由于过渡金属的外层含有未填充的空d轨道或一定数量的d电子,它可以通过空d轨道与底物配位,或者用自己的d电子向底物的空轨道反馈而形成碳-金属键。因此,这类催化剂用途广泛,并有许多用于工业生产手性药物的成功案例。
3.1 金属催化的发展
过渡金属催化的不对称反应研究迄今已有五十多年的历史。1968年,KNOWLES等[2]和HORNER等[3]分别首次报道了手性铑配合物均相催化的不对称氢化反应,开创了不对称合成的新纪元。由于这一开拓性的工作,KNOWLES与NOYORI(首次报道了轴手性双膦配体Binap)发明了不对称氧化反应的SHARPLESS,荣膺了2001年诺贝尔化学奖[“这三位获奖者为合成具有新结构的分子和物质开创了一个全新的领域。现在像抗生素、抗癌药和心脏病药等都是根据他们的研究成果创造出来的”(2001年诺贝尔化学奖评语)]。他们的工作改变了手性药物的生产途径。
用于不对称氢化的催化剂主要是由手性膦配体与过渡金属(Rh、Ir、Ru)配位而成。在林林总总、结构各异的膦配体中,根据手性类型可以把它们分为膦手性、碳手性、轴手性和螺手性四类配体。从20世纪70年代起手性膦配体如雨后春笋,除了单膦配体外,人们报道了更多的手性双膦配体。下面归纳了各类配体的结构和发明人以及首次报道的时间和演变过程(图6)。
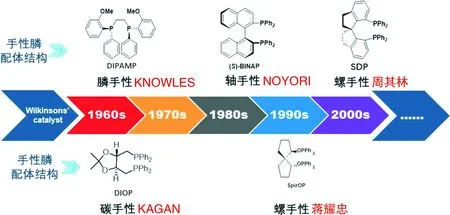
图6 各类膦配体的结构和发明人以及首次报道的时间和演变过程
近几年来,作者团队在烯丙醇(图7A)[4]、α-烷氧基-α,β-不饱和羧酸(图7B)[5]、异喹啉(图7C)[6]、N-芳基亚胺(图7D)[7]、β-芳酮-α-甲基-α,β-不饱和羧酸(图7E)[8]、高共轭α-甲基-α,β-不饱和羧酸(图7F)[9]和2-羧基色酮(图7G)[10]等挑战性底物的不对称催化氢化的研究中,不仅获得了优秀的对映选择性,而且区域选择性和化学选择性都高达100%。
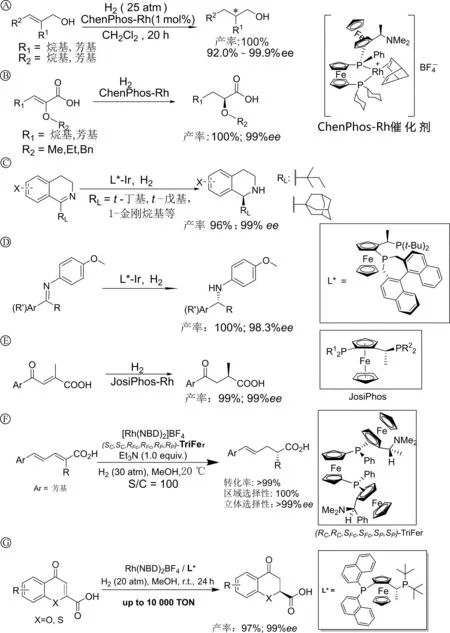
图7 作者团队挑战性底物的不对称催化氢化研究
上述挑战性底物的不对称催化氢化反应,不仅为构建手性药物提供了关键的手性砌块,同时作者还利用这些反应成功地合成了手性药物阿莫罗芬(图8A)、索利那辛(图8B)和氟罗布芬(图8C)。
3.2 金属催化在手性药物工业生产中的应用
不对称催化氢化反应是最重要的药物绿色合成技术之一。例如,度洛西汀、阿利克仑、西他列汀和雷美替胺等手性药物都是在过渡金属配合物的存在下通过不对称催化氢化反应工业生产(图9)。

图9 部分由过渡金属配合物催化的不对称氢化反应生产的手性药物
(S)-异丙甲草胺(商品名“金都尔”)是玉米和其他农作物最为重要的手性除草剂,是瑞典先声达公司于20世纪90年代末率先开发的。它的关键步骤就是采用不对称催化氢化反应,在反应式所示的条件下,转化数(TON)高达1 000 000,是金属催化用于工业生产最成功的范例之一(图10)。
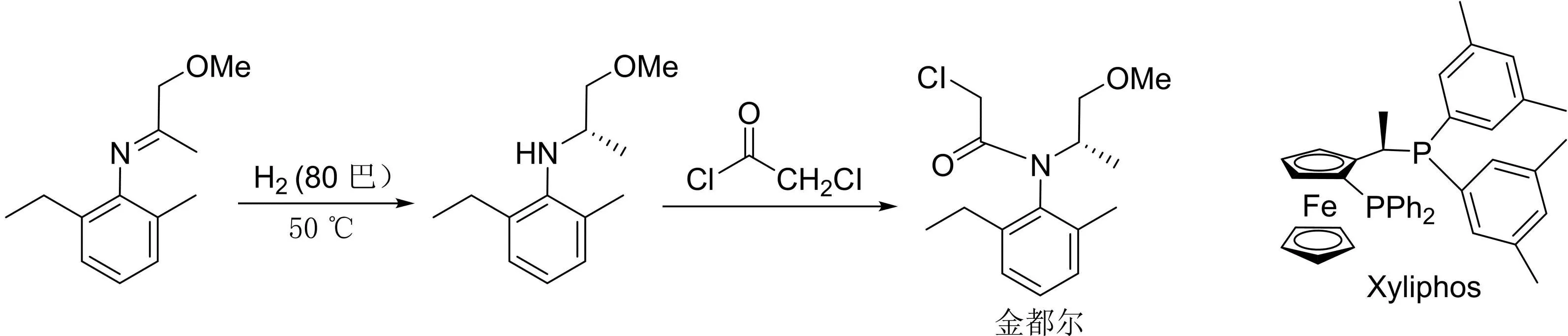
图10 (S)-异丙甲草胺(商品名“金都尔”)的工业生产路线
不对称氧化反应在手性药物的生产中也扮演了重要的角色。例如,抗艾滋病药茚地那韦就是利用Jacobsen催化剂(Salen盐)通过烯键的不对称环氧化生产的[11-12](图11)。
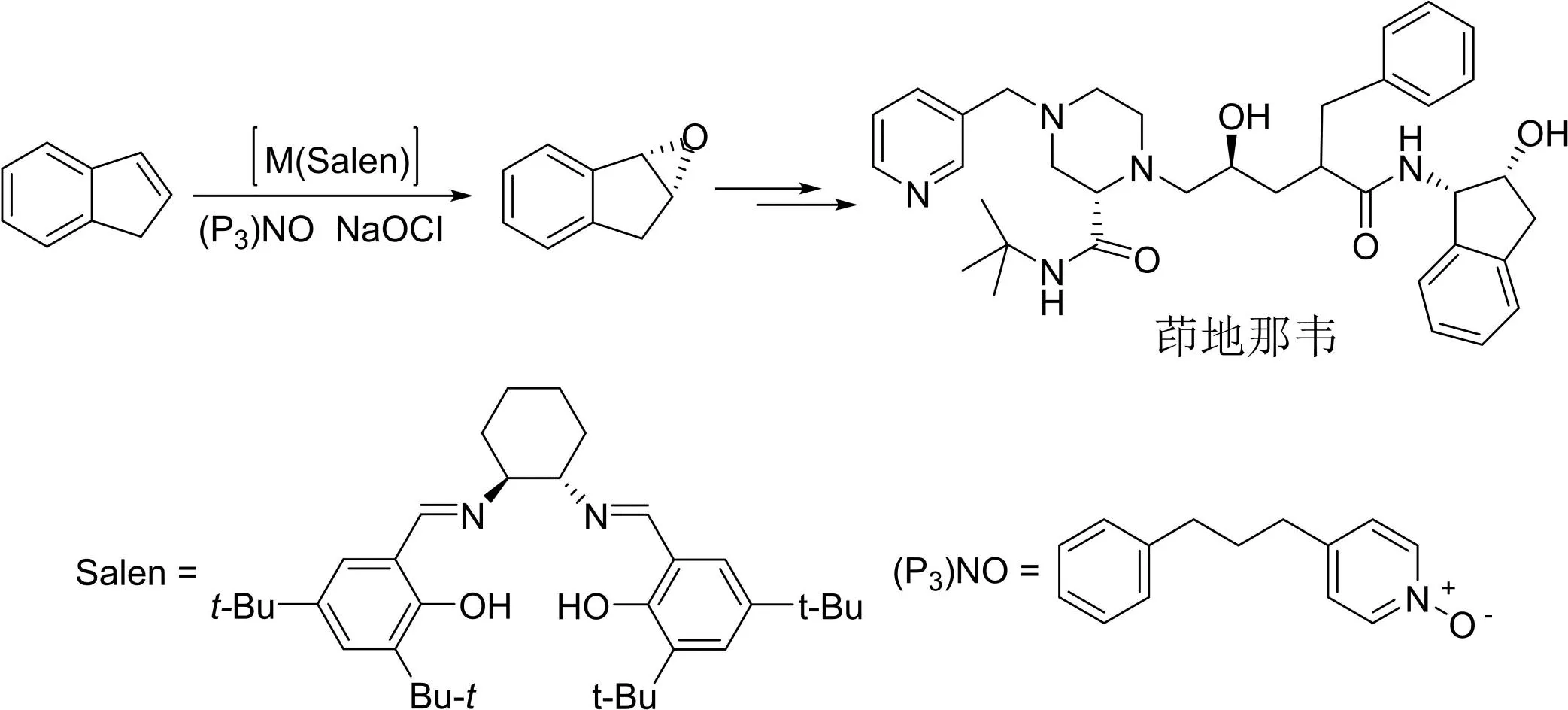
图11 抗艾滋病药茚地那韦的工业生产路线
KAGAN率先报道的硫醚不对称氧化反应在工业生产中也得到了广泛的应用。例如,治疗胃溃疡的拉索美拉唑和被称为“不夜神”的阿莫菲尼都是通过硫醚的不对称氧化反应的关键步骤生产的[13-16](图12)。拉索美拉唑在2012年是全球第四位的畅销药。(R)-阿莫非尼属兴奋剂药物,临床上主要用于治疗白天睡眠过多的发作性睡病和抑郁症患者,也用于治疗特发性嗜睡或发作性睡眠症。由于其效果显著,因此成为美军的战备药物。

图12 通过不对称氧化反应生产拉索美拉唑和阿莫菲尼
尽管金属催化获得了巨大的进展,也取得了诸多突破,但仍存在不尽人意之处,例如,普遍使用昂贵的稀有金属,而有时使用的手性配体甚至比金属更贵,因此成本普遍较高。同时,在多数情况下催化剂的活性和立体选择性也不尽如人意。更重要的是,贵重金属毒性大,不适合用于手性药物和食品添加剂的合成。尽管近年来已有使用铁、钴、镍、锰等廉价金属的报道,但合适的配体很少,同时适用范围有限,催化性能还有待提高。
4 不对称有机催化:机遇与挑战
李斯特和麦克米伦因对“不对称有机催化”的突出贡献而荣膺了2021年的诺贝尔化学奖[“他们开发了一种新的、巧妙的分子构建工具:有机催化。它的用途包括了研究新药,使化学更环保,并使生产手性分子变得更容易”(2021年诺贝尔化学奖评语)]。
长久以来,用于不对称合成的催化剂有两种:酶和金属催化剂。但是,到2000年前后,得益于李斯特和麦克米伦突破性的工作进展,将不对称有机催化推向高潮,从此产生了第三种不对称催化:有机催化。目前,不对称有机催化将分子构建带到了一个全新的水平,并已奠定了与金属催化和酶催化三足鼎立的地位,同时展现了一些独特的优势:①可以通过手性源方便合成,即以价廉、易得的光学纯天然产物为原料,通过手性保持或构型翻转合成所需要的有机催化剂。②催化剂对水和空气相对稳定,使用方便,易于贮存和运输。同时,不存在重金属污染的后顾之忧,适合于药物和食品添加剂等手性精细化学品的合成。③具有丰富的活化模式,可以根据底物特点用不同的活化模式设计新反应;催化剂与底物之间的作用可以通过氢键、共价键或离子对等方式有效地控制反应的立体选择性。④可以通过使用双功能或多功能催化剂的协同作用实现单一催化剂无法解决的合成难题。
4.1 有机催化的发展
2000年,李斯特采用脯氨酸作为丙酮和芳香醛之间羟醛缩合反应的催化剂,结果获得了68%的化学产率和高达96%ee的立体选择性[17-18](图13)。因此,结构简单、价格低廉的脯氨酸几乎是最好的催化剂,即便使用手性金属催化也难以在如此温和的条件下实现高选择性分子间反应,但是有机催化剂竟然做到了,这不能不说既是一个奇迹,也是一个突破。

图13 脯氨酸作为催化剂的羟醛缩合反应
几乎与李斯特在同一时期,麦克米伦在研究金属催化剂时发现这类催化剂很不稳定,易被湿气或氧气破坏。因此,他开始思考是否有可能开发出一种更耐用、更稳定的催化剂。于是,他设计了一些可以产生亚铵离子的简单分子咪唑烷酮,其中的一种在不对称催化方面表现优异[19]。在5%手性咪唑烷酮的存在下,α,β-不饱和醛与共轭环戊二烯的狄尔斯-阿尔德反应,获得了优异的结果[19](图14)。
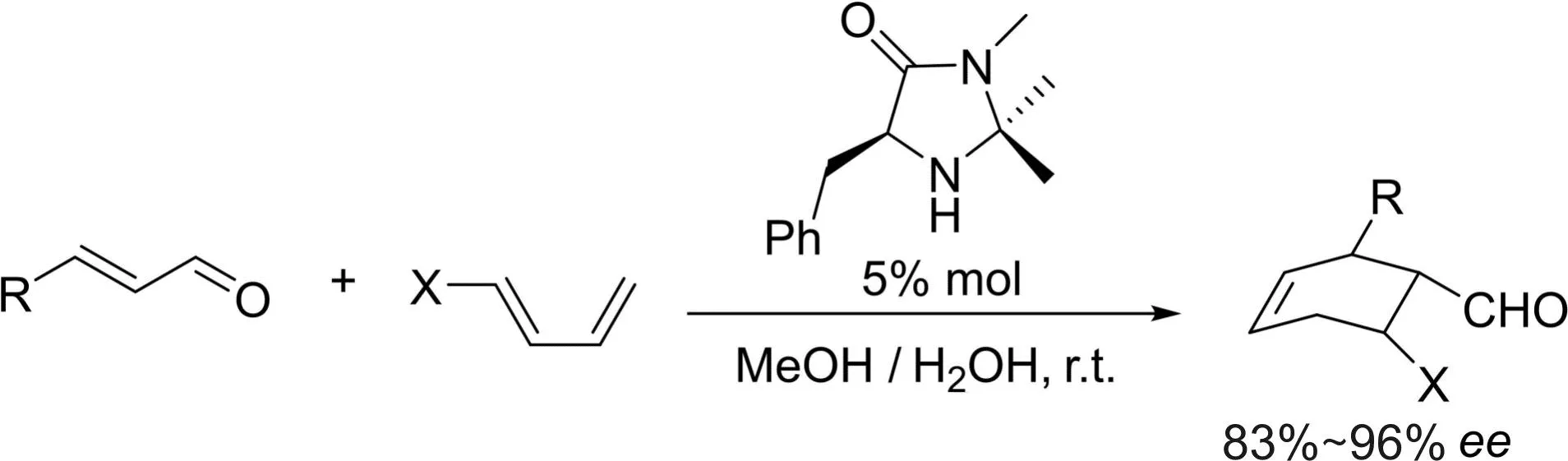
图14 手性咪唑烷酮催化的狄尔斯-阿尔德反应
实际上,有机催化并不是什么新鲜事,也不是2000年才出现的新型催化形式,它最早能够追溯到1894年,克脑文盖尔报道的乙二胺催化甲醛与丙二酸酯的缩合反应。尽管不是立体选择的催化反应,但他开创了有机催化的先河,成为“第一个吃螃蟹的人”。不对称催化的第一次尝试是在1904年,当时利用生物碱类天然产物催化合成手性羧酸。1912年,BREDIG和FISKE使用金鸡纳生物碱奎宁或奎尼丁进行芳香醛与氰化氢的加成反应,他们发现金鸡纳碱能够加快反应,并获得了光学活性的加成氰化物,但立体选择性≤10%ee。
不对称有机催化从20世纪90年代后期开始进入到一个新的发展时期。YANG等[20-21]率先报道了含有轴手性骨架的酮催化剂(图15)不对称催化烯烃的环氧化反应。在反式烯烃的不对称环氧化反应中获得了最高达90%的产率和95%ee的立体选择性。

图15 杨丹报道的含有轴手性骨架的酮催化剂
几乎与杨丹同时,史一安也报道了一类结构简单、易于合成的手性有机酮催化剂。他们以果糖为原料在温和条件下只经过两步反应就能够高产率的制备[22]目标手性化合物(图16)。

图16 史一安报道的手性有机酮催化剂及其制备路线
史一安酮的优势在于性能卓越,适用底物广泛,原料价廉易得,便于合成,更适合于工业生产。
我国化学工作者在有机催化领域也是一支非常活跃的研究群体,ZHU等[23]用有机小分子催化烷氧基醛与β-乙酰氨基硝基烯烃的不对称Michael加成反应的关键步骤,成功地合成了含有3个手性中心的抗流感药奥司他韦(商品名“达菲”)。CHEN等[24]利用有机小分子催化不对称Michael加成反应合成了三种生物活性氢化二苯并呋喃生物碱(-)-石蒜胺、(+)-月桂碱以及治疗阿尔茨海默病的(-)-加兰他敏。YOU等[25]用脯氨酸衍生的有机小分子催化剂不对称催化狄尔斯-阿尔德反应合成了具有抗HIV活性的降三萜(+)propindilactone G。GUO等[26]利用手性硫脲催化硝基甲烷与环己烯酮的不对称Michael加成反应合成了海洋生物碱(-)Haliclonin。
近20年来,作者在不对称有机催化领域也进行了探讨,先后报道了脲、硫脲、芳酰胺和金鸡纳生物碱季铵盐等数十种有机催化剂,它们在Michael加成、Henry反应、MBH反应、相转移反应和环氧化等十多种不对称反应中都获得了理想的结果。现将一些典型的例子汇总如下。
金鸡纳生物碱季铵盐不对称有机催化Nitro-Mannich反应[27]、Henry反应[28]、相转移反应[29]和RC反应[30](图17)。

图17 金鸡纳生物碱季铵盐催化的不对称反应
硫脲、脲、芳酰胺有机催化不对称Michael加成[31]、MBH反应[32]和环氧化反应[33](图18)。

图18 硫脲、脲、芳酰胺催化的不对称反应
氨基酸衍生的芳酰胺、类二肽有机催化剂和吡咯烷衍生的脲类有机相转移催化剂不对称催化的反应以及动力学拆分[34-36](图19)。
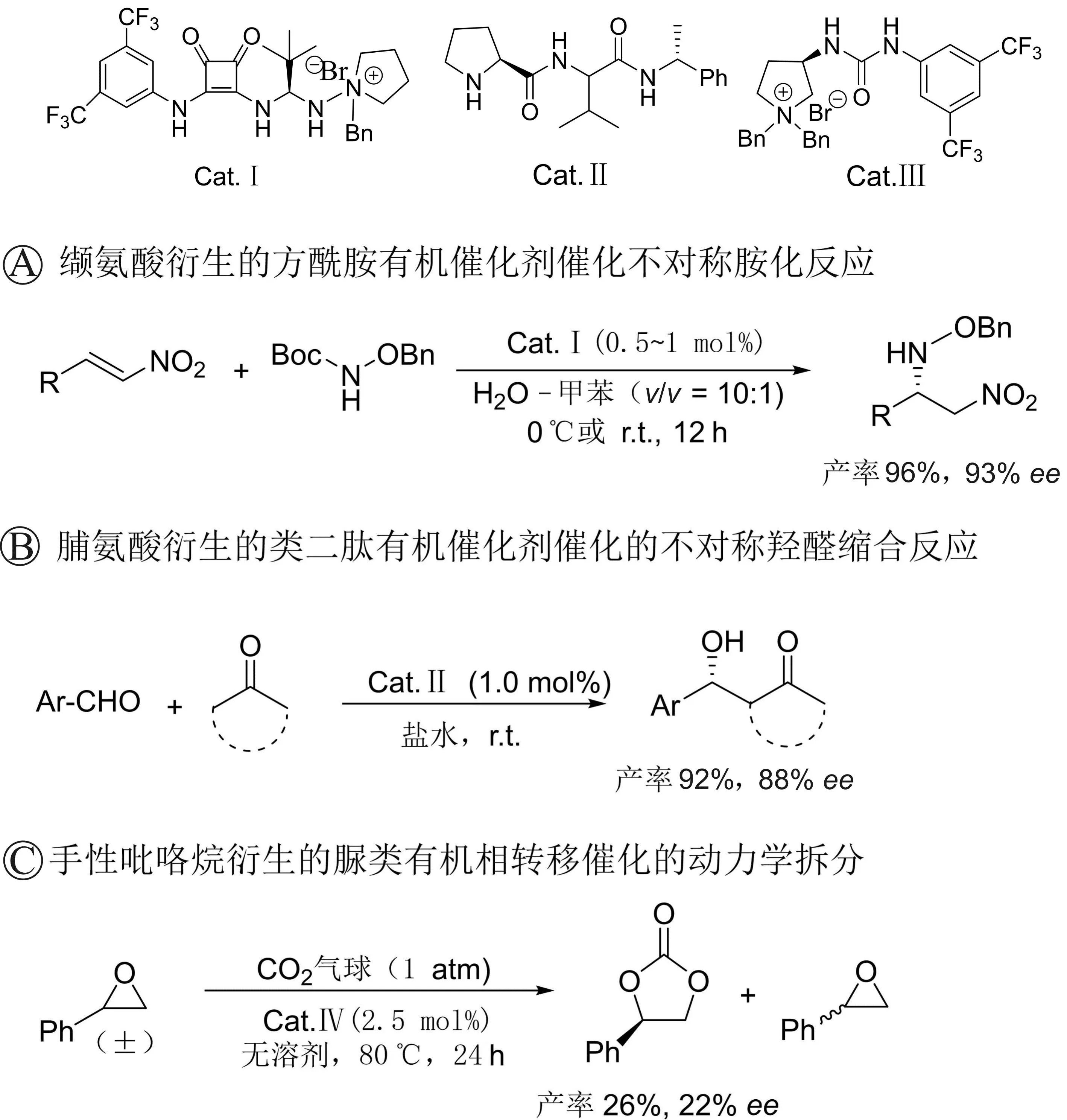
图19 芳酰胺、类二肽有机催化剂和脲类有机相转移催化剂催化不对称反应以及动力学拆分
4.2 有机催化在药物合成中的应用
有机催化这种全新而巧妙的分子构建工具不仅可以被用来研究新药,还能让化学更环保,因此它在手性药物合成中的应用已初露端倪。作为典型事例,这里仅介绍有机催化不对称合成抗流感手性药物奥司他韦。
奥司他韦的商品名为“达菲”,是一种特异性神经氨酸酶抑制剂,可以有效的抑制禽流感和甲型H1N1流感病毒。奥司他韦的高效绿色合成一直是药物化学和有机合成领域探讨的热点问题,虽然迄今已有近20种合成方法,但是从经济、高效和绿色合成的角度考虑,其中的大多数方法都难以实现工业化生产。因此,继续研究高效绿色的合成方法就成为化学家面临的迫切问题。2009年,ISHIKAWA等[37]采用从脯氨酸衍生的有机催化剂,通过烷氧基醛与β-羧酸叔丁酯硝基烯的不对称Michael加成反应的关键步骤全合成了奥司他韦(图20)。
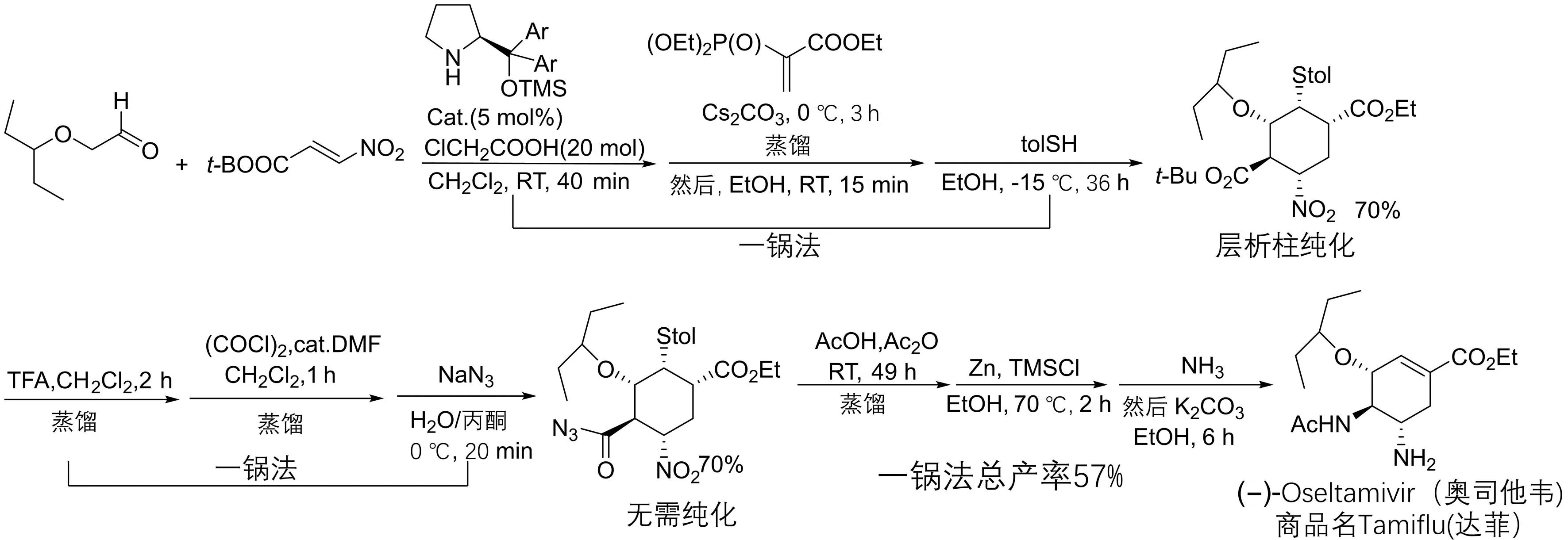
图20 有机催化的不对称Michael加成反应合成抗流感病毒药奥司他韦
ZHU等[23]于2010年采用同样的催化剂,用β-乙酰氨基硝基烯代替Hayashi的β-羧酸叔丁酯硝基烯,通过β-乙酰氨基硝基烯与烷氧基谜不对称Michael加成反应的关键步骤,用简单分子成功合成了结构较复杂的奥司他韦(图21)。

图21 通过不对称Michael加成反应的关键步骤合成奥司他韦
手性有机小分子化合物作为继酶和金属催化剂之后第三类用途很广的手性催化剂,它们廉价、低毒,结构和分子组成确切,且充满活力,对水和氧气相对稳定,既便于回收和重复使用,也基本上不需要惰性气体保护、低温、绝对的无水溶剂等特殊的反应条件。但是,从整体上讲,目前有机催化剂存在的主要问题是催化活性低,催化剂用量大。同时,立体选择性在许多情况下也只是差强人意,真正能够用于工业生产的有机小分子催化剂迄今尚未见报道。
5 展望
生物催化已经走过了100多年的漫长之路,如今已经成为构建手性药物分子的重要工具。由于生物催化剂——酶具有精巧的三维空间结构和很好的协同催化作用,因此它的催化活性和选择性都是金属催化剂和有机催化剂无法比拟的。
目前,药物化学家面临的主要任务,一是进一步挖掘天然酶的催化功能,扩大其应用范围;二是在深入了解模拟酶的结构与功能的基础上,理性设计、合成结构简单、功能更强大的模拟酶。我们相信,通过对酶分子的设计、改造和应用范围的探讨,将为药物化学家构建手性药物分子提供无限广阔的发展空间。同时,酶和金属这两类催化剂互补的特性也逐步显现,这无疑会扩大它们在药物合成中的应用范围。
与生物催化相比,金属催化具有独特的优势和无可替代的地位。这种独特性源于组成配合物催化剂的手性配体和与之配位的过渡金属。首先可以通过调节配体的刚性、电性等精准地构筑催化活性中心的手性环境,以实现高立体选择性的不对称催化反应。其次,配位金属具有独特的外层电子结构,便于参与底物分子中各种化学键的活化和重组。
金属催化是用途最广的不对称催化反应,已经广泛地应用于工业生产。同时,近几年来发展起来的金属-有机协同催化更是扩大了金属催化的应用范围。
设计合成更高效的有机催化剂、开发新的不对称催化反应和有机-金属协同反应等仍然是有机催化今后的研究方向和重点领域。同时,利用有机小分子化合物能够容纳不同官能团的特点设计多功能催化剂,进行串联反应或高效构建天然产物分子中复杂的手性骨架也是研究的热点。鉴于有机催化的现状,还应当努力开发能适用于工业生产的新型催化剂,真正实现使手性物质的生产变得更容易、更环保、更经济。
