分子对接阐明草甘膦与水稻醛酮还原酶(OsALR2)的作用及QsALR2的表达纯化
2023-12-28孙跃刘蓉王思威徐汉虹吴鹰花
孙跃 刘蓉 王思威 徐汉虹 吴鹰花


关键词:水稻;草甘膦;分子对接;原核表达;包涵体变复性;酶活测定
草甘膦(glyphosate)是一种重要的除草剂,具有内吸传导性强,广谱,药效好,靶向性高,环境兼容性高等优点。草甘膦以植物叶绿体中5-烯醇丙酮酰莽草酸-3-磷酸合成酶(5-enolpyruvate shikimate-3phosphate synthase,EPSPS)为靶标。EPSPS是莽草酸代谢途径的第6个酶,负责催化磷酸烯醇式丙酮酸(PEP)和磷酸莽草酸(S3P)生成5一烯醇式丙酮酰莽草酸-3-磷酸(EPSP),这个步骤是进一步合成芳香族氨基酸、激素和次生代谢物的关键。草甘膦以竞争PEP和非竞争S3P的方式与植物体内EPSPS结合,形成结构稳定的EPSPS-S3P-草甘膦复合物,从而导致EPSPS活性丧失,进而使莽草酸在组织中大量积累。同时,蛋白质生物合成所需的芳香族氨基酸的合成严重受阻,最终导致植物死亡。此外,植物叶绿体的亚微结构、核糖体、RNA和色素的形成都受到草甘膦的影响。
醛酮还原酶(aldo-keto reductase,AKR)是一类结构和功能相似的依赖还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的氧化还原酶蛋白超家族,广泛分布于原核生物、酵母、植物、动物和人类等所有生物中。研究发现,AKR可以催化多种羰基化合物,包括葡萄糖、小型羰基代谢物、谷胱甘肽结合物、脂质过氧化物等的氧化还原反应。AKR以NADPH作为辅酶,将醛和酮类物质还原成初级和次级的醇。除了这些主要功能外,研究发现AKR在植物体内过量表达后能缓解草甘膦的毒性,暗示植物体内的AKR可能具有降解草甘膦的作用。Pan等在澳大利亚的野生稗草Echinochloa Crus-galliP.Beauv.中过表达AKR基因使稗草获得了草甘膦抗性。目前草甘膦在水稻中的作用机理尚不清楚,这使得草甘膦在水稻田的推广使用受到了严重限制。本研究首先通过生物信息学软件对水稻体内OsALR2蛋白的理化性質、亚细胞定位、跨膜特性,二硫键含量等生物学特性进行了系统分析。再通过结构预测软件模拟了水稻OsALR2蛋白的三维结构,并通过Auto Dock Vina展示草甘膦与OsALR2分子对接的结果。最后,在原核系统中表达和纯化OsALR2。本研究为OsALR2与草甘膦的共结晶奠定了基础,同时为抗草甘膦水稻的商业化提供理论依据。
1材料与方法
1.1试验材料
大肠杆菌trans-T1感受态购自上海唯地生物技术有限公司。大肠杆菌C43(DE3)感受态购自安徽吐露港生物科技有限公司。pET-32a质粒为本实验室保藏。氯化钠、酵母提取物、蛋白胨、咪唑、丙三醇、Tris、SDS和IPTG等试剂购自生工生物工程(上海)股份有限公司;抗生素Ampicillin (Amp)购自Sigma; His(融合HRP)抗体购自北京聚合美生物科技有限公司。限制性内切酶Not、Xho和KOD高保真酶购自NEB。LxnaseⅡ重组酶购自诺唯赞生物科技有限公司。DNA marker、Protein marker购自大连宝生物,胶回收试剂盒购自天根生化科技(北京)有限公司,质粒抽提试剂盒购自北京全式金公司。引物合成和常规测序分析由华大基因完成。质谱分析服务由北京生物物理所质谱平台提供。
1.2试验方法
1.2.1OsALR2蛋白生物信息学分析
利用TMHMM 2.0(https:∥servlces. health-tech. dtu. dk/service.php? TMHMM-2.0)分析OsALR2蛋白的跨膜次数;利用DiANNA1.1webserver (http:∥clavius. bc. edu/Nclotelab/DiAN-NA/)分析OsALR2蛋白的二硫键数目;利用A1-phaFold(https:∥www. alphafold. ebi. ac. uk/search/text/OsOlg0847600)和UniProt(https:∥www. uniprot. org/)预测其三级结构。
1.2.20sALR2蛋白与小分子草甘膦的分子对接及对接结果分析
检索PubChem数据库(https:∥pubchem. nc-bi. nlm.nih. gov/)获得草甘膦的分子结构式。在Auto Dock中对小分子进行加氢和加电荷处理,再定义tortion确定小分子哪些键可旋转。通过Al-phaFold和UniProt数据库下载OsALR2蛋白三级结构的pdb格式文件,用PyMOL删去其多余水分子,然后用在线网站Prepare PDB file for dockingprograms (https:∥swift. cmbi. umcn. nl/servers/html/prepdock. html)对蛋白进行修复。将OS-ALR2蛋白和草甘膦在Auto Dock中打开,通过查询文献确定蛋白受体的结合位点坐标,输入坐标生成对接盒子,进行对接。选取对接结果中结合能较低且构象较好的,对蛋白和小分子相互作用位点的氨基酸和作用力进行可视化展示。将ADT生成的分子对接结果分别上传到PDBsum Generate(http:∥WWW.ebi. ac. uk/thornton-srv/databases/pdbsum/Generate.html)和https:∥saves.mbi.ucla.edu/在线网站中,评价对接获得的三维结构的可靠性。
1.2.3原核表达载体的构建
提取水稻‘中花11'总RNA,反转录成cDNA,再以cDNA为模板,以5,-ATGGCGAGTGC_CAAGGCGAT-3为正向引物,5,-TTAGAC-CTCGTTATCCCAGACC-3为反向引物,扩增出水稻编码AKR的基因Os-ALR9,并将其克隆至T载体。利用同源重组的方法构建原核表达载体:以含有水稻OsA/R2的T载体为模板,用KOD高保真酶扩增水稻OsALR2。回收PCR产物并测定浓度,分别用内切酶Not工和Xho工对OsALR7基因和pET32a质粒在37℃下双酶切3h,利用ExnaseⅡ重组酶将酶切后的OsALR9和pET-32a产物按照2:1的摩尔比在37℃连接30min。取5uL连接产物转化大肠杆菌感受态细胞trans-T1进行菌落PCR鉴定,挑取阳性克隆送华大基因进行序列测定,选取序列完全正确的克隆,提取质粒,即为原核表达载体pET32a-His-OsALR2,-20℃保存。
1.2.40sALR2蛋白的诱导表达
将pET32a-His-OsALR2质粒转化大肠杆菌表达菌株C43 (DE3)。先进行小量诱导:挑取4个单克隆分别接种于3mL LB培养液中,37℃、200r/min培养至菌液OD600为0.6~0.8,在4管菌液中分别加人终浓度为0、0. 25、0.5、1mmol/L的IPTG。在16℃、120r/min条件下诱导12h。取2ml。菌液25℃、2500r/min离心10min,弃上清,加入40uL的2×SDSloading buffer,煮沸5~10min,13000 r/rmn离心5min,取20ul-上清进行SDS-PAGE凝胶电泳。通过考马斯亮蓝(CBB)染色和Western blot检测蛋白是否表达,并确定最适IPTG浓度。大量诱导表达:将小量诱导已确认表达的新鲜菌液按1:500的体积比加入到2L的LB液体培养基中,加入抗生素Amp至终浓度50ug/mL37℃、200r/min培养至菌液OD600为1.0~1.2,加入终浓度为0.25mmol/L的IPTG,16℃、120r/min诱导12h,25℃、2500r/min离心10min,收集菌体。
1.2.5OsALR2蛋白的纯化
His标签的OsALR2蛋白纯化:将4L诱导表达的菌体(10g左右)重悬于100mL裂解液(25mmol/L pH 8.0Tris, 300mmol/L NaCI, 5%甘油)中高压(1500psi)破碎2次。细胞破碎液18000r/min离心30min,取上清液在Ni-NTA重力层析柱中进行亲和层析。使用5个柱体积的洗涤缓冲液(25mmol/L pH 8.0Tris,300mmol/LNaCI,40mmol/l。咪唑)洗涤Ni-NTA中的杂蛋白,用洗脱缓冲液(2 mmol/l。pH 8.0Tris,300mmol/l。NaCI,300mmol/L咪唑)洗脱并收集目的蛋白。
采用UNICORN 6.3控制的AKTA avant色谱系统,通过阴离子交换柱(HiTrap,HP5 mL,Cyti-va)和分子筛进一步纯化OsALR2蛋白。AKTAavant纯化步骤均在16℃下进行。用2个柱体积的经0. 22um滤膜过滤的超纯水清洗阴离子交换柱,再用5个柱体积的平衡缓冲液(20mmol/LpH 8.0Tris-HC1,0.1 mol/L NaC1)平衡阴离子交换柱。用注射器将蛋白质混合物加载到预平衡的阴离子交换柱上。用5个柱体积的洗涤缓冲液(20mmol/L pH8.0Tris-HC1,0.1mol/l NaCI)洗涤阴离子交换柱。在AKTA上设置洗脱程序:洗脱时将低盐缓冲液(20mmol/LpH 8.0Tris-HC1,0.1mol/IJ NaCI)和高盐缓冲液(20mmol/L pH 8.0Tris-HC1,1mol/LNaCI)由AKTA混合配置洗脱缓冲液,洗脱时NaCI的浓度线性上升,高盐缓冲液占比从10%线性上升到70%。再用5个柱体积的过滤超纯水和5个柱体积的20%乙醇分别清洗阴离子交换柱。收集紫外信号UV280出峰位置所对应的蛋白,即为目标蛋白。
分子筛纯化使用凝胶层析柱superdex 10/300lncrease (24.7mL) (Cytiva)。先用2个柱体积的过滤超纯水清洗凝胶层析柱,再用2个柱体积的平衡缓冲液(20mmol/L pH 8.0Tris-HC1,0.1mol/LNaC1)平衡凝胶层析柱。平衡后,通过注射器将600uL经阴离子交换柱洗脱的OsALR2蛋白注入到500uL的上样环中。再用平衡缓冲液洗脱目的蛋白,收集紫外信号UV280出峰位置所对应的蛋白。
1.2.6包涵体蛋白的变复性
按照1.2.4的方法表达蛋白质。收集菌体,高压破碎(1500psi)裂解菌液2次后将细胞破碎液18000r/min离心30min,收集沉淀,得到粗制包涵体。使用含有低浓度变性剂的洗涤液[2mol/L尿素,50mmol/IJ,pH8.0Tris, 50 mmol/IJ NaCI,1mmol/L EDTA,0.5% (V/V) Triton X-IOO]重悬包涵体,12000r/min离心10min,重复此清洗步骤3次,去除杂蛋白获得精制包涵体。使用含有高浓度变性剂的变性液(6 mol/L尿素,20 mmol/L pH8.0Tris, 500 mmol/lJ, NaC1,5mmol/l。咪唑,1mmol/L)对精制包涵体进行溶解变性:用变性液将包涵体重悬混匀,室温振荡溶解2h。将溶解变性后的包涵体蛋白溶液加载到预先用变性液平衡的Ni-NTA重力层析柱中,再用复性液(20 mmol/LpH 8.0 Tris, 500 mmol/L,NaCI,5 mmol/l.咪唑,1mmol/L)洗涤层析柱,使包涵体蛋白逐渐复性。最后用洗脱液(20mmol/L pH 8.0Tris,500mmol/L NaCI, 500mmol/L咪唑,1mmol/L)洗脱复性后的蛋白,并用Nanodrop测定蛋白浓度。
1.2.7蛋白活性测定
OsALR2蛋白以NADPH为辅酶,将醛和酮类物质还原成初级和次级醇。通过分光光度计检测产物吸光度的变化即可分析OsALR2蛋白是否具有酶活性。如果OsALR2蛋白具有酶活性,随着时间延长吸光度会不断升高,直至反应完全,吸光度不再变化。如果将OsALR2蛋白加入反应体系后,吸光度无变化,说明OsALR2蛋白无酶活性。OsALR2蛋白酶活性测定反应体系:1mL的反应液[50mmol/L,pH 7.4的K3PO40.1 mmol/L,NADPH,10mmol/L,苯甲醛(浓度分别设置为2.5、5.0、7.5、10、15、20mmol/L)]和100ug的OsALR2蛋白。測定OsALR2以草甘膦为底物的作用活性时,作为初始值,加入OsALR2后每隔30 s测定并记录OD340,共测定3min。所有测量重复3次,阴性对照中用缓冲液75 mmol/L Tris-HCl(pH 8.6)取代OsALR2蛋白。
2结果与分析
2.10sALR2蛋白的理化性质分析
水稻OsALR2蛋白由311个氨基酸组成。OsALR2分子量为35kD,理论等电点为5.89。TMHMM预测结果显示,OsALR2蛋白不具有跨膜螺旋区,不是膜蛋白。DiANNA 1.1 web server分析表明,OsALR2蛋白含有3组二硫键,说明该蛋白较易形成包涵体。
2.20sALR2蛋白与草甘膦的分子对接
通过AlphaFold预测得到的水稻OsALR2蛋白的三维结构见图1a。在NCBI数据库中检索,获得与水稻OsALR2蛋白氨基酸序列一致性最高的蛋白AKR4C9,其PDB ID为6kb1。通过查询文献,确定6kbl的小分子配体结合位点的坐标为:AKR4C9(center_x=18.8,center y=13.6,center-Z=34.2),参照该坐标设置OsALR2的对接盒子的位置。对接结果显示草甘膦配体与AKR蛋白受体对接结果中结合能最低的为-13.4 kcal/mol。草甘膦与OsALR2主要通过氢键作用连接:草甘膦磷酸基团的2个羟基分别与Lys253的氨基相互作用,草甘膦磷酸基团的羰基和草甘膦中间的氨基分别与Ser208的氨基和羟基相互作用,草甘膦另一侧的羰基分别与Ser204的氨基和羟基相互作用(图lc)。蛋白与小分子2D相互作用结果进一步证实了小分子与蛋白发生相互作用的氨基酸位点(图1b)。OsALR2与草甘膦对接结果的可靠性用Ramachandran图评价,结果显示93.3%的氨基酸落在允许区域,大于90%,衡量对接复合体中各二面角和主链共价键作用力等参数的合理性的GFactors各指数均大于-0.5(图1d),表明对接结果是合理的。ERRAT评价对接结果表明,ERRAT中overall quality factor值为97.03%,大于95%,即对接获得的结构是高分辨率的(图le)。用Veri-fy 3D分析对接结果,其中94.53%的残基对应的3D/ID的平均得分大于等于0.2,残基比例大于等于80%(图1f)。综上表明分子对接获得的三维结构是合理的。
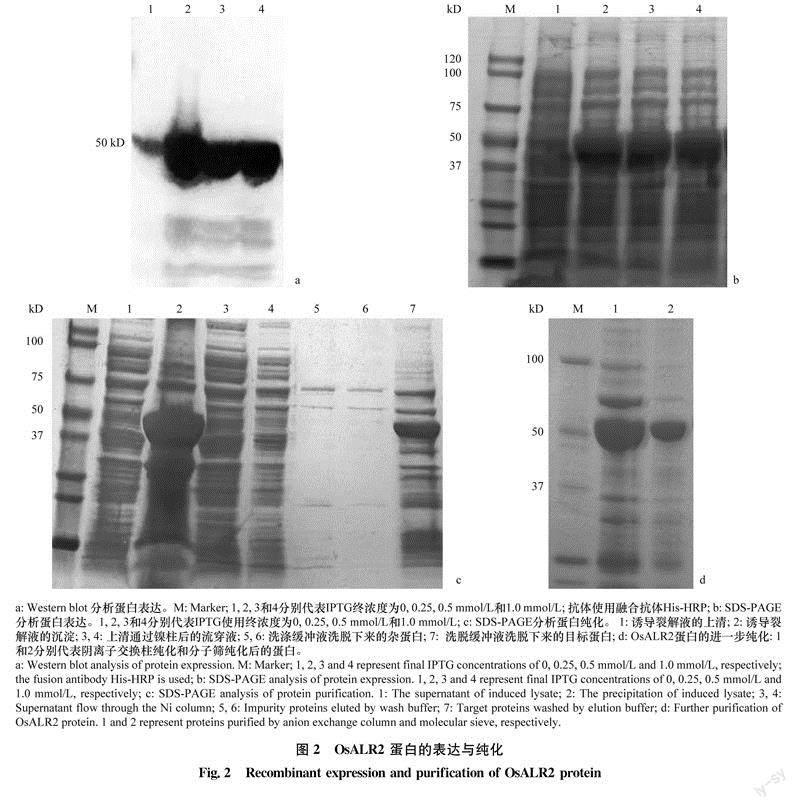
2.30sALR2蛋白表达与纯化
将pET32a-His-OsALR2质粒转化至表达菌株C43 (DE3)中进行表达。对小量诱导表达的蛋白样品分别进行Western blot和SDS-PAGE分析检测。结果显示:不加IPTG时蛋白表达量极低;在IPTG终浓度分别为0.25、0.5mmol/L和1.0mmol/L时,OsALR2都有表达。后续大量诱导表达试验使用IPTG的终浓度为0.25mmol/l(图2a,b)。使用Ni-NTA亲和层析柱初步纯化His-osALR2蛋白,纯化过程的各步骤分别取样进行SDS-PAGE电泳,结果显示,细菌裂解液离心后的上清中His-Os-ALR2蛋白较少,且含有较多杂质;而离心后的沉淀中含有较多的OsALR2蛋白(图2c),说明osALR2蛋白主要以包涵体的形式表达。为了降低上清中可溶性OsALR2蛋白的杂质含量,先后使用阴离子交换柱和凝胶过滤层析柱纯化OsALR2蛋白。SDS-PAGE结果显示OsALR2蛋白经过阴离子交换柱和分子筛纯化后杂质含量有所降低(图2d),但是其纯度仍然不足90%,不能满足后续结晶试验的要求。
2.4包涵体蛋白的变性,复性及纯化
由于破菌离心后的上清中OsALR2蛋白杂质含量高,纯度不符合后续试验要求,而沉淀中含有大量的OsALR2蛋白,我们尝试将沉淀中的包涵体进行变复性,以获得大量的有活性的OsALR2蛋白。通过SDS-PAGE分析变复性后获得的蛋白,结果显示包涵体变复性后的蛋白与上清中所表达的OS-ALR2分子量大小一致,均为50kD,且蛋白含量较高,杂质较少(图3a)。根据OsALR2蛋白氨基酸序列预测得到的理论分子量为35kD,表达得到的蛋白分子量与理论值差距较大,这是因为在OsALR2蛋白表达载体pET32a的多克隆位点(即Os-ALR2基因的插入位点)的上游有一个TrxA tag。TrxA tag与下游目标蛋白融合表达,且其分子量为20.4kD左右,所以OsALR2蛋白在SDS-PAGE上的表观分子量为TrxA与OsALR2融合蛋白的分子量总和。为了检验包涵体复性后所得到蛋白的结构均一性,我们使用分子筛对复性后的蛋白进行纯化。分子筛结果显示在洗脱体积62mL处出现单一的尖锐的峰,说明包涵体变复性后的蛋白的寡聚状态较均一(图3b)。切割SDS-PAGE胶中变复性后的OS-ALR2蛋白对应的条带,送质谱平台运用MALDI-TOF/TOF UltraflextremeTM进行分析,根据酶解后所产生的肽段的一级质谱数据,搜索水稻数据库Swissprot并进行比对,结果证明检测样品对应的条带确实为水稻OsALR2蛋白(图3c)。
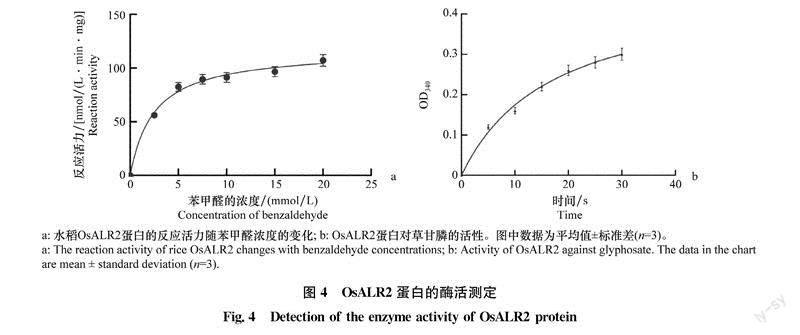
2.5酶活测定
为了测定包涵体变复性后得到的OsALR2蛋白是否具有降解草甘膦的活性。我们首先分析水稻OsALR2蛋白与醛类底物的结合活性,分别在2.5、5.0、7.5、10、15mmol/L和20 mmol/l。等6个不同苯甲醛浓度下测定340 nm处吸光度在3min内的变化,将结果拟合成相应曲线。结果(图4a)表明,OsALR2蛋白具有醛酮还原酶的活性,能在NADPH作为辅酶的条件下将苯甲醛还原成苯甲醇。为了测定OsALR2蛋白降解草甘膦的活性,在含OS-ALR2蛋白的反应体系中加入0.5mmol/L的草甘膦并测定30min内OD340变化值。结果显示,随时间延长OD340值增加,这说明OsALR2蛋白可以在NADPH作为辅酶的条件下与草甘膦发生反应,使OD340升高,即以草甘膦为底物时OsALR2具有酶活性(图4b)。
3结论与讨论
草甘膦是农业生产上应用广泛的高效广谱除草剂,但是草甘膦与水稻OsALR2蛋白的相互作用机理尚不清楚。本文通过生物信息学分析研究了水稻与草甘膦的作用方式。结果显示,OsALR2理论等电点为5.89,为后期纯化蛋白时选择阴离子交换柱还是阳离子交换柱提供了理论依据;消光系数为1.859,结合蛋白在280nm处的吸光度(OD280)利用公式OD280/消光系数计算蛋白的实际浓度;不稳定因子为42.75,说明蛋白较不稳定,在菌体破碎过程中可加入适量的甘油和合适的还原剂以减少蛋白的降解。OsALR2蛋白含有3组二硫键,推测其很大程度上会形成包涵体。
纯化水稻OsALR2蛋白遇到的难题是OsALR2以包涵体形式表达。重组蛋白在大肠杆菌中异源表达时经常生成不可溶的和没有活性的蛋白聚集体,通常称作包涵体。当蛋白表达量超过细胞蛋白质总数的2%时,易导致包涵体的形成。另外,目的基因的高拷贝、强启动子和高浓度诱导剂都有利于包涵体的形成。目的基因拷贝数过高会使细胞损耗过高,当细胞有一个强大的启动子系统时,重组蛋白的产生会使细胞代谢负荷水平提高,从而聚集成包涵体。包涵体的形成也依赖于蛋白质的氨基酸序列,疏水性氨基酸较多也会形成包涵体。此外,胞质伴侣ClpB的缺失也会导致蛋白的不溶性表达。常通过以下方法从包涵体中获得有活性的蛋白:1)裂解细胞;2)去除细胞壁和膜组分;3)使用强变性剂溶解蛋白聚集体;4)伴随着还原型的半胱氨酸残基氧化成正确的二硫键,变性的蛋白正确折叠成天然构象。包涵体变性再复性后是否具有活性还受以下因素的影响:首先是变性剂的选择,常用的变性剂有尿素和盐酸胍,尿素有使用范围广,溶解力较温和,成本低,可用于多种色谱法纯化等优点;盐酸胍作为强变性剂,溶解时间短,但是不利于蛋白的共价修饰,且成本高,在酸性条件下易沉淀,对蛋白的离子交换色谱有干扰。所以本文选用尿素作为OsALR2包涵体的变性剂。此外,大肠杆菌的外膜蛋白OmpT具有蛋白水解酶的活性,在包涵体变复性中可能引起重组蛋白的降解,所以必须经过低浓度尿素重复洗涤以清除包涵体蛋白的膜组分。试验证明OsALR2包涵体蛋白复性后具有醛酮还原酶活性和降解草甘膦的活性,且分子筛凝胶过滤层析结果显示蛋白的寡聚状态均一,这使得我们得到了较高纯度和浓度的OsALR2蛋白,有利于后续蛋白结晶。
综上,本研究首先通过生物信息学分析,分子对接表明了OsALR2的基本理化性質及OsALR2与小分子的作用位点,为试验设计提供方向;其次成功对OsALR2包涵体进行变复性,并证实了包涵体复性后的OsALR2具有降解草甘膦的酶活性,为后续蛋白与小分子的共结晶和阐明草甘膦的作用机理奠定了基础。但是验证包涵体变复性后的蛋白折叠的结构和寡聚状态的均一性时,仅用分子筛的峰图这一种方法判断是不够的,如果结合动态光散射,交联后跑蛋白胶以及分析超离等多种方法加以论证会更加可信。
