食源性鲜味肽的研究进展
2023-11-22吴日帮周其洋
吴日帮,周其洋
(1.佛山市海天调味食品股份有限公司,广东 佛山 528000;2.广东海天创新技术有限公司, 广东 佛山 528000;3.佛山市海天(高明)调味食品有限公司,广东 佛山 528000)
鲜味是赋予人们愉悦感的味觉,也是人们对美味的重要评判维度之一。科学界已经证明谷氨酸、天冬氨酸、5′-呈味核苷酸(IMP和GMP)是已知的最主要的鲜味物质[1],但人们发现鲜味氨基酸和呈味核苷酸并不能完整还原食物的鲜感,谷氨酸钠鲜味单一、留口短,IMP和GMP与谷氨酸钠可协同增鲜,但口感干涩,与食品中协调、饱满、丰富、持久的鲜感有较大差距。随着对食物呈味物质研究的进一步深入,研究人员发现肽类物质对于鲜味同样具有重要贡献,并且提供了较鲜味氨基酸和5′-呈味核苷酸更加丰富、柔和、协调的鲜感。呈味肽是一类由氨基酸通过肽键连接形成的生物小分子,广泛存在于食物及蛋白质的酶解加工产物中。
自1978年Yoshio等[2]从木瓜蛋白酶酶解牛肉中分离出美味肽Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala并证明其具有风味增强效果起,国内外学者不断对呈味肽进行大量的挖掘与研究,呈味肽也因为其独特的风味增强效果、良好的加工特性、天然安全的物质属性成为食品工业界技术开发的新热点。鲜味肽在呈味肽领域中研究最广泛,目前国内外关于鲜味肽的研究主要集中在制备工艺的开发上,对鲜味肽构效关系、呈味机理等的研究相对缺乏。本文将对现有报道的食源性鲜味肽的种类、呈味效果与制备技术进行综述,进而对鲜味肽构效关系、呈味机制研究进展及研究方法展开讨论,为鲜味肽的研究、开发和利用提供参考。
1 食源性鲜味肽的种类与来源
国内外研究学者从天然食材中发现了诸多鲜味肽的存在,其中以鲜味突出的食用真菌类、水产类最为常见(见表1)。蒋希希等[3]从草菇的水提物中分离出4个鲜味肽,分别为Asp-Asp-Cys-Pro-Asp-Lys、Leu-Val-Asp-Lys-Pro-Arg、Gln-Ala-Asp-Lys-Arg-Lys、Asp-Thr-Phe-Asn-Asp-Lys,其中Asp-Asp-Cys-Pro-Asp-Lys和Asp-Thr-Phe-Asn-Asp-Lys的鲜味阈值分别为0.10 mg/mL和0.17 mg/mL,与谷氨酸钠的鲜味阈值(0.12 mg/mL)接近。李晓明等[4]从白玉菇中分离鉴定出6个鲜味肽,分别为Glu-Leu-Glu-Leu-Gln、Glu-Leu-Gln-Ser-Gly-Asn-Thr-Tyr、Asn-Tyr-Asn-Gly-Gly-Tyr、Glu-Ala-Lys-Val-Tyr、Val-Ala-Asn-Gly-Gly-Gly-Phe-Gly-Ala-Ala和Ser-Leu-Leu-Gln-Pro-Leu。Song等[5]从美味牛肝菌中发现了3个鲜味肽(Asp-Gly-Phe、Lys-Cys-Gly-Gln和His-His-Tyr-Glu),其中His-His-Tyr-Glu不仅具有呈鲜效果,还具备与谷氨酸钠协同增鲜的作用,在含有谷氨酸钠的体系中,其鲜味阈值约为水溶液体系中的一半。具有良好鲜味的水产往往含有效果显著的鲜味肽,如宁梦华等[6]通过超滤和凝胶过滤层析方式从暗纹东方鲀中分离出7个鲜味肽,其中Asn-Trp-Asp-Asp-Met-Glu-Lys的鲜味阈值最低,为0.38 mmol/L(约0.36 mg/mL)。Zhang等[7]从蛤蜊中发现了鲜味阈值更低的3个鲜味肽,分别为Asp-Asp-Leu-Asp-Arg(0.198 mmol/L,约0.13 mg/mL)、Ala-Lys-Ala-Leu-Lys-Glu-Glu-Asp-Leu(0.123 mmol/L,约0.13 mg/mL)和Asp-Leu-Arg-Ala-Asp(0.212 mmol/L,约0.12 mg/mL),鲜味阈值与谷氨酸钠接近。
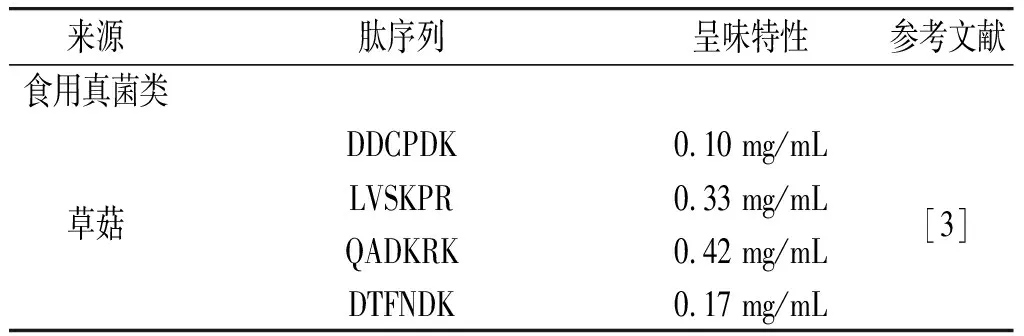
表1 天然食材来源的鲜味肽Table 1 Umami peptides from natural food sources
科学界对于传统发酵食品中鲜味肽的研究也比较广泛(见表2),如印度尼西亚学者Muhamad等[11]从当地的一种利用少孢根霉发酵的大豆食品中分离出Gly-Glu-Asn-Glu-Glu-Glu-Asp-Ser-Gly-Ala-Ile-Val-Thr-Val-Lys。Yang等[12]从臭鳜鱼中鉴定出6个鲜味肽,包括Asp-Gly-Glu-Lys-Val-Asp-Phe-Asp-Asp-Ile-Gln-Lys、Lys-Glu-Val-Lys-Glu-Glu-Pro-Ala-Glu-Ala-Val-Gly-Asp、Asp-Asp-Met-Glu-Lys-Ile-Trp-His-His-Thr、Glu-Glu-Val-Gly-Val-Glu-Glu-Glu-Lys-Pro-Lys-Phe、Asp-Arg-Glu-Val-Asp-Asp-Thr-Gly-His-Val-Pro和Glu-Glu-Ala-Gln-Glu-Arg-Ala-Asp-Ile-Ala-Glu。日本学者Masashi等[13]从长时间熟成的味噌中分离出1~5 kDa的多肽组分,其具有显著的增鲜效果,且具有鲜味饱满持久的特点。酱油作为我国最主要的传统发酵调味品之一,具有浓厚咸鲜的特点,成为国内发酵食品来源鲜味肽的研究热点。与天然食材中分离的鲜味肽不同,酱油中的鲜味肽氨基酸残基数目明显更少,主要以2~4肽为主,而食用真菌、水产以及其他类型发酵食品中分离的鲜味肽则以5~11肽甚至分子量更大的肽为主。如Zhu等[14]分析对比了全黄豆与脱脂大豆发酵酱油中的肽组成时,发现了多个鲜味肽,包括5个二肽(Glu-Glu、Glu-Leu、Leu-Glu、Val-Glu、Asp-Arg)、4个三肽(Thr-Gly-Cys、Gly-Leu-Glu、Asp-Ala-Glu、Glu-Val-Cys)和2个四肽(Val-Glu-Ala-Leu、Gly-Gly-Gly-Glu),这些鲜味肽中除Thr-Gly-Cys和Glu-Val-Cys的水溶液不呈味或呈涩味以外,其他肽分子水溶液均呈鲜味,在酱油体系中均呈现出增鲜效果。陈嘉辉[15]在研究酱油中的呈味肽时,发现11个具有显著鲜味提升作用的肽分子,分别为Gly-Gly-Gly-Glu、Lys-Pro、Glu-Phe、Asp-Pro、Glu-Glu、Asp-Arg、Asp-Ala-Glu、Glu-Val、Asp-Leu、Val-Glu和Gly-Ile-Glu,其中大部分为2~3肽。造成这种差异的原因是酱油使用米曲霉菌种对原料进行固态发酵,米曲霉是一类分泌高活力胞外水解酶且酶系丰富的食品发酵微生物,酱油生产时经过米曲霉制曲工序,使得米曲霉的蛋白酶充分合成分泌,结合长时间发酵,蛋白酶作用充分,蛋白质的水解程度高,因此其呈味肽分子量也相对更小。
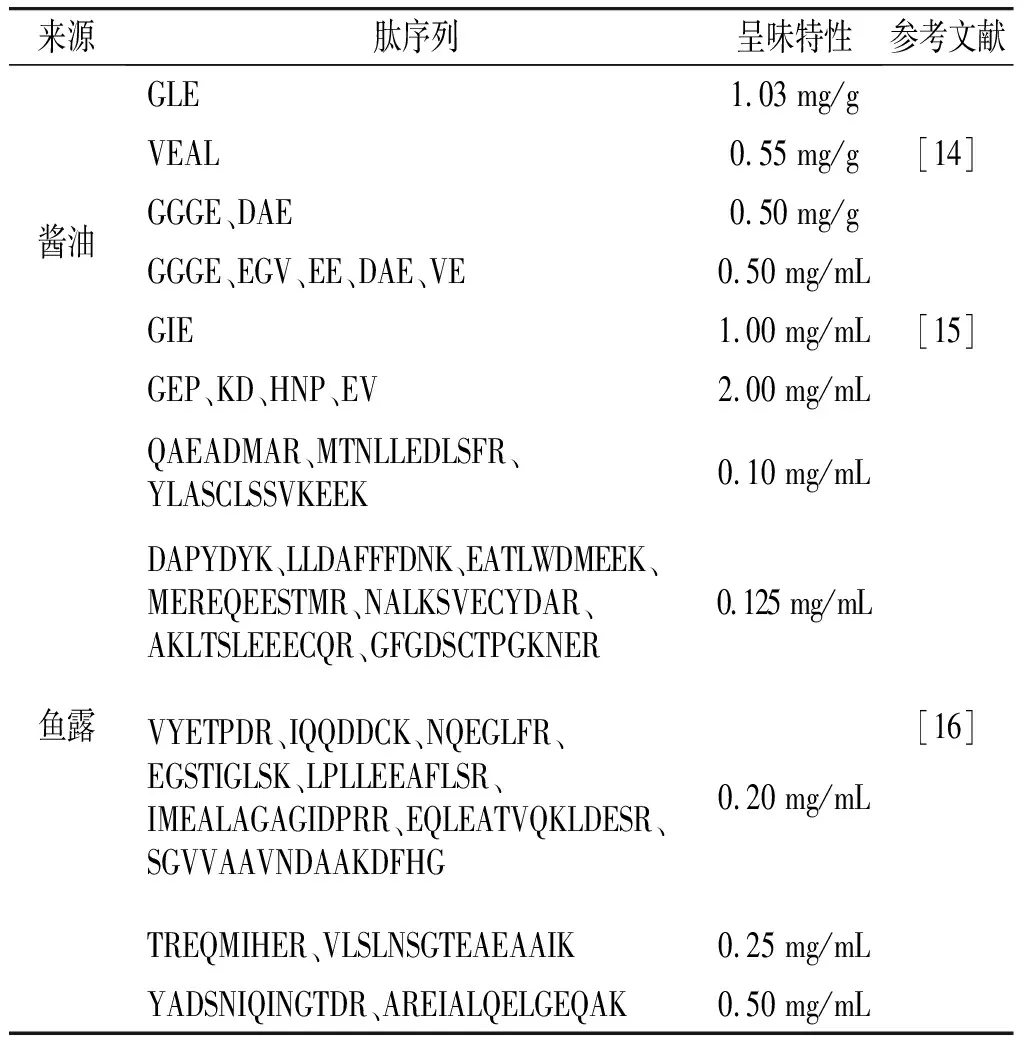
表2 发酵食品来源的鲜味肽Table 2 Umami peptides from fermented food sources
2 食源性鲜味肽的制备技术
尽管许多食物和发酵食品中含有效果显著的鲜味肽,但从食物和发酵食品中分离纯化出足够的鲜味肽应用于食品调味成本依旧很高,无法实现产业化,因此开发规模化鲜味肽制备技术成为食品工业界的研究重点。多肽制备主要包括固相合成法、化学水解法、基因重组表达法和酶解法[17]。
固相合成法[18]是利用载体树脂固定氨基酸C端后,通过添加Fmoc-氨基酸进行缩合反应,实现氨基酸的逐步延伸,是医药和科研领域常用的多肽定制化合成技术,目前产业界已实现了自动化合成,可轻易实现对多肽的多种修饰,但由于其生产效率较低,且需要对产物进行纯化,无法满足食品行业的庞大需求,应用成本过高。
化学水解法[19]包括酸水解和碱水解,其中酸水解应用更广泛,是酸水解植物蛋白调味液的主要生产方式,但酸水解法对氨基酸破坏明显,如色氨酸、丝氨酸、苏氨酸、酪氨酸等,天冬酰胺和谷氨酰胺会发生脱酰胺,此外,酸水解法为非定向水解,因此无法有效获得目标呈味肽。
基因重组表达法[20]是根据生物遗传学中心法则将多肽氨基酸序列转换为对应的基因碱基序列,通过合成相应的DNA片段并整合到质粒表达载体中,利用细菌、酵母等细胞工厂进行多肽的外源表达,该方法的优点在于多肽表达生产可控性高,通过添加标签序列可实现高效分离纯化,然后通过特异性蛋白酶且切除标签序列获得成熟的目标多肽[21]。该技术在多肽药物生产领域已广泛使用,目前有研究团队尝试对氨基酸数目较大的鲜味肽进行外源表达,如伍圆明[22]将美味肽对应的DNA片段进行多拷贝串联,并使用细胞密度依赖型高效表达启动子PsrfA作为产物表达启动子,以枯草芽孢杆菌Bacillussubtilis168作为宿主进行高密度发酵和融合多肽的异源表达,获得了含有8个美味肽序列且C端带有His标签的融合多肽产物,通过His标签可实现多肽的高效提纯。但目前基因重组表达法仅适用于氨基酸数目较多的肽分子表达,对于鲜味寡肽并不适用。
酶解法是利用蛋白酶对蛋白质肽键进行水解获得多肽的方法,由于蛋白酶具有特异性识别、切割氨基酸位点的特性,因此具备可控制备特定结构特征多肽的可能性,且蛋白酶反应条件温和,来源天然安全,易于终止反应,易于实现规模化应用,是应用潜力最大的鲜味肽制备途径。目前酶解法已在蛋白质加工领域被广泛应用,如生产作为蛋白营养补充剂的大豆肽[22]、乳清蛋白肽[23],以及在护肤领域应用的胶原蛋白肽[24]。在食品调味领域,酶解法也逐步推动了鲜味肽领域的发展。学术界通过酶解法对不同食源性蛋白质,如豆粕[25]、花生粕[26]、小麦蛋白[27]等进行深加工,从酶解产物中发现了许多新型的或已知的鲜味肽,酶解产物呈鲜效果显著,如范海茹等[28]发现利用中性蛋白酶、木瓜蛋白酶和风味蛋白酶对豆粕进行分步连续复合酶解后,可以获得与谷氨酸、呈味核苷酸二钠相似的鲜味肽组分。刘冰等[29]使用胰蛋白酶和风味蛋白酶对条浒苔进行复合酶解,当酶活比例为2∶1时获得的分子量<3 kDa的多肽组分具有显著的鲜味。杨文君等[30-31]从豌豆蛋白深度酶解产物以及豌豆固态发酵酶解产物中发现咸味肽同时具有显著的鲜味增强效果,这可能与其氨基酸中富含鲜味氨基酸残基有关。李自会等发现大量禽类肉及其副产物经过蛋白酶解后所得肽类物质具有增强食物鲜香的作用[32]。酵母是天然的微生物蛋白来源,广泛用于调味品、营养补充剂制备,Alim等从商品化的酵母抽提物中分离鉴定出一系列鲜味肽,包括Ala-Asp-Ala、Pro-Gly-Asp、Glu-Met-His、Gln-Pro-Ser、Val-Glu-His、Glu-Asp、Pro-Ser-Gly、Ala-Glu-Ala、Gly-Gly-Pro-Gly、Asp-Asp、Glu-Asp和Asp-Asp-Asp[33],证明鲜味肽的酶法生产已具备产业化应用条件。
定向酶解技术是高效获得目标鲜味肽的重要技术,其中蛋白酶的选择具有决定性的作用。目前市售的蛋白酶制剂主要为碱性蛋白酶、中性蛋白酶、酸性蛋白酶、木瓜蛋白酶、风味蛋白酶、胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶等,研究人员可根据MEROPS蛋白酶数据库(https://www.ebi.ac.uk/merops/)查询各种蛋白酶的酶切位点偏好性,结合鲜味肽的氨基酸组成与序列特征,筛选合适的蛋白酶制剂进行鲜味肽的酶法制备。常见的蛋白酶酶切特性见表3。普遍认为,水解活性高的蛋白酶更有利于获得小分子肽,但其酶切位点也会相应更加广泛,专一性获得具有某种序列特征的肽分子也越难,酶切位点特异性较强的蛋白酶其水解率较低,原料蛋白利用率较低。此外,不同蛋白酶作用后的产物在风味上也有较大区别,使用单一蛋白酶进行处理往往在效率和风味上都达不到预期效果,如经碱性蛋白酶酶解处理的肽分子苦味明显,需要搭配风味蛋白酶或氨肽酶进行脱苦处理[34],但如果在酶解植物蛋白时减少碱性蛋白酶的使用,其蛋白利用率和酶解效率就会显著下降。因此要根据蛋白底物种类进行蛋白酶的合理搭配和酶解设计,这需要技术开发者积累大量的蛋白酶应用经验,也需要研究人员在肽分子构效关系研究上取得突破。

表3 常见市售蛋白酶的酶切位点Table 3 Restriction sites of common commercially available proteases
3 鲜味肽的呈味机理研究进展
尽管食品领域已对鲜味肽开展大量研究,但仍以鲜味肽制备技术开发和鲜味肽的分离纯化鉴定为主,对于鲜味肽呈味机制的研究相对有限。有研究学者通过归纳分析目前已报道的鲜味肽氨基酸组成,认为鲜味肽呈味效果与鲜味氨基酸密切相关,大部分已被鉴定的鲜味肽中都含有鲜味氨基酸残基Glu或Asp[35],如酱油来源的一系列鲜味肽中,含有鲜味氨基酸残基的肽阈值更低,在0.50~1.09 g/kg范围内,而不含鲜味氨基酸残基的Thr-Gly-Cys呈味阈值则达到(2.35±0.11) g/kg,显著高于其他鲜味肽[14]。此外,鲜味氨基酸在肽中的位置可能对鲜味强度同样具有影响,当肽分子氨基酸组成一致,鲜味氨基酸位于肽分子C端时,其鲜味阈值普遍低于鲜味氨基酸位于N端的肽分子,如Leu-Glu、Val-Glu和Asp-Glu的鲜味阈值比Glu-Leu、Glu-Val和Glu-Asp更低。
钱方等已证明游离的鲜味氨基酸通过与鲜味受体T1R1/T1R3两个亚基上的正构位点结合激活鲜味受体的细胞转导信号[34],但鲜味肽中的鲜味氨基酸残基是否直接参与正构位点的结合目前仍缺乏证据,一些研究人员根据前人鉴定的鲜味肽序列进行合成,发现其鲜味作用并不明显。此外,许多研究报道鉴定出的鲜味肽并不含有鲜味氨基酸残基,而含有鲜味氨基酸残基的肽分子并不显示出鲜味。因此,学术界针对鲜味氨基酸对鲜味肽的作用仍存在较大分歧。
从蛋白质相互作用角度开展研究是从本质上阐明鲜味肽呈味机理的必要途径。目前科学界普遍采用分子模拟对接的方式研究鲜味肽的作用机理,并推测鲜味肽与游离的鲜味氨基酸和5'-呈味核苷酸的作用机理可能不同。Roberta等[36]研究认为,甜味受体中的T1R2和T1R3蛋白亚基的VFT活性区域具有一个较大的“楔形”空间,借助其表面的楔形构型和电荷互补与蛋白分子相互作用来触发后续的信号转导效应,而与甜味受体高度相似的鲜味受体同样具有T1R3蛋白亚基,其与鲜味肽的作用机制可能具有一定的相似性。
与该结论类似,一些研究学者通过分子模拟对接同样发现鲜味肽可能是结合在鲜味受体的配体结合口袋空腔处发挥作用的,如余霞琴对Arg-Pro-Leu-Gly-Asn-Cys、Thr-Leu-Arg-Arg-Cys-Met、Lys-Gly-Arg-Tyr-Glu-Arg、Glu-His-Ala-Met-Leu-Asn、Glu-Phe-Lys-Glu-Tyr-Asn、Leu-Ser-Glu-Arg-Tyr-Pro、Cys-Cys-Asn-Lys-Ser-Val共7个已鉴定的鲜味六肽与鲜味受体T1R1/T1R3进行分子模拟对接,发现鲜味受体上的氨基酸残基Cys62、Arg277、Arg281、Trp303、Ser306对于鲜味六肽结合可能具有重要影响,其中Cys62和Arg281位于鲜味受体蛋白配体结合口袋空腔两侧,发挥类似钳子的作用,强化了六肽与口袋结合的稳定性,从而提高了激活鲜味受体的概率[37]。Yang等[12]通过分子对接方式研究了臭鳜鱼中的鲜味肽与鲜味受体T1R1/T1R3的作用模式,发现鲜味肽主要与鲜味受体中的T1R3亚基相互作用,而T1R3亚基的结合口袋表面含有大量氢键位点、亲水性位点以及碱性位点,这些位点主要由Ser、Glu、His、Gln、Arg和Lys残基提供,当鲜味肽中含有“-Glu-Glu-”、“-Glu-Asp-”、“-Asp-Glu-”和“-Asp-Asp-”结构时,能够与结合口袋形成更稳定的氢键和盐桥,从而直接或间接提升其他鲜味物质的受体激活能力和作用时间。上述推论主要针对氨基酸数目较多的鲜味肽分子,对于氨基酸数目相对较少的鲜味肽,其作用机制可能会有所不同,如Zhao等[38]采取分子模拟对接的方式,研究了虹鳟鱼来源的鲜味肽与鲜味受体的作用方式,推测鲜味四肽Glu-Ala-Asn-Lys、Glu-Glu-Ala-Lys和Glu-Met-Gln-Lys能够进入到T1R1亚基蛋白的结合口袋中,通过氢键和盐桥与Arg151、Asp147、Gln52和Arg277位点相互作用,从而产生鲜味信号,但目前仍缺乏相应的实验验证。
4 展望
总体而言,国内外对鲜味肽的研究仍处于起步阶段,尽管学术界对鲜味肽的制备技术研发逐渐加快,但真正实现产业化、商品化应用的仍十分有限。对于鲜味肽呈味机制的研究也相对滞后,尽管分子模拟对接是目前研究鲜味肽与鲜味受体作用过程和原理的主要手段,对于人们认识鲜味肽作用机制具有重要的参考价值,但分子模拟无法代替验证性实验,鲜味肽的作用机理只是停留在假设阶段,并未形成严谨的科学理论。未来关于鲜味肽的机理研究可以借助分子模拟计算的手段筛选鲜味肽与鲜味受体的潜在作用位点,通过替换潜在关键氨基酸位点,结合固相合成手段验证肽分子的呈味效果差异,或者结合生理学、神经生物学和生物化学等学科的研究方法,如细胞膜片钳技术、表面等离子共振技术、等温滴定微量热技术、蛋白晶体衍射技术、冷冻电镜技术等,从鲜味产生的生物学角度揭示鲜味肽的作用机理,从而明确鲜味肽的关键结构特征与共性,为鲜味肽的结构理性设计与定向制备技术的优化提供科学理论指导。
