活性氧对牛乳β- 乳球蛋白结构、功能特性和致敏性的影响
2023-11-10杨子滢葛新宇闫欣杨永新于春娣杨庆利吕良涛
杨子滢,葛新宇,闫欣,杨永新,于春娣,杨庆利,吕良涛
(青岛农业大学 食品科学与工程学院,山东 青岛 266109)
食物过敏已成为全球范围内重要的食品安全问题。牛乳是可能导致人类食物过敏的食品之一,严重影响了部分人群特别是婴幼儿的身体健康,轻度症状表现为腹泻、荨麻疹等,重度或引发休克反应甚至死亡[1]。随着牛乳及其制品的消费量逐年增加,牛乳过敏的人群也在逐渐增加[2],联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)认定牛乳及其制品为“八大”致敏性食物之一[3]。牛乳β-乳球蛋白(β-lactoglobulin,β-LG)是牛乳中的主要蛋白质成分,在牛乳乳清中占蛋白总量的50%,分子量为16~18 kDa[4],具有多方面的营养作用。β-LG 是一种具有良好功能特性的优质蛋白质,常用其作为功能性配料在食品加工中广泛应用[5]。
天然存在于牛乳中的β-LG 被认为是牛乳的主要过敏原[6]。由于β-LG 高度结构化与耐水解特性,在人体肠道内消化后仍存在部分肽段分子,从而引起过敏症状[7]。近年来,有研究学者探究不同加工技术对牛乳β-LG 致敏性的影响。Jia 等[8]发现利用高压脉冲电场技术可导致β-LG 致敏性降低。Yang 等[9]研究表明利用低频超声可促进β-LG 的消化,使其致敏性降低。王明礼等[10]利用辐照技术对β-LG 进行处理,结果表明β-LG经过辐照加工后,其构象表位破坏,导致其致敏性降低。Fei 等[11]利用静态高压技术使β-LG 的致敏性降低。这些研究在食品产业链中为控制过敏原风险提供技术支持,但由于加工过程中化学反应众多,影响因素复杂,尚不足以阐明牛乳过敏原的变化规律。牛乳在加工过程中影响蛋白质的化学反应多样,其中氧化是非常普遍且重要的化学反应之一[12]。目前,有关活性氧氧化对牛乳β-LG 致敏性影响的研究鲜见。本研究旨在分析活性氧氧化对牛乳β-LG 结构、功能特性和致敏性的影响。通过聚十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、圆二色谱、表面疏水性、内源荧光等方法分析牛乳β-LG 氧化前后结构的变化;乳化性、起泡性等方法分析牛乳β-LG 的功能特性变化;采用酶联免疫试验(enzyme linked immunosorbent assay,ELISA),大鼠嗜碱性细胞白血病细胞(rat basophilic leukemia cells,RBL-2H3)试验等方法分析牛乳β-LG 的致敏性变化。通过上述研究,有助于更好地了解加工过程中氧化对牛乳功能特性和致敏性的影响。
1 材料与方法
1.1 材料与试剂
H2O2水溶液(3%):商丘圣邦生物科技有限公司;牛乳β-LG(纯度≥90%)、标准蛋白marker、三羟甲基氨基甲烷、磷酸盐缓冲液、磷酸盐吐温缓冲液、三羟甲基氨基甲烷盐酸盐、十二烷基硫酸钠(均为分析纯):北京Solarbio 公司;过氧化物酶标记的羊抗人免疫球蛋白E(Immunoglobulin E,IgE)抗体:北京中杉金桥生物科技公司;三硝基苯磺酸、四甲基联苯胺、8-苯胺-1-萘磺酸(8-Anilino-1-naphthalenesulfonic acid,ANS)、牛血清蛋白、考马斯亮蓝G250、EMEM 培养基(含厄尔平衡盐、L-谷氨酰胺、D-缬氨酸):美国Sigma 公司;牛乳过敏血清(特异性IgE 水平>0.5 kU/L):青岛大学附属医院;ELISA 试剂盒:美国Minneapolis 公司。
1.2 仪器与设备
荧光分光光度计(F2700):日本日立公司;分光光度计(Characin V100):英国应用物理摄影有限公司;DYY-12 电泳仪:北京六一仪器厂;Tanon 4100 凝胶成像仪:上海天能公司;CD 偏光光谱仪(J-815):日本分光株式会社;原子力显微镜(SPM-9700HT):日本岛津公司。
1.3 方法
1.3.1 样品处理
利用超纯水将牛乳β-LG 溶液调整为2 mg/mL,采用芬顿氧化体系[13](100 μL FeCl3分别与0、25、50、100 μL H2O2混合后加入5 mL 蒸馏水)对等体积2 mg/mL 牛乳β-LG 进行氧化处理,最终H2O2浓度分别为0、2.5、5、10 mmol/L 4 组浓度梯度,在37 ℃避光环境下反应12 h。
1.3.2 聚丙烯酰胺凝胶电泳分析
参考Sharman 等[14]的方法对氧化后的牛乳β-LG进行电泳试验。按照4 ∶1 的体积比将样品和上样缓冲液混合,混合后的样品沸水浴7 min 后3 000 r/min 离心50 s。将样品按顺序装入12%预制胶孔中,在120 V电压下进行SDS-PAGE 试验,待蓝线即将抛出时停止电泳。将凝胶取出后,在染色盒中加入考马斯亮蓝R-250 染色液没过凝胶,摇床上50 r/min 轻摇染色2 h,倒尽染色液后用超纯水漂洗,倒入脱色液,直至凝胶上条带清晰。最后用双蒸水漂洗后,采用Tanon 4100 凝胶成像仪拍照。
1.3.3 圆二色谱分析
利用CD 偏光光谱仪检测氧化前后牛乳β-LG 二级结构的变化[15]。以超纯水为空白,将氧化前后的牛乳β-LG 样品用超纯水稀释至0.6 mg/mL。测定参数设置为扫描波长190~260 nm,时间间隔0.25 s,扫描速率100 nm/min。数据以平均摩尔椭圆率表示,利用JASCO 软件分析试验结果。
1.3.4 内源荧光强度检测
根据Ju 等[16]的研究方法稍有改动,将氧化的牛乳β-LG 样品溶解于超纯水中,使得上清液中蛋白浓度调整到0.5 mg/mL。以超纯水为空白,每个样品取1 mL到荧光比色皿中,利用荧光分光光度计检测样品的内源荧光强度。设置参数为激发波长295 nm,发射波长300~400 nm,扫描速度1 200 nm/min,狭缝宽度2.5 nm。
1.3.5 表面疏水性测定
采用Rodriguez 等[17]的方法略作修改,用超纯水稀释氧化前后的牛乳β-LG 样品,使样品浓度为0.05~0.5 mg/mL。取不同浓度的样品1.5 mL,加入15 μL ANS 溶液,振荡后静置3 min,设置荧光分光光度计激发波长与发射波长分别为370 nm 与490 nm(狭缝校正均为5 nm),以荧光强度对蛋白质浓度作图并外推至蛋白浓度为0,曲线初始阶段斜率即为样品表面疏水性指数。
1.3.6 微观结构观察
根据Hu 等[18]的方法分析氧化前后β-LG 的微观结构变化。各组样品按体积比1 ∶1 000 稀释,将蛋白悬浮液(10 μL,1 μg/mL)沉积到新鲜裂解的云母上,并在加热灯下干燥。使用Bioscope(BS3-02)ScanAsyst 模式通过原子力显微镜(atomic force microscope,AFM)在多个点进行成像。扫描尺寸和扫描频率分别为10.0 μm×10.0 μm,0.997 Hz。分析每个样品3×512 nm 视场下的原子力显微镜(AFM)图像。
1.3.7 功能特性测定
1.3.7.1 乳化性与乳化稳定性测定
根据梁肖娜[19]的方法测定乳化性和乳化稳定性。用超纯水配制质量浓度1 mg/mL 的β-LG 溶液,向溶液中加入体积比为1 ∶4 的大豆油,15 000 r/min 匀浆1 min后立即倒入试管中。分别于静置0、10 min 时,在距离试管底0.5 cm 处用移液枪吸取50 μL 的乳液于5 mL 0.1%的SDS 溶液中,充分混匀后于500 nm 波长处测定吸光值。计算β-LG 的乳化活性指数(emulsification activity index,EAI) 和乳化稳定性指数(emulsification stability index,ESI)。
式中:E 为乳化活性指数,m2/g;S 为乳化稳定性指数,%;ρ 为β-LG 质量浓度,g/mL;φ 为油相所占体积分数;A500nm为波长500 nm 处的吸光值;A10为静置10 min时乳液的吸光值;A0为静置0 min 时乳液的吸光值。
1.3.7.2 起泡能力与起泡稳定性测定
同样采取1.3.7.1 中梁肖娜[19]的方法,取10 mL 的β-LG(1 mg/mL)溶液在10 000 r/min 条件下均质匀质2 min,迅速倒入50 mL 量筒,读取泡沫体积V0,静置30 min 后读取泡沫体积V。计算β-LG 的起泡能力(foaming capacity,FC)与起泡稳定性(Foaming stability,FS)。
式中:C 为起泡能力,%;F 为起泡稳定性,%。
1.3.8 酶联免疫试验
参照Liu 等[20]的方法,利用间接ELISA 检测活性氧氧化对牛乳β-LG 的IgE 结合能力。将各组样品在50 mmol/L 碳酸盐缓冲液中稀释至10 μg/mL,严格按照ELISA 试剂盒提供的方案进行相关指标测定。
1.3.9 RBL-2H3 细胞试验
RBL-2H3 细胞试验根据Yang 等[21]的方法稍作修改。大鼠肥大细胞RBL-2H3 接种于EMEM 培养基中,培养基中加入10%胎牛血清,100 U/mL 青霉素与100 g/mL 链霉素,在37 ℃下置于5% CO2/95%空气环境中培养。当细胞达到2×106个/mL 的密度时,接种于96 孔培养板中,将细胞用来自牛乳过敏患者的血清(1 ∶10 稀释)致敏24 h,用台氏液洗涤3 次,在培养基中加入100 ng/mL β-LG 进行激发。参考Kuehn 等[22]的方法测定β-己糖苷酶的释放率。将所有样品1 000 r/min离心15 min 后收集上清液,采用ELISA 试剂盒测定β-己糖苷酶、组胺、半胱氨酰白三烯、前列腺素D2、白介素-4 与白介素-13 的释放量。
1.4 数据处理
本研究中所有试验平行操作3 次,数据用平均值±标准差表示,并采用Prism 软件作图。SPSS 19.0 软件用于试验中各组数据的单因素方差分析。
2 结果与分析
2.1 活性氧氧化牛乳β-LG 聚丙烯酰胺凝胶电泳分析
活性氧氧化β-LG 产物的聚丙烯酰胺凝胶电泳结果如图1 所示。
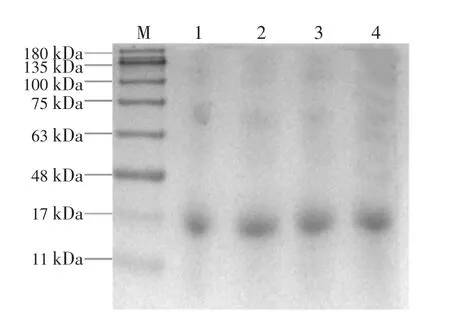
图1 β-乳球蛋白与不同浓度过氧化氢反应后产物电泳图Fig.1 Electrophoresis of the products of β-LG after reaction with different concentrations of hydrogen peroxide
由图1 可知,所用蛋白标准分子量为11~180 kDa,活性氧氧化的β-LG 经电泳分析后,结果显示随着氧化反应浓度的增加,β-LG 条带向上发生轻微迁移。未经氧化的β-LG 在16 kDa 处有一条蛋白条带,当芬顿氧化体系中H2O2浓度为10 mmol/L 时,在更高分子量的位置形成了聚合物,即在17 kDa 左右处形成新的条带。
2.2 活性氧氧化牛乳β-LG 构象结构的变化
活性氧氧化牛乳β-LG 构象结构的变化如图2 所示。

图2 活性氧氧化对牛乳β-LG 构象结构的影响Fig.2 Effect of reactive oxygen species oxidation on conformational structure of bovinemilk β-LG
由图2A 可知,0 mmol/L 组的牛乳β-LG 在195 nm附近显示2 个正峰,208 nm 处有一个明显的负峰。195 nm 处的正峰和208 nm 处的负峰表示牛乳β-LG中存在β-螺旋结构。随着H2O2浓度增加,活性氧氧化引起牛乳β-LG 二级结构改变,主要表现在α-螺旋含量减少。相关研究发现丙烯醛氧化乳球蛋白后,α-螺旋结构也下降[23]。
利用内源荧光光谱评估蛋白质的构象变化,对活性氧氧化牛乳β-LG 的荧光强度进行分析。由图2B 可知,牛乳β-LG 的荧光强度的峰值λmax 在346 nm处,随着芬顿氧化体系浓度的增加,氧化修饰的牛乳β-LG荧光强度有持续下降趋势。当芬顿氧化体系浓度达到10 mmol/L 时,牛乳β-LG 的荧光强度的峰值相较于氧化体系浓度0 mmol/L 组降低了48%,λmax 从346 nm蓝移到342 nm。氧化后牛乳β-LG 引起λmax 蓝移,推测可能是牛乳β-LG 分子外部处于极性环境中,色氨酸和酪氨酸残基被转移到内部非极性环境中[24],这是由于活性氧氧化牛乳β-LG 发生聚集变化引起的。
2.3 活性氧氧化牛乳β-LG 疏水性的变化
蛋白质的表面疏水性也是评估其构象变化的特征指标之一。氧化前后牛乳β-LG 的表面疏水性结果如图3 所示。
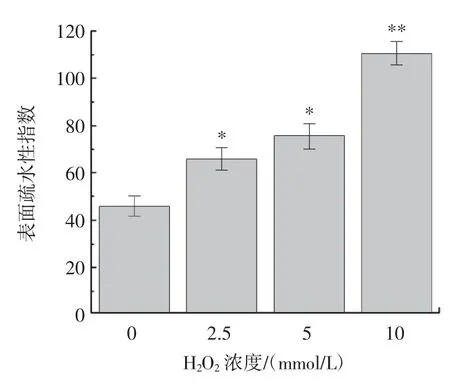
图3 活性氧氧化对牛乳β-LG 表面疏水性的影响Fig.3 Effect of reactive oxygen species oxidation on surface hydrophobicity of bovine milk β-LG
由图3 可知,随着H2O2浓度的增加,牛乳β-LG的表面疏水性逐渐增加。当H2O2浓度达到10 mmol/L时,牛乳β-LG 的表面疏水性是H2O2浓度为0 mmol/L时的2.4 倍。根据以上的结果推测芬顿体系氧化修饰的牛乳β-LG 产生聚集可能是由于蛋白质通过折叠使疏水基团暴露,暴露的疏水基团可以通过疏水相互作用形成聚集体[25]。进一步说明,蛋白质表面疏水性与疏水侧链氧化程度的强弱、蛋白质去折叠以及蛋白质聚集程度有关。
2.4 活性氧氧化牛乳β-LG 微观结构的变化
使用原子力显微镜确定氧化前后牛乳β-LG 颗粒的聚集和表面形貌。用芬顿氧化体系处理牛乳β-LG的AFM 高度图像如图4 所示。

图4 牛乳βLG 的AFM 高度图像Fig.4 AFM height image of bovine milk βLG
由图4 可知,未经氧化处理的牛乳β-LG 在形状周围显示并堆叠形成较厚的蛋白质层,其顶部几乎没有蛋白质聚集体。然而,当芬顿氧化体系浓度增加到2.5 mmol/L 时,观察到少量的βLG 聚集体,这表明低过氧化氢氧化剂浓度诱导βLG 的分段聚集。随着芬顿氧化体系浓度的逐渐增加,蛋白质聚集程度增加。可能是因为蛋白质表面存在静电作用,由于正负电荷排斥放大其暴露的疏水表面,疏水表面形成聚集倾向区域,从而促进了蛋白质颗粒的聚集[18]。
2.5 活性氧氧化牛乳β-LG 功能特性的变化
活性氧氧化对牛乳β-LG 功能特性的影响如图5所示。
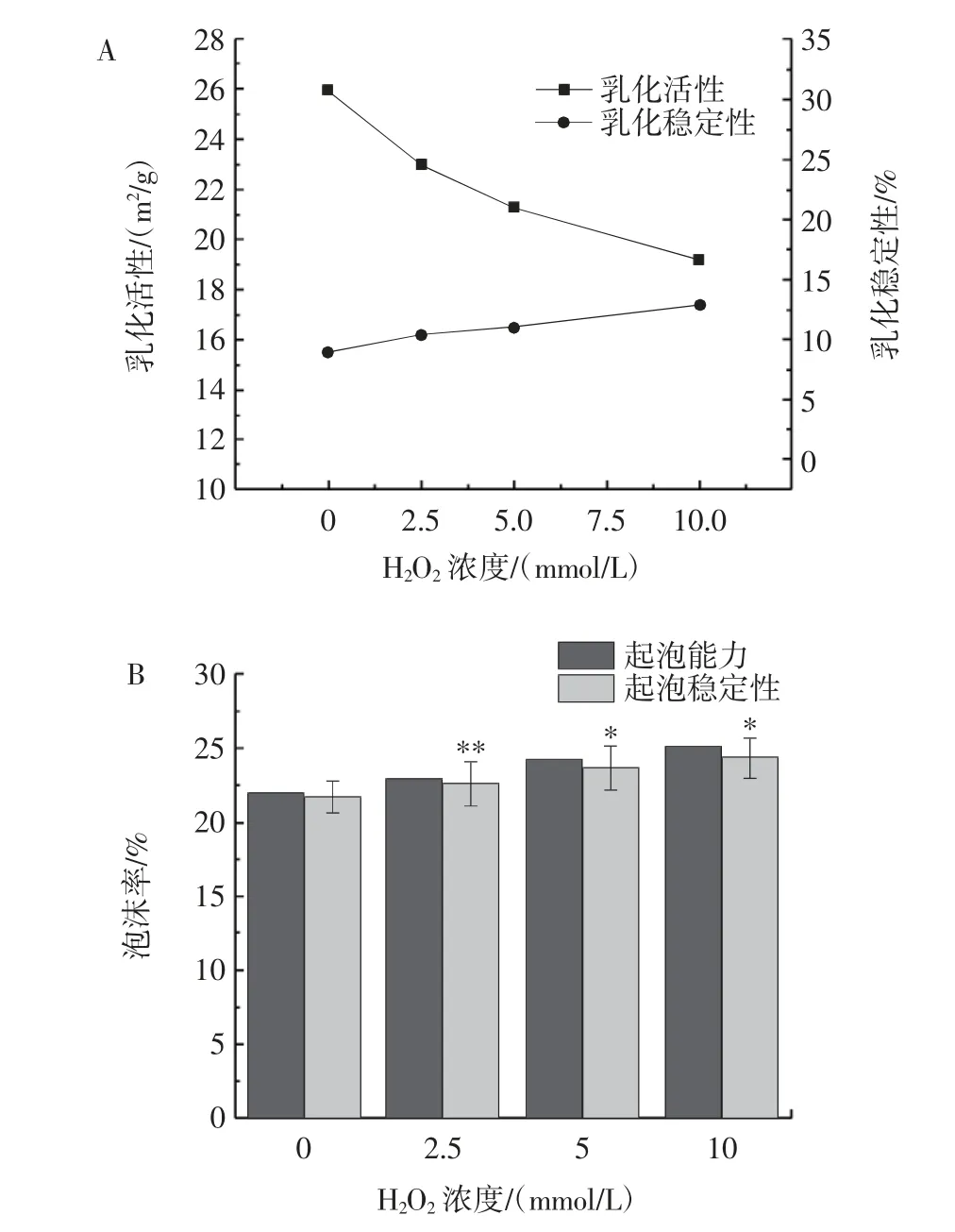
图5 活性氧氧化对牛乳β-LG 功能特性的影响Fig.5 Effect of reactive oxygen species oxidation on functional characteristics of bovine milk β-LG
由图5A 可知,与对照组相比,添加2.5 mmol/L 过氧化氢后,牛乳β-LG 的EAI 从26.12 m2/g 降至23.36 m2/g,ESI 升高至10.11%。随着芬顿氧化体系浓度升高至10 mmol/L,EAI 降低至19.02 m2/g,而ESI 升高至12.52%。乳化活性随着芬顿氧化体系浓度的增加而降低,而乳化稳定性却升高。可能是因为过氧化氢导致β-LG 表面疏水性升高,亲水能力下降,吸附在油-水界面蛋白质含量减少,这是影响β-LG 乳化活性的关键因素,故导致EAI 下降[26]。乳化稳定性提高可能归因于静置后蛋白质在分层处重排乳化形成一层高弹性膜,阻止油滴聚集上浮,从而提高乳化稳定性[27]。
由图5B 可知,随着过氧化氢浓度增加,牛乳β-LG 的FC 及FS 都有不同程度增高,过氧化氢浓度从0 mmol/L增加到10 mmol/L 时,FC 由21.47%升高至25.38%,FS 由21.31%升高至23.46%。可能是因为活性氧氧化使牛乳β-LG 的疏水基暴露在蛋白表面,同时增强其分子间相互作用,从而增强表面张力与表面弹性,FC 与FS 得到提高[28]。
2.6 活性氧氧化牛乳β-LG 潜在致敏性的变化
为进一步评估芬顿氧化体系对牛乳β-LG IgE 结合能力的影响,通过间接ELISA 来测定与牛乳过敏患者血清的结合能力,结果如图6 所示。
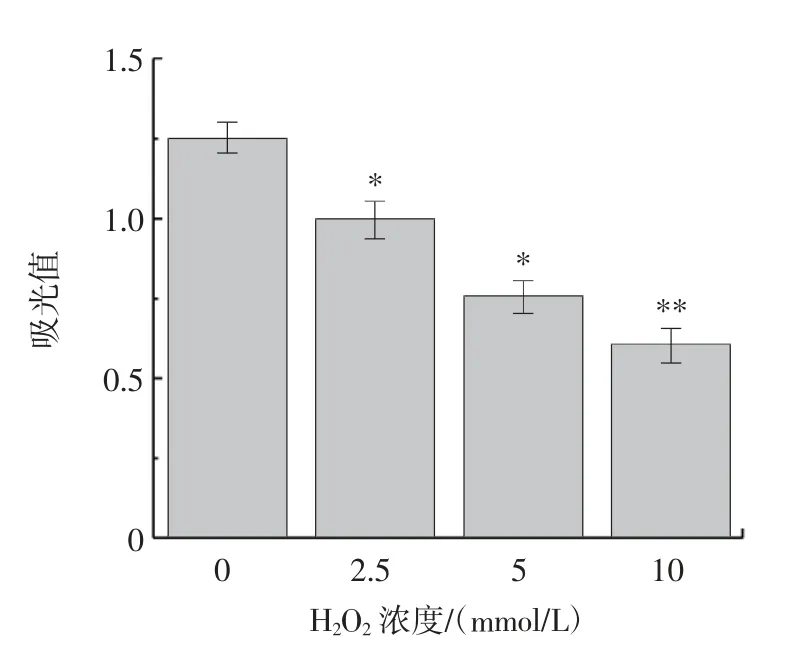
图6 活性氧氧化对牛乳β-LG 致敏性的影响Fig.6 Effect of reactive oxygen species oxidation on sensitization of bovine milk β-LG
由图6 可知,相比于纯化的牛乳β-LG,芬顿氧化体系氧化的牛乳β-LG 的IgE 结合能力降低。当芬顿氧化体系浓度为10 mmol/L 时,牛乳β-LG 的IgE 结合能力相较于氧化体系浓度为0 mmol/L 下降了50%。有研究表明,在氧化过程中,氨基酸侧链被修饰导致某些表位的破坏,或者修饰后产生的蛋白质发生交联,导致牛乳β-LG 过敏原IgE 结合能力降低[29]。因此,原因可能是随着芬顿氧化体系浓度的增加,牛乳β-LG 氨基酸侧链发生改变,引起蛋白质交联产生聚集体,破坏了其相应的过敏表位,从而引起其IgE 结合能力下降。由于过敏原能够和IgE 高效结合,这其中肥大细胞在IgE 介导的过敏中起到了关键的作用,是过敏反应过程中重要的效应细胞。因此,过敏反应在体外研究中常常运用大鼠嗜碱性细胞白血病细胞(RBL-2H3)作为肥大细胞模型[30]。采用RBL-2H3 测定芬顿体系氧化的牛乳β-LG 致敏性的变化,结果如图7 所示。
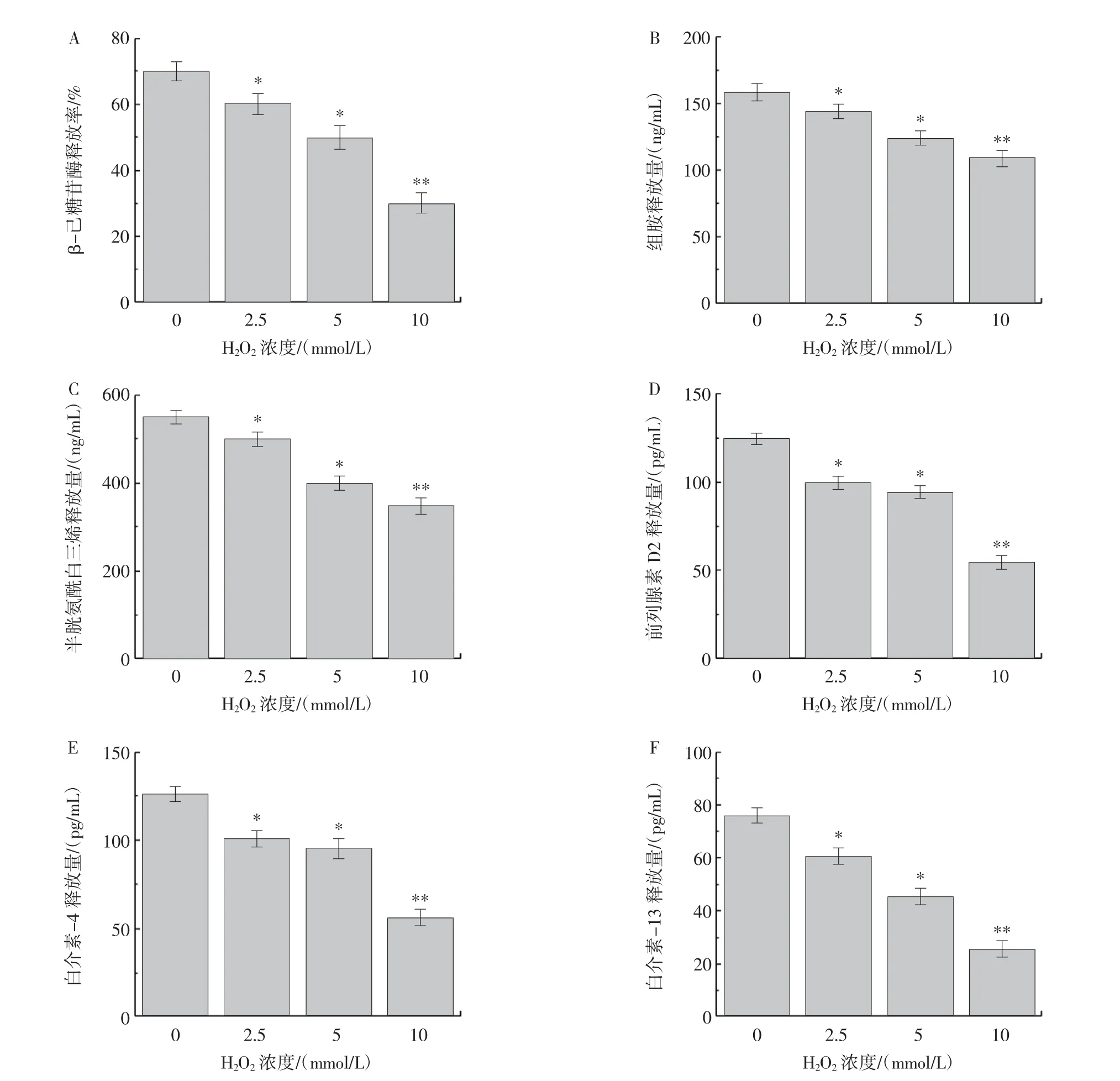
图7 RBL-2H3 细胞模型中各过敏介质对应释放率与释放量变化Fig.7 Changes in cytokine release rate and content in RBL-2H3 cell model
由图7 可知,未添加过氧化氢的对照组RBL-2H3的β-己糖苷酶释放率为64.46%,组胺释放量为166.23 ng/mL,半胱氨酰白三烯释放量为538.01 pg/mL,前列腺素D2 释放量为124.55 pg/mL,白介素-4 释放量为109.56 pg/mL,白介素-13 释放量为71.83 pg/mL,随着过氧化氢浓度升高,各细胞因子释放率或释放量逐步下降。在β-己糖苷酶释放率的测定中,当过氧化氢浓度为10 mmol/L 时,β - 己糖苷酶释放率降低至23.36%(图7A),结果说明芬顿体系氧化的牛乳β-LG能够有效地抑制RBL-2H3 释放β-己糖苷酶。在组胺释放量测定中,10 mmol/L 芬顿体系氧化的牛乳β-LG刺激细胞组胺释放量下降了57.2 ng/mL(图7B)。在半胱氨酰白三烯释放量的测定中,10 mmol/L 芬顿体系氧化的牛乳β-LG 刺激细胞后半胱氨酰白三烯释放量下降到386.73 pg/mL(图7C),抑制率为28.12%。在前列腺素D2 释放量的测定中,芬顿体系氧化修饰的牛乳β-LG 刺激细胞后前列腺素D2 释放量下降,尤以10 mmol/L 组最为显著,其释放量降低至63.89 pg/mL(图7D),抑制率达为48.70%。白介素-4 释放量与白介素-13 释放量相较于未添加过氧化氢组均表现出显著抑制,抑制率分别为46.54%与32.72%(图7E、图7F)。
上述试验结果表明芬顿体系氧化的牛乳β-LG 能够有效的抑制RBL-2H3 释放活性介质和细胞因子。
3 结论
通过活性氧氧化牛乳β-乳球蛋白,探究其对牛乳β-乳球蛋白结构、功能特性和致敏性的影响。结果表明,加工过程中适当氧化可以改变牛乳β-LG 构象结构,从而影响其功能特性和致敏性。β-LG 的二级结构发生显著变化,当过氧化氢浓度达到10 mmol/L 时,表面疏水性升高至原来的2.4 倍,内源荧光强度降低了48%,起泡能力由21.47%升高至25.38%,起泡稳定性由21.31%升高至23.46%,乳化活性由26.12 m2/g降低至19.02 m2/g,但乳化稳定性由21.31%升高至23.46%。β-LG 的IgE 结合能力升高,RBL-2H3 中各过敏介质释放率及释放量发生显著变化。本研究为探究食品加工过程中牛乳β-LG 功能特性及致敏性的变化规律提供参考。
