Polo样激酶1抑制剂在奥希替尼耐药的非小细胞肺癌细胞中的作用
2023-11-04代晓阳刘湘宁葛孚晶朱宏道郑楚润严芳洁
代晓阳,刘湘宁,葛孚晶,朱宏道,郑楚润,严芳洁,杨 波
1.浙江大学药学院,浙江 杭州 310058
2.浙江大学智能创新药物研究院,浙江 杭州 310018
NSCLC 包括肺腺癌和鳞状细胞癌,占肺癌的80%~85%,是全球癌症相关死亡的主要原因之一[1]。约50%的亚洲NSCLC 患者中检测到EGFR激活突变[2],这些患者采用EGFR-TKI 治疗后存活率及临床结局显著改善[3]。作为第三代EGFRTKI,奥希替尼对EGFR 敏感性激活突变以及T790M 耐药突变细胞的抑制率更高[4],是EGFRT790M 突变所致耐药的NSCLC 患者的一线治疗药物[5]。然而,尽管治疗初期患者对奥希替尼的响应率良好,但仍不可避免会出现获得性耐药[6]。因此,探寻奥希替尼的耐药机制、开发奥希替尼耐药的治疗策略对NSCLC 患者的临床治疗具有重要意义。
PLK1属于丝/苏氨酸蛋白激酶的Polo亚家族,在人体具有有丝分裂活性的细胞和组织中高表达,参与调控细胞周期进展、分化和存活等多种细胞过程[7]。PLK1在多种人类恶性肿瘤中高表达并与患者的不良预后相关[8],有研究报道PLK1驱动NSCLC 细胞的上皮-间充质转化从而促进NSCLC转移[9]。近年来,研究者开发出多款PLK1小分子抑制剂,这些小分子抑制剂在肿瘤临床前治疗研究中展现出良好的活性,但因为剂量限制性毒副作用及脱靶效应在临床试验中表现欠佳[10]。
本研究在成功构建奥希替尼耐药的NSCLC细胞株基础上,筛选出对奥希替尼耐药细胞有抑制作用的PLK1 抑制剂,并考察了PLK1 抑制剂与奥希替尼的协同治疗效果,旨在为NSCLC 的奥希替尼耐药问题提供新的解决方案。
1 材料与方法
1.1 主要试剂和仪器
人NSCLC细胞株NCI-H1975购自中国科学院典型培养物保藏委员会细胞库;NCI-H1975敏感株与耐药株源自GSE146850 队列(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE146850),PC-9敏感株与PC-9 耐药株源自GSE153183 队列(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE153183)。肿瘤经典通路抑制剂化合物库(L3500)为美国Selleck 公司产品;奥希替尼、PLK1 抑制剂为美国MedChemExpress 公司产品;RPMI-1640 培养基、胎牛血清为美国Thermo Fisher 公司产品;胰蛋白酶为美国Invitrogen 公司产品;Tris-base 为德国BioFroxx 公司产品;SRB 为美国Sigma-Aldrich公司产品。
细胞培养箱与生物安全柜为美国Thermo Electron 公司产品;普通倒置显微镜为日本Leica公司产品;多功能酶标仪为美国Thermo Fisher Scientific公司产品。
1.2 细胞培养
NCI-H1975 细胞在添加了10%胎牛血清、100 U/mL 青霉素和100 µg/mL 链霉素的RPMI-1640 培养基中培养,所有细胞均置于培养箱(37 ℃、5%二氧化碳)中,待细胞生长至合适密度时进行传代培养,经0.05%胰蛋白酶消化传代,所有实验细胞均传代不超过十次。
1.3 药物浓度递增法构建耐药株
取汇合度60%~80%的人NSCLC 细胞株NCIH1975(即药物敏感细胞株,记为H1975 敏感细胞),在培养基加入1 nmol/L 的奥希替尼,培养24 h 后观察细胞状态。若细胞大量死亡则弃含药培养基并用磷酸盐缓冲液清洗,更换不含药物培养基继续培养,待细胞生长速度至对数生长期,消化传代后再次加入1 nmol/L 奥希替尼培养24 h,及时观察细胞状态,若细胞仍大量死亡则继续做撤药处理,待细胞增殖至正常状态后,重复上述循环,直至当细胞在1 nmol/L 奥希替尼培养条件下稳定增殖并连续传代三次以上。按20 nmol/L的药物浓度差提升奥希替尼浓度,继续培养24 h。若细胞增殖速度异常缓慢或大量死亡,则更换为原含1 nmol/L 奥希替尼的培养基,待其恢复至正常增殖速度后再次更换为筛选浓度培养基。重复上述循环,直至细胞在该筛选药物浓度培养条件下稳定增殖并连续传代三次以上。期间需在不同时间段测量细胞对于奥希替尼的IC50以确定耐药指数,耐药指数=耐药细胞IC50/亲本细胞IC50。耐药株构建时间共计7个月,最终细胞维持培养浓度为1 µmol/L,耐药株记为H1975 耐药细胞。
1.4 肿瘤经典通路抑制剂库筛选与奥希替尼具有协同作用的化合物
将肿瘤经典通路抑制剂库中化合物(0.1 µmol/L)与奥希替尼(0.5 µmol/L)联合用于H1975 耐药株中,使用SRB 染色检测并计算细胞株的增殖抑制率,以单用奥希替尼(0.5 µmol/L)的细胞株增殖抑制率为对照,筛选出肿瘤经典通路抑制剂库中与奥希替尼存在协同作用的化合物。
1.5 SRB染色法考察细胞存活率
H1975 敏感细胞和H1975 耐药细胞分别以3.0×104个/孔 的 细 胞 密 度 接 种 于96 孔 板 中(100 µL/孔),于细胞培养箱中培养24 h 后,给予梯度浓度的相应化合物孵育72 h。孵育结束弃去上清液,每孔加入100 µL 10%三氯乙酸溶液固定,弃培养液,用双蒸水洗涤后烘干。每孔加入100 µL SRB 染色液(用1%冰醋酸配置,每500 mL 加 入1.5~2.0 g SRB 粉 末),室 温 放 置20 min,用1%冰醋酸洗涤干净后烘干。每孔加入100 µL Tris-base 碱溶液溶解结合到细胞内的SRB染色液,置于室温摇床20 min后,检测515 nm波长处的吸光度值并计算细胞存活率。
1.6 差异基因富集分析考察耐药株中PLK1 信号通路的变化情况
选取GSE146850 队列中H1975 奥希替尼耐药株与敏感株以及GSE153183 队列中PC-9 耐药株与敏感株的转录组数据,使用R 软件包limma 3.42.2对数据进行比较并计算差异基因,筛选差异基因标准为P<0.05 且log2FC的绝对值大于1。对分析得到的差异基因采用R 软件包clusterProfiler 4.0 进行基因集富集分析,评估差异基因中相关信号通路的富集情况。
1.7 采用NSCLC 患者队列数据分析PLK1 表达水平与患者无进展生存期的相关性
选取11例接受过奥希替尼治疗后的EGFR 突变的NSCLC 患者的RNA 测序数据与生存随访数据(https://github.com/aleighbrown/pwgs_snakemake),采用皮尔逊相关性分析考察患者PLK1mRNA 表达水平与患者无进展生存期的相关性。
1.8 统计学方法
采 用RStudio(R 软 件 包ggplot2)、Excel 和Graphpad Prism 8 软件进行相关实验数据的分析和绘图。所有数据均以均数±标准差(±s)表示,组间差异比较采用双侧student’st检验,P<0.05表示差异具有统计学意义。
2 结 果
2.1 奥希替尼耐药株构建成功
SRB 染色结果见图1。H1975 敏感细胞多呈多边形,细胞轮廓明显,易成团生长;H1975耐药细胞多呈梭形,轮廓不规则,分散程度较高。处理72 h 后奥希替尼对H1975 耐药细胞的IC50显著高于H1975 敏感细胞(分别为1550.00和35.67 nmol/L,P<0.05),耐药指数为43.45,见图2。表明H1975 耐药株构建成功。

图1 奥希替尼敏感和耐药H1975细胞显微镜下形态Figure 1 Cell morphology of osimertinib sensitive and resistant H1975 cell lines
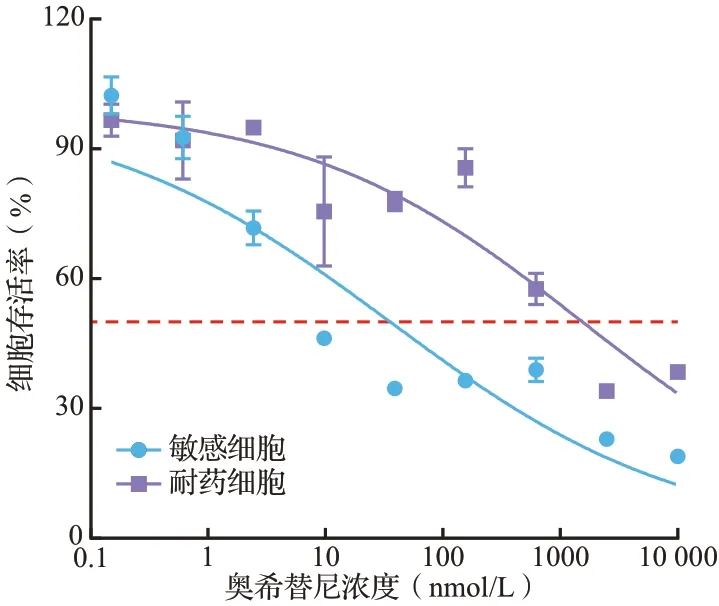
图2 奥希替尼处理72 h 后敏感和耐药H1975 细胞的生存曲线Figure 2 Cell survival curves of osimertinib sensitive and resistant H1975 cells
2.2 筛选出与奥希替尼具有协同作用的肿瘤经典通路抑制剂
SRB 染色结果显示,实验浓度下单用奥希替尼对H1975耐药细胞的增殖抑制率为35.80%;而将肿瘤经典通路抑制剂库中化合物(0.1 µmol/L)与奥希替尼(0.5 µmol/L)联合作用72 h,抑制率前十的化合物见表1。其中合用抑制率排名前二的化合物为PLK1 抑制剂GSK 461364 和BI 2536,与奥希替尼合用后对H1975 耐药株的抑制率分别达到90.10% 和87.90%。表明PLK1 抑制剂GSK 461364、BI 2536 与奥希替尼合用能够显著抑制奥希替尼耐药细胞的增殖,提示奥希替尼的耐药现象可能与NSCLC中PLK1异常激活相关。

表1 与奥希替尼合用72 h 对耐药H1975 细胞抑制率排名前十的肿瘤经典通路抑制剂及其靶点Table 1 Top10 tumor classic pathway inhibitor and their targets in terms of inhibition rate of osimertinibresistant cells after 72 hours of combined use of osimertinib
2.3 奥希替尼耐药可能与PLK1通路激活有关
奥希替尼耐药株(H1975 耐药细胞与PC-9 耐药细胞)中PLK1 调控通路和细胞周期通路被显著激活(P<0.01),见图3。同时,在接受奥希替尼治疗的EGFR 突变NSCLC 患者队列中,奥希替尼治疗后患者的PLK1mRNA 水平与无进展生存期呈负相关(R=-0.62,P<0.05),见图4。结果提示,NSCLC 细胞中PLK1 过度激活可能导致细胞对奥希替尼耐药。
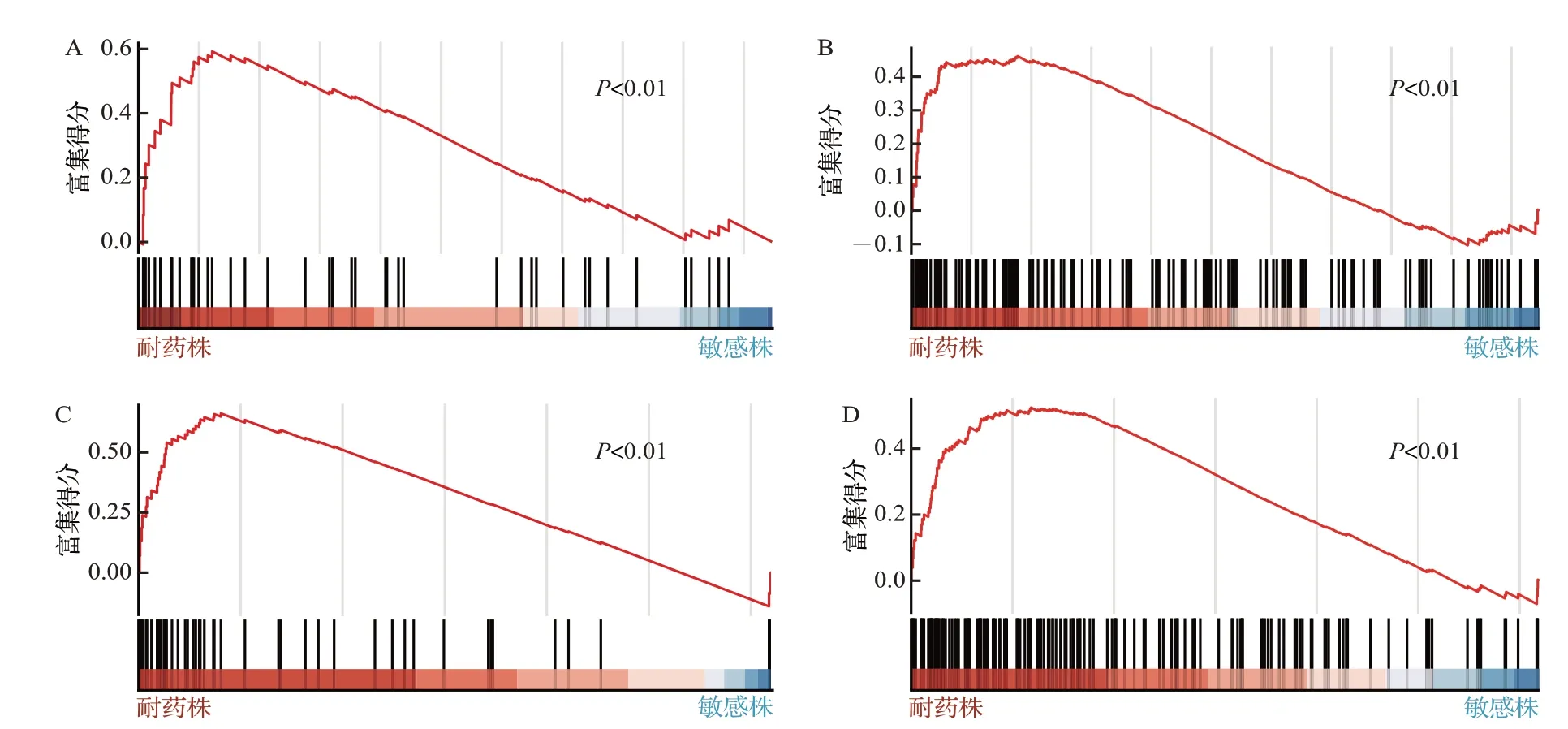
图3 奥希替尼耐药株与亲本敏感株中PLK1调控通路和细胞周期通路相关基因富集结果Figure 3 Activation of PLK1 regulatory pathway and cell cycle pathway in samples of osimertinib resistant cells and parental sensitive cells

图4 接受奥希替尼治疗的EGFR 突变非小细胞癌患者中PLK1 mRNA 水平与无进展生存期的相关性Figure 4 The correlation between PLK1 mRNA levels and progress free survival in a cohort of EGFR mutated NSCLC patients receiving osimertinib treatment
2.4 奥希替尼耐药细胞对PLK1抑制剂更敏感
采用PLK1单靶点抑制剂伏拉塞替(BI 6727)和GSK 461364 进行细胞增殖抑制实验。SRB 染色结果显示,伏拉塞替和GSK 461364 作用72 h后,H1975 耐 药 细 胞 的IC50(分 别 为19.36 和8.24 nmol/L)显著低于H1975 敏感细胞(分别为37.83 和28.54 nmol/L,均P<0.05),见图5,表明奥希替尼耐药细胞对PLK1抑制剂更敏感。
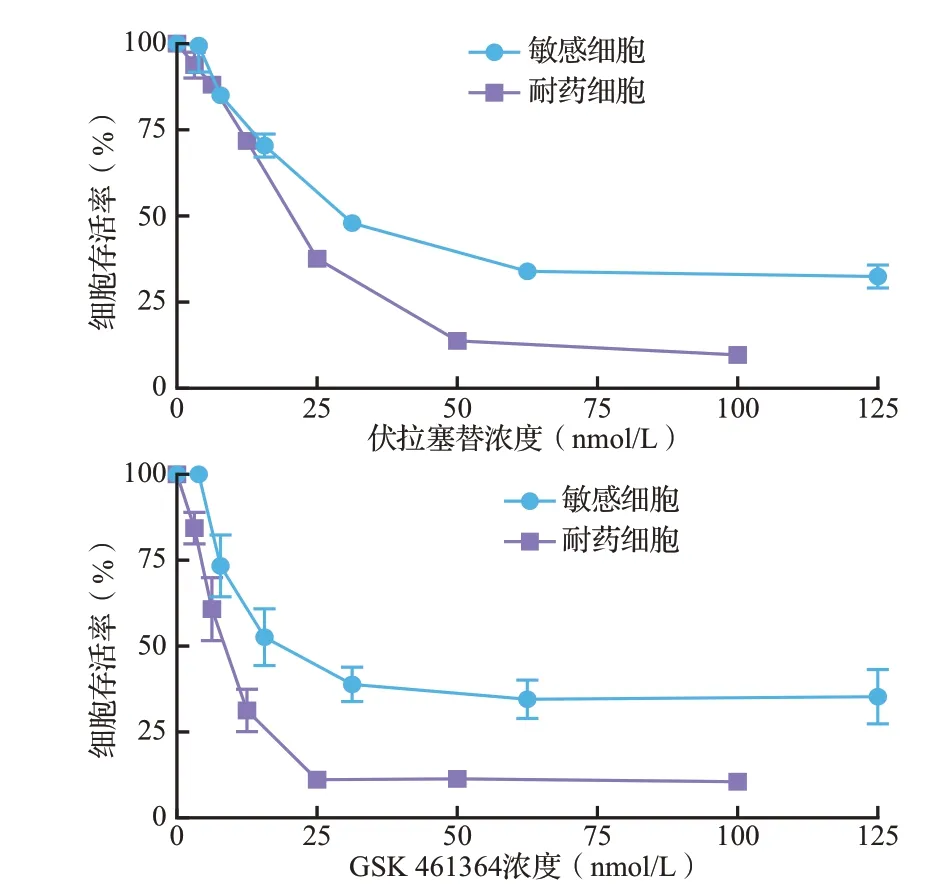
图5 伏拉塞替或GSK 461364 作用后奥希替尼敏感和耐药H1975细胞的生存曲线Figure 5 Cell survival curves of osimertinib sensitive and resistant H1975 cells treated with BI 6727 or GSK 461364
2.5 PLK1 抑制剂与奥希替尼合用可增强对耐药细胞的增殖抑制作用
根据上述结果,选择对H1975 耐药细胞增殖抑制率约在30%的PLK1 抑制剂浓度与奥希替尼合用。伏拉塞替(12.5 nmol/L)和GSK 461364(6.25 nmol/L)分别与奥希替尼联合作用于H1975耐药细胞72 h后,H1975耐药细胞的存活率较单用奥希替尼组显著降低(均P<0.05,图6),表明PLK1抑制剂与奥希替尼合用可增强对耐药细胞的增殖抑制作用,提示合用PLK1抑制剂与奥希替尼可能是解决临床NSCLC奥希替尼耐药的新途径。
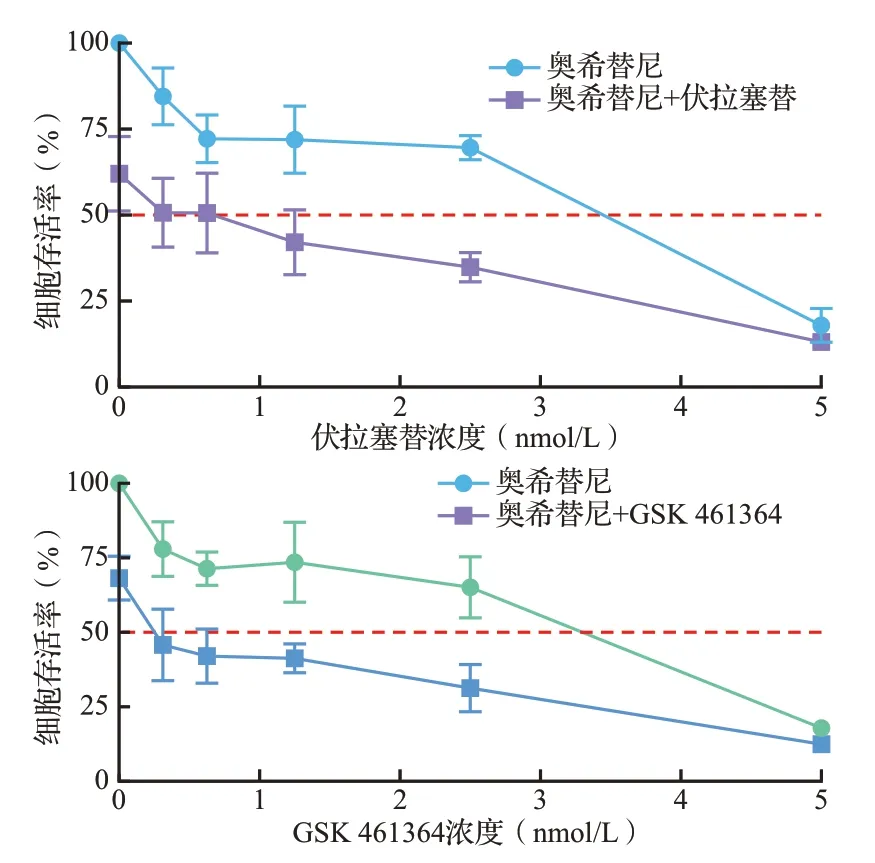
图6 伏拉塞替或GSK 461364联合奥希替尼作用后H1975耐药细胞的生存曲线Figure 6 Cell survival curves of osimertinib resistant H1975 cells treated by BI 6727 or GSK 461364 combined with osimertinib
3 讨 论
NSCLC 是世界上最为常见的癌症相关死亡原因之一,全球每年死亡人数超过8 万人[11]。约50%的亚洲NSCLC 患者和11%~16%的西方国家NSCLC 患者携带EGFR 突变[2]。数据显示,携带EGFR 敏感突变的患者获益于EGFR-TKI,其客观缓解率与无进展生存期有效改善[12]。
然而,作为携带EGFR 突变的NSCLC 患者的标准一线治疗手段,第一代与第二代EGFR-TKI如吉非替尼和阿法替尼等虽然在患者中显示出良好的临床收益,但多数患者在治疗后产生获得性耐药[13]。为了解决第一、二代EGFR-TKI 耐药问题,研究者开发了第三代EGFR-TKI 奥希替尼用于对EGFR-TKI 获得性耐药的T790M 阳性NSCLC 患者[14]。奥希替尼在T790M 驱动的第一代EGFR-TKI 获得性耐药患者中显示出优越的疗效及更低的皮肤和胃肠道毒性[15]。然而与早期EGFR-TKI 类似,接受奥希替尼治疗的患者依然不可避免地出现获得性耐药。现有研究揭露的耐药机制可分为EGFR 依赖性耐药和EGFR 非依赖性耐药[16]。EGFR 依赖性耐药机制主要包括EGFR 三 级 突 变 如EGFR-C797、EGFR-L718 和EGFR-G719 突变等类型,阻碍奥希替尼与EGFR之间形成共价结合,从而赋予患者耐药性[17]。EGFR 非依赖性耐药机制主要包括旁路途径激活、组织学转化和致癌融合等[18]。目前,c-MET扩增是奥希替尼最常见的EGFR 非依赖性耐药机制,占奥希替尼进展患者的5%~24%,c-MET 通过与配体肝细胞生长因子结合,导致受体磷酸化并激活EGFR 下游信号通路的旁路导致奥希替尼耐药[19];EGFR 下游信号通路如PI3K-AKT、RASMAPK-ERK、JAK-STAT 等异常激活也会促进肿瘤发生、增殖、迁移、侵袭和对治疗的抵抗[20];除此之外,含卷曲螺旋结构域6与RET融合等致癌融合突变也会赋予患者奥希替尼耐药性[21]。尽管在表征奥希替尼的部分分子耐药性方面已经取得了进展,但由于耐药性的异质性和复杂性,仍有30%~50%患者的耐药机制仍未明确[22]。
联合其他分子靶向药物是一种解决或延缓奥希替尼耐药的治疗策略。目前,奥希替尼联合c-MET 抑制剂沃利替尼、MEK 抑制剂司美替尼或RET 抑制剂普拉替尼等多种分子靶向药物的临床试验显示出良好的肿瘤治疗作用与可控的毒副作用[23-25]。基于此,本研究首先成功构建了奥希替尼耐药株,并将肿瘤经典通路抑制剂库中的化合物与奥希替尼合用,旨在筛选出能有效克服奥希替尼耐药的药物组合。结果显示,在所有化合物中,PLK1 抑制剂GSK 461364 和BI 2536 与奥希替尼合用后对奥希替尼耐药株的增殖抑制率最高。结合基因集富集分析结果,奥希替尼耐药株样本中PLK1 调控通路和细胞周期通路显著激活,表明NSCLC 细胞对奥希替尼耐药可能与PLK1 过度激活有关,提示联合使用PLK1 抑制剂与奥希替尼可能是临床上解决NSCLC 患者奥希替尼耐药的新途径。接着,本研究在细胞水平考察了奥希替尼敏感和耐药细胞对PLK1 抑制剂的敏感性,结果显示奥希替尼耐药细胞对PLK1 抑制剂更加敏感,且PLK1 抑制剂与奥希替尼合用对奥希替尼耐药细胞的增殖有较好的抑制作用。
PLK1 作为丝/苏氨酸蛋白激酶的Polo 亚家族成员,在有丝分裂和维持基因组稳定性方面发挥至关重要的作用,调控细胞周期进展、分化和存活等多种细胞过程[7]。相较于靶向微管等传统抗有丝分裂药物,靶向有丝分裂调节激酶PLK1 可降低其在正常细胞中的微管抑制而产生的毒副作用[26]。作为具有癌症治疗潜力的靶点,近年来,研究者开发了多种PLK1 抑制剂并进入临床试验。本文所使用的PLK1 抑制剂伏拉塞替以及GSK 461364均为ATP竞争性抑制剂,其中伏拉塞替为二氢蝶酮衍生物类化合物,与PLK1 的激酶结构域R57、L59 和C133 等残基通过氢键相互作用[27];GSK 461364 为噻吩衍生类化合物,其对PLK1 具有高度选择性[28]。目前,研究进展最快的PLK1 抑制剂伏拉塞替在多组临床试验中表现出优异的抗肿瘤活性及安全性,被美国食品药品监督管理局称为治疗急性髓性白血病的“突破性疗法”[29]。然而,目前开发的PLK1 抑制剂大多靶向PLK1 的ATP 结合位点,PLK 家族ATP 结合口袋的高度保守性使得多数化合物不可避免地面临脱靶效应,单药治疗时抑制剂的非特异性活性常导致剂量限制性毒性[30]。实体肿瘤对单一PLK1 抑制剂的反应有限[31]。目前尚未有一款成熟的PLK1抑制剂进入临床。
本研究初步揭示了PLK1 可能是解决临床奥希替尼耐药的有效靶点。关于合用PLK1 抑制剂与奥希替尼增强对耐药细胞抗肿瘤作用的具体机制,有研究揭示了PLK1抑制剂伏拉塞替与厄洛替尼合用可促进肿瘤细胞的DNA 损伤以及G2/M 停滞并引发细胞凋亡[32]。除此之外,在EGFR-TKI获得性耐药的NSCLC 患者肿瘤标本中有丝分裂调控激酶Aurora B 表达增加且明显激活[33-34],而PLK1 通过在Thr236 位点上磷酸化Aurora B 调控其激酶活性[35-36]。推测抑制PLK1 可能通过进一步抑制Aurora B激酶活性从而增强奥希替尼对耐药细胞的增殖抑制作用。
综上所述,本研究通过体外筛选、细胞水平评估和生物信息学分析证实,PLK1 的异常激活可能是奥希替尼耐药的新机制,PLK1 抑制剂与奥希替尼合用对奥希替尼耐药细胞的抗肿瘤作用更强,可为奥希替尼耐药的NSCLC 患者的临床治疗提供了新的思路。
志谢 研究得到国家自然科学基金(82104193)和浙江省自然科学基金(LY22H310001)支持
Acknowledgements This work was supported by National Natural Science Foundation of China (82104193) and Natural Science Foundation of Zhejiang Province (LY22H310001)
利益冲突 所有作者均声明不存在利益冲突
Conflict of Interests The authors declare that there is no conflict of interests
©The author(s) 2023.This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)
