猪瘟病毒和牛病毒性腹泻病毒双重荧光定量PCR检测方法的建立和初步应用
2023-10-29夏应菊赵俊杰王团结张乾义宋振辉
邹 宏,夏应菊,李 玲,徐 璐,赵俊杰,王团结,张乾义*,宋振辉
(1.西南大学动物医学院,重庆 402460;2.中国兽医药品监察所 国家/WOAH猪瘟参考实验室,北京 100081)
当前,随着猪瘟兔化弱毒疫苗(C株)的使用,CSF得到有效控制[1],但近年来多地报道的慢性猪瘟和非典型瘟病毒流行,使防控形势变得严峻复杂[2]。BVDV与CSFV同属于黄病毒科瘟病毒属[3],两者核苷酸序列同源性约60%,彼此存在血清学交叉反应[4]。1973年[5]首次证实BVDV可自然感染猪[5],且实验室诊断中常能检测到BVDV抗体。此外,商品化胎牛血清及用于疫苗生产的细胞系中也有BVDV污染的报道[6]。猪瘟疫苗在生产过程中利用牛源血清增殖病毒,一旦血清中含有BVDV,就容易造成猪瘟疫苗中BVDV污染,进而感染猪群,导致猪瘟疫苗免疫失败,容易存在生物安全风险和疫病传播隐患。
为加强CSFV和BVDV临床病例的混合感染诊断、生物制品及相应原料BVDV的筛查,本研究基于快速、准确、敏感的RT-qPCR检测方法,针对CSFVE2片段及BVDV 5′UTR片段设计引物和探针,建立了一种更加敏感的双重RT-qPCR方法,旨在能更特异地的区分CSFV和BVDV,为这两种病毒的分子生物学检测、流行病学调查和监测提供技术支持。
1 材料与方法
1.1 毒株及临床样本
CSFV、BVDV、口蹄疫病毒(FMDV)、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)、猪圆环病毒2型病毒(PCV 2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪流感病毒(SIV)、日本乙型脑炎病毒(JEV)、猪非典型瘟病毒(APPV)、非洲猪瘟病毒(ASFV)的毒株及116份临床病料均由中国兽医药品监察所保存 。
1.2 引物和探针的设计及合成
利用MEGA软件对NCBI核酸数据库中公布的BVDV 5′UTR、CSFVE2 基因序列进行比对,通过Primer 5软件对每个病原分别设计引物和探针。引物和探针由生工生物工程(上海)股份有限公司合成。
1.3 重组阳性质粒模板的制备
根据核酸提取试剂盒以CSFV-C株、BVDV-NADL标准毒株为模板提取病毒RNA,反转录为cDNA,PCR产物经琼脂糖凝胶电泳检测,回收纯化。将产物与pGEM-TEasy载体连接,转化、菌液PCR鉴定为阳性后,进一步测序鉴定。通过核酸测定仪检测质粒浓度,使用道尔顿计算法计算质粒拷贝数,ddH2O将质粒稀释成1.0×100~1.0×109copies·μL-1后于-80 ℃保存备用。
1.4 RT-qPCR反应条件优化及标准曲线的建立
使用浓度为1×104copies·μL-1的两种重组质粒混合后作为模板,对退火温度、引物及探针浓度进行优化。以质粒浓度为1.0×107~1.0×102copies·μL-16个稀释度的两种重组质粒混合后作为模板,按优化好的反应条件进行RT-qPCR扩增建立标准曲线。
1.5 灵敏度试验
取浓度为1.0×103~1.0×100copies·μL-1的两种重组质粒混合后作为模板进行双重RT-qPCR扩增;用1.0×107~1.0×100copies·μL-1的两种重组质粒各自作为模板,进行普通PCR扩增,比较两种扩增方法的灵敏度。
1.6 特异性试验
分别以BVDV、CSFV、ASFV、APPV、FMDV、PPV、PRV、PCV2、PRRSV、PEDV、TGEV、SIV、JEV的病毒核酸作为样本,采用上述优化好的方法进行RT-qPCR扩增,检测该方法的特异性。
1.7 重复性试验
分别取1.0×102、1.0×104、1.0×106copies·μL-1的两种重组质粒混合后作为模板,按照建立的双重RT-qPCR方法扩增,每个阳性质粒做3次重复,计算组内和组间的变异系数。
1.8 临床样品的检测
利用建立的双重RT-qPCR方法及现行的CSFV RT-qPCR检测方法(GB/T 27540—2011)、BVDV RT-qPCR检测方法(GB/T 18637—2018)分别对山西省猪场临床样品、CSFV石门株感染动物组织样品、BVDV-NADL株共109份不同组织、全血及7份来自不同生产商的胎牛血清进行检测,并比较二者之间的符合率。
2 结 果
2.1 CSFV、BVDV阳性质粒模板的制备及RT-qPCR检测方法的建立
分别将CSFV-E2、BVDV-5′UTR克隆至pGEM-T载体构建重组质粒,PCR扩增后经琼脂糖凝胶电泳验证,目的条带大小为1 100 bp(CSFV-E2)和385 bp(BVDV-5′UTR),测序结果显示插入片段同源性均为100%。优化后的RT-qPCR反应体系为 25 μL,2×HyperProbe Mixture 12.5 μL,CSFV-E2-F1/CSFV-E2-R1/CSFV-E2-P1和BVDV-F1/
BVDV-R1各加1 μL,BVDV-P1 加0.5 μL,模板2 μL,ddH2O 5 μL。反应程序 95 ℃ 30 s;95 ℃ 10 s;58 ℃ 20 s,45个循环。
将浓度为1.0×101~ 1.0×106copies·μL-1的两种重组质粒混合后作为模板进行双重RT-qPCR扩增,绘制标准曲线,见图1。结果显示CSFV-E2 回归方程式y=-3.636 8x+38.567,相关系数R2为0.998 6;BVDV-5′UTRy=-3.666 4x+37.476,相关系数 R2为 0.998 1。表明两种重组质粒的拷贝数均与各自的Ct值有良好的线性关系。
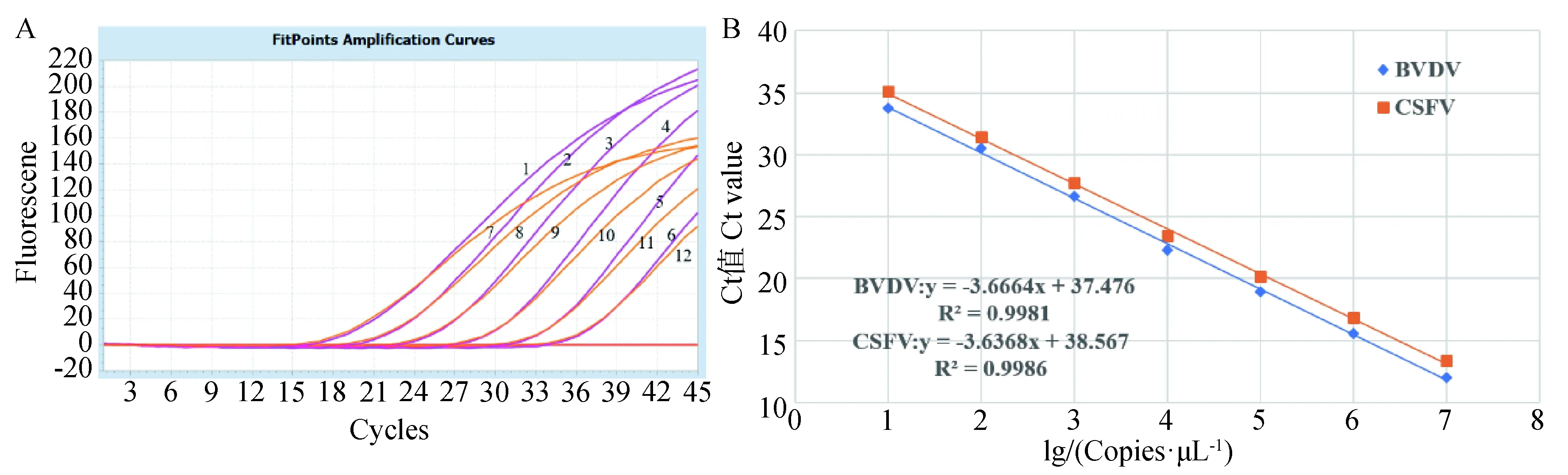
A. 荧光定量PCR结果:1~6.1×106 ~1×101 copies·μL-1CSFV阳性质粒;7~12.1×106 ~1×101 copies·μL-1BVDV阳性质粒;B. CSFV和BVDV标准曲线A. Results of RT-PCR:1-6. 1×106 ~1×101 copies·μL-1 CSFV positive plasmids;7-12. 1×106 ~1×101 copies·μL-1 BVDV positive plasmids;B. CSFV and BVDV standard curves图1 CSFV、BVDV标准曲线建立结果Fig.1 Results of CSFV and BVDV standard curve creation
2.2 敏感性试验
将浓度为1.0×107~ 1.0×100copies·μL-1的混合质粒标准品为模板,进行普通PCR扩增;将浓度为1.0×103~1.0×100copies·μL-1的混合质粒标准品为模板进行双重RT-qPCR扩增。结果表明,该方法检测的最低拷贝数均为5 copies·μL-1;普通PCR扩增最低检测极限均为103copies·μL-1。前者比后者更敏感,表明所建方法敏感性较高(图2)。

A. CSFV荧光定量PCR敏感性试验结果;B. CSFV普通PCR敏感性试验结果;C. BVDV荧光定量PCR敏感性试验结果;D. BVDV普通PCR敏感性试验结果。M. Marker;1~8. 1×107 ~1×100 copies·μL-1;9. 阴性对照(-)A. CSFV real-time RT-PCR sensitivity test results; B. CSFV normal PCR sensitivity test results; C. BVDV real-time RT-PCR sensitivity test results; D. BVDV normal PCR sensitivity test results. M. marker; 1-8: 1×107 ~1×100 copies·μL-1; 9. Negative control (-)图2 荧光定量PCR和普通PCR敏感性试验结果Fig.2 Results of real-time RT-PCR and PCR sensitivity tests
2.3 特异性试验
分别以BVDV、CSFV、ASFV、APPV、FMDV、PPV、PRV、PCV2、PRRSV、PEDV、TGEV、SIV、JEV的核酸为模板,用建立的双重RT-qPCR 方法检测,结果显示仅CSFV、BVDV出现特异性扩增,其他病原均为阴性,表明本方法具有很好的特异性。
2.4 重复性试验
以1.0×102、1.0×104、1.0×106copies·μL-1的两种重组质粒混合后作为模板,进行组内和组间的重复性试验。结果表明变异系数均小于2%,说明本方法具有很好的重复性。
2.5 临床样品检测
本研究建立的双重RT-qPCR方法对109份临床样品及7份商品化牛血清进行检测,结果显示,CSFV 阳性率为12.9%;BVDV 阳性率为6.0%,与BVDV(GB/T 18637—2018)、CSFV(GB/T 16551—2020)国家标准诊断技术检测结果一致,符合率为100%,表明此次建立的方法可用于CSFV和BVDV流行病学调查。
3 讨 论
此前,为鉴别CSFV和BVDV,梁洪等[7]建立了BVDV与CSFV双重RT-PCR一步检测法,缩短了检测时间,减少了操作污染,张宏伟等[8]、韦雪华等[9]建立了CSFV与BVDV双重RT-qPCR检测方法,前者仅为定性检测,后者对两种疾病的检测极限分别为36和100 copies·μL-1。较之相比,本研究建立的双重RT-qPCR检测方法最低检测极限为5 copies·μL-1,具有很高的敏感性;对其他猪群常见病原及阴性对照均未出现特异性扩增,展现出良好的特异性,在CSFV、BVDV早期鉴别诊断中更具优势。
猪群BVDV的感染原因尚不明确,Tao等[10]认为,早期猪群BVDV感染是与牛直接接触导致感染。目前由于集约化、规模化养殖的不断提升及养殖技术、生物安全管理的不断加强,牛群与猪群直接接触的机会较少,BVDV病原的直接有效传播基本被阻断。但随着CSF疫苗与牛源生物制品的广泛应用,BVDV 间接感染猪群的事件时有报道[6]。利用本研究中建立的双重RT-qPCR检测方法对7个不同生产商购买的胎牛血清检测出5个BVDV阳性血清,表明商品化牛血清中存在BVDV污染。商品化牛血清的品质与牛场生物安全及BVDV控制情况息息相关,目前生产厂家普遍采用辐射灭菌杀死病原微生物,虽然其不具有传染性,但感染BVDV的牛血清用于种毒繁殖可能会中和CSFV导致猪瘟抗原效价偏低,且随着细胞苗的大规模使用,有必要保证其生产过程及终产品的有效性和安全性,因此对CSFV和BVDV进行鉴别检测有较大意义。
4 结 论
本研究构建了一种CSFV和BVDV双重鉴别诊断RT-qPCR方法,可满足生产实践和临床检测的需要,为CSFV和BVDV的鉴别诊断提供了更加敏感的检测方法,也为我国猪瘟的净化提供了新的技术支撑。
