miR-502调控犬乳腺肿瘤细胞增殖、迁移和EMT的作用机制
2023-10-29任晓丽范玉营皇甫和平靳双星石冬梅
任晓丽,范玉营,皇甫和平,王 军,靳双星,刘 云,石冬梅*
(1.河南牧业经济学院动物医药学院,郑州 450046;2.东北农业大学动物医学院,哈尔滨 150030)
犬乳腺肿瘤是兽医临床上最常见的恶性肿瘤之一,主要发生在未进行卵巢子宫未切除的雌性犬,8岁以上的犬多发,每10万例犬中约有476例为恶性乳腺肿瘤,发病率和死亡率呈逐渐上升的趋势,转移是造成患犬死亡的主要原因[1-2]。目前,临床上犬乳腺肿瘤的治疗主要采用手术切除、激素治疗、化学疗法和放射治疗相结合的方式,但由于治疗选择方式有限、肿瘤病理学类型复杂性、多重耐药和易转移复发,影响治疗效果[3]。因此,筛选犬乳腺肿瘤的分子靶标用于早期诊断、治疗或癌症进展监测具有重要的临床意义。
miRNA作为转录后基因调控因子,参与恶性肿瘤发生发展的各个阶段,如肿瘤增殖、分化、侵袭、血管生成、转移、凋亡和耐药性等,正在成为各种类型癌症的预测、诊断、预后和治疗靶点的潜在的非侵入性细胞和分子生物标志物[4-6]。本团队前期研究发现,微小RNA-502(cfa-miR-502或miR-502)在犬乳腺肿瘤组织中表达上调,与犬乳腺肿瘤的发生、转移密切相关,发挥促癌作用[7]。其他研究显示,Osaki等[8]对SNP(犬乳腺癌细胞系)和犬的正常乳腺组织miRNA assay结果显示有291种不同的差异表达的miRNAs,发现miR-502在SNP细胞中高表达,表达差异5.994 5倍。但miR-502对犬乳腺肿瘤细胞的作用机制尚不清楚。RBMS1最初被认为是一种c-Myc基因单链结合蛋白,参与调节DNA复制、转录、凋亡和细胞周期进程[9],也可以通过调节靶向mRNA的稳定性和翻译来调节癌症进展[10-11]。在肿瘤组织中,不同miRNA通过不同的靶基因而发挥作用,因此,探讨miR-502与犬乳腺肿瘤的关系,及与抑癌基因RBMS1之间是否存在调控关系,对研究犬乳腺肿瘤发生发展的分子机制以及作为治疗靶点的潜力提供理论基础。本试验主要研究miR-502和RBMS1在犬乳腺肿瘤细胞中的表达,及miR-502是否通过靶调控RBMS1基因影响犬乳腺肿瘤细胞增殖、迁移及EMT中的作用,旨在为犬乳腺肿瘤诊断和治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞与培养基 犬乳腺肿瘤细胞CHMp和CHMm细胞,分别从12岁的患恶性乳腺腺癌的雌性杂种犬的原发病灶和转移病灶中(胸腔积液)分离培养出来,由东北农业大学外科实验室馈赠;犬乳腺正常乳腺组织,来源于乳腺肿瘤切除手术中的肿瘤旁正常乳腺组织(经病理组织学确认为正常乳腺组织结构),手术遵守东北农业大学实验动物伦理委员会(SRM-11)制定标准,并取得犬主人签名的知情同意书。DMEM高糖培养基购自HyClone公司;Matrigel购自Corning公司、Opti-MEM、胎牛血清、青链霉素和胰蛋白酶购自Gibco公司。
1.1.2 试剂 二甲基亚砜(dimethylsulfoxide,DMSO)、脂质体转染试剂Lipofectamine 2000、TRIzol购自美国Invitrogen公司;RIPA裂解液、增强型BCA蛋白浓度测定试剂盒购自上海碧云天生物有限公司;逆转录试剂盒、实时荧光定量PCR试剂盒购自日本TaKaRa公司;miRcute增强型miRNA cDNA第一链合成试剂盒、miRcute增强型miRNA 荧光定量检试剂盒(SYBR Green)、U6(RNU6B)引物购自北京天根生化科技有限公司;CCK-8试剂盒购自日本同仁化学研究所;miR-502模拟剂(mimic)和阴性对照(negative control,NC)、miR-502抑制剂(inhibitor)和阴性对照(negative control,NC)购自上海吉玛生物技术有限公司;荧光素酶报告基因检测试剂盒购自Promega公司;增强型ECL发光液购自上海天能生物有限公司;上皮细胞标志物E-钙黏蛋白(E-cadherin)、细胞迁移标志物基质金属蛋白酶2(MMP2)、增殖标志物增殖细胞核抗原(PCNA)抗体购自北京博奥森生物有限公司;间质细胞标志物波形蛋白(vimentin)、GAPDH抗体和辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自沈阳万类生物有限公司;所有引物均由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 细胞培养与处理 犬乳腺肿瘤转移细胞系CHMm和犬乳腺原发肿瘤细胞系CHMp细胞分别用含10%胎牛血清、100 U·mL-1青链霉素的DMEM高糖培养液,置于37 ℃,5%CO2细胞培养箱中培养,当细胞融合度在80%左右时,用0.25%胰蛋白酶消化传代,每2~3 d传代1次。取对数生长期细胞进行试验,使用Lipofectamine 2000试剂进行细胞转染,按照试剂盒说明书要求将mimic NC、miR-502 mimic、miR-502 inhibitor、inhibitor NC转入细胞。
1.2.2 RNA的提取及qRT-PCR检测 利用TRIzol法提取各试验细胞和组织中总RNA,Nanodrop分光光度计测定总RNA的纯度、浓度和完整性,根据逆转录试剂盒说明书将RNA逆转录为互补脱氧核糖核酸(cDNA);此外,根据逆转录试剂盒说明书将RNA反转录为miRNAs的cDNA第一链,以snRNAU6作为内参,miR-502引物设计由北京天根生物有限公司完成,参考miRNAs荧光定量试剂盒说明书利用qRT-PCR检测miR-502的表达。miR-502、E-cadherin、vimentin和GAPDH等引物序列详见表1。使用ABI荧光定量PCR仪进行扩增,反应体系20 μL,反应条件:95 ℃预变性30 s,95 ℃ 5 s、60 ℃ 30 s,共40个循环,计算各基因的相对表达量,其中U6和GAPDH作为内参对照,采用2-ΔΔCt法计算miR-502和相关基因的相对表达量。

表1 引物序列
1.2.3 CCK-8试验 取对数生长期的CHMm细胞接种于96孔板,培养12 h后,转染miR-502 mimic/inhibitor及其对照组(NC),分别于转染后24、48、72 h进行CCK-8检测,每孔加入10 μL CCK-8试剂,继续培养1 h。应用酶标仪检测450 nm波长下的每孔的吸光度值(OD)。
1.2.4 细胞迁移试验 取经转染miR-502后的各试验组细胞,用无血清DMEM培养基重悬各组细胞,计数使细胞密度为4×105·mL-1,分别取100 μL细胞悬液加入24孔内的Transwell小室上室内,下室加入600 μL含20%FBS的DMEM培养液,常规培养12 h,用镊子小心取出Transwell小室,用无钙的PBS液清洗3次,甲醇固定30 min,用0.1%结晶紫染色20 min,用棉签轻轻擦去上层未迁移细胞,PBS洗3次,在倒置显微镜下拍照观察细胞。
1.2.5 细胞侵袭试验 24孔内的Transwell小室上室内加入50 μL基质胶培养基混合物,37 ℃孵育1 h使其凝固,其他同“1.2.4”。
1.2.6 Western blot检测 收取处理48 h后的miR-502转染组及其对照组的细胞,用预冷的PBS洗涤2次。RIPA裂解液提取各组细胞总蛋白,BCA法测定其上清液中的蛋白质浓度,进行SDS-PAGE电泳80 V 30 min,120 V 60 min,然后湿转至PVDF膜上,在含5%脱脂奶粉溶液封闭2 h,蛋白条带分别用一抗(anti-rabbit-E-cadherin,1∶750;anti-rabbit-vimentin,1∶500;anti-rabbit-MMP2,1∶750;anti-rabbit-PCNA;1∶500;anti-rabbit-GAPDH,1∶1 000)进行4 ℃孵育过夜,PBS液漂洗3次,山羊抗兔辣根过氧化物酶标记的二抗HRP(1∶2 000)室温孵育2 h,TPST液漂洗3次后,加入ECL化学发光液显影,曝光,以GAPDH作为内参,应用凝胶成像软件扫描,通过Image J软件分析蛋白条带的灰度带。
1.2.7 双荧光素酶报告试验miR-502与RBMS1的靶向关系 通过TargetScan 8.0软件等预测miR-502与RBMS1之间存在互补的核苷酸序列。将含有miR-502结合位点RBMS1 3′-UTR序列克隆至荧光素酶报告基因质粒中,构建RBMS1野生型(RBMS1 3′-UTR WT)和突变型(RBMS1 3′-UTR MUT)载体,按照LipofectamineTM2000试剂盒说明书将miR-502 mimic/NC、pMIR-REPORT-3′UTR或pMIR-REPORT-con质粒以及Renilla luciferase pRL-TK内对照质粒共转染至CHMm细胞中,继续培养48 h,按照荧光酶试剂盒说明书步骤检测转染细胞的荧光素酶活性。
1.3 数据处理与统计分析
2 结 果
2.1 miR-502和RBMS1在犬乳腺肿瘤细胞中的转录水平
qRT-PCR检测犬乳腺肿瘤细胞中miR-502和RBMS1转录情况,结果如图1所示,与正常乳腺组织相比,CHMm细胞中miR-502的转录显著上调,差异极显著(P<0.01),miR-502在CHMp中转录上调,差异显著(P<0.05);而RBMS1在 CHMm细胞中转录水平显著下调,差异极显著(P<0.01),CHMp细胞中RBMS1的转录下调,差异显著(P<0.05)。
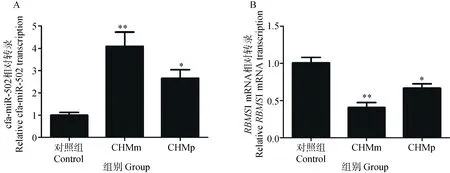
与对照组比较,*. P<0. 05,**. P<0. 01,下图同Compared with control group, *. P<0. 05,**. P<0. 01, the same as below图1 miR-502和RBMS1在犬乳腺肿瘤细胞和正常乳腺组织中的转录Fig.1 Relative transcription of miR-502 and RBMS1 in canine mammary tumor cells and normal mammary gland tissues
2.2 miR-502转染细胞模型的验证
构建miR-502 mimic/inhibitor的犬乳腺肿瘤细胞转染模型,利用qRT-PCR检测miR-502 mimic和miR-502 inhibitor的转染效果,与对照组(miR-NC)相比,转染miR-502 mimic 48 h后,CHMm和CHMp细胞中miR-502的转录水平显著增强(P<0.01);反之,转染miR-502 inhibitor 48 h后,CHMm和CHMp细胞中miR-502的转录水平显著降低(图2)。
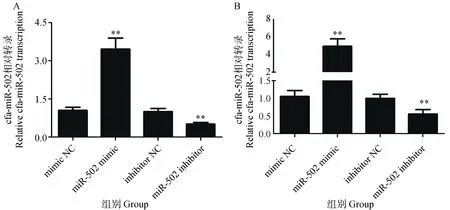
A. CHMp细胞; B. CHMm细胞A. CHMp cells; B. CHMm cells图2 犬乳腺肿瘤细胞转染miR-502后的转录检测Fig.2 Measurement of miR-502 transcription in canine mammary tumor cells after transfection of miR-502 mimic/inhibitor
2.3 转染miR-502后对犬乳腺肿瘤细胞增殖、迁移和侵袭的影响
转移是影响患犬预后不良的主要因素,基于前面的试验结果,miR-502在CHMm的转录水平显著高于CHMp,选择CHMm细胞进行后续试验。为明确转染miR-502后是否影响CHMm细胞增殖、迁移和侵袭,采用CCK-8和Transwell试验检测转染miR-502对CHMm细胞增殖、迁移和侵袭能力的影响。CCK-8试验结果显示,转染miR-502 mimic后,与对照组(mimic NC)相比,CHMm细胞的活力显著升高(P<0.01);反之,转染miR-502 inhibitor后,与对照组(inhibitor NC)相比,CHMm细胞的活力显著降低(P<0.01),如图3A;Transwell结果表明,转染miR-502 mimic后,与对照组(mimic NC)相比,CHMm细胞的迁移和侵袭能力显著升高;转染miR-502 inhibitor后,CHMm细胞的迁移和侵袭能力较对照组显著降低(图3B);结果表明,转染miR-502后可以调控犬乳腺肿瘤细胞的增殖、迁移和侵袭。
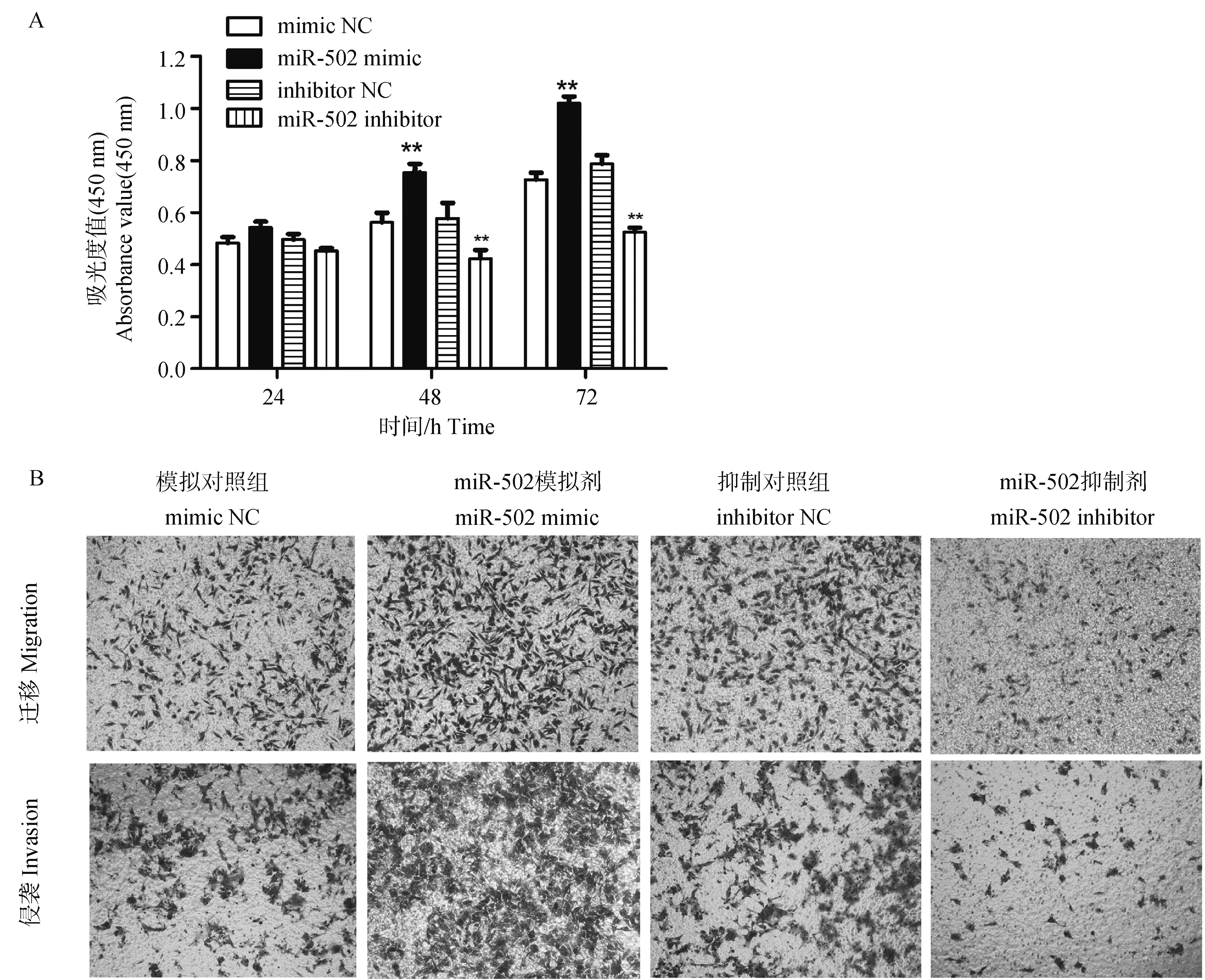
A.转染miR-502 mimic后促进CHMm细胞增殖,转染miR-502 inhibior抑制细胞增殖; B. 转染miR-502 mimic后促进CHMm细胞迁移和侵袭,转染miR-502 inhibior抑制细胞迁移和侵袭(200×)A. Transfection of miR-502 mimic promoted the proliferation of CHMm cells, whereas miR-502 inhibitor suppressed the proliferation of CHMm cells; B. The migration and invasion of CHMm cells were increased by transfection of miR-502 mimic, but suppressed by the transfection of miR-502 inhibitor (200×)图3 转染miR-502后对犬乳腺肿瘤CHMm细胞增殖、迁移和侵袭能力的影响Fig.3 Effects of miR-502 transfection on the proliferation, migration and invasion of canine mammary tumor CHMm cells
2.4 转染miR-502后对犬乳腺肿瘤细胞EMT相关基因的影响
肿瘤细胞迁移能力与细胞发生EMT有关。为明确miR-502抑制CHMm细胞迁移的作用是否与调控EMT有关,利用qRT-PCR检测转染miR-502后犬乳腺肿瘤细胞EMT相关基因的转录情况,结果显示(图4),与mimic NC组相比,转染miR-502 mimic后显著下调CHMm中上皮细胞标志物E-cadherin mRNA的相对转录水平(P<0.01),上调CHMm中间质标志物vimentin、MMP2、PCNAmRNA的相对转录水平(P<0.01),差异极显著。反之,与inhibitor NC组相比,转染miR-502 inhibitor后显著上调上皮细胞标志物E-cadherin mRNA的相对转录水平(P<0.01),显著下调间质标志物vimentin、MMP2、PCNAmRNA的相对转录水平(P<0.01),下调PCNAmRNA的相对转录水平(P<0.05)。
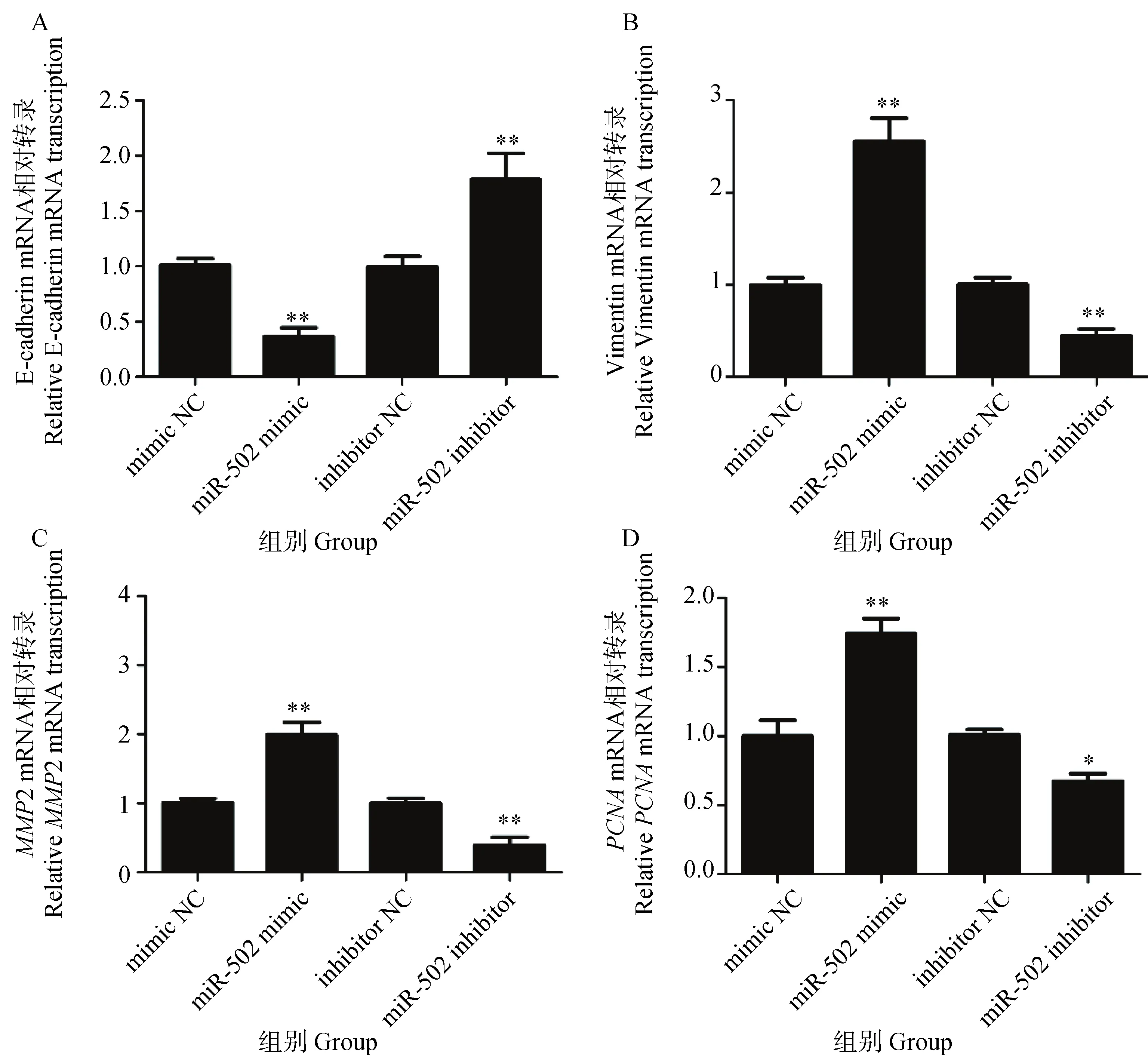
A. E-钙黏蛋白; B. 波形蛋白; C. 基质金属蛋白酶2; D. 增殖细胞核抗原 A. E-cadherin; B. Vimentin; C. MMP2; D. PCNA图4 转染miR-502对犬乳腺肿瘤CHMm细胞EMT相关基因转录的影响Fig.4 Effects of miR-502 on transcription of EMT-related mRNA in canine mammary tumor CHMm cells
2.5 转染miR-502后对犬乳腺肿瘤细胞EMT相关蛋白的影响
Western blot方法检测E-cadherin、vimentin、MMP2、PCNA蛋白表达含量的结果如图5所示,转染miR-502 mimic后CHMm细胞中E-cadherin蛋白的相对表达量显著低于mimic NC组(P<0.01),而vimentin和MMP2蛋白的相对表达量显著高于mimic NC组(P<0.01),PCNA 蛋白的相对表达量高于mimic NC组(P<0.05);反之,与inhibitor NC组相比,转染miR-502 inhibitor后显著升高CHMm中E-cadherin 蛋白的相对表达量(P<0.01),显著降低vimentin和MMP2蛋白的相对表达量(P<0.01),降低PCNA蛋白的相对表达量(P<0.05)。上述结果提示,转染miR-502后调控犬乳腺肿瘤CHMm细胞的EMT。
2.6 miR-502靶向负调控RBMS1表达
miRNA主要通过调节生物靶标发挥调控作用,利用生物信息学软件如miRDB、miRbase和Targetscan 8.0在线数据库初步预测分析RBMS1 3′-UTR可能为miR-502的候选靶标,miR-502和RBMS1 mRNA之间存在互补结合位点(图6A、6B和6D);qRT-PCR试验结果显示,与miR-NC组比较,miR-502 mimic组细胞中的RBMS1 mRNA相对转录水平显著降低,反之,miR-502 inhibitor组的RBMS1 mRNA相对转录被明显的上调(P<0.01)(图6C);进一步通过双荧光酶试验报告基因结果显示,与miR-NC组相比,miR-502与RBMS1 3′-UTR WT载体共转染细胞的荧光素酶活性显著降低(P<0.01),而与miR-502与RBMS1 3′-UTR MUT载体共转染细胞的荧光素酶活性无显著改变(图6E),结果表明,miR-502可以直接靶向结合RBMS1 的3′-UTR,调控RBMS1的表达。
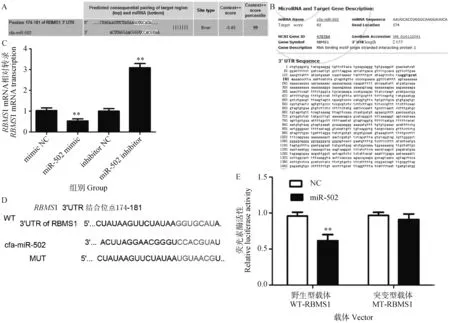
A、B、D. 利用miRDB、miRbase和Targetscan 8.0在线数据库预测分析RBMS1 3′-UTR和miR-502的序列; C. qRT-PCR检测miR-502 mimic、miR-502 inhibitor对RBMS1 mRNA转录的影响; E. 双荧光素酶报告试验验证miR-502与RBMS1的靶向关系A, B, D Using miRDB, miRbase, and Targetscan 8.0 online databases to predict and analyze the sequences of RBMS1 3′-UTR and miR-502; C. qRT-PCR was used to detect the effects of miR-502 mimic and miR-502 inhibitor on the transcription of RBMS1 mRNA; E. Verification of the targeting relationship between miR-502 and RBMS1 using dual luciferase reporter assay图6 miR-502与RBMS1的靶向关系Fig.6 Targeting relationship between miR-502 and RBMS1
3 讨 论
乳腺肿瘤由于其发病率高、治疗方法有限及预后不良,已经成为全世界主要的公共卫生问题[12]。犬与人类共享生活环境,犬与人乳腺肿瘤在发生、临床表现、诊断与治疗反应等方面具有相似之处,可作为研究乳腺肿瘤的模型[13-14]。迄今为止,乳腺肿瘤的诊断与治疗仍存在局限性,迫切需要进一步了解乳腺肿瘤发病机制,发现一些新颖的诊断标志物。
miRNA是一类调控基因表达的非编码单链小RNA,长度约含22个碱基的核苷酸,并可控制多种肿瘤细胞的功能,一些异常表达的miRNA影响人和犬乳腺肿瘤细胞的增殖、凋亡、侵袭及转移等生物学功能,可作为肿瘤性疾病诊断、预后和治疗靶点的潜在生物标志物[5,15]。研究发现,miRNA的差异表达与犬乳腺肿瘤的进展有关,如miR-124在犬乳腺肿瘤细胞中表达降低,miR-124通过靶向CDH2 3′-UTR区抑制犬乳腺肿瘤细胞的增殖、迁移和侵袭[16]。Zhang等[17]发现IRAK2被证明是miR-497的一个功能靶点,miR-497在犬乳腺癌细胞低表达,过表达miR-497能通过IRAK2/NF-κB轴抑制犬乳腺癌细胞的增殖、诱导细胞凋亡。miR-502位于染色体Xp11.23,是miRNA-500家族的成员,在许多不同的恶性肿瘤组织发挥作用,如人食管鳞状细胞癌、骨肉瘤、乳腺癌、膀胱癌等[18-21]。Liu等[20]发现miR-502在乳腺癌组织中的表达显著低于癌旁组织,且miR-502通过靶向组蛋白甲基转移酶(SET domain containin lysine methyltransferase,SET8)抑制乳腺癌细胞增殖、侵袭和EMT。Xu等[18]发现与正常组织相比,miR-502在食管鳞状细胞癌中表达上调,这种上调通过PI3K/AKT信号通路促进TE1细胞的增殖和抑制细胞凋亡。与此研究结果相似,在本试验中,与正常乳腺组织相比,犬乳腺肿瘤原发CHMp和转移CHMm细胞中miR-502表达上调,其中CHMm中miR-502表达最高,因此选定CHMm细胞进行下一步的生物功能学试验,通过细胞转染在CHMm细胞中干扰miR-502的表达,过表达miR-502后,增强CHMm细胞的增殖、迁移及侵袭能力,反之,抑制miR-502后,细胞的增殖、迁移及侵袭能力被抑制。相比miR NC组,miR-502 mimic可从基因和蛋白水平下调上皮细胞标志物E-cadherin的表达,上调CHMm细胞增殖标志物PCNA、细胞迁移标志物MMP2和间质细胞标志物vimentin的表达,转染miR-502 inhibitor相反。上述结果表明miR-502通过调控犬乳腺肿瘤CHMm细胞的增殖、迁移、侵袭和EMT,提示miR-502可为犬乳腺肿瘤的诊断、治疗提供潜在的靶点。
miRNA主要通过与靶基因的3′-非翻译区(3′-untranslated region,3′-UTR)结合,抑制翻译或增加mRNA降解来调节转录后基因表达,为进一步研究miR-502在犬乳腺肿瘤中发挥作用的下游靶基因,通过在线生物信息学网站预测发现,RBMS1是miR-502的潜在靶基因,具有特异性结合位点。先前的一些研究表明,RBMS1在各种恶性肿瘤类型中低表达,如前列腺癌组织和细胞中mRNA表达水平低于正常的前列腺细胞和组织,过表达RBMS1抑制前列腺癌细胞的增殖、克隆形成及迁移,人前列腺癌中过表达miR-106b显著降低RBMS1蛋白的表达,RBMS1作为miR-106b的潜在靶标[11];RBMS1在结肠癌肝转移的病人来源的异种移植小鼠模型中表达显著降低,敲低RBMS1促进转移能力增加,而恢复其表达会减弱转移性肝定植[22]。小鼠卵巢颗粒细胞(ovarian granulosa cell,OGC)和卵母细胞中miR-383可通过影响RBMS1 mRNA的稳定性抑制RBMS1作用,进而抑制c-Myc对GC雌二醇的释放作用[23]。本研究证实犬乳腺肿瘤细胞CHMm和CHMp中RBMS1的表达显著低于正常犬乳腺组织,转染 miR-502 mimic后可明显下调CHMm中RBMS1 mRNA的表达,反之,抑制miR-502可使RBMS1表达上调,此外,进一步证实miR-502可以通过RBMS1发挥调节作用,通过双荧光素报告基因试验验证了miR-502通过结合到RBMS1 mRNA 3′-UTR,转染miR-502 mimic后显著降低CHMm中野生型RBMS1荧光载体的荧光素酶活性,而对突变型RBMS1荧光载体的荧光素酶活性没有明显的变化,结果表明,miR-502可以靶向负调控RBMS1的表达,但miR-502通过调控RBMS1的表达影响犬乳腺肿瘤发生发展的具体机制还需进一步深入研究。
4 结 论
miR-502在犬乳腺肿瘤细胞CHMm和CHMp中表达上调,发挥癌基因的作用,促进CHMm细胞增殖、迁移及EMT,且miR-502靶向调控RBMS1基因的表达。
