PIWI相互作用RNA:结直肠癌诊断和预后的生物标志物
2023-10-29李雪婷李百祥
闻 杰,李雪婷,李百祥
哈尔滨医科大学公共卫生学院卫生毒理学教研室,黑龙江 哈尔滨 150081
结直肠癌是常见的恶性肿瘤之一。根据世界卫生组织国际癌症研究机构(IARC)的数据[1]:在2020 年,结直肠癌成为全球癌症死亡的第二大原因。其中,结直肠癌在我国癌症死亡原因中位居第5位,新增28万人死亡,每年新发病例达55万人,且结直肠癌发病年轻化趋势明显。因早期通常无症状且缺乏有效的检测手段,60%~70%的结直肠癌患者确诊时已是晚期。结直肠癌的早期发现是决定其预后的最重要因素。因此,探索结直肠癌的发生机制,识别新的标志物是结直肠癌早期诊断早期治疗的关键。最近研究表明,piRNA在血清/血浆与肿瘤组织中表达稳定且易于检测[2],异常表达的PIWI相互作用RNA(PIWI-interacting RNA,piRNA)与多种恶性肿瘤的发生密切相关,并在恶性肿瘤的分化、转移和预后不良中发挥重要作用。此外,在人类基因组中已经鉴定出超过2 万个piRNA,远远大于miRNA(2 000 个左右)的数量[3]。这表明piRNA可能是潜在的、有效的癌症诊断和预后的生物标志物。文章重点阐述了piRNA 的生物学功能和在结直肠癌发生发展中的新进展,以及piRNA 在结直肠癌诊断和预后中的新思路。
1 piRNA的概述
1.1 piRNA的特征与生物发生
人类基因组中估计含有约2 万个编码蛋白质的基因,约占基因组序列的2%。仅转录成RNA(约3 000 个)不编码蛋白质的基因被称为非编码RNA(non-coding RNA,ncRNA)[4]。这些ncRNA 主要包括小干扰RNA(siRNA)、微RNA(miRNA)、piRNA等(表1)。piRNA是一种长度约为26~30个核苷酸,能与来自Argonaut蛋白亚家族的PIWI蛋白结合,参与转座因子沉默与调节基因表达的小RNA[5]。最近,开发了许多生物信息学方法用于piRNA 鉴定,分析它们的功能,以及寻找同源piRNA 和piRNA 簇(表2)。piRNA 与其他小分子ncRNA 如siRNA 或miRNA相比,长度更长。其次,piRNA由少量长单链RNA 前体生成,这些前体通过RNaseⅢ型酶独立机制从不同的转座子转录而来,称为“piRNA 簇”[6]。最后,piRNA 在3′-端有2′-O-甲基修饰,在5′端有一个单磷酸基团,这表明其在不同物种中功能高度保守,具有抗氧化降解的能力,可作为一组有前景的肿瘤标志物[7]。piRNA的生物发生包括两种主要途径:一次扩增和二次扩增(也称为乒乓循环)[8]。这两种途径是对抗转座子强大防御功能的关键。在一次扩增途径中,长piRNA 前体从piRNA 簇中转录,在细胞质中被复杂因子切割和修饰,然后与PIWI蛋白复合物转运到细胞核中,产生的piRNA可能在调控基因表达中发挥作用[9]。次要piRNA在乒乓循环中形成,以特异性增强piRNA序列[10]。

表1 小的ncRNA的分类Table 1 Classification of small non-coding RNA

表2 piRNA数据库及其描述Table 2 piRNA database and its description
1.2 piRNA的生物学功能与调控机制
以往研究表明,piRNA/PIWI 通路通过DNA 甲基化参与转录基因沉默。DNA 甲基化是DNA 化学修饰的一种类型,是在不改变DNA碱基序列的情况下,由DNA 甲基转移酶介导的基因表达调控[11],它在长期基因沉默中起着重要作用,特别是在启动子区域[12]。DNA高甲基化会抑制基因的表达,DNA低甲基化则会激活基因的表达。DNA甲基化异常可能直接或间接导致肿瘤抑制因子失活[13],piRNA 可以通过调节DNA 甲基化参与疾病进展[14]。piRNA 与DNA甲基化之间的相互作用对基因组稳定性和基因表达具有深远影响,可能导致细胞信号转导通路的畸变,最终导致疾病的发生[15]。已有研究证明,piRNA 在水螅和人类等生物中抑制转座子动员[5]。转座子,被称为跳跃基因,它们通过将自身插入基因组的方式进行重排,转座子的不当插入可能会破坏基因组的稳定性和完整性,引起染色体易位、反转、复制和缺失,过度激活的转座子有很高的致病性[16]。piRNA簇含有很多转座子,piRNA可以和PIWI蛋白结合形成piRNA/PIWI 复合物(piRISC)。piRISC 通常被认为是“细胞的免疫系统”,因为它在整个基因组中调节转座子的表达水平[17],参与转录或转录后基因沉默。piRISC功能丧失或表达减少可通过转座子的不受限制作用诱导更大的基因组损伤,同时导致疾病相关基因的异常表达[18]。piRNA可以抑制转座子动员,通过表观遗传机制实现转录沉默,并通过形成piRISC参与转录后抑制,从而调控癌症进展[7]。
piRNA 介导的基因调控是通过多种方式进行的,如表观遗传机制和piRNA 在转录后水平介导的基因调控。其中,piRNA通过与RNA或RNA核酸内切裂解的相互作用,以及对mRNA 稳定性或选择性剪接。同样重要的是,在生理和病理环境下,干扰RNA/piRNA 样(iRNA/piRNA-L)可能通过与蛋白质编码基因的直接联系参与基因表达的翻译或翻译后调控[19]。此外,piRNA和PIWI蛋白在生殖干细胞中高度富集,参与生殖细胞发育、干细胞维持、减数分裂等。癌症干细胞处于异常的“干细胞”状态,参与癌症的发生,并与癌细胞的侵袭和转移密切相关。癌症干细胞中的转录信号、表观遗传状态和信号通路与干细胞中相类似。一些关键的信号通路,包括Wnt/β-catenin和Hedgehog通路,在癌症干细胞中可能被异常调节[20]。因此,piRNA 可能是癌症预后和诊断的潜在生物标志物。
2 piRNA与肿瘤
许多研究表明,piRNA参与了多种癌症的发生,并在癌组织和非癌组织中差异表达,包括胃癌、乳腺癌和结直肠癌等[21]。然而,piRNA 在不同类型癌症中的作用可能是复杂的(抑癌或促癌)。piR-823是最重要的piRNA之一,其在肝细胞癌、乳腺癌、结直肠癌等[21]几种癌症中显著上调并促进癌症进展。然而,piR-823在胃癌组织中表达下调,piR-823高表达模型中胃癌细胞的生长受到抑制,这表明piR-823抑制胃癌的发展[22]。同时,它被发现在肾细胞癌组织中下调,但矛盾的是它与较差的预后呈正相关,这表明piR-823 在肾细胞癌中发病机制的复杂性[23]。除此之外,piR-651 也是研究较多的piRNA 之一。它在经典霍奇金淋巴瘤[24]、胃癌、肺癌、肝细胞癌、乳腺癌和结直肠癌等几种癌症中都显著上调[21]。与piR-823不同的是,piR-651在胃癌的发展中具有促进作用。piR-651 抑制剂(拮抗剂)可以抑制胃癌细胞的细胞周期[25]。值得注意的是,虽然piR-651在经典霍奇金淋巴瘤患者样本中过表达,但低水平的piR-651与患者预后差有关。综上,piRNA在不同类型癌症中的作用可能具有特异性。现已发现,piRNA可能通过PI3K/PTEN/Akt/mTOR和Ras/Raf/MEK/ERK 这两条通路参与癌症的进展[26]。piRNA 的异常表达很可能导致癌细胞机制失衡,从而引起细胞凋亡减少、增殖增加以及侵袭和转移增加,导致癌症发展。因此,探索癌症发生中相关的piRNA 及其分子机制,可以为癌症诊断与预后研究提供新的手段。
3 piRNA 作为结直肠癌诊断与预后生物标志物的价值
目前,在结直肠癌中发现了一些异常表达的piRNA,如piR-823、piR-1245和piR-54265等(图1)。这些异常表达的piRNA 与结直肠癌诊断与预后密切相关。越来越多的研究表明在诊断结直肠癌方面,piRNA 比常用的结直肠癌生物标志物,如CEA和CA19-9更敏感[27-28],且在反复冻融或长期室温环境下,有些piRNA 在血清和血浆样本中表现出高稳定性[2]。此外,piR-017724和piR-1245等少数piRNA表达异常与结直肠癌晚期和整体临床表现不佳相关[2,29]。因此,piRNA有成为结直肠癌诊断与预后生物标志物的潜力,甚至成为结直肠癌的治疗靶点。
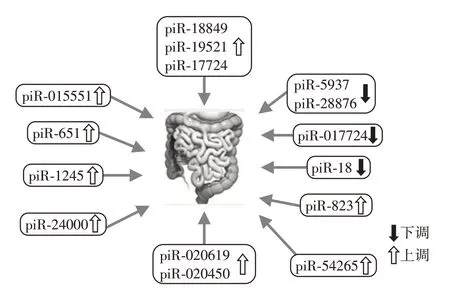
图1 结直肠癌中异常表达的piRNAFigure 1 Abnormal expression of piRNA in colorectal cancer
3.1 piRNA作为结直肠癌诊断生物标志物的价值
3.1.1 piR-020619和piR-020450
结直肠癌患者血清中piR-020619和piR-020450的表达水平明显高于健康对照组[28],piRNA 的激活可能参与了结直肠癌发病。联合使用这两种piRNA的诊断性能较好。灵敏度高于常用的结直肠癌生物标志物(CEA 和CA19-9)。最后,在胃癌、肺癌和乳腺癌患者的血清中发现piR-020619和piR-020450的表达水平与正常对照组相似,证明这两种piRNA对结直肠癌诊断具有一定特异性[28]。
3.1.2 piR-823
在血浆和癌细胞系中已经鉴定出piR-823,其被认为是调节恶性肿瘤相关的piRNA 之一[30]。高表达的血清piR-823 与结直肠癌晚期(Ⅲ期和Ⅳ期)、淋巴结转移、分化较差有关[30]。piR-823在结直肠癌发展中有多种机制。第一种机制是piRNA/PIWI 复合物2 磷酸化STAT3,通过STAT3/BCLx1/cyclinD1信号通路,可能使细胞周期蛋白依赖性激酶抑制剂(CDKI)表达,从而控制G1 期的进展。另一种是通过“翻译后机制”,使热休克蛋白表达增加,从而抑制细胞凋亡和促进增殖,发挥促瘤作用[30]。piR-823的诊断性能较好[30],受试者工作特征曲线(ROC 曲线)显示,piR-823诊断结直肠癌的特异度为89.3%,灵敏度为83.3%,曲线下面积为0.933(P<0.001),结直肠癌患者血清中piR-823的表达与癌变组织表达呈正相关(相关系数为0.929,P<0.001)。这些研究支持piR-823作为结直肠癌诊断的无创生物标志物。
3.1.3 piR-54265
piR-54265 在结直肠癌中表达上调,其表达水平与患者耐药和预后不良有关,是结直肠癌的致癌piRNA[31]。功 能研究表明,piR-54265 可以结合PIWIL2 蛋白,并通过激活STAT3 信号通路起作用,促进结直肠癌细胞的增殖和转移[31]。此外,血清piR-54265比临床常用的结直肠癌生物标志物CEA、CA19-9 和CA125 对结直肠癌的检测更敏感,该piRNA稳定存在于患者血清中[27]。与对照组和其他类型癌症患者相比,发现只有结直肠癌患者血清piR-54265 的水平升高[27],表明血清piR-54265 在结直肠癌诊断中具有一定特异性。这些发现支持血清piR-54265作为结直肠癌早期诊断的生物标志物。
3.1.4 piR-24000
与邻近正常组织相比,piR-24000 在结直肠癌组织中的表达明显升高,为结直肠癌中的致癌基因[32]。piR-24000 过表达与侵袭性结直肠癌表型有很大相关性。piR-24000诊断的ROC曲线下面积为0.818(95%CI 为0.752~0.883,灵敏度为93.1%,特异度为68.97%,P<0.001)[32]。数据显示,piR-24000可以作为结直肠癌潜在的诊断标志物。但是,这种piRNA 的特异性相对较低,与其他相关的生物标志物联合使用为宜。
3.1.5 piR-5937和piR-28876
piR-5937 和piR-28876 在结肠癌患者的血清样本中显著下调,与目前使用的生物标志物CEA 和CA19-9相比,它们在检测结肠癌方面具有更高的灵敏度[33]。此外,术后1 个月患者血清样本中两种piRNA 的表达水平均显著升高。提示piR-5937 和piR-28876 可作为早期结肠癌检测的非侵入性生物标志物,也可以作为手术治疗后监测患者的潜在手段。
3.1.6 piR-18
piR-18 在结直肠癌和结直肠癌细胞系中的表达低于邻近组织和正常肠黏膜上皮细胞,这表明,piR-18 可能在结直肠癌中发挥抑制作用[34]。实验证明,piR-18 过表达可以抑制结直肠癌细胞系(SW480、LOVO)的增殖、侵袭以及迁移。上调piR-18表达是结直肠癌治疗的新思路,piR-18 有望成为新的诊断和治疗结直肠癌的生物标志物。
3.2 piRNA作为结直肠癌预后生物标志物的价值
3.2.1 piR-823
过表达的piR-823与结直肠癌患者较差的总生存率有关,抑制piR-823 可以显著抑制结直肠癌细胞的增殖[35]。机制研究表明,piR-823 通过G6PD/HIF-α通路调控结直肠癌细胞的增殖、侵袭和凋亡,为有前景的结直肠癌预后生物标志物。
3.2.2 piR-001311、piR-004153、piR-017723、piR-017724和piR-020365
研究发现,诊断结直肠癌的5个piRNA组合(包括piR-001311、piR-004153、piR-017723、piR-017724和piR-020365)在肿瘤患者中差异表达[2]。此外,组合piRNA 的诊断潜力优于CEA 和CA19-9,血清piRNA的稳定性较好。低水平血清piR-017724与患者生存期较差有关,可能是结直肠癌的独立预后因素,有作为结直肠癌预后生物标志物的潜力[2]。
3.2.3 piR-18849、piR-19521和piR-17724
与邻近非肿瘤组织相比,结直肠癌组织中piR-18849、piR-19521 和piR-17724 的表达水平升高[36]。高表达piR-18849 与淋巴结转移相关。此外,piR-18849 和piR-19521 的表达上调与肿瘤分化程度较差有关[36],提示这两种piRNA 在结直肠癌发生中起调控作用,piR-18849 和piR-19521 可能成为结直肠癌患者预后的生物标志物。
3.2.4 piR-1245
在结直肠癌中,piR-1245的表达上调,起促癌作用[29]。piR-1245的表达水平与结直肠癌细胞的增殖率呈正相关。在结直肠癌细胞中,抑制piR-1245可以激活p53 通路,从而抑制细胞增殖,诱导细胞坏死和凋亡。piR-1245 影响癌症相关基因,通过抑制几种肿瘤抑制基因的RNA水平发挥致癌作用,包括B-细胞易位基因1(BTG1)、人尿苷磷酸化酶1(UPP1)、激活转录因子3(ATF3)等在内的9个功能相关的癌症基因[29]。结直肠癌患者预后不良与piR-1245 表达上调有关,piR-1245 高表达患者的总生存期较短。由此表明,piR-1245 是结直肠癌患者可靠的预后生物标志物。
4 结语
综上所述,piRNA 在结直肠癌组织与血清中异常表达,提示piRNA 可能调控了结直肠癌的发生发展。此外,piRNA 诊断性能优于常用生物标志物,piRNA 高表达患者的总生存期较短。由此我们认为piRNA 为结直肠癌诊断与预后提供了新的可能。但总的来说,目前对这些piRNA 在结直肠癌中的研究仍处于起步阶段,在临床实践中,建立新的基于piRNA 的预后或诊断程序仍存在大量障碍。未来对piRNA 在结直肠癌中的研究,需要关注以下几方面:①深入对piRNA 在结直肠癌发病调控机制的研究;②确定结直肠癌中piRNA 的整体表达谱;③增加实验所用结直肠癌临床监测样本量;④尽可能增加结直肠癌样本深度测序的数量。相信随着多组学、测序等技术的进步,piRNA作为结直肠癌诊断和预后生物标志物的价值会得到全面和更深入的评估。
