虾肝肠胞虫水通道蛋白基因EHP00_492 的克隆与表达特征分析
2023-10-29李晨曦吴慧欣吴玉娇孟宪志潘国庆龙梦娴
李晨曦,吴慧欣,2,吴玉娇,陈 洁,孟宪志,潘国庆,龙梦娴
(1.西南大学资源昆虫高效养殖与利用全国重点实验室/微孢子虫感染与防控重庆市重点实验室,重庆 400715;2.西南大学蚕桑纺织与生物质科学学院,重庆 400715)
【研究意义】凡纳滨对虾原产于太平洋沿岸,目前是我国主要的对虾养殖品种之一,年产量可高达百万吨[1]。但凡纳滨对虾常遭受病毒、细菌和真菌等病原感染,给全球对虾养殖业造成严重经济损失[2]。2004 年泰国新发现了一种对虾病原,2009 年鉴定为微孢子虫,命名为虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)。EHP 主要感染对虾肝胰腺,通过影响宿主免疫和代谢,抑制对虾正常生长发育甚至危及存活率[3-5]。2013年我国首次检出EHP,至今已传播至各大养殖区,极大地威胁国内对虾养殖业的健康发展[6-8]。迄今已发现200 多属、1 700 多种微孢子虫[9-11],它们具有相似且特殊的侵染方式,即适宜环境条件下,刺激微孢子虫发芽,极管迅速弹出,病原性孢原质通过此中空管道运输至宿主细胞内。研究发现,水通道蛋白参与激活微孢子虫发芽[12-14]。为有效防控虾肝肠胞虫,揭示其侵染机制显得尤为重要。【前人研究进展】水通道蛋白作为细胞膜上的跨膜蛋白,参与水和小分子溶质跨膜的双向运输,几乎存在于所有生物中。水通道蛋白以四聚体形式存在,每个单体都会形成具有高度选择性的中空通道以运输合适分子。目前,已发现300 多种不同的水通道蛋白,其中人的水通道蛋白有13 种亚型,分别是AQP0~AQP12[15]。水通道蛋白由6 个α-螺旋跨膜结构域组成,具有2 个保守基序NPA(Asn-Pro-Ala)、5 个环结构(A~E 环),汞离子通过作用于E 环上NPA 基序前的半胱氨酸位点可逆地抑制水通道蛋白功能[16-17]。Frixione 等[14]利用HgCl2处理按蚊微孢子虫(Nosema algerae),发现HgCl2可显著抑制按蚊微孢子虫发芽,推测水通道蛋白参与按蚊微孢子虫的发芽过程。2006 年Ghosh 等[18]从兔脑炎微孢子虫(Encephalitozoon cuniculi)中鉴定到首个微孢子虫水通道蛋白EcAQP,其具有保守的水通道蛋白序列特征,将其编码基因转染至非洲爪蟾卵母细胞中异源表达,发现该卵母细胞的通透性显著增加,表明EcAQP 具有促进水渗透的功能。Chen 等[19]从家蚕微孢子虫(Nosema bombycis)基因组中克隆得到NbAQP,发现NbAQP蛋白定位于成熟孢子的孢壁,并且NbAQP 抗体能有效抑制孢子发芽率,进一步证实了水通道蛋白在微孢子虫发芽中发挥重要功能。【本研究切入点】目前虾肝肠胞虫全基因序列测序分析已经完成[20],但有关EHP 水通道蛋白的研究尚未见报道。鉴于此,本研究以虾肝肠胞虫水通道蛋白EHP00_492 为试验对象,对其编码基因进行克隆,预测其蛋白质的序列与结构特征,分析该蛋白在EHP 成熟孢子中的表达定位特征。【拟解决的关键问题】本研究从虾肝肠胞虫EHP 的cDNA 中克隆EHP00_492基因;通过生物信息学方法分析其编码蛋白的序列特征、三维结构特征及其与同源蛋白间的亲缘关系;构建重组表达载体pCold-TF-EHP00_492,转化大肠杆菌异源表达,纯化重组蛋白并制备多克隆抗体;分析EHP00_492在EHP 成熟孢子中的表达及亚细胞定位特征,以期为EHP 水通道蛋白的功能研究奠定基础。
1 材料与方法
1.1 试验材料
试验于2021—2022 年在西南大学资源昆虫高效养殖与利用全国重点实验室开展。供试的感染EHP 与未感染EHP 的凡纳滨对虾均购自重庆市合川区和铜梁区的养殖池塘,新西兰实验兔购自重庆恩斯维尔生物科技有限公司;大肠杆菌Escherichia coliDH5α 和Rosetta 感受态细胞购自重庆灵精生物科技有限公司,pCold-TF 表达质粒由本实验室保存;PrimeSTAR DNA 聚合酶、XhoI 和PstI 限制性内切酶、IPTG、脱脂奶粉购自Takara Bio 公司,425-600 μm 玻璃珠、弗氏佐剂、DAPI 细胞核染料、HRP 标记山羊抗兔IgG、Triton X-100购自Sigma-Aldrich公司,Alexa Fluor®594 山羊抗兔荧光二抗购自Invitrogen 公司,TF-tag 兔多克隆抗体购自迅检(重庆)生命科技有限责任公司;DNA 胶回收试剂盒、Total RNA提取试剂盒、质粒抽提试剂盒购自Omega Bio-Tek 公司,一步法快速克隆试剂盒购自上海翊圣生物公司;PMSF、考马斯亮蓝染色液、Wheat Germ Agglutinin(WGA-488)购自碧云天生物技术有限公司。
1.2 试验方法
1.2.1 引物设计与合成 根据虾肝肠胞虫水通道蛋白编码基因EHP00_492序列(GenBank No.MNPJ01000023.1: 89 904~90 632,729 bp),使用Primer 5.0 软件设计特异性引物。用于RT-PCR 的引物对,EHP00_492-F1序列:5′-ATGCAAGTCAGTAAAAAATTAATAG-3′,EHP00_492-R1 序列:5′-TTATTTAAACAACAAAA ATACTTG-3′;用于克隆的引物对,EHP00_492-F2 序列:5′-GGCATATGGAGCTCGGTACCCTCGAG ATGCAAGTCAGTAAAAAATTAATAG-3′(下划线为XhoI 酶切位点),EHP00_492-R2序列:5′-GCAGAGATTACCTATCTAGACTGCAGTTATTT AAACAACAAAAATACTTG-3′(下划线为PstI 酶切位点)。引物由生工生物工程(上海)股份有限公司合成。
1.2.2 RNA 提取和RT-PCR 采用RT-PCR 方法克 隆EHP00_492基因。取 约1×106个EHP 孢子,按照RNA 提取试剂盒说明书提取RNA,并利用逆转录试剂盒将总RNA 逆转录为cDNA。以cDNA 为模板、EHP00_492-F1/R1 为引物,通过PCR 扩增EHP00_492基因。PCR 反应体系:PrimerSTAR DNA(2×)聚合酶 25 μL,引物 0.2 μmol/L,cDNA 1 μL,ddH2O 补足至50 μL。PCR反应条件:98 ℃ 3 min;98 ℃ 20 s、50 ℃ 20 s、72 ℃ 10 s,35 个循环;72 ℃ 10 min。采用1%琼脂糖凝胶电泳分析PCR 产物,并送生工生物工程(上海)股份有限公司进行测序。
1.2.3 生物信息学分析 通过NCBI(http://ncbi.nlm.nih.gov/)完成序列检索并利用微孢子虫数据库(https://microsporidiadb.org/micro/app/)进行基因座位分析;利用ExPASy(https://web.expasy.org/protparam/)进行分子量、氨基酸数量和等电点等特征预测;利用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)进行蛋白信号肽预测;利用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)进行蛋白潜在磷酸化位点预测;利用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)进行蛋白二级结构预测;利用SMART(http://smart.embl-heidelberg.de/)进行蛋白质功能域预测;利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)进 行跨膜结构域预测;利用MAFFT(https://mafft.cbrc.jp/alignment/server/index.html)进行微孢子虫与不同物种之间水通道蛋白的多重序列比对;利用AlphaFold 软件进行蛋白质三维结构预测与比对;利用MEGA 7.0 软件基于Neighbor-Joining 法构建系统发育树。
1.2.4EHP00_492重组质粒构建 将pCold-TF载体质粒进行XhoI 和PstI 双酶切,酶切反应体系:限制性内切酶各3.5 μL,CutSmart buffer 5 μL,模板1~5 μg,ddH2O 补足至50 μL。酶切反应条件:37 ℃下孵育20 min。将酶切产物进行琼脂糖凝胶电泳并割胶回收。使用EHP00_492-F2/R2 引物扩增EHP00_492片段,反应体系:PrimerSTAR DNA 聚合酶 25 μL,引物 0.2 μmol/L,模板1 μL,ddH2O 补足至50 μL。反应条件:98 ℃ 3 min;98 ℃ 20 s、50 ℃ 20 s、72 ℃ 10 s,35 个循环;72 ℃ 10 min,扩增产物进行琼脂糖凝胶电泳并割胶回收。根据一步法克隆试剂盒的操作说明将4 μL 载体与6 μL 外源片段进行连接,连接酶10 μL,50 ℃孵育20 min。将连接产物转化至E.coliDH5α 感受态细胞中,并涂布于含有氨苄青霉素的LB 培养基过夜培养。挑取单菌落提取质粒进行PCR 和双酶切验证,并送至生工生物工程(上海)股份有限公司测序。
1.2.5 EHP00_492 异源蛋白表达、纯化及其兔多克隆抗体制备 将测序正确的pCold-TFEHP00_492重组质粒转化至表达菌株E.coliRosetta 中,添 加0.5 mmol/L IPTG诱导,收 集菌体进行破碎,使用Ni-NTA 亲和层析柱纯化rEHP00_492 重组蛋白。纯化后的rEHP00_492 蛋白与佐剂混合后免疫新西兰实验兔,制备兔多克隆抗体。
1.2.6 EHP 孢子总蛋白提取 取约1×106个EHP成熟孢子,加入1×PBS 300 μL、PMSF 20 μL 和425~600 μm玻璃珠0.4 g混合进行破碎,破碎条件:6 m/s,30 s/轮,6 轮/次,每轮间歇10 s,共破碎3 次。离心后的上清即为EHP 孢子总蛋白。
1.2.7 蛋白免疫印记(Western blot)将EHP 孢子总蛋白进行SDS-PAGE 电泳后,电转至PVDF膜。将PVDF 膜于37 ℃下封闭1~2 h;分别利用EHP00_492 兔多克隆抗体和TF-tag 兔多克隆抗体室温下孵育PVDF 膜1 h,利用羊抗兔IgG 二抗室温下孵育PVDF 膜45 min。采用化学发光成像仪(Azure Biosystems C300)对PVDF膜进行曝光、成像。
1.2.8 间接免疫荧光实验(Indirect immunofluorescence assay,IFA)将EHP 孢子涂布于包被0.01%(V/V)多聚赖氨酸的载玻片上,滴加4%(V/V)多聚甲醛固定样品,加入1%(V/V)Triton X-100 处理20 min;加入IFA 封闭液于室温下孵育1 h,分别加入EHP00_492 兔多克隆抗体和TF-tag 兔多克隆抗体于室温下孵育1 h,加入Alexa Fluor®594山羊抗兔荧光二抗于室温下避光孵育1 h;加入DAPI 和Wheat Germ Agglutinin(WGA-488)于室温下避光染色20 min,使用激光共聚焦显微镜(OLYMPUS FV1000)观察结果。
2 结果与分析
2.1 EHP00_492 基因座位保守性分析
通过6 种微孢子虫同源基因座位保守性分析发现,虾肝肠胞虫EHP00_492与毕氏肠胞虫EBI_27080、黄道蟹微孢子虫ECANGBI_2177、兔脑炎微孢子虫ECU07_0740、肠脑炎微孢子虫Eint_070680和海伦脑炎微孢子虫EHEL_070710同源基因及其邻近基因座位相当保守(图1),推测这些基因行使相似且保守的功能。兔脑炎微孢子虫ECU07_0740 已被鉴定具有水通道蛋白的功能[18],推测EHP00_492是虾肝肠胞虫水通道蛋白编码基因。
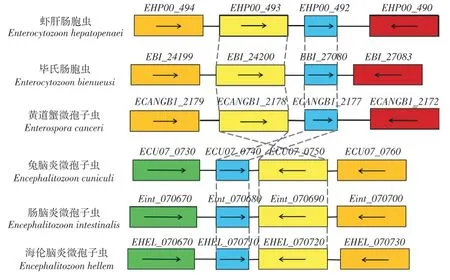
图1 EHP00_492 同源基因座位保守性分析Fig. 1 Conservation analysis of EHP00_492 homologous gene locus
2.2 EHP00_492 基因克隆
提取EHP 总RNA,反转录cDNA,以cDNA为模板,采用EHP00_492-F1/R1 引物进行RTPCR 扩增。电泳结果(图2)显示,约750 bp 处有1 条特异性扩增条带;经测序可知,RT-PCR扩增条带的序列与EHP00_492全长序列一致,表明该基因无内含子。
2.3 EHP00_492 序列特征
EHP00_492 含有242 个氨基酸,预测分子量为25 kD。经预测EHP00_492 无信号肽,但具有多个丝氨酸和苏氨酸磷酸化修饰位点。利用PSIPRED 对EHP00_492 的二级结构进行分析,结果(图3)表明该蛋白具有8 个α 螺旋和多个无规则卷曲。TMHMM 分析发现,EHP00_492 中12~31 aa、41~60 aa、91~113 aa、133~155 aa、176~198 aa、218~240 aa 的位置存在6 个跨膜结构域(图4)。SMART 预测结果(图5)显示,EHP00_492 含有1 个保守的水通道蛋白家族结构域(2~236 aa)。比较EHP00_492 与不同微孢子虫同源蛋白发现,它们都富含亮氨酸,等电点偏酸性,均含有6~8 个跨膜结构域(表1)。
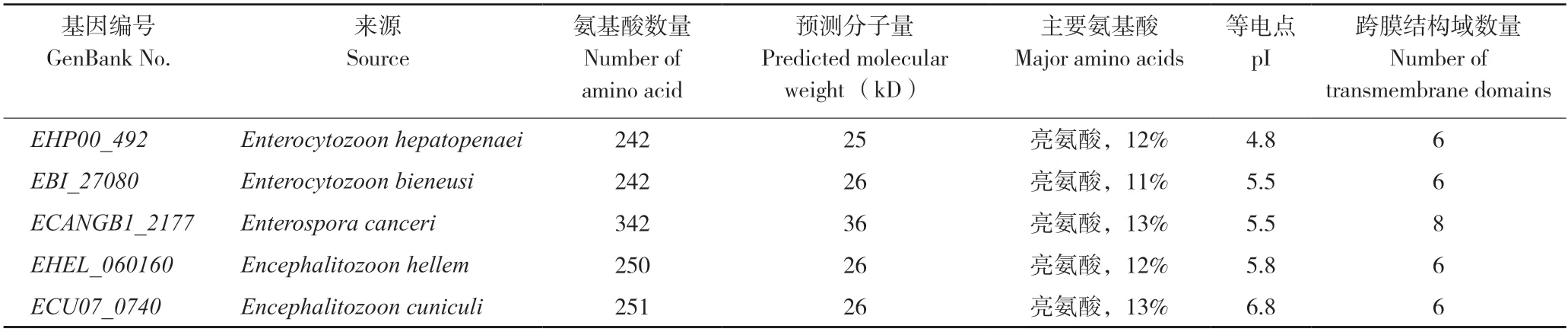
表1 EHP00_492 同源蛋白序列特征比较Table 1 Comparison sequence characteristics of EHP00_492 and homologous proteins

图3 EHP00_492 二级结构特征分析Fig. 3 Analysis of the secondary structure of EHP00_492
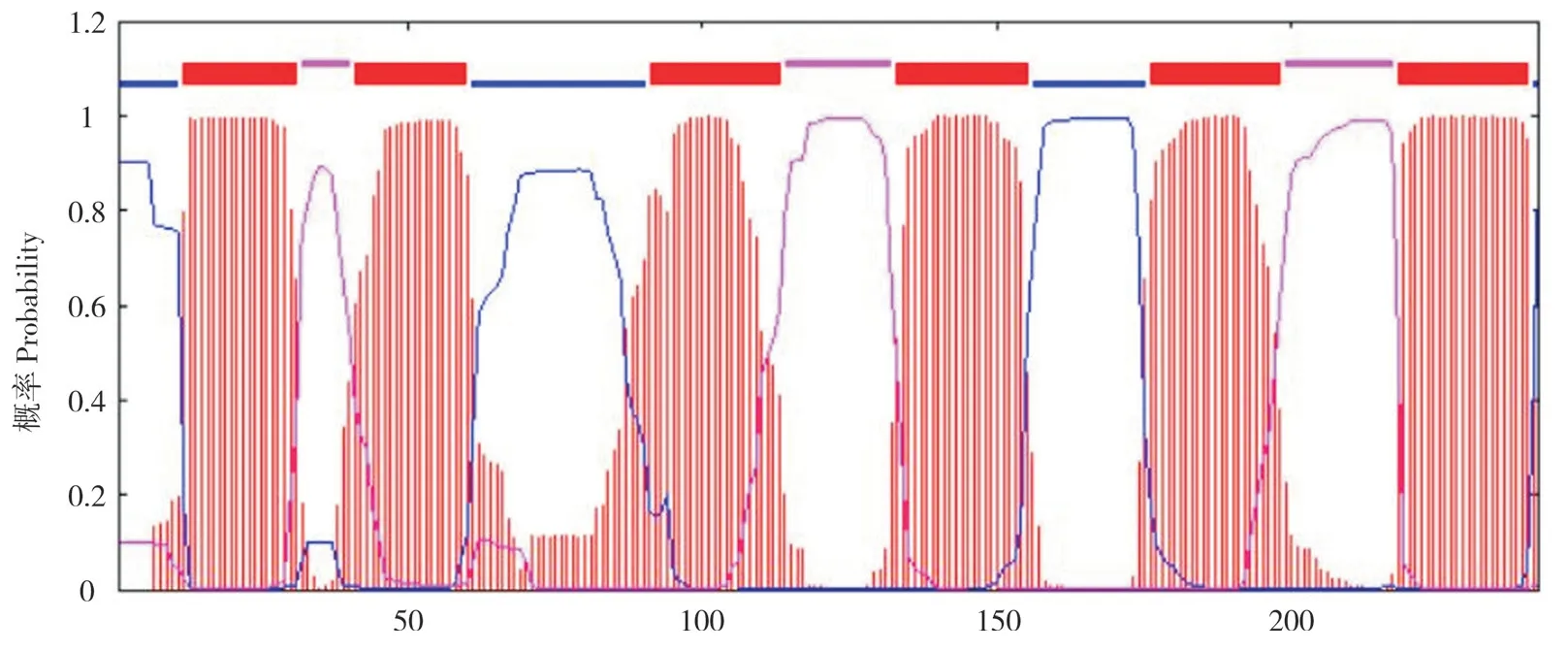
图4 EHP00_492 跨膜域预测Fig. 4 Prediction for the transmembrane domain of EHP00_492

图5 EHP00_492 功能结构域分析Fig. 5 Analysis of the function domain of EHP00_492
2.4 EHP00_492 序列保守性与同源蛋白亲缘进化关系分析
BlastP 比对结果(图6)发现,EHP00_492与毕氏肠胞虫EBI_27080 序列相似性最高,为74%;与兔脑炎微孢子虫ECU07_0740、海伦脑炎微孢子虫EHEL_070710、肠脑炎微孢子虫Eint_070680 序列相似性介于46%~48%之间;多重序列比对发现,EHP00_492 与其他同源蛋白均存在2 个水通道蛋白的保守基序NPA/G,分别位于69~71 aa 和201~203 aa 处,且呈对称分布。系统进化树分析结果(图7)发现,EHP00_492 与毕氏肠胞虫水通道蛋白EBI_27080 聚为一支;相比于人水通道蛋白NP932766.1 和对虾水通道蛋白ROT75608.1,微孢子虫来源的水通道蛋白与酵母水通道蛋白ADC55558.1 的进化关系更近。

图6 EHP00_492 同源序列比对Fig. 6 Alignment analysis of EHP00_492 and homologous sequences
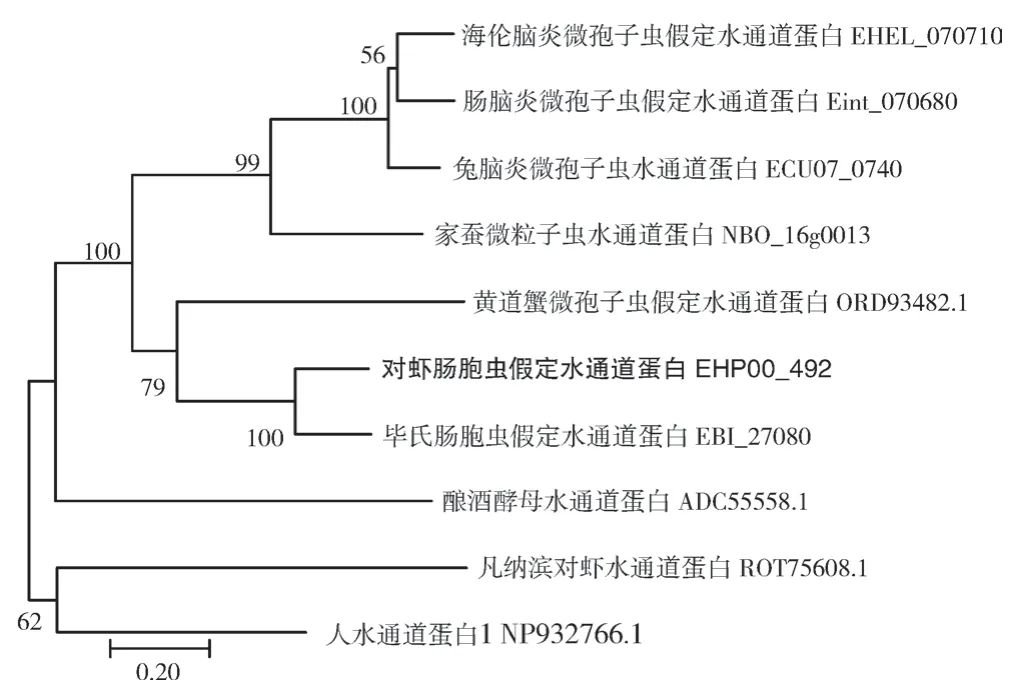
图7 EHP00_492 系统进化树分析Fig. 7 Phylogenetic tree analysis of EHP00_492
2.5 EHP00_492 蛋白三维结构预测
利用AlphaFold 软件预测EHP00_492 蛋白的三维结构(图8),并与已完成功能鉴定的
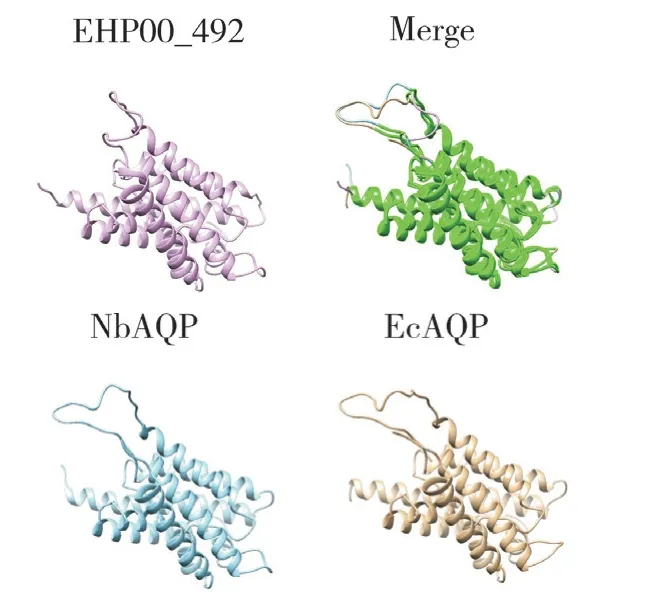
图8 EHP00_492 与NbAQP 和EcAQP 三维结构比对Fig. 8 Comparison the three-dimensional structure of EHP00_492,NbAQP and EcAQP
家蚕微粒子虫水通道蛋白NbAQP(GenBank No.NBO_16g0013)和兔脑炎微孢子虫水通道蛋白EcAQP(GenBank No.ECU07_0740)的三维结构比对,发现3 个蛋白质在10~32 aa、42~126 aa、129~160 aa、172~242 aa 处存在重叠,暗示其蛋白功能的保守性。
2.6 EHP00_492 蛋白的表达特征
将pCold-TF-EHP00_492重组表达质粒转化E.coliRosetta 菌株中,IPTG 诱导后获得大量rEHP00_492 重组蛋白,利用Ni-NTA 亲和层析柱纯化后,SDS-PAGE 检测发现100 mmol/L 咪唑能纯化出质量较高的rEHP00_492 重组蛋白,分子量大小约为75 kD,与预测分子量大小一致(图9 A)。将rEHP00_492 重组蛋白免疫新西兰实验兔制备EHP00_492 兔多克隆抗体。通过蛋白免疫印记分析EHP00_492 在EHP 中的表达特征,结果(图9 B)显示,与阴性对照pCold-TF 抗体相比,EHP00_492 兔多克隆抗体可在EHP 天然总蛋白中识别1 条大小约21 kD 的条带,表明EHP00_492在EHP 中能表达,其分子量大小为21 kD。
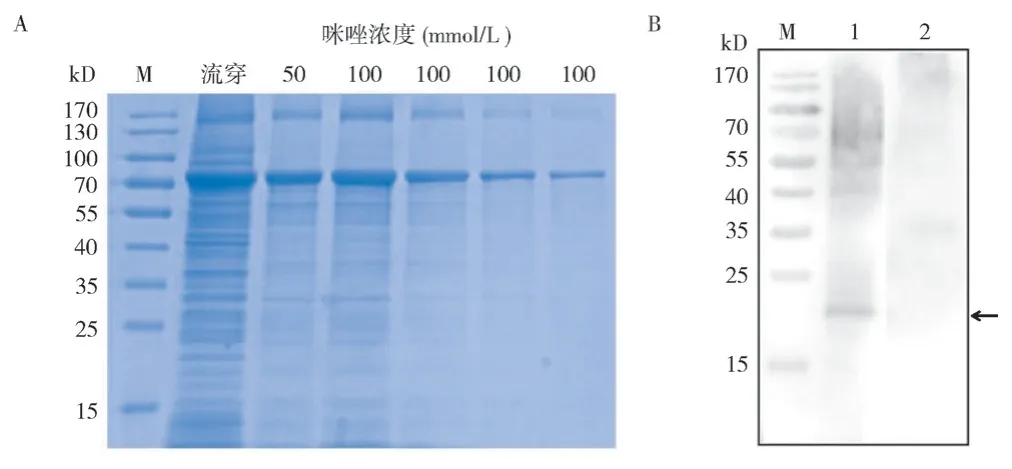
图9 EHP00_492 蛋白的纯化与表达特征Fig. 9 Purification and expression characteristics of EHP00_492
2.7 EHP00_492 亚细胞定位特征
为进一步分析EHP00_492 的亚细胞定位特征,利用麦胚芽凝集素WGA-488 特异性标记EHP 成熟孢子孢壁上的几丁质,结果(图10)发现,与对照组相比,红色荧光标记的EHP00_492兔多克隆抗体能特异性识别EHP 成熟孢子中的EHP00_492 蛋白,并且红色荧光信号与绿色荧光标记的WGA-488 信号存在共定位现象,表明EHP00_492 蛋白定位于EHP 成熟孢子的孢壁上。
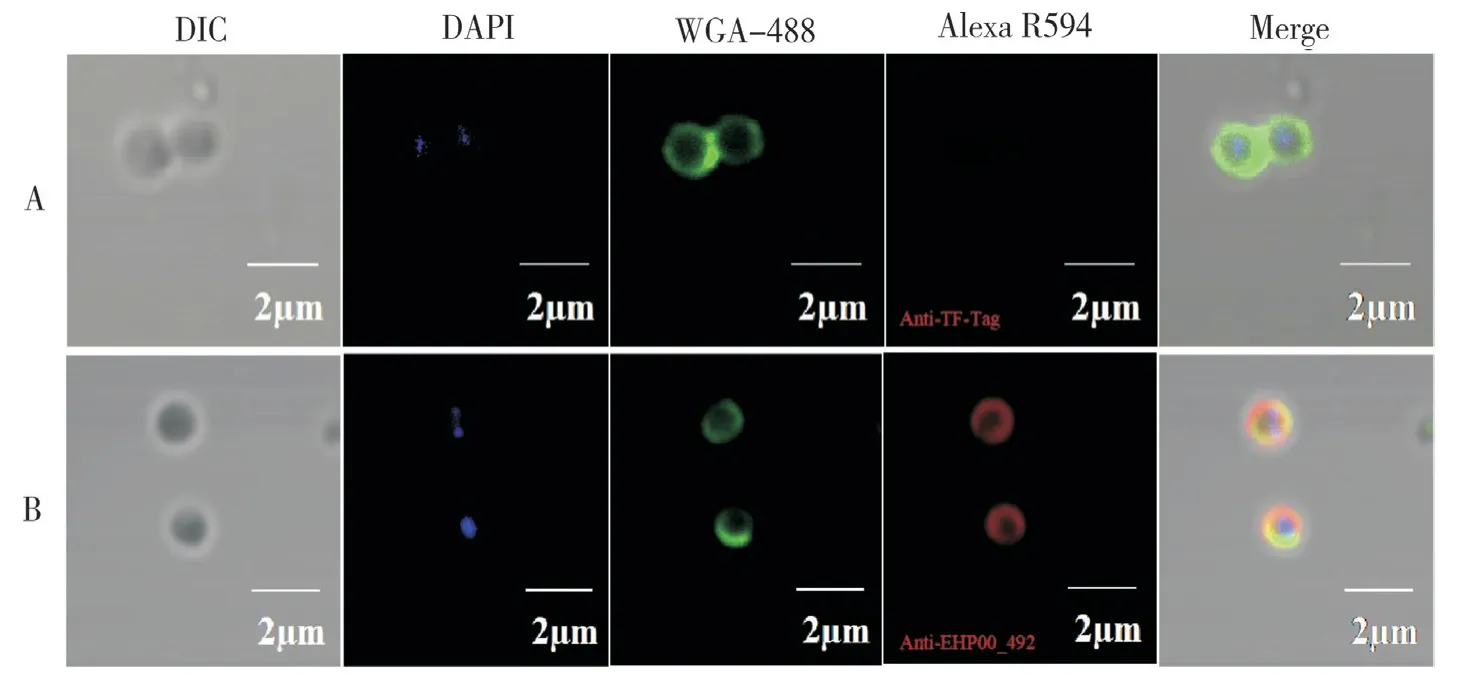
图10 IFA 分析EHP00_492 在EHP 成熟孢子中的亚细胞定位特征Fig. 10 Subcellular location characteristics of EHP00_492 in EHP mature spores by IFA
3 讨论
2004 年以来,EHP 相继在泰国、中国、印度、印度尼西亚和委内瑞拉等对虾养殖大国被发现,由于其具有快速水平传播和垂直传播的能力,给全球对虾养殖生产造成了严重经济损失[21]。微孢子虫具有一个特殊的侵染装置,由极管、极膜层和后极泡3 部分组成[22-23]。特定环境刺激孢子发芽,极管从成熟孢子内部迅速弹出并刺入宿主细胞,将具有病原性的孢原质运送至宿主细胞完成侵染[24-25]。因此,发芽是微孢子虫成功感染宿主的关键。
研究发现,微孢子虫内外渗透压的瞬间变化激活了孢子发芽,在此过程中,水通道蛋白发挥重要作用[26]。水通道蛋白属于MIP 蛋白超家族,可选择性地将水、中性小分子和离子进行跨膜运输。MIP 超家族分为水通道蛋白(AQPs)和甘油摄取促进剂(GlpFs)两大类,前者存在于所有生命,后者多来源于微生物[27]。作为第一亚家族,AQPs 是水选择透性的水通道蛋白,包括AQP0、AQP1、AQP2、AQP4、AQP5 和AQP6。第二亚家族GlpFs 既能渗透水,也能运输其他不带电的小分子(如氨、尿素和甘油等)。根据氨基酸序列特征,AQP3、AQP7、AQP9 和AQP10 归属于这一家族[28-29]。原核生物的水通道蛋白首次发现于大肠杆菌,水通道蛋白AqpZ 介导水的快速流入或流出以应对大肠杆菌细胞外渗透压变化,此外,AqpZ 还有助于大肠杆菌细胞体积的增长[27]。酿酒酵母含有4 个水通道蛋白基因,分别为AQY1、AQY2、AQY3和Fps1。低温使酿酒酵母细胞膜的流动性和渗透性降低,但水通道蛋白AQY1 能加速胞内水的流出,避免细胞死亡[30]。水通道蛋白参与了细胞膜的渗透调节。微孢子虫也具有水通道蛋白,当其发芽激活时,水通道蛋白促进水分子迅速流入孢子内部,造成后极泡和极膜层瞬间膨胀,直至孢子前端破裂,极管被膨胀的后极泡推动并外翻弹出。此外,氯化汞能抑制水通道蛋白功能,但无法抑制EcAQP 对水的渗透,推测EcAQP 缺乏位于NPA 保守基序旁对汞敏感的半胱氨酸位点。虾肝肠胞虫作为养殖对虾检出率最高的病原之一,目前暂无有效防治药物。因此,后续研究工作可探索靶向EHP00_492 的抑制剂降低孢子发芽,以期有效控制EHP 传播。
4 结论
本研究从虾肝肠胞虫基因组中筛选到水通道蛋白编码基因EHP00_492,序列分析发现EHP00_492 符合水通道蛋白保守的序列特征。系统进化树分析发现,EHP00_492 与毕氏肠胞虫水通道蛋白EBI_27080 亲缘关系最近,并且与已鉴定的家蚕微孢子虫水通道蛋白NbAQP、兔脑炎微孢子虫水通道蛋白EcAQP 的三维结构高度相似。EHP00_492 能表达定位于虾肝肠胞虫成熟孢子的孢壁上,推测其在EHP 发芽过程中发挥重要功能。本研究初步明确了EHP00_492 蛋白的序列特征、结构特征和表达定位特征,对进一步探究EHP 水通道蛋白的功能具有重要意义。
