实验室制备高产率硫酸亚铁铵条件的研究
2023-10-11常越凡张慧捷马卫华
常越凡,张慧捷,马卫华
(山西工程职业学院,山西 太原 030009)
0 引言
(NH4)2Fe(SO4)2·6H2O 的实验室制备过程涉及多个化学基本操作过程,作为一个综合性实验,成为了大学化学实验内容之一[10-12]。但文献研究发现[13-17],在实验室制备的(NH4)2Fe(SO4)2·6H2O 产品往往存在产率较低或纯度较低的问题,导致试剂的利用率降低,制得的产品由于杂质含量较高而无法直接利用。本文通过研究原材料铁和硫酸的加入比例,在水浴条件下反应最终得到(NH4)2Fe(SO4)2·6H2O。通过表征产品的纯度及产率,以期找到高纯度、高产率的制备条件,为(NH4)2Fe(SO4)2·6H2O 的制备提供一定参考。
1 实验原理
单质铁与硫酸反应生成硫酸亚铁,在酸亚铁溶液中加入等物质的量的硫酸铵,待硫酸铵完全溶解后,将溶液蒸发结晶,得到六水合硫酸亚铁铵,反应方程式如式(1)、式(2):
用目测比色法估计产品中所含杂质Fe3+的量,由于Fe3+与SCN-生成红色配合物[Fe(SCN)n]3-n。当溶液的红色越深,表明产品中的Fe3+越多;取一定质量的产品配制成一定浓度的溶液,加入KSCN 后,利用产品中Fe3+与SCN-生成配合物颜色的深浅,与含一定量Fe3+的标准物[Fe(SCN)n]3-n系列进行目视比色,根据颜色的深浅程度,即可知制得的(NH4)2Fe(SO4)2·6H2O 晶体中Fe3+的含量,从而确定产品等级。
采用1,10-菲啰啉分光光度法,在pH=2~9 的范围内,Fe2+可以与1,10-菲啰啉生成稳定的橙色配合物。根据lambert-beer 定律,可以通过测定该配合物最大吸收波长处的吸光度,计算二价铁离子含量,进而判定产品纯度。
2 实验部分
2.1 试剂与仪器
试剂:盐酸(1∶1)、稀硫酸(3 mol/L)、硫酸铵(分析纯)、无水碳酸钠(分析纯)、还原铁粉(分析纯)、无水乙醇(分析纯)、六水合硫酸亚铁铵(分析纯)、硫酸高铁铵(分析纯)、硫氰化钾(分析纯)、缓冲试剂混合溶液(0.025 mol/L 盐酸邻菲啰啉溶液、0.5 mol/L 氨基乙酸溶液、0.1mol/L 氨三乙酸溶液,按体积比5∶5∶1配制)。
仪器:UV1800 紫外-可见分光光度计、AUW320电子分析天平、真空循环水泵。
随着手工技艺在设计领域的不断发掘,可以预见的是将来的设计领域将会越来越强调人性的关怀、个性的张扬以及文化属性的体现,部落式的、阶层性的消费符号通过手工的打造会不断涌现。手工艺和设计之间的关系亦会越来越密切,两者抑或成为互不可缺的组成部分。设计领域的新手工艺运动中的设计理念也会对设计教育提出新的要求,会要求设计教育不但要培养会设计的设计师,还要培养会动手的设计师。
2.2 硫酸亚铁铵的制备
2.2.1 原料净化
于烧杯中称取一定量的还原铁粉,加入一定体积的15%(质量分数)碳酸钠溶液,加热煮沸10 min,以除去表面少量的油污。倾泻倒去碳酸钠溶液后,所得铁粉用去离子水洗至中性,最后用适量无水乙醇洗涤,晾干备用。
2.2.2 制备硫酸亚铁
称取一定质量的净化后的铁粉于锥形瓶中,并加入相应体积的稀硫酸,水浴加热至不再有气泡放出。反应结束后,趁热过滤至蒸发皿中。所称铁粉中未反应完的部分晾干后称量,以此计算实际与硫酸反应的铁的质量。
2.2.3 制备硫酸亚铁铵
根据反应生成硫酸亚铁的量,按反应方程式计算并称取所需(NH4)2SO4的质量。在室温下将(NH4)2SO4缓慢加入盛有硫酸亚铁溶液的蒸发皿中,搅拌使(NH4)2SO4溶解完全。将所得混合溶液用沸水浴加热浓缩,待溶液中大部分水分蒸干,取下蒸发皿,静置使其自然冷却至室温,待硫酸亚铁铵晶体完全析出。
将所得产品减压过滤,用少量无水乙醇洗涤晶体,过滤完毕后取出晶体,用滤纸吸除晶体表面残留的水和乙醇,放置在室温中待产品完全晾干(产品质量达到恒重),称量产品质量。
2.3 Fe3+含量分析
2.3.1 标准色阶溶液的配制
准确称取一定质量的硫酸高铁铵,配制成Fe3+质量浓度为1.000 g/L 的标准储备溶液,再将储备液稀释成一定浓度的使用液,再分别准确移取3 个不同体积的使用液于3 支25 mL 比色管中,依次加入1 mL盐酸溶液(1∶1)和2 mL 25%KSCN 溶液,用去离子水定容至刻线,摇匀。标准色阶中Fe3+含量如表1所示。

表1 标准色阶中Fe3+含量
2.3.2 产品溶液的配制
称取0.50 g 硫酸亚铁铵产品,置于25 mL 比色管中,加入一定体积的除氧水溶解晶体,然后依次加入1 mL 盐酸溶液(1∶1)和2 mL 25%KSCN 溶液,最后用无氧水定容,摇匀。将配制好的溶液与标准色阶进行目视比色,确定产品等级。
2.4 产品纯度检验
2.4.1 吸收曲线和标准曲线的绘制
于分析天平上准确称取一定质量的硫酸亚铁铵,用一定体积稀硫酸溶解后定量转移至容量瓶中,用无氧水稀释至刻度,摇匀,配制成Fe2+质量浓度为1.500 g/L 的标准储备溶液。准确移取一定体积储备液于另一容量瓶中,用无氧水配制成Fe2+质量浓度为75 mg/L 的标准使用溶液。再从使用液中移取不同体积的溶液于7 个容量瓶中,加入20 mL 缓冲试剂混合溶液,无氧水稀释定容后放置约20 min。
以标准系列中Fe2+质量浓度为0 μg/mL 的溶液作为参比溶液,选择Fe2+质量浓度为2 μg/mL 左右的标准溶液作为待测溶液,测定400~800 nm 范围内溶液的吸光度。以入射光波长为横坐标,吸光度为纵坐标绘制光吸收曲线。
以标准系列中Fe2+质量浓度为0 μg/mL 的溶液作为参比溶液,在最大吸收波长处测定标准系列溶液的吸光度,以标准系列溶液浓度为横坐标,吸光度为纵坐标绘制工作曲线。
2.4.2 产品纯度的测定
准确称取一定质量的硫酸亚铁铵产品,用一定体积稀硫酸溶解后定量转移至容量瓶中,用无氧水稀释至刻度,摇匀。确定产品溶液的稀释倍数,配制待测溶液,按照工作曲线绘制时的溶液显色方法和测定方法,在最大吸收波长处测定其吸光度。再由测得吸光度从工作曲线查出待测溶液中Fe2+的质量浓度,计算出产品的纯度。计算公式如式(1):
式中:ρx为从工作曲线查得的待测溶液中铁质量浓度,mg/L;n 为产品溶液的稀释倍数;V 为产品溶液定容后的体积,L;m 为准确称取的产品质量,g;M1为铁元素的摩尔质量,55.84 g/mol;M2为六水合硫酸亚铁铵的摩尔质量,391.97 g/mol。
由产品的纯度及称得的产品质量,计算产品的产率。
式中:(NH4)2Fe(SO4)2·6H2O 的理论产量由实际与硫酸反应的铁的质量计算得出。
3 结果分析与讨论
3.1 (NH4)2Fe(SO4)2·6H2O 的粗产率及产品等级
调整加入稀硫酸溶液的量,按照n(Fe)∶n(H2SO4)分别为1∶1.1、1∶1.2、1∶1.3、1∶1.4、1∶1.5 加入相应体积的稀硫酸溶液,最终得到的(NH4)2Fe(SO4)2·6H2O 的产品粗产率及产品等级如表2 所示。
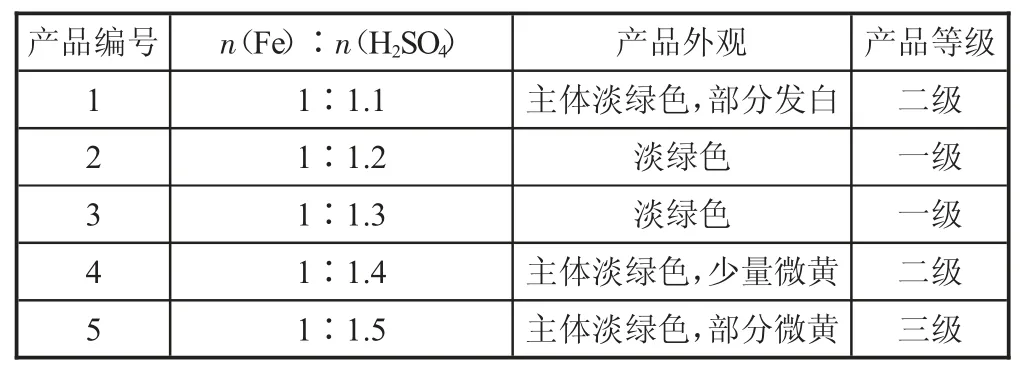
表2 按不同比例制备得到的(NH4)2Fe(SO4)2·6H2O 的产品外观及产品等级
从表2 可以看出,加入的硫酸的量不同,制得的(NH4)2Fe(SO4)2·6H2O 的外观和产品等级不同。其中,只有2 号和3 号产品的等级为一级,并且2 号和3 号产品的外观为淡绿色,而其他产品的外观上则出现少量微黄色或白色。这说明,当硫酸的量不足时,生成的FeSO4会发生部分水解,而水解后的Fe2+容易在后续的制备过程中被氧化为Fe3+,并且水解的Fe 不会和(NH4)2SO4继续反应,因此产品中有少量(NH4)2SO4出现,产品外观发白。因此整个制备过程中,为了提高铁的转化率以及防止溶液中生成的硫酸亚铁水解,应过量加入硫酸,但过多地加入硫酸后,加速了Fe2+转化为Fe3+的速率,导致有少量NH4Fe(SO4)2生成,产品外观上有少量微黄色出现。实验结果表明,加入的硫酸的量控制在1.2~1.3 之间,此时的产品等级可达到一级并且外观呈淡绿色。
3.2 (NH4)2Fe(SO4)2·6H2O 的纯度分析
含有Fe2+溶液的吸收曲线如图1 所示。
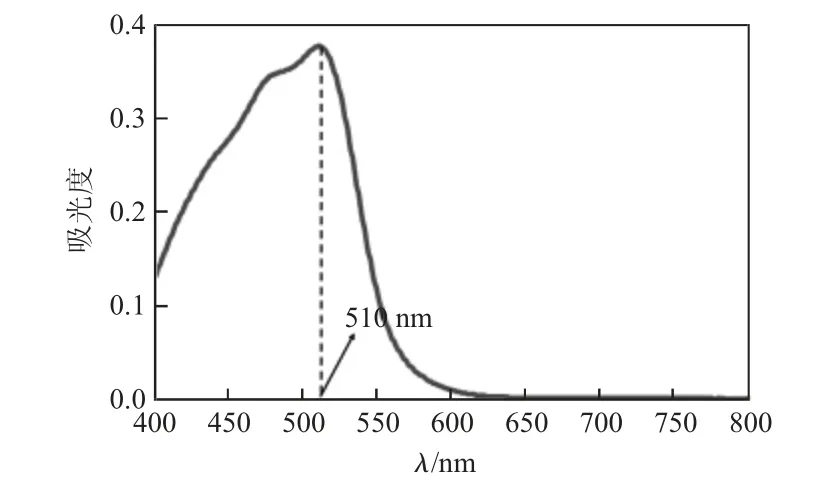
图1 Fe2+与1,10-菲啰啉形成的配合物的吸收曲线
从图1 吸收曲线图可知,Fe2+与1,10-菲啰啉所形成的配合物在510 nm 处存在最大吸收。设置测定的入射光波长为510 nm,测得标准系列溶液的吸光度及标准工作曲线如表3、图2。
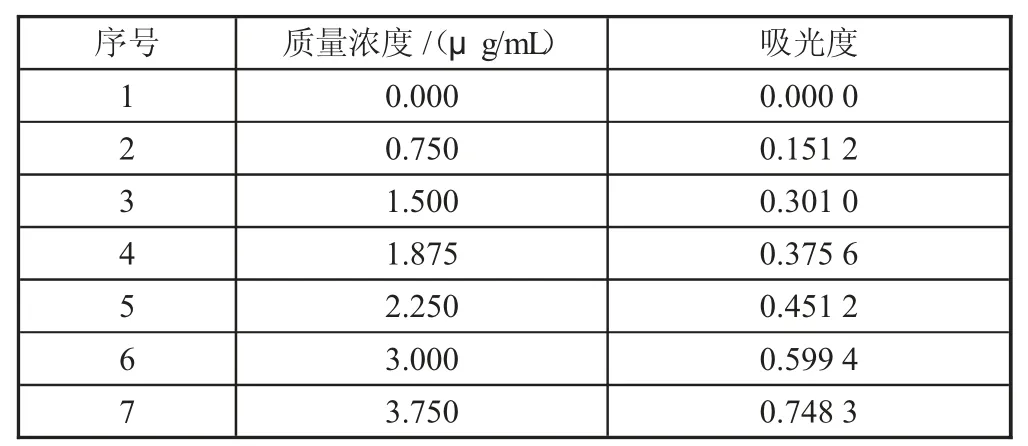
表3 标准系列浓度及相应吸光度
由标准工作曲线,结合测得的产品溶液的吸光度,再根据纯度计算公式,得到产品的纯度,如表4所示。
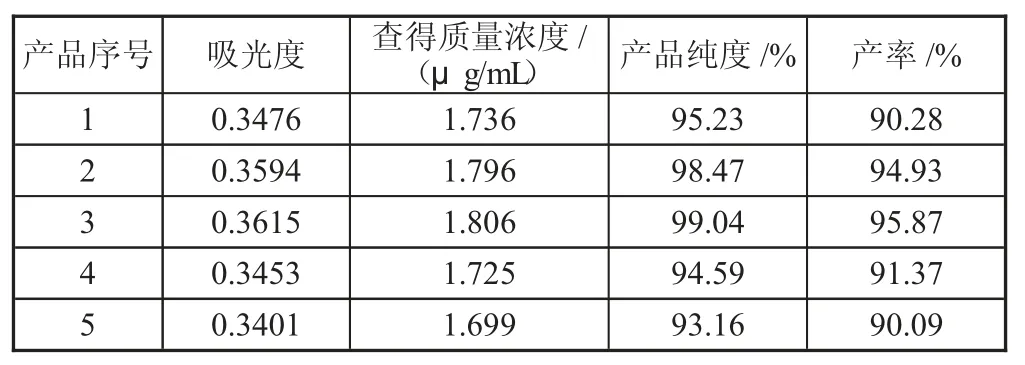
表4 根据Fe 与稀H2SO4 不同的比例得到的(NH4)2Fe(SO4)2·6H2O 的纯度及产率
从表4 可知,所有(NH4)2Fe(SO4)2·6H2O 产品的产率均高于90%,当n(Fe)∶n(H2SO4)=1∶1.3 时,制备得到的(NH4)2Fe(SO4)2·6H2O 的纯度最高,可达到99.04%,其产率也超过95%。这是由于该比例下合成(NH4)2Fe-(SO4)2·6H2O 时,硫酸既能很好地抑制Fe2+的水解,同时又不会加快Fe2+向Fe3+转化的速率。
4 结论
本文研究了在制备(NH4)2Fe(SO4)2·6H2O 时,硫酸对于产品的产率及纯度的影响。实验结果表明,当硫酸过量30%时,得到的产品纯度在99%以上且产率也在90%以上。产品纯度接近分析纯且产率较高,进而一定程度上提高了试剂的利用率,为实验室制备硫酸亚铁铵提供了一定的参考。
