丙泊酚促进绝经后骨质疏松大鼠血管生成
2023-10-11赵晓琦任鹏程
赵晓琦,董 鑫,刘 聪,任鹏程,张 亮
1.空军军医大学第二附属医院 麻醉科,陕西 西安 710016;2.西安航天总医院 麻醉科,陕西 西安 710100
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)以骨量减少和骨折风险增加为特征,主要由绝经后雌激素水平降低所致[1]。药物干预、饮食和生活方式改变是PMOP的常见防治措施。据报道,血管生成与骨代谢间存在特定的“耦合”关系[2],调控骨血管生成可能对于PMOP防治至关重要。丙泊酚是一种静脉麻醉剂,被广泛应用于骨科手术,可通过抑制NF-κB受体活化因子配体(nuclear factor κB recep-tor activating factor ligand,RANKL)/骨保护素(osteoprotegerin,OPG)表达轴减弱破骨细胞的生成,从而对骨重塑发挥有益作用[3-4]。但丙泊酚对PMOP的作用及相关机制尚不清楚。激活Wnt/β-连环蛋白(β-catenin)信号通路可促进骨髓间充质干细胞(BMSC)成骨分化,并防止卵巢切除术引起的骨丢失[5]。Wnt/β-catenin信号通路可促进血管生成,加速骨再生[6]。本研究探究丙泊酚对PMOP大鼠血管生成的影响及Wnt/β-catenin信号通路的作用,以期对麻醉药物在骨丢失和骨折愈合中的作用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 动物:雌性Wistar大鼠,SPF级,12周龄,未孕,体质量240~260 g(湖南斯莱克景达实验动物有限公司)[生产许可证号:SCXK(湘)2019-0004]。所有动物实验程序遵循《实验动物管理条例》中相关要求。
1.1.2 药品和试剂:丙泊酚(上海源叶生物科技有限公司);Wnt抑制剂重组人血管内皮抑制素(Endostar)(山东先声生物制药有限公司);骨碱性磷酸酶(bone alkaline phosphatase,BALP)、OPG、促血管生成素-1(angiopoietin-1,Ang-1)酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司);RANKL、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)ELISA试剂盒(上海酶联生物科技有限公司);苏木精-伊红(hematoxylin-eosin staining,HE)染色试剂盒(上海联迈生物工程有限公司);CD31、骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)、Runt相关转录因子2(runt-related transcription factor 2,Runx2)、VEGFA、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(Abcam公司);Wnt2、磷酸化糖原合酶激酶-3β[phosphorylated glycogen synthase kinase-3,p-GSK-3β(Ser9)]、β-catenin抗体(Invitrogen公司)。
1.2 方法
1.2.1 大鼠的分组及处理: 将大鼠分为假手术组、PMOP组(切除双侧卵巢[7])、丙泊酚2.5 mg/kg和5.0 mg/kg组(分别腹腔注射2.5、5.0 mg/kg丙泊酚[8])和丙泊酚(5.0 mg/kg)+Wnt抑制剂(尾静脉注射2 mg/kg Endostar[9])组,每组10只,1次/周,持续12周。
1.2.2 ELISA法检测大鼠血清骨代谢指标水平: 取腹主动脉血4 mL,分离血清。参照各自ELISA试剂盒说明检测各组大鼠血清中骨代谢指标-BALP、OPG、RANKL及血管生成相关因子VEGF和Ang-1水平。
1.2.3 大鼠股骨骨密度(bone mineral density,BMD)的测定: 处死大鼠后取左侧股骨,去除附着的肌肉和结缔组织,将股骨置于双能X射线骨密度仪中,扫描图像后计算各组大鼠股骨BMD值,以单位面积骨矿物质含量表示(g/cm2)。
1.2.4 HE观察大鼠骨组织病理:取大鼠右侧股骨,置于4%多聚甲醛中固定,脱钙液中脱钙,脱水、透明后包埋于石蜡中,切成6 μm厚的冠状切片,切片脱蜡至水后依次进行苏木精-伊红染色。于显微镜下观察大鼠骨组织病理形态学改变。
1.2.5 免疫组化法检测大鼠骨组织中CD31阳性表达: 6 μm厚的骨组织切片脱蜡至水后使用3% H2O2灭活内源性酶,在枸橼酸盐缓冲液中加热进行抗原修复,5% BSA室温封闭30 min,添加一抗(CD31抗体,1∶50)4 ℃孵育过夜,次日添加生物素标记二抗(1∶2 000),37 ℃孵育30 min,添加SABC-POD工作液37 ℃孵育30 min,DAB显色,苏木素染核。于显微镜下观察CD31阳性表达情况(CD31阳性表达细胞呈棕黄色或棕褐色)并拍照,每张切片任选5个视野,采用Image-Pro Plus 6.0软件定量分析平均吸光度(absorbance,A)值,并标准化为假手术组。

1.3 统计学分析

2 结果
2.1 丙泊酚对PMOP大鼠血清BALP、OPG和RANKL水平的影响
与假手术组比较,PMOP组大鼠血清BALP和OPG水平降低(P<0.05),RANKL水平升高(P<0.05);与PMOP组比较,丙泊酚组和丙泊酚+Wnt抑制剂组大鼠血清BALP和OPG水平升高,RANKL水平降低(P<0.05);与丙泊酚5.0 mg/kg组比较,丙泊酚+Wnt抑制剂组大鼠血清BALP和OPG水平降低,RANKL水平升高(P<0.05)(表1)。

表1 各大鼠血清BALP、OPG和RANKL水平Table 1 Serum BALP, OPG and RANKL levels of rats in each group n=10)
2.2 丙泊酚对PMOP大鼠血清VEGF和Ang-1水平的影响
与假手术组比较,PMOP组大鼠血清VEGF和Ang-1水平降低(P<0.05);与PMOP组比较,丙泊酚组和丙泊酚+Wnt抑制剂组大鼠血清VEGF和Ang-1水平升高(P<0.05);与丙泊酚5.0 mg/kg组比较,丙泊酚+Wnt抑制剂组大鼠血清VEGF和Ang-1水平降低(P<0.05)(表2)。

表2 各大鼠血清VEGF和Ang-1水平Table 2 Serum VEGF and Ang-1 levels of rats in each
2.3 丙泊酚对PMOP大鼠股骨BMD的影响
与假手术组比较,PMOP组大鼠股骨BMD降低(P<0.05);与PMOP组比较,丙泊酚组和丙泊酚+Wnt抑制剂组大鼠股骨BMD升高(P<0.05);与丙泊酚5.0 mg/kg组比较,丙泊酚+Wnt抑制剂组大鼠股骨BMD降低(P<0.05)(表3)。
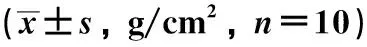
表3 各大鼠股骨BMDTable 3 Femoral BMD of rats in each group
2.4 丙泊酚对PMOP大鼠骨组织病理形态学的影响
假手术组大鼠骨组织结构、形态未见明显异常;PMOP组大鼠骨小梁不完整、断裂、变细且数量减少,髓腔明显扩大;丙泊酚组和丙泊酚+Wnt抑制剂组大鼠上述病理形态学改变较PMOP组均有所改善,且丙泊酚高剂量组改善更为明显;与丙泊酚5.0 mg/kg组比较,丙泊酚+Wnt抑制剂组大鼠骨组织病理形态学改变加重(图1)。
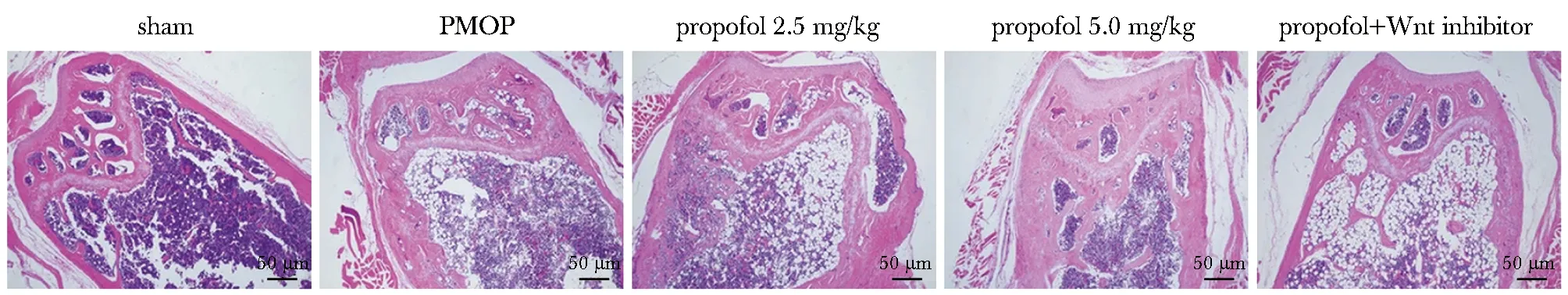
图1 HE观察各大鼠骨组织病理形态学(HE染色)Fig 1 Bone histomorphology of rats in each group(HE staining)
2.5 丙泊酚对PMOP大鼠骨组织中CD31阳性表达的影响
与假手术组比较,PMOP组大鼠骨组织中CD31阳性表达降低(P<0.05);与PMOP组比较,丙泊酚组和丙泊酚+Wnt抑制剂组大鼠骨组织中CD31阳性表达升高(P<0.05);与丙泊酚5.0 mg/kg组比较,丙泊酚+Wnt抑制剂组大鼠骨组织中CD31阳性表达降低(P<0.05)(图2、表4)。

图2 免疫组化法检测各大鼠骨组织中CD31阳性表达Fig 2 Positive expression of CD31 in bone tissue of rats in each group was detected by immunohistochemistry

表4 各大鼠骨组织中CD31阳性表达Table 4 Positive expression of CD31 in bone tissue of rats in each group
2.6 丙泊酚对PMOP大鼠骨组织中BMP-2、Runx2、VEGFA、CD31蛋白表达的影响
与假手术组比较,PMOP组大鼠骨组织中BMP-2、Runx2、 VEGFA、 CD31蛋白表达降低(P<0.05);与PMOP组比较,丙泊酚组和丙泊酚+Wnt抑制剂组大鼠骨组织中BMP-2、Runx2、VEGFA、CD31蛋白表达升高(P<0.05);与丙泊酚5.0 mg/kg组比较,丙泊酚+Wnt抑制剂组大鼠骨组织中BMP-2、Runx2、VEGFA、CD31蛋白表达降低(P<0.05)(图3、表5)。
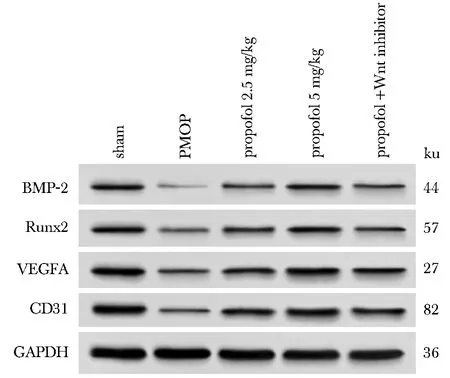
图3 Western blot法检测各大鼠骨组织中BMP-2、Runx2、VEGFA、CD31蛋白表达Fig 3 BMP-2, Runx2, VEGFA, CD31 protein expression in bone tissue of rats in each group by Western blot

表5 各大鼠骨组织中BMP-2、Runx2、VEGFA、CD31蛋白表达Table 5 BMP-2, Runx2, VEGFA and CD31 protein expression in bone tissue of rats in each group
2.7 丙泊酚对PMOP大鼠骨组织中Wnt2、p-GSK-3β、β-catenin蛋白表达的影响
与假手术组比较,PMOP组大鼠骨组织中Wnt2、p-GSK-3β、β-catenin蛋白表达降低(P<0.05);与PMOP组比较,丙泊酚组和丙泊酚+Wnt抑制剂组大鼠骨组织中Wnt2、p-GSK-3β、β-catenin蛋白表达升高(P<0.05);与丙泊酚5.0 mg/kg组比较,丙泊酚+Wnt抑制剂组大鼠骨组织中Wnt2、p-GSK-3β、β-catenin蛋白表达降低(P<0.05)(图4、表6)。

表6 各大鼠骨组织中Wnt2、p-GSK-3β、β-catenin蛋白表达Table 6 Wnt2, p-GSK-3β and β-catenin protein expression in bone tissue of rats in each group
3 讨论
骨形成标志物BALP、OPG和骨吸收标志物RANKL,与骨吸收、骨形成能力密切相关[10]。本研究通过构建大鼠PMOP模型,发现其血清RANKL水平升高,血清BALP、OPG水平及骨组织中BMP-2、Runx2蛋白表达降低, 而给予丙泊酚维持麻醉后,PMOP模型大鼠血清及骨组织中上述指标得到改善,且骨组织病理形态学改变有所改善,表明丙泊酚可在一定程度上调节PMOP大鼠骨代谢失衡,促进骨形成,减少骨吸收,延缓骨量丢失,增加BMD,改善骨组织形态。
VEGFA是血管发生和血管生成中重要的调控因子,Ang-1、CD31分别是重要的促血管再生因子和血管新生因子,3者均在骨质疏松症防治中发挥重要作用[11-12]。本研究中,丙泊酚维持麻醉的PMOP模型大鼠血清Ang-1水平及骨组织中CD31阳性表达和VEGFA、CD31蛋白表达均升高,表明一定浓度范围内的丙泊酚可促进PMOP大鼠血管生成,提示丙泊酚可能通过提高骨血管再生和成骨分化能力增加BMD,进而发挥抗PMOP作用。
Wnt/β-catenin通路参与调节PMOP骨血管生成,Wnt与其受体结合增强GSK-3β Ser9磷酸化,促进β-catenin向细胞核内转移,调节下游靶基因的转录和翻译,进而维持细胞存活、分化等生物学过程[13-14]。本研究结果显示,PMOP模型大鼠骨组织中Wnt2、p-GSK-3β、β-catenin蛋白表达降低,使用丙泊酚维持麻醉可升高PMOP模型大鼠骨组织中Wnt2、p-GSK-3β、β-catenin蛋白表达,表明丙泊酚可能通过激活骨组织中Wnt/β-catenin信号通路促进PMOP大鼠血管生成,调节骨代谢。进一步研究发现Wnt抑制剂不仅能够抑制Wnt/β-catenin信号通路激活,而且减弱了丙泊酚对PMOP大鼠血管生成和骨代谢调节、骨组织形态的改善作用。这些结果提示丙泊酚可能是通过激活骨组织中Wnt/β-catenin信号通路实现的。
综上所述,本研究证实丙泊酚可能通过激活Wnt/β-catenin信号通路促进PMOP大鼠血管生成,调节骨代谢,进而发挥抗PMOP作用。本研究为麻醉药物在骨丢失和骨折愈合中的应用提供了一定理论依据,但目前类似研究仍较少,后续研究将通过设置不同剂量组丙泊酚并使用自然绝经骨质疏松大鼠更加详细探究其作用效果及机制。
