基于滇黄精转录组序列的SSR标记开发及其在黄精属资源分析中的应用
2023-09-19钱丽华严建立吴晓疆阮松林尹舒雅崔海瑞
钱丽华 严建立 吴晓疆 阮松林 尹舒雅 崔海瑞


摘要:本研究基于滇黃精转录组序列开发简单重复序列(SSR)标记并将其应用于黄精属资源分析。设计合成了45对SSR引物,经PCR扩增验证,选择其中20对SSR引物对75份黄精属资源进行分析。结果表明,共在46 416个Unigene中检出含有二核苷酸~六核苷酸重复类型的SSR位点60 238个,序列SSR发生频率为22.78%,平均分布距离约7.07 kb;SSR位点中的主导类型是二核苷酸和三核苷酸重复,分别占50.06%和34.89%。测试的45对SSR引物中有34 对(75.56%)可扩增SSR条带。筛选的20对引物共扩增出153个条带,多态率为98.69%,每对引物扩增条带4.00~14.00个,平均7.65个,不同SSR标记的多态性信息含量为0.626~0.973,平均为0.870。75份材料的等位基因数和遗传相似系数分别为7.00~52.00个和0.531~0.941,平均值分别为24.65个和0.689,显示出丰富的遗传多样性。基于SSR标记分析的聚类图显示,在遗传相似系数0.666处可将供试材料分为4类,较好地反映了供试材料的分类归属。此外,还发现5份多花黄精材料具有特异性的SSR条带扩增或缺失,可作为不同多花黄精材料鉴定的重要分子依据。本研究开发的SSR标记多态性较高,能够有效揭示黄精属种质资源的遗传多样性,对于丰富黄精分子标记种类、构建遗传图谱、促进种质资源的评价与育种应用、开展特定性状的辅助选择等研究都具有重要的意义。
关键词:黄精;转录组;SSR标记开发;资源分析
中图分类号:S567.2文献标识码:A文章编号:1000-4440(2023)05-1120-12
Development of simple sequence repeat (SSR) markers based on transcriptome sequences of Polygonatum kingianum and their application in analysis of Polygonatum germplasm resourcesQIAN Li-hua1,YAN Jian-li1,WU Xiao-jiang2,RUAN Song-lin1,YIN Shu-ya1,CUI Hai-rui2
(1.Hangzhou Academy of Agricultural Sciences, Hangzhou 310024, China;2.Institute of Nuclear-Agricultural Sciences, Zhejiang University, Hangzhou 310058, China)
Abstract:In this study, simple sequence repeat (SSR) markers were developed based on transcriptome sequence data of Polygonatum kingianum and were utilized in germplasm resource analysis of Polygonatum. Forty-five pairs of SSR primers were designed and synthetized, then 20 of them were selected by PCR amplification verification test to analyse 75 Polygonatum resources. The results showed that, a total of 60 238 SSR loci including dinucleotide to hexanucleotide repeats were detected from 46 416 Unigenes in P. kingianum transcriptome, with an occurring frequency of 22.78% and an average distribution distance of 7.07 kb. Dinucleotide repeat and trinucleotide repeat were the dominant types, with frequencies of 50.06% and 34.89% of all SSRs, respectively. Among 45 pairs of SSR primers, 34 of them showed amplification ability, which accounted for 75.56%. A total of 153 bands were amplified by the selected 20 pairs of primers, with a polymorphism rate of 98.69%. Each pair of primer could amplify 4.00-14.00 bands, with an average of 7.65 bands. The polymorphic information content varied from 0.626 to 0.973 for different SSR markers, with an average value of 0.870. Number of allele genes and genetic similarity coefficients of 75 materials were 7.00-52.00 and 0.531-0.941 respectively, and the average values were respectively 24.65 and 0.689, which displayed rich genetic diversity. A dendrogram constructed based on SSR markers showed that, the test materials could be classified into four cluster groups with the genetic similarity coefficient of 0.666, which presented a good reflection of affiliation in taxonomy of tested Polygonatum materials. In addition, five P. cyrtonema materials showed specific present or absent SSR bands, which could be used as important molecular basis for identification of different materials. The SSR markers developed in this study were highly polymorphic and could be used to effectively reveal the genetic diversity of the Polygonatum germplasm resources. The markers are of great significance for enriching molecular marker types, constructing genetic linkage map, promoting the evaluation and breeding application of germplasm resources, and carrying out assisted selection of specific traits in Polygonatum.
Key words:Polygonatum;transcriptome;simple sequence repeat (SSR) marker development;resource analysis
黄精是多年生草本植物,属百合科(Liliaceae)黄精属(Polygonatum Mill),全世界有70余种,主要分布于北半球,分布地包括中国、朝鲜半岛、俄罗斯、欧洲和北美等[1]。滇黄精(Polygonatum kingianum)、黄精(P. sibiricum)和多花黄精(P. cyrtonema)的根茎统称为黄精,含有甾体皂苷类、多糖类、黄酮类、生物碱类等多种活性成分,在抗衰老、抗肿瘤、免疫调节、抗菌、抗病毒、降血糖血脂等方面具有重要的药用价值[1-2],作为药食同源药材,黄精在保健品、食品、日化领域都有广泛应用。
种质资源的鉴定与科学评价是合理利用遗传资源和选育新品种的基础。中国黄精属种质资源有30余种[3],传统的鉴别大多依据产地和形态,但因其植物形态上具有过渡性,生药学性状较相似,地理分布存在重叠性,种间也常伴有杂交现象而界限模糊,导致其分类和种的识别与鉴定十分困难,且存在争议[4-6]。与传统鉴别方法相比,DNA分子鉴定技术可在基因组水平上揭示植物存在差异的内在遗传本质,因其客观性与准确性迅速成为传统中药鉴定的重要手段,并在黄精属植物中得到了应用[7-8]。
简单重复序列(SSR)是指基因組中以几个核苷酸(一般1~6个)为基本单位的重复序列重复多次构成的一段DNA,其长度具有高度变异性,是建立多态性DNA标记的资源[9],其种属特异性强,在品种鉴别和育种中应用很广[10-11]。在黄精属植物研究中,基于生物素富集法[12-13]、特异性长度扩增片段测序(SLAF-seq)[14]、基因组测序[15]、转录组测序[16-17]等不同策略,已开发了一些SSR引物,分析了引物在黄精属植物间的可转移性[12-13],并利用这些SSR标记进行了指纹图谱构建[16]和遗传多样性分析[14-15]。这些研究为黄精属植物的准确鉴别和进一步开展新品种选育奠定了基础。
目前,黄精属植物能够利用的SSR 标记数量较少,尚不能满足相关遗传研究与育种的实际需要[14,17]。转录组测序技术是近年来新崛起的全面快速获取物种特定组织或器官在某状态下的所有转录本信息的研究方法,在药用植物研究中也得到了广泛应用[18-20]。转录组测序获得的数据为SSR 标记的开发提供了良好的基础。本研究对滇黄精转录组序列中的SSR位点与特征进行挖掘和分析,开发SSR 标记并将其用于75份黄精属植物资源的分析,以期为黄精属种质资源的合理利用与新品种选育提供科学依据。
1材料与方法
1.1供试材料
供试黄精属植物材料75份,均种植于杭州市农业科学研究院黄精资源圃。其中多花黄精53份、黄精17份、长梗黄精4份、川黄精1份(表1)。
1.2基因组 DNA 提取
取黄精幼嫩叶片,洗净晾干后按每份100~200 mg放入1.5 ml离心管中,加液氮用组织研磨器(上海净信实业发展有限公司产品)在60 Hz频率下磨至粉末状,按DNA抽提试剂盒(上海生工生物工程股份有限公司产品)操作说明书提取DNA,采用微量分光光度计(Thermo Scientific公司产品)测定DNA浓度,经1%琼脂糖凝胶电泳检测DNA的质量和完整性,-15 ℃保存备用。
1.3序列来源与SSR挖掘
从美国国家生物技术信息中心(NCBI)网站(https://www.ncbi.nlm.nih.gov/bioproject/474626)下载滇黄精(Polygonatum kingianum)鞭芽转录组测序后组装和拼接的Unigene序列,共203 772条,总长度约426 Mb[21]。利用SSRIT软件对这些序列按二核苷酸、三核苷酸、四核苷酸至六核苷酸重复分别不少于6次、5次、4次的要求进行SSR查找,对查找出的SRR相关信息进行统计和分析。
1.4SSR引物设计与PCR
根据SSR相关信息统计和分析结果,参考重复基元的出现频率和重复次数,选择部分SSR用PRIMER 3(http://frodo.wi.mit.edu/)设计引物,引物由杭州擎科生物技术有限公司合成。
从参试样品中随机抽取10个样本,将其DNA等量混合作为模板,并对引物进行不同退火温度(50~62 ℃)的PCR 测试。SSR-PCR反应体系为:含7.5 μl的2×Taq Master Mix(北京百奥莱博科技有限公司产品)、1.0 μl DNA模板(约50 ng)、上下游引物各0.5 μl(终浓度0.4 μmol/L)和5.5 μl的超纯水。PCR循环条件:94 ℃预变性5 min;35个循环,每个循环94 ℃变性45 s,适宜温度退火45 s,72 ℃延伸45 s;72 ℃终延伸10 min。对75份黄精资源分析时PCR扩增所采用的退火温度为58 ℃。
混合模板测试引物时采用1.5%的琼脂糖凝胶电泳(AGE)检测有无扩增产物。黄精资源分析时采用10%聚丙烯酰胺凝胶电泳检测扩增产物,进样量为1 μl,以110~120 V恒压电泳约2.5 h,银染检测,扫描电泳图谱并保存。
1.5扩增条带的统计与分析
对所扩增产物的电泳图谱进行条带数量记录(有记作1,无记作0),生成原始数据矩阵。根据 Botstein 等[22]描述的方法计算多态性信息含量(PIC值)。采用 NTSYS-pc 2.10 软件分析数据,利用 SIMQUAL 程序计算各黄精材料间的遗传相似系数,用非加权成对算术平均法(UPGMA)进行聚类生成聚类图。
2结果与分析
2.1滇黄精转录组 SSR的分布、频率及特征
对滇黄精203 772条Unigene序列搜索后发现46 416条序列含有SSR位点(表2)。其中36 003条序列只含1个SSR位点,其他10 413条序列含有2个及以上的SSR位点,个别序列所含SSR位点数高达9个。
在滇黄精总长度约426 Mb的转录组序列中共检出60 238个SSR位点(表3),平均约7.07 kb检测到1个SSR,序列发生频率(含有SSR的序列数与序列总数之比)为22.78%,出现频率(SSR总数与序列总数之比)为29.56%。
在检出的SSR重复类型中,二核苷酸至六核苷酸重复均有出现,但频率差异很大(表3)。其中二核苷酸和三核苷酸重复占主导地位,出现频率分别为14.80%和10.31%,分别占总SSR的50.06%和34.89%;四核苷酸至六核苷酸重复数量较少,出现频率分别为2.02%、0.86%和1.57%, 分别占SSR总数的6.82%、2.90%和5.33%。
滇黄精转录组序列中含有的SSR基元种类有262种,各基元重复次数为4~52次,基元越长,重复次数越少(表4)。尽管四核苷酸至六核苷酸SSR发生频率较低,但其基元的种类却较多,占重复基元总数的94.7%;而占据主导地位的二核苷酸和三核苷酸重复基元种类则较少,仅占重复基元总数的5.3%。
在二核苷酸重复基元中,出现频率较高的依次是AG、AT、AC和CG,AG和 AT重复次数大多分布在6~12,而AC和CG则以6~9次重复为主(表5)。在三核苷酸重复基元中,出现较多的4种基元依次是AGG、AAG、AAT和ACG,占三核苷酸SSR的比例均在13.0%以上,其他6种基元出现的频率较低,占三核苷酸SSR的比例为4.7%~8.1%。所有三核苷酸重复基元均以5~8次重复为主,重复次数在9次及以上的只占约3.2%。
2.2SSR引物筛选
根据滇黄精转录组序列中SSR的挖掘结果,设计合成了45对引物(表6),并进行温度梯度PCR测试。经测试发现,11对引物(PkSSR3、PkSSR12、PkSSR15、PkSSR16、PkSSR17、PkSSR19、PkSSR20、PkSSR34、PkSSR38、PkSSR42、PkSSR45)无扩增产物,其余34对引物有扩增产物,可扩增引物约占75.56%,其中31对引物扩增出了预期大小的条带,另外3对引物(PkSSR1、PkSSR13、PkSSR27)的扩增产物大小大于预期长度,图1是部分引物的扩增结果。
2.3SSR引物的多态性
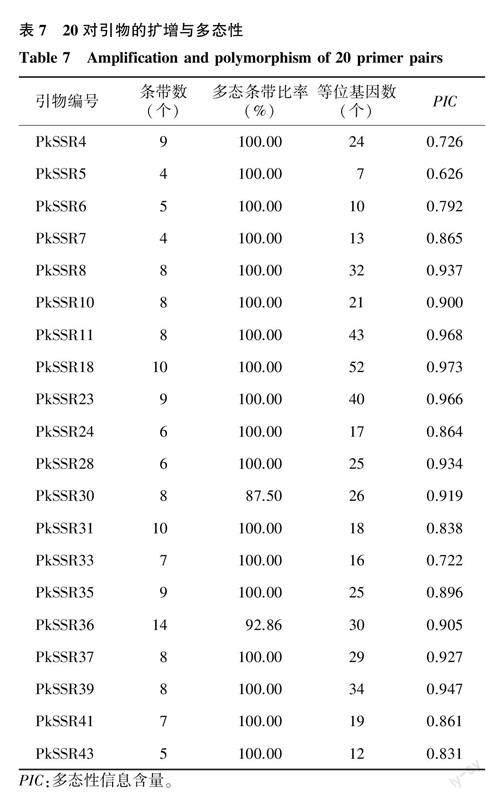
选择其中条带清晰的20对SSR引物(表7)对75份参试材料进行分析。20对引物共扩增出153个条带,多态性条带151个,多态率为98.69%。不同SSR的扩增条带数为4.00~14.00个,平均7.65个,多态性条带比率为87.50%~100.00%。不同SSR标记分析所揭示的75份材料等位基因数为7.00~52.00个,平均24.65个。20个SSR标记的PIC为0.626~0.973,大多在0.800以上,平均值为0.870。结果表明这些SSR标记的多态性较高,对不同材料具有较强的鉴别能力。
2.4遗传多样性与亲缘关系聚类分析
采用20个SSR 标记对75份黄精材料进行分析,发现有5份多花黄精材料出现特异性的SSR条带扩增或缺失(表8)。其中H-QDN-45和H-CA-1具有特异性扩增条带,分别来自标记PkSSR31和PkSSR36,而H-QDN-49、H-QDN-43和H-HZ-4这3份材料则表现为特异性条带缺失,缺失条带分别来自标记PkSSR5、PkSSR11、PkSSR41。本试验中发现的这些特异性的SSR条带扩增和缺失可作为不同多花黄精材料鉴定的重要分子依据,也揭示了参试多花黄精材料遗传的特异性。
经聚类分析(图2)发现:参试的75份材料的遗传相似系数为0.531~0.941,大部分材料的遗传相似系数为0.60~0.80,平均值约为0.689。其中以多花黄精H-CA-4(52号)与H-CA-4-2(53号)间的遗传相似系数最高,这2个種源都来自淳安左口乡同一个采集点,因采集时发现两者叶片背部颜色有一定差异而作为2个种源,实则为同一个种质,而多花黄精H-QDN-38-2(32号)与长梗黄精H-LA-3(75号)间遗传相似系数最低。从结果来看,笔者发现多数材料之间具有一定的遗传相似性,而少数材料之间遗传差异较大,且遗传相似系数变化范围较大,说明参试材料之间具有遗传多样性。
在遗传相似系数约0.666处,可将参试材料划分为4个类群:A和C均为单一种群,分别包含11份黄精和34份多花黄精,而B和D则为不同种混聚类群。其中,聚在B类的有16份材料,包括12份多花黄精和4份长梗黄精,长梗黄精在此类群中单独归入同一亚类;D类有14份材料,包括7份多花黄精、6份黄精和1份川黄精,且后两者也归入同一亚类。这一结果表明,聚类分析结果与种类归属符合度较好。
3讨论与结论
前人研究结果表明,不同物种中SSR位点的分布和频率不同。造成这种差异的原因有三个:一是物种遗传基础特异性, 有研究认为SSR出现频率随着物种基因组变大而越来越低,与物种单拷贝DNA百分比之间存在高度显著的正相关线性关系[23];二是SSR搜索标准(SSR重复类型及次数、长度等)不同,统计的SSR发生频率则相差较大;三是分析和统计的SSR序列数和类型等数据量不同。比如搜索的序列数可以从几千到几十万不等,统计的SSR类型也不尽相同,在党参[24]、甘草[25]、黄秦艽[26]和厚朴[27]中统计的SSR数据中包含单核苷酸重复,而在杜仲[28]、多花黄精[17]以及本研究中统计的SSR则未包含单核苷酸重复。本研究共在46 416条序列中发现二核苷酸至六核苷酸SSR位点60 238个,序列发生频率22.78%,平均分布频率约1/7.07 kb。与模式植物水稻和拟南芥相比,滇黄精SSR发生频率和分布频率高于拟南芥,低于水稻[29]。与其他药用植物相比,滇黄精序列SSR发生频率高于杜仲(2.9%)[28]、丹参(3.79%)[30]、人参(7.3%)[31]和党参(12.22%)[24],但低于甘草(60.10%)[25]、黄秦艽(30.73%)[26]和厚朴(52.75%)[27],平均分布频率高于杜仲(1/26.13 kb)[28]、丹参(1/12.74 kb)[30],但低于人参(1/5.80 kb)[31]、党参(1/4.52 kb)[24]、甘草(1/3.23 kb)[25] 、黄秦艽(1/4.11 kb)[26]和厚朴(1/3.43 kb)[27]。与黄精属植物相比,滇黄精SSR发生频率远高于多花黄精(9.73%),但分布频率则略低于多花黄精(1/5.91 kb)[17]。
不同植物中SSR优势重复基元的出现数量不同,这可能与其编码相应蛋白质时使用频率有关,比如拟南芥[32]。理论上,在数量足够且无偏倚的情况下,单核苷酸至六核苷酸重复基元可能产生的种类分别有2种、4种、10种、33种、102种、350种[33]。本研究从滇黄精转录组中搜索出的SSR基元种类也较为丰富,共262种。二核苷酸和三核苷酸理论上的重复类型全部出现,但四核苷酸至六核苷酸只出现了理论上的一部分,说明滇黄精转录组中 SSR也存在一定的偏倚性。在滇黄精转录组SSR中,二核苷酸和三核苷酸重复是主要类型,分别占总SSR的50.06%和34.89%,这与多花黄精及大多数植物表达序列中 SSR 以二核苷酸、三核苷酸为主要类型相符[29,34]。从滇黄精占主导地位的二核苷酸、三核苷酸重复基元种类来看,二核苷酸重复基元以AG/CT最多, GC/CG 最少,种类与多花黄精相近,但三核苷酸重复基元种类滇黄精比多花黄精多出ACG/CGT和ACC/GGT 2种基元,且主要的2种基元AGG/CCT(2 145)与AAG/CTT(2 143)数量基本相近,而多花黄精中AGG/CCT则比AAG/CTT高出5.4%[17],但均以AGG/CCT最多。而同样是单子叶植物的小麦中却以AAC/GTT居多,大麦、玉米、水稻和高粱则均以CCG/CGG为主要类型[29]。
基于NCBI数据库中大量的表达或转录组序列可开发多种类型的分子标记[35-36],其中开发较多和应用广泛的是SSR,也被称为genic-SSR[10,37]。由于来自已知的表达基因序列,所以能够更好地帮助挖掘植物重要性状连锁的基因,了解基因与表现型之间的联系[38-39]。此外genic-SSR序列的两端单拷贝序列保守性较高,具有较好的可转移性[35-36,40],可用于种内甚至是种间的遗传多样性评价。本研究中有24.4%的引物无扩增产物,这与多花黄精[17]、油菜[41]及茶树[42]中的研究结果类似,这可能是滇黄精与多花黄精、长梗黄精、川黄精对应的序列存在差异导致引物同源性低、引物与模板不匹配或者跨越内含子等原因造成的。
目前基于转录组测序已对多花黄精和黄精开发了genic-SSR标记[16-17],但数量有限且应用甚少。王世强等[16]根据黄精转录组测序数据鉴定出黄精多糖代谢合成途径中关键酶基因的SSR 位点,筛选出12对多态性丰富的SSR 引物,并应用在32 份野生黄精资源的遗传多样性分析中, PIC平均为0.46,SSR标记聚类结果能揭示供试材料之间的亲缘关系。然而关于这12对引物的研究结果反映的只是不同材料多糖代谢的遗传差异,难以用來全面评估材料间的遗传多样性。陈友吾等[17]通过对多花黄精转录组测序数据的分析,发现SSR 位点出现频率高,重复单元类型丰富,在测试的50对SSR引物中,有29对(58%)扩增出符合预期的产物,但这些标记尚未应用于黄精属植物的资源分析,其多态性还有待实际研究去评判。本研究在明确滇黄精转录组测序数据中SSR位点信息和特征的基础上,测试了45对SSR引物,有34对(75.6%)具有扩增产物,并利用其中20对引物对黄精、多花黄精、长梗黄精及川黄精共75份资源进行了分析,发现所测试的引物具有较高的多态性,PIC平均值达到0.870。聚类结果能够反映参试材料的亲缘关系,与分类归属具有较好的吻合度。SSR可扩增引物比率和PIC均高于上述2篇文献[16-17]报道的结果,同时也证明根据滇黄精Unigene序列设计的SSR引物对黄精、多花黄精、长梗黄精及川黄精均具有可转移性。
综上,本研究基于滇黄精转录组序列开发的SSR标记,是对现有滇黄精转录组数据的进一步发掘和利用;所建立的标记对于丰富黄精属植物分子标记类型、构建遗传图谱、促进资源的评价与育种应用、开展特定性状的辅助选择等都具有重要的意义。
参考文献:
[1]ZHAO P, ZHAO C C, LI X, et al. The genus Polygonatum: a review of ethnopharmacology, phytochemistry and pharmacology [J]. Journal of Ethnopharmacology, 2018, 214:274-291.
[2]张娇,王元忠,杨维泽,等. 黄精属植物化学成分及药理活性研究进展[J]. 中国中药杂志, 2019, 44(10): 1989-2008.
[3]中国科学院《中国植物志》编辑委员会.中国植物志(第15卷) [M]. 北京: 科学出版社,1978: 58-82.
[4]王雨婷,刘婉滢,沈舶宁 ,等. 黄精的本草考证[J]. 中医药学报, 2019,47(3): 81-86.
[5]田启建,赵致. 黄精属植物种类识别及资源分布研究[J]. 现代中药研究与实践,2007,21(1):18-21.
[6]魏晓楠,郝铁成,刘庆华,等.中药鉴别方法与技术探究[J]. 中国野生植物资源,2018,37(4):65-69.
[7]龙炳宏,蒋向辉,宋荣,等 . DNA条形码在黄精属药用植物鉴定与遗传多样性分析中的应用[J]. 植物科学学报,2022,40(4):533-543.
[8]石乃星,文国松,赵明富.黄精属植物 DNA 分子鉴定技术应用研究进展[J]. 植物遗传资源学报, 2021,22(5): 1209-1218.
[9]TAUTZ D. Hyper-variability of simple sequences as a general source for polymorphic DNA markers[J]. Nucleic Acids Research, 1989, 17(16): 6463-6471.
[10]VARSHNEY R K, GRANER A, SORRELLS M E. Genic microsatellite markers in plants: features and applications[J]. Trends in Biotechnology, 2005, 23(1): 48-55.
[11]KALIA R K, RAII M K, KALIA S, et al. Microsatellite markers: an overview of the recent progress in plants[J]. Euphytica, 2011, 177(3): 309-334.
[12]LIU T,CHENG W J,ZHOU S,et al.Eleven polymorphic microsatellite loci in Polygonatum umfilipes and cross—amplification in other congeneric species[J].Conservation Genetics Resources,2010,2(S1): 77-79.
[13]CHENG W J,LIU T T,WU H L,et al.Isolation and characterization of twelve polymorphic microsatellite loci in Polygonatum cyrtonema and cross—species amplification[J].Conservation Genetics Resources ,2010,2:105-107.
[14]朱巧,邓欣,张树冰,等. 黄精属 6 种植物的 SSR 遗传差异分析[J]. 中国中药杂志, 2018,43(14):2935-2943.
[15]WOOKJIN K,YUN-UI J,YOUNGMIN K,et al.Evaluation of genetic diversity of Polygonatum spp by the analysis of simple sequence repeat[J].Korean Herb Medicine Informations,2014,2(2): 41-47.
[16]王世强,王立儒,刘帅,等. 基于 SSR 标记的黄精品种(系)DNA 指纹图谱库构建[J].分子植物育种,2018,16(6):1878-1887.
[17]陈友吾,廖荣俊,叶碧欢,等. 多花黄精转录组 SSR 位點分析及分子标记开发[J]. 中草药,2020,51 (1):182-189.
[18]赵振宇, 王仕玉, 郭凤根,等. 转录组测序及其在药用植物上的应用[J]. 基因组学与应用生物学, 2017, 36(2): 820-825.
[19]刘厚伯,上官艳妮,潘胤池,等. RNA-Seq在药用植物研究中的应用[J]. 中草药, 2019, 50(21):5346-5354.
[20]慧芳,刘秀岩,李宗谕,等. 转录组测序技术在药用植物研究中的应用[J]. 中草药, 2019, 50(24): 6149-6155.
[21]WANG Y, LIU X, SU H, et al. The regulatory mechanism of chilling-induced dormancy transition from endo-dormancy to non-dormancy in Polygonatum kingianum Coll.et Hemsl rhizome bud[J]. Plant Molecular Biology, 2019,99:205-217.
[22]BOTSTEIN D, WHITE R L, SKOLNICK M, et al. Construction of genetic linkage map in man using restriction fragment length polymorphisms[J]. The American Journal of Human Genetics, 1980, 32(3): 314-331.
[23]MORGANTE M, HANAFEY M, POWELL W. Microsatellites are preferentially associated with nonrepetitive DNA in plant genomes[J]. Nature Genetics,2000, 30:194-200.
[24]王东,曹玲亚,高建平. 党参转录组中SSR 位点信息分析 [J]. 中草药, 2014, 45(16): 2390-2394.
[25]LIU Y, ZHANG P, SONG M, et al. Transcriptome analysis and development of SSR molecular markers in Glycyrrhiza uralensis Fisch [J]. PLoS One, 2015, 10(11): e0143017.
[26]WANG L, WANG Z, CHEN J, et al. De novo transcriptome assembly and development of novel microsatellite markers for the traditional Chinese medicinal herb, Veratrilla baillonii Franch (Gentianaceae) [J]. Evolutionary Bioinformatics, 2015, 11(S1): 39-45.
[27]代娇,时小东,顾雨熹,等. 厚朴转录组SSR 标记的开发及功能分析 [J]. 中草药, 2017, 48(7): 2726-2732.
[28]黄海燕,杜红岩,乌云塔娜,等. 基于杜仲转录组序列的SSR分子标记的开发[J]. 林业科学, 2013, 49(5):176-181.
[29]李永强,李宏伟,高丽锋,等. 基于表达序列标签的微卫星标记(EST-SSRs)研究进展[J]. 植物遗传资源学报, 2004, 5(1):91-95.
[30]邓科君,张勇,熊丙全,等. 药用植物丹参EST-SSR标记的鉴定[J]. 药学学报, 2009,44(10):1165-1172.
[31]LI C F, ZHU Y J XU G, et al. Transcriptome analysis reveals ginsenosides biosynthetic genes, microRNAs and simple sequence repeats in Panax ginseng C. A. Meyer [J]. BMC Genomics, 2013, 14(1): 204-205.
[32]范三红,郭蔼光,单丽伟,等. 拟南芥基因密码子偏爱性分析[J].生物化学与生物物理进展, 2003, 30(2): 221-225.
[33]LA ROTA M, KANTETY R V, YU J K, et al. Nonrandom distribution and frequencies of genomic and EST-derived microsatellite markers in rice, wheat, and barley[J]. BMC Genomics, 2005, 6(23):23.
[34]姜春芽,廖娇,徐小彪,等. 植物EST-SSR技术及其应用[J]. 分子植物育种,2009,7(1):125-129.
[35]李小白,崔海瑞,张明龙. EST分子标记开发及在比较基因组学中的应用[J].生物多样性,2006, 14(6):541-547.
[36]李小白,向林,罗洁,等.转录组测序(RNA-seq)策略及其数据在分子标记开发上的应用[J].中国细胞生物学学报,2013, 35(5): 720-726.
[37]李小白,金凤,金亮,等.利用建兰转录数据开发genic-SSR标记[J].农业生物技术学报,2014, 2(8): 1046-1056.
[38]BOZHKO M, RIEGEL R, CHUBERT R, et al. A cyclophilin gene marker confirming geographical differentiation of Norway spruce populations and indicating viability response on excess soil-born salinity[J]. Molecular Ecology, 2003, 12(11): 3147-3155.
[39]SCHUBERT R, STARCK G M, RIEGEL R. Development of EST-PCR markers and monitoring their intrapopulational genetic variation in Piceaabies (L.) Karst[J]. Theoretical and Applied Genetics, 2001, 103(8): 1223-1231.
[40]忻雅, 崔海瑞, 張明龙,等. 白菜EST-SSR标记的通用性[J]. 细胞生物学杂志, 2006, 28(2): 248-252.
[41]李小白,张明龙,崔海瑞. 油菜EST-SSR标记的建立[J].分子细胞生物学报,2007, 40(2): 137-144.
[42]金基强,崔海瑞,陈文岳,等. 茶树EST-SSR的信息分析与标记建立[J].茶叶科学,2006, 26(1): 17-23.
(责任编辑:陈海霞)
