重症胰腺炎患者血清载脂蛋白B/载脂蛋白A1、微管相关蛋白1-轻链3和细胞间黏附分子-1水平在预测并发感染性胰腺坏死中的价值*
2023-09-11吴生赞
敖 雪,邓 超,吴生赞
中南大学湘雅医学院附属海口医院重症医学科,海南海口 570208
急性胰腺炎(AP)是一种由胰腺酶异常激活引起的胰腺局部炎症反应,其发病率在全球范围内呈上升趋势,AP发作后的病死率为6%~20%,患者死亡与AP的严重程度、胰腺坏死和器官障碍相关[1]。在大多数胰腺炎患者中,AP的病程较轻,这些患者在经过常规内科治疗1~2周内恢复,然而约20%的患者伴持续性器官功能障碍,发展为重症胰腺炎(SAP)。SAP患者伴随器官衰竭、局部或严重的全身炎症反应,疾病发作后2周,还可能发展为感染性胰腺坏死(IPN)[2-3]。IPN是SAP患者死亡的主要原因之一,继发IPN的患者死亡率高达30%~39%[4]。因此,尽早对SAP患者评估和预测并发IPN的风险,对于及时采用抗菌药物预防或其他有效干预等临床决策降低病死率具有重要的临床意义。目前少有早期指标能准确、客观预测IPN发生,仍有必要探索预测IPN发生的指标。有研究发现,不同严重程度的AP患者入院时血清ApoB/ApoA1、MAP1-LC3和ICAM-1水平存在差异,上述指标可能参与了AP的发病及进展过程,因此推测3项指标或可用于SAP疾病早期预测IPN的发生[5]。目前鲜见该方面研究的报道,故本研究旨在观察SAP患者血清ApoB/ApoA1、MAP1-LC3及ICAM-1水平,并分析与患者并发IPN的关系和预测价值。
1 资料与方法
1.1一般资料 选取2019年1月至2022年1月于本院收治的172例SAP患者作为SAP组。纳入标准:(1)结合症状体征,实验室、影像学检查确诊为SAP;(2)发病48 h内就诊;(3)年龄≥18岁;(4)临床资料完整。排除标准:(1)未康复即出院、转院;(2)入院前已出现胰腺感染;(3)合并恶性肿瘤;(4)合并其他部位的严重感染;(5)长期使用激素或免疫抑制剂。诊断标准:SAP及IPN的诊断参考《中国急性胰腺炎诊治指南(2019年,沈阳)》[6]。根据SAP患者住院期间有无并发IPN分为IPN组和非IPN组。同期选取本院70例体检健康者作为对照组。SAP组中,男98例,女74例;平均年龄(50.45±8.75)岁;对照组中,男38例,女32例;平均年龄(51.26±8.53)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。所有受试者均知情同意参与本研究。
1.2方法 患者入院后,参考文献[7]给予规范医嘱治疗,包括早期液体复苏、腹胀者胃肠减压、重症监护、器官支持治疗(机械通气、维持血透等)、抑酸抑酶、肠内营养、抗菌药物抗感染等治疗。对于出现IPN的患者采用创伤递升策略治疗,行经皮穿刺引流,根据疗效情况决定是否进一步治疗(微创、内镜或开腹坏死组织清除手术)[8]。
1.3观察指标 观察指标选取SAP患者的一般资料、实验室指标及SAP患者疾病严重程度评估评分。
1.3.1一般临床资料 收集SAP患者的一般临床资料,包括患者年龄、性别、体质量指数(BMI)、病因、糖尿病史、高血压史。
1.3.2实验室指标 入院即刻留取外周静脉血标本,完善实验室检测,检查指标包括白细胞计数(WBC)、血清清蛋白(ALB)、血尿素氮(BUN)、血清淀粉酶(AMY)、血清脂肪酶(LPS)、降钙素原(PCT)、载脂蛋白B(ApoB)、载脂蛋白A1(ApoA1)、微管相关蛋白1-轻链3(MAP1-LC3)和细胞间黏附分子-1(ICAM-1)。WBC采用血常规分析仪(全自动血液分析仪,北京指真生物科技有限公司,B421)检测;ALB、AMY和LPS采用全自动生化分析检测(西门子,Advia2400);血清BUN、PCT、ApoB、ApoA1采用全自动生化分析仪(江西特康科技有限公司,TC9080)检测,计算ApoB/ApoA1;MAP1-LC3和ICAM-1采用酶联免疫吸附试验测定,试剂盒购自英国Abcam(批号:0465R)和北京百奥莱博公司(批号:ab174445)。1.3.3SAP患者疾病严重程度评估评分 包括入院24 h内急性生理与慢性健康评分系统Ⅱ(APACHEⅡ)评分和CT严重指数(CTSI)。APACHEⅡ评分为12个急性生理变量、年龄和既往健康状况组成的重症评分系统,分数越高,提示疾病越严重[9]。CTSI为对AP患者的胰腺及胰周的CT表现评估严重程度的影像学评估系统,总分0~10分,总分越高,提示病情越严重[10]。
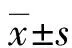
2 结 果
2.1SAP组与对照组血清ApoB/ApoA1、MAP1-LC3和ICAM-1水平比较 SAP组血清ApoB/ApoA1及P1-LC3和ICAM-1水平较对照组相对更高(P<0.05)。见表1。

表1 SAP患者与健康者血清ApoB/ApoA1、MAP1-LC3和ICAM-1水平对比
2.2IPN组和非IPN组相关资料比较 172例SAP患者中有67例并发IPN,IPN发生率为38.95%。IPN组和非IPN组相关资料比较结果显示,两组年龄、性别、病因、糖尿病史、高血压史、WBC、ALB、AMY水平比较差异均无统计学意义(P>0.05);而BMI、BUN、LPS、PCT、APACHE-Ⅱ评分、CTSI、ApoB/ApoA1、MAP1-LC3和ICAM-1水平在两组患者之间比较差异有统计学意义(P<0.05);IPN组患者入院时血清ApoB/ApoA1、MAP1-LC3、ICAM-1水平高于非IPN组(P<0.05),见表2。

表2 IPN组和非IPN组相关资料比较或n)
2.3影响SAP患者并发IPN的多因素Logistic回归分析 以表2中差异有统计学意义的因素(BMI、BUN、LPS、PCT、APACHE-Ⅱ评分、CTSI、ApoB/ApoA1、MAP1-LC3和ICAM-1水平)为因变量(均原值输入),以有无并发IPN作为因变量(无=0,有=1)纳入多因素Logistic回归分析,结果显示,LPS、PCT、APACHE-Ⅱ评分、ApoB/ApoA1、MAP1-LC3和ICAM-1水平均为SAP患者并发IPN的影响因素(P<0.05)。见表3。

表3 多因素Logistic回归分析
2.4ROC曲线分析血清ApoB/ApoA1、MAP1-LC3和ICAM-1对SAP患者并发IPN的预测价值 以SAP患者有无并发IPN作为状态变量,将血清ApoB/ApoA1、MAP1-LC3、ICAM-1水平及三者联合检测作为检验变量,绘制ROC曲线,见图1。ApoB/ApoA1、MAP1-LC3、ICAM-1水平预测SAP患者并发IPN的曲线下面积(AUC)分别为0.761(95%CI:0.683~0.840)、0.765(95%CI:0.681~0.848)、0.882(95%CI:0.829~0.935),有一定预测价值。血清ApoB/ApoA1、MAP1-LC3、ICAM-1的最佳截断值分别为1.60、0.99 ng/mL、226.55 ng/mL;ApoB/ApoA1的灵敏度和特异度分别为76.1%和61.0%,MAP1-LC3的灵敏度和特异度分别为68.7%和89.5%,ICAM-1的灵敏度和特异度分别为71.6%和91.4%。3项指标联合预测的AUC为0.957,灵敏度和特异度分别为85.1%和96.2%,具有优异的预测价值,见表4、图3。

图3 ApoB/ApoA1、MAP1-LC3、ICAM-1预测SAP患者并发IPN的ROC曲线

表4 ROC曲线分析ApoB/ApoA1、MAP1-LC3、ICAM-1预测SAP患者并发IPN的效能
3 讨 论
SAP是腹部最危险的急性炎症性疾病之一,具有进展迅速、并发症严重、病死率高的特点[11]。约33%的SAP患者病程晚期发生IPN,是除全身炎症反应综合征和多器官功能障碍综合征外的另一死亡高峰,由于早期获取胰周积液或坏死组织进行病原学检查困难,且IPN患者存在菌谱复杂、多重耐药的特点,抗菌药物的选择、内镜、外科手术的干预时机仍存在争议[12-13]。因此,早期、准确地预测IPN对于确定应采取哪些干预措施、预防或延缓严重并发症及降低病死率至关重要。
据邓峰等[14]对目前IPN预测因素的总结报道,预测因素主要包括实验室指标、影像学指标、胰腺相关或重症评分系统,本研究结果显示,PCT、APACHE-Ⅱ评分是SAP患者并发IPN的影响因素。但这些指标存在一定局限,检测时机、检测方法、操作简便性仍需统一优化。在不同研究中PCT的检测方法不同,其临界值差异较大,而APACHE-Ⅱ评分包含参数多,评估相对复杂、不够简便。此外,本研究中,CTSI不是SAP患者并发IPN的影响因素,考虑胰腺坏死可能出现在发病2~4周,在患者早期CT结果中可能表现不明显。因此,有必要不断探索简便、准确、可在早期预测的新指标。
本研究中,SAP组血清ApoB/ApoA1及P1-LC3和ICAM-1水平较对照组相对更高,与徐炎松等[5]的研究结果相符。ApoB/ApoA是反映人体脂质代谢平衡和炎症状态的综合指标,目前被广泛用于预测冠状动脉粥样硬化病变[15-16]、代谢综合征[17]、妊娠结局[18]。ApoB为低密度脂蛋白(LDL-C)和乳糜微粒主要结构蛋白,主要作用在于载运LDL-C,当血中ApoB水平过高时,可促进脂蛋白突破血管内皮进入血管,影响免疫反应,激活巨噬细胞,诱导炎症反应[19]。ApoA1是构成高密度脂蛋白(HDL)或血浆中胆固醇的主要结构和功能的蛋白质成分,可促进HDL的合成、脂质摄取,并促进胆固醇外排,抑制脂质过氧化,并能通过可抑制内皮黏附分子(ICAM-1及血管细胞黏附分子-1)的表达,维持内皮细胞稳态,导致免疫细胞的跨内皮迁徙困难,抑制单核细胞活化或炎性因子的产生,因而具有抗氧化和抗炎的特性[20]。MAP1-LC3是自噬通道调控蛋白,介导自噬体形成。目前研究认为,AP患者血清MAP1-LC3水平与患者预后相关[21]。ICAM-1是一种跨膜糖蛋白,具有介导白细胞黏附到内皮细胞和引导白细胞穿过血管壁的作用,其表达在组织炎症反应时上调,可促进炎症反应的启动和进展,是炎症反应的重要标志物[22]。刘中华等[23]发现,血清ICAM-1水平变化与AP患者病情严重程度及预后密切相关,或具有预测意义。
本研究中,IPN组入院时血清ApoB/ApoA1、MAP1-LC3、ICAM-1水平高于非IPN组,且多因素Logistic回归分析结果显示,ApoB/ApoA1、MAP1-LC3和ICAM-1水平均为SAP患者并发IPN的影响险因素。提示SAP患者血清ApoB/ApoA1、MAP1-LC3、ICAM-1水平的变化参与了IPN的发生发展过程。原因可能是:(1)SAP患者合并全身炎症反应综合征时间越长,患者发生IPN的风险更高,而ApoB/ApoA1升高可反映促炎和抗炎症反应失衡,存在全身炎症反应综合征,因此ApoB/ApoA1升高,患者发生IPN的风险更高[24-25]。(2)自噬受损是导致胰腺炎发展的原因之一,随着自噬的活性升高,大量腺泡细胞空泡化和腺泡内胰蛋白酶积累,促进胰腺病程的进展[26]。而MAP1-LC3水平反映自噬活化水平,MAP1-LC3水平过高提示自噬过度激活,胰腺自身消化作用增强,导致胰腺炎病情加重,因此MAP1-LC3水平升高提示患者发生IPN的风险更高[27]。(3)血清ICAM-1水平可通过介导炎症细胞黏附于白细胞跨内膜转移聚于胰周,致胰腺组织受损,此外有研究指出,高ICAM-1水平易引发肠道病菌移位,从而导致感染[28]。
本研究中,ROC曲线结果显示,ApoB/ApoA1、MAP1-LC3、ICAM-1水平预测SAP患者并发IPN的AUC分别为0.761、0.765、0.882,一般认为AUC>0.700表示指标具有一定的区分度,提示这些指标均有一定独立预测价值。而三者指标联合预测的AUC为0.957,灵敏度和特异度分别为85.1%和96.2%,具有优异的预测价值。本研究患者均来自同一所医院,样本量受限,后续仍需多中心、大样本量的研究对本研究结果加以证明。
综上所述,SAP患者的血清ApoB/ApoA1、MAP1-LC3、ICAM-1水平与并发IPN显著相关,并发IPN的患者ApoB/ApoA1、MAP1-LC3和ICAM-1水平更高,预测SAP患者并发IPN具有一定的价值。
