逍遥丸对“怒”应激大鼠海马差异表达基因的影响及机制探讨*
2023-09-11陈思洁李玮婷杨军平
陈思洁,肖 亮,王 莹,李玮婷,付 勇,杨军平△
1.江西中医药大学研究生院,江西南昌 330004;2.江西中医药大学附属医院检验科,江西南昌 330006;3.江西中医药大学附属医院针灸科,江西南昌330006
应激是外部压力作用于机体,导致的一系列网络调节和生理反应。短期应激能够增强机体对外部环境的适应能力,反复或长期应激则会破坏机体的调节系统,出现一系列神经内分泌、免疫和代谢等的异常和紊乱,导致机体出现情绪和行为异常[1]。近些年来,情绪心理应激作为心血管疾病、结直肠癌、不孕症等多种疾病的致病因素而成为研究热点[2]。
源自中医理论体系的七情致病论强调情志活动与疾病的关系,“怒”情志首伤肝,《医碥》曰:“百病皆生于郁...皆肝木之病矣”,“肝主疏泄”与情志疾病的发生发展有着密不可分的联系[3]。研究表明,“肝主疏泄”这一功能与神经-内分泌-免疫(NEI)网络息息相关,通过中枢多种神经递质及其神经肽、激素等的表达变化来调节相关脏腑的功能,与情绪心理应激的免疫功能调控密切相关[4]。逍遥丸作为抗“怒”应激的首选方药,其被广泛应用于现代心身医学划分的情绪心理应激相关疾病中[5-6],对机体内稳态的破坏具有较好的治疗作用,但目前有关逍遥丸与情绪心理应激在基因水平方面的研究鲜见相关报道。
转录组测序技术(RNA-Seq)是一种从生物体水平进行基因转录组分析的技术手段,能够从分子层面揭示疾病的发生发展过程及多靶点药物的作用机制,被广泛应用于各个领域,对研究情志致病起着重要的作用。海马体是应激性刺激中受损最严重的大脑区域之一,与情绪和行为有着密切的联系[7-9]。因此,本研究通过RNA-Seq分析正常、“怒”应激及逍遥丸干预后大鼠海马的差异表达基因(DEG),并对测序结果进行生物信息学分析及验证,以期从基因组学层面探究“怒”情绪应激的生物学机制及逍遥丸抗“怒”应激的作用机制,为进一步筛选“怒”应激相关基因和中药逍遥丸的药效靶基因等奠定基础。
1 材料与方法
1.1材料来源 选用Wistar大鼠(SPF级)72只,SD大鼠(SPF级)12只,均为雄性,8周龄,体质量(200±20)g;两种品系的大鼠均由斯贝福(北京)生物技术有限公司提供。动物合格证号:SCXK(京)2019-0010。将大鼠随机分笼适应性喂养1周,不限饮食,室温20~25 ℃,早上7点开灯,晚上7点熄灯[10]。实验方案已通过江西中医药大学动物实验伦理委员会批准,审核批号:JZLLSC20220814。
1.2仪器与试剂 DK-8D型电热恒温水槽(上海森信实验仪器有限公司),VII A 7 Real-time PCR System(美国Applied Biosystems公司),NanodropTMOne超微量紫外分光光度计(美国Thermo公司),NanoDrop ND-1000(美国NanoDrop公司),Gene Amp PCR System 9700(美国Applied Biosystems公司),Agilent 2100 Bioanalyzer(美国Agilent公司),Illumina HiSeq2000/2500/3000/4000(美国Illumina公司)。逍遥丸(仲景宛西制药股份有限公司,国药准字:Z41021831),氟西汀胶囊(苏州中化药品工业有限公司,批号:J20200039),5-HT、CORT酶联免疫吸附试验(ELISA)测定试剂盒(江西博茵达生物科技有限公司,批号分别为MM-0442R1、GT10870)、TRIZOL试剂(美国Invitrogen公司,批号10296-028),异丙醇、氯仿(国药集团化学试剂有限公司,批号分别为40064391、10006818),RNA酶抑制剂、RiboZero Magnetic Gold Kit(Human/Mouse/Rat)、KAPA Stranded RNA-Seq Library Prep Kit(Illumina,批号KK8401)。
1.3方法
1.3.1造模 参照文献[10-11]方法,采用“足底电击+社会隔离法”对孤养的Wistar大鼠制备“怒”应激模型。为孤养大鼠制造早晚颠倒的生活环境,晚上7点开灯,早上7点熄灯;每天不定时进行侵犯鼠干扰(随机选取1只SD大鼠放入模型鼠的单笼,持续15 min),进行无法逃避的足底电击(电击棒3 000 V,持续15 min),不限饮食,持续21 d(正常组大鼠与侵犯鼠隔离声音饲养且光线正常)。
1.3.2分组与给药 Wistar大鼠随机分成正常组(12只)和“怒”应激模型组(60只),正常组每6只1笼,“怒”应激模型组单笼(37 cm×27 cm×17 cm)孤养,并按上述方法复制“怒”应激模型,正常组大鼠不做处理。SD大鼠作为侵犯鼠,实验结束后废弃处理。造模1周后,60只“怒”应激模型组大鼠随机分出48只进入中药低、中、高剂量组和氟西汀组,每组12只,并于每日应激造模后分别给予含生药量为0.45 g/kg·d、0.90 g/kg·d、1.80 g/kg·d的逍遥丸混悬液[12]及10 mg/kg·d的氟西汀[13]灌胃治疗2周,中药低、中、高剂量组统称中药组,余下12只作为“怒”应激模型对照组,正常组与“怒”应激模型对照组灌服生理盐水,灌胃容积为1 mL/100 g体质量。实验第21天晚上8点大鼠禁食,翌日上午8点开始麻醉,采用眼静脉取血方式收集血液,静置后离心(3 000 r/min,15 min),分离血清待测;用颈椎脱臼法处死大鼠,于冰盒上摘取海马组织,放入-80 ℃冰箱。
1.3.3动物行为学试验 (1)旷场试验[14-15]。于实验前及实验第3周末进行。试验全程保持安静,准备旷场箱大小为1.0 m×1.0 m×0.5 m,底面分为25个等方格,靠内壁一圈为周围格,其余为中央格。启动摄像仪器,提起大鼠尾巴中后段将其放置于旷场箱中央,记录大鼠3 min运动轨迹。采用软件分析以下各项得分,①水平得分:大鼠经过格子数;②垂直得分:大鼠直立次数。(2)攻击行为试验[16]。于实验前及实验第3周末进行。将单只大鼠放入待测笼,启动摄像仪器,随机选取1只SD侵犯鼠放入大鼠笼中,记录15 min内大鼠的行为变化,计算以下得分,①攻击次数;②攻击累积时间。
1.3.4海马5-HT、血清CORT水平测量 严格按照ELISA试剂盒说明书检测海马中5-HT、血清中CORT水平。
1.3.5海马组织收集与RNA-Seq 分别从正常组、“怒”应激模型对照组、中药高剂量组中随机选择5只大鼠的海马组织作为样本进行测序分析。提取各组海马的总RNA,经琼脂糖凝胶电泳检测和紫外分光光度计定量检验后,去除rRNA,富集mRNA并构建cDNA文库,用qPCR方法进行文库的最终定量,对合格cDNA文库进行测序。
1.3.6转录数据与基因差异表达分析 原始测序数据经过严格的测序质量控制,在测序完成后,需要对Illumina测序仪产生FASTQ格式的原始序列进行质检以评估能否进行后续分析,通过统计Q30来判断测序质量,一般Q30≥80%表示测序质量极高。本研究Q30(评估测序质量的参数)均超过90%,说明样本测序质量极高。对转录组测序的原始数据进行过滤后通过Ensembl数据库与参考基因组进行比对,计算基因的FPKM值,设定阈值为显著性水平P≤0.05且组内FPKM均值≥0.5,差异倍数≥1.5或≤0.667来筛选差异表达基因。
1.3.7基因本体(GO)和京都基因和基因组百科全书(KEGG)通路富集分析 对筛选获得的差异表达基因,进行GO与KEGG通路富集分析。其中GO分析包括以下3个子条目:分子功能(MF)、细胞组成(CC)、参与的生物学过程(BP)[17]。
1.3.8逍遥丸回调差异表达基因分析[18]使用Venny2.1.0工具将正常组vs.“怒”应激模型对照组vs.中药组的差异表达基因取交集,进一步筛选逍遥丸在回调“怒”应激致病网络中的重要基因。
1.3.9实时荧光定量PCR(RT-qPCR)验证 用TRIZO提取海马总RNA并检测浓度,采用逆转录+扩增对转录组测序的交集差异表达基因进行RT-qPCR验证。引物由英骏生物技术有限公司合成。使用基因β-actin作为内参,目的基因扩增后的结果经过内参校正,使用2-ΔΔCt法计算各基因的相对表达量,各引物序列见表1。

表1 待测基因引物序列
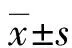
2 结 果
2.1“怒”应激大鼠旷场试验结果 实验期间“怒”应激模型对照组大鼠在造模过程中死亡1只,剩余11只大鼠纳入最终实验。实验前1天,各组水平得分、垂直得分差异均无统计学意义(P>0.05)。实验第21天,相较于正常组,“怒”应激模型对照组水平得分、垂直得分下降(P<0.01);相较于“怒”应激模型对照组,中药中剂量组、中药高剂量组和氟西汀组水平得分、垂直得分上升(P<0.01),但中药高剂量组和氟西汀组组间比较差异均无统计学意义(P>0.05)。见表2。

表2 各组大鼠旷场试验结果分)
2.2“怒”应激大鼠攻击行为试验结果 实验前1天,各组大鼠攻击次数和攻击累积时间差异均无统计学意义(P>0.05)。实验第21天,相较于正常组,“怒”应激模型对照组攻击次数、攻击累积时间增加(P<0.01);相较于“怒”应激模型对照组,中药中剂量组、中药高剂量组和氟西汀组攻击累积时间减少(P<0.01),中药高剂量组和氟西汀组攻击次数减少(P<0.01),但中药高剂量组和氟西汀组组间比较差异均无统计学意义(P>0.05)。见表3。

表3 各组大鼠攻击行为试验结果
2.3各组大鼠海马5-HT、血清CORT水平比较 相较于正常组,“怒”应激模型对照组5-HT、CORT水平升高(P<0.01);相较于“怒”应激模型对照组,中药低剂量组、中药中剂量组、中药高剂量组和氟西汀组大鼠5-HT、CORT水平均降低(P<0.01),但中药高剂量组和氟西汀组组间比较差异均无统计学意义(P>0.05)。见表4。

表4 各组大鼠海马5-HT、血清CORT水平比较
2.4RNA-Seq结果分析
2.4.1差异表达基因分析 使用Ballgown进行样本表达水平的定量,分析不同组间基因的差异表达,筛选出差异有统计学意义的基因(P≤0.05,差异倍数≥1.5或≤0.667且组内FPKM均值≥0.5)。相较于正常组,”怒”应激模型对照组有43个差异表达基因,其中上调基因28个,下调基因15个;相较于”怒”应激模型对照组,中药组差异表达基因共有42个,其中上调基因22个,下调基因20个。见图1。

注:A为“怒”应激模型对照组 vs. 正常组;B为中药组 vs. “怒”应激模型对照组;左右两条纵向的绿线分别为上调和下调,绿色横线为P阈值。
2.4.2差异表达基因GO富集分析结果 相较于正常组,“怒”应激模型对照组差异表达基因富集到BP条目34条,上调差异表达基因主要涉及细胞氧化解毒,红细胞、骨髓细胞生长,血小板激活,对有毒物质的反应等;下调差异表达基因主要涉及细胞蛋白质复杂装配、组成。富集到MF条目10条,上调差异表达基因主要涉及氧化还原酶活性、抗氧化活性、有机酸结合、血红素结合、结合珠蛋白结合、四吡咯结合;下调差异表达基因主要涉及蛋白质结构域。富集到CC条目10条,上调差异表达基因主要涉及结合珠蛋白-血红蛋白复合;下调差异表达基因主要涉及线粒体膜、细胞及细胞器内膜。
相较于“怒”应激模型对照组,中药组差异表达基因富集到BP条目50条,上调差异表达基因主要涉及蛋白质折叠、基因转译、RNA生物合成、细胞元调控;下调差异表达基因主要涉及血小板激活、血液凝固与止血、细胞氧化解毒、分解代谢。富集到MF条目16条,上调差异表达基因主要涉及RNA聚合酶Ⅱ、DNA结合转录、蛋白质二聚活动;下调差异表达基因主要涉及氧化还原酶活性、抗氧化活性、有机酸结合、血红素结合、结合珠蛋白结合、四吡咯结合。富集到CC条目13条,上调差异表达基因主要涉及细胞内体,线粒体被膜、膜间隙,核小点;下调差异表达基因主要涉及细胞外空隙、结合珠蛋白-血红蛋白复合、血红蛋白复合体、分泌泡、分泌泡囊、细胞质。
2.4.3差异表达基因KEGG通路富集分析结果 “怒”应激模型对照组与正常组差异表达基因比较,共富集到3条通路,其中上调差异表达基因富集到2条,涉及非洲锥虫病、疟疾;下调差异基因富集到1条,涉及糖尿病性心肌病。中药组与“怒”应激模型对照组差异表达基因比较,共富集到3条通路,其中上调差异表达基因富集到1条,涉及单纯疱疹病毒1型;下调差异表达基因富集到2条,涉及非洲锥虫病、疟疾。见图2、3。

注:A为上调差异表达基因,B为下调差异表达基因;图中条目按照P从低到高排列,纵坐标表示P(-log10转化)。

注:A为上调差异表达基因,B为下调差异表达基因;图中条目按照P从低到高排列,纵坐标表示P(-log10转化)。
2.4.4逍遥丸回调差异表达基因分析 将正常组vs.“怒”应激模型对照组vs.中药组先上调后下调的差异表达基因取交集,得到1个交集基因Slc25a22;将正常组vs.“怒”应激模型对照组vs.中药组先下调后上调的差异表达基因取交集,得到4个交集基因Rtkn、Pf4、Hbb-b1、Hbb,表明逍遥丸可能通过调节这些基因表达水平回调“怒”应激致病。见表5、图4。
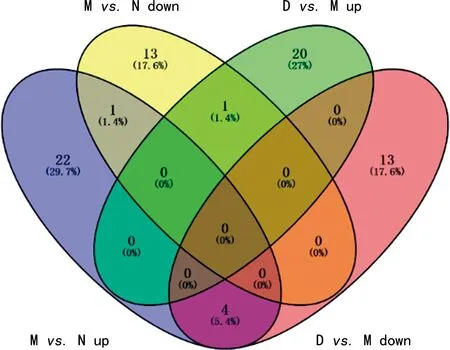
注:N为正常组;M为“怒”应激模型对照组;D为中药组;up为上调;down为下调。
2.4.5RT-qPCR验证差异基因结果 相较于正常组,“怒”应激模型对照组Rtkn、Pf4、Hbb-b1、Hbb mRNA表达均上调(P<0.05),Slc25a22 mRNA表达下调(P<0.05);相较于“怒”应激模型对照组,中药组Rtkn、Pf4、Hbb-b1、Hbb mRNA表达均下调(P<0.05),Slc25a22 mRNA表达上调(P<0.05),与RNA-Seq结果一致。见表6。

表6 逍遥丸对“怒”模型大鼠关键基因mRNA表达的影响
3 讨 论
随着社会的迅速发展与现代医学研究的进步,负性情绪致病已成为研究的一大热点。七情致病论与情绪心理应激是传统中医和现代医学关于情志致病研究的重要内容,二者在理论框架与发病原理方面存在相似性,都认为负性情绪与健康和疾病密切相关[19]。七情中的“怒”情志是不良负性情绪的核心,“怒”首伤肝,导致肝失疏泄,诸病丛生。有多项研究表明,长期心理应激和情绪异常容易引起体内NEI网络功能失衡,伴随下丘脑-垂体-肾上腺轴(HPA轴)和单胺类神经递质分泌失常,进一步诱发多系统的异常变化,主要涉及内分泌、消化、生殖和心脑血管系统等[20-23]。
课题组前期研究发现,采用“社会隔离+足底电击法”制备的大鼠模型出现易激惹、怒叫、呼吸急促等典型怒表现[10,24]。本研究基于前期实验的基础上,采用孤养及昼夜颠倒改变大鼠生活环境,通过不定时的同类入侵及足底电击,从心理、社会、躯体3个方面制造应激源因素。在造模期间应激大鼠表现出对外界刺激高度敏感、易激易怒,对侵犯鼠出现直立对峙、追逐攀压、怒叫威胁等主动攻击行为。行为学试验提示,大鼠情绪紧张、烦躁焦虑,对外界探究的积极性降低,说明“怒”应激模型的建立是有效的。
现代医学认为,单胺类神经递质可作为情绪异常疾病的诊断标志物[25]。研究发现,身体应激和心理应激能够引起海马内神经递质去甲肾上腺素(NE)、多巴胺(DA)水平抑制,5-HT水平升高,促进HPA轴异常激活,导致其终末激素CORT呈高水平分泌[26-27]。同时,NE与CORT水平的改变还可引起下丘脑负反馈抑制机制受损,诱导小胶质细胞重编码,促进神经细胞凋亡,损害海马的结构和功能,导致中枢机制的失调[1]。本研究结果显示,“怒”应激组大鼠海马5-HT与血清CORT水平均显著升高,提示大鼠HPA轴异常亢进并成功处于心理应激状态,逍遥丸干预后,以上指标均得到显著改善,说明逍遥丸抗“怒”情绪应激的机制涉及中枢单胺类神经递质与HPA轴的神经-内分泌功能调节,并与5-HT和CORT的高水平分泌有关。
相关研究结果证实,“怒”情绪应激大鼠体内存在内分泌-炎症反应网络紊乱、线粒体网络失衡、血液黏度上升及氧化应激的情况[28-30]。本研究差异表达基因功能富集分析结果显示,“怒”应激相关基因涉及氧化应激、代谢、免疫及凝血功能、细胞因子生成和线粒体网络,且与糖尿病性心肌病有关,其功能范围与NEI网络密切相关。逍遥丸对“怒”应激的调节主要集中于改善氧化应激、凝血异常、代谢紊乱、免疫炎症反应及线粒体网络失常。将差异表达基因取交集得到逍遥丸干预后具有显著翻转效果的5个基因并进行RT-qPCR验证,结果与RNA-Seq数据相符。其中Rtkn是Rho效应因子,Rtkn能够与TIP-1相互作用以促进Rho介导的血清应答元件的激活[31],其表达量与多种癌症皆有密切联系[32]。本研究“怒”应激大鼠血清应答元件CORT水平的升高可以为海马组织中Rtkn水平上调提供理解。Pf4除了有止血功能,也含有黏附分子、促炎和免疫调节化合物。有研究表明,精神压力和高水平的循环肾上腺素生理水平可增强血小板在体内的聚集,上调髓系细胞中炎症细胞因子的表达[33]。Hbb和Hbb-b1都属于血红蛋白基因,研究发现,血红蛋白基因的表达量随着应激时间的增加而增加,慢性应激可能参与血管系统功能、损伤和炎症的基因调控[34-35]。Slc25a22是一种线粒体谷氨酸转运蛋白,具有促进细胞合成天门冬氨酸,动员丝裂原激活的蛋白激酶及胞外信号调节的激酶信号,减弱氧化应激的作用[36]。综合上述基因功能的分析,推测逍遥丸对“怒”情绪应激的治疗作用可能主要集中在维持血清素水平稳态、调节代谢、调控凝血和免疫功能、减轻损伤与炎症及抵抗氧化应激方面。
综上所述,“怒”情绪应激反应可影响中枢神经递质和HPA轴的正常分泌,与NEI网络的异常活动密切相关,逍遥丸可通过调节Rtkn、Pf4、Hbb-b1、Hbb、Slc25a22这些基因回调“怒”应激致病。其结果值得进一步深入研究和探讨,且有助于深化对中医药调治分子机理的认识,为基因情绪应激研究提供新的线索。然而研究存在一些不足:由于仪器与试剂缺乏,未能验证海马表型的差异及证明差异表达基因与海马表型的相关性;其次,在后续实验中计划采用基因敲除等方法验证差异表达基因的临床意义,深入开展多水平的研究,进一步佐证研究结果。
