长茎葡萄蕨藻水提物体外抗氧化活性和对人肝细胞L02氧化损伤的保护作用
2023-09-09林香任天宇周梅兰高瑞丽邹雄刘忠群肖晔谢曦王蓉宋彦廷胡文婷
林香,任天宇,周梅兰,高瑞丽,邹雄,刘忠群,肖晔,谢曦,王蓉,宋彦廷,胡文婷*
(1.海南大学药学院,热带生物资源教育部重点实验室,海南海口 570228)(2.中国水产科学研究院东海水产研究所,上海 200090)
当机体受到外源性或内源性氧化物质的刺激时,自由基产生和清除的动态平衡就会遭到破坏,从而引起活性氧(ROS)堆积[1]。过量富集的ROS攻击细胞中的蛋白质、脂质和DNA等大分子物质,产生细胞毒性,造成氧化损伤[2]。外源性补充抗氧化剂可以帮助有效清除多余的自由基,预防或减缓ROS引起的氧化应激造成的伤害。据报道,多种合成抗氧化剂具有一定的潜在毒性和致癌作用,因此寻找天然来源的抗氧化剂受到研究者越来越多的关注[3-6]。海藻中生物活性化合物丰富,是获得天然抗氧化物质的重要来源之一[7]。长茎葡萄蕨藻(Caulerpa lentillifera)属于绿藻门中蕨藻属,是一种高蛋白、高膳食纤维、低脂肪、低热能,且富含矿物质的天然优质藻类食品[8,9]。目前,在我国的福建、海南等地,长茎葡萄蕨藻人工养殖处于逐步推广阶段[10,11]。长茎葡萄蕨藻在原产地日本民间被称作“长寿藻”,成分分析表明其含有丰富的多糖、酚类、不饱和脂肪酸及蕨藻红素、β-胡萝卜素等抗衰老和抗氧化物质[12,13]。现代药理作用研究显示,长茎葡萄蕨藻对多种与氧化应激密切相关的疾病,如炎症、心血管疾病、糖尿病、肥胖症,均有潜在的治疗作用,能够提高机体抗氧化水平,是极具开发潜力的药食兼用藻类资源[14,15]。然而,针对长茎葡萄蕨藻的抗氧化活性及氧化应激损伤保护效应的研究仍鲜有报道,有待对其深入研究。
肝脏是人体重要的代谢器官,肝细胞中含有大量的线粒体,受到氧化应激容易形成过量的ROS堆积,使细胞遭到严重的氧化损伤[16,17]。近年来许多研究表明,氧化应激可能是多种肝病,包括脂肪肝、肝炎、肝纤维化和肝癌等共同发病机制[18]。阻断氧化应激是缓解肝脏疾病发生的有效途径之一。H2O2是生物体内最常见的活性氧分子,易透过细胞膜与细胞内铁离子结合产生高活性的自由基,从而诱导细胞产生过量的ROS,而且易于获得,是氧化应激模型中最常用的氧化剂之一[19]。本研究测定了长茎葡萄蕨藻水提物(CLE)中总多糖、总三萜、总多酚和总黄酮含量[20-22],考察CLE对自由基的清除作用,并采用H2O2诱导L02人肝细胞构建氧化损伤模型,从细胞水平探讨CLE缓解氧化应激的能力,为长茎葡萄蕨藻用于干预氧化应激相关疾病以及功能性食品开发提供理论基础。
1 材料与方法
1.1 仪器与试剂
CPY-180二氧化碳培养箱,天津莱玻特瑞仪器设备有限公司;AE31AEFL-INV倒置荧光显微镜,厦门麦克奥迪实业集团有限公司;MultiskanFC酶标仪,美国BiotekIntruments;Centrifuge 5430R低温高速离心机,德国Eppendorf;MaXterile47高压灭菌锅,日本Hirayama;UV1800紫外可见分光光度计,翱艺仪器有限公司;FJ200-S高速分散匀质机,星源科技有限公司。
RPMI1640培养液,上海碧艾;胎牛血清,上海煊翎;CCK-8试剂盒、0.25%胰蛋白酶消化液、青链霉素混合液,武汉赛维尔;BCA蛋白浓度测定试剂盒,Biosharp;还原型谷胱甘肽(GSH)检测试剂盒、丙二醛(MDA)检测试剂盒、乳酸脱氢酶(LDH)检测试剂盒、谷丙转氨酶(ALT)检测试剂盒、谷草转氨酶(AST)检测试剂盒,南京建成;活性氧ROS检测荧光探针DHE,江苏凯基生物;其他试剂均为国产分析纯。
1.2 样品与细胞株
正常人肝L02细胞,海南大学药学院生化药物实验室保存。
长茎葡萄蕨藻,由海南文昌龙楼淇水湾养殖场提供。取新鲜的长茎葡萄蕨藻用流水冲洗,除去其他杂质,滤干。以1:1(g/mL)的比例加入纯水,高速分散匀质机破碎,室温放置2 h,4 ℃静置过夜,双层纱布过滤,6 000 r/min离心20 min,上清通过截留分子量为1 000 u的透析袋,冻干,即得长茎葡萄蕨藻水提物干粉,放入-20 ℃保存备用。
1.3 CLE中总多糖、总三萜、总多酚及总黄酮含量测定
1.3.1 总多糖含量测定
以葡萄糖为标准品,采用蒽酮-硫酸法[23]测定CLE中总多糖含量,在0.01~0.06 mg/mL浓度范围内呈现较好的线性关系,获得标准曲线方程:Y=9.205 7X+0.133 5(R2=0.991)。结果换算为每克干基中所含的多糖相当于葡萄糖的毫克数。
1.3.2 总三萜含量测定
以齐墩果酸为标准品,采用香草醛-浓硫酸法[24]测定CLE中总三萜含量,在0.004 6~0.092 mg/mL浓度范围内呈现较好的线性关系,获得标准曲线方程:Y=4.759 9X+0.220 1(R2=0.992 1)。结果换算为每克干基中所含的三萜相当于齐墩果酸的毫克数。
1.3.3 总多酚含量测定
以没食子酸为标准品,采用福林-酚法[25]测定CLE中总多酚含量,在0.012~0.192 mg/mL浓度范围内呈现较好的线性关系,获得标准曲线方程:Y=4.77 6X+0.066 7(R2=0.999 8)。其中Y为吸光度,X为浓度,结果换算为每克干基中所含的多酚相当于没食子酸的毫克数。
1.3.4 总黄酮含量测定
以芦丁为标准品,采用亚硝酸钠-硝酸铝法[26]测定CLE中总黄酮含量,在0.08~0.48 mg/mL浓度范围内呈现较好的线性关系,获得标准曲线方程:Y=1.338 5X+0.001 9(R2=0.999 3)。结果换算为每克干基中所含的黄酮相当于芦丁的毫克数。
1.4 抗氧化活性检测
1.4.1 超氧阴离子自由基清除能力测定
在Chen等[27]的方法基础上略作修改。在3 mL 50 mmol/L的Tris-HCl缓冲液(pH值8.4)中加入0.2 mL样品,25 ℃反应10 min,在相同温度下,加入12 μL预热的30 mmol/L邻苯三酚溶液反应4 min,然后快速在320 nm波长处测定吸光度记为A1;以蒸馏水代替样品,测定吸光度记为A2;Tris-HCl缓冲液记为A0。以同浓度抗坏血酸(Vc)溶液作为阳性对照。清除率按公式(1)计算。
式中:
C1——超氧阴离子清除率,%;
A0——Tris-HCl缓冲液在320 nm波长处的吸光度;
A1——样品在320 nm波长处的吸光度;
A2——以蒸馏水代替样品在320 nm波长处的吸光度。
1.4.2 羟自由基清除能力测定
羟自由基清除的测定参考Li等[28]和朱月等[29]的方法并稍作改进。取不同浓度的样品溶液1 mL,分别加入1 mL硫酸亚铁(6 mmol/L),1 mL水杨酸-无水乙醇(6 mmol/L),1 mL H2O2(6 mmol/L),涡旋混匀,37 ℃恒温水浴15 min,测定510 nm吸光度,记为A1;以蒸馏水代替样品,测定吸光度记为A0;以蒸馏水代替水杨酸-无水乙醇,测定吸光度记为A2。以Vc作为阳性对照,对羟自由基清除率按公式(2)计算。
式中:
C2——羟自由基清除率,%;
A3——以蒸馏水代替样品在510 nm处测定的吸光度;
A4——样品在510 nm处测定的吸光度;
A5——以蒸馏水代替水杨酸-无水乙醇在510 nm处测定的吸光度。
1.5 CLE对氧化损伤细胞增殖的影响
1.5.1 不同浓度CLE对L02细胞存活率的影响
将处于对数生长期的L02细胞,用胰酶消化后加入1640培养基,倒置显微镜下计数,调节细胞个数为每孔5×103个接种于96孔板,在含有5% CO2的37 ℃恒温培养箱中培养24 h,弃细胞培养液,加入含有5%血清1640培养基配制的不同浓度的CLE(0.0、22.5、45.0、90.0、180.0 μg/mL),培养8 h后去掉上清液,
采用CCK8方法检测细胞存活率。
1.5.2 H2O2诱导L02细胞氧化损伤模型的建立
取对数生长期的L02细胞,胰酶消化后以每孔5×103个的浓度,接种于96孔板中培养24 h,弃细胞培养液,加入用含有5%血清的1640培养基配置的H2O2溶液,终浓度分别为 0(空白组)、200、400、600、800、1 000 μmol/L。继续培养8 h,采用CCK8法检测细胞存活率,确定H2O2的最适浓度。
1.5.3 CLE对氧化损伤L02细胞的保护作用
取对数期L02细胞调整浓度至每孔5×103个,每孔100 μL接种于96孔板。随机分为5组,包括对照组、H2O2组(400 μmol/L)、H2O2+22.5 μg/mL CLE组、H2O2+45.0 μg/mL CLE组和H2O2+90.0 μg/mL CLE组。待细胞贴壁后,用5%血清的1640培养基配制不同浓度的药物。对照组添加含有5%血清的1640培养基,H2O2培养组加入含有400 μmol/L H2O2的培养基,H2O2+CLE组用400 μmol/L H2O2与不同质量浓度的CLE(22.5、45.0、90.0 μg/mL)同时处理细胞,继续培养8 h,采用CCK8法检测细胞存活率。
1.6 CCK8法检测细胞存活率
在相同条件处理下设置空白组、对照组和实验组,将96孔板中各组培养的细胞上清液去掉。空白组、对照组和实验组加入用含有5%血清的1640培养基100 μL(含有10%的CCK8溶液),在含有5% CO2的37 ℃恒温培养箱中放置2 h,在450 nm处测量各组吸光度,其中空白组的吸光度值记为OD0,实验组记为OD1,对照组记为OD2,细胞存活率按公式(3)计算。
式中:
L——细胞存活率,%;
OD0——空白组在450 nm处的吸光度值;
OD1——实验组在450 nm处的吸光度值;
OD2——对照组在450 nm处的吸光度值。
1.7 细胞上清液中LDH、AST、ALT水平检测
采用试剂盒对细胞泄露的LDH、AST、ALT进行检测。设置对照组、H2O2培养组(400 μmol/L)、H2O2+低浓度CLE组(22.5 μg/mL)、H2O2+高浓度CLE组(45.0 μg/mL)和CLE(45.0 μg/mL)组,将L02细胞接种于6孔板中,待细胞贴壁之后给药处理细胞后培养8 h,收集细胞培养液,按照试剂盒的说明检测。
1.8 细胞内ROS含量的测定
将L02细胞接种于6孔板中,待细胞贴壁之后按照1.7节分组给药处理细胞后,去除培养液,用PBS清洗L02细胞,按照试剂盒说明,加入用无血清的1640培养液稀释的DHE荧光探针,37 ℃孵育30 min,PBS清洗3次,荧光显微镜下观察拍照,用ImageJ软件分析各组细胞的荧光强度,以对照组计算相对荧光强度。
1.9 细胞内MDA、GSH水平检测
将L02细胞接种于6孔板中,按1.7节给细胞分组和给药后收集细胞,按照试剂盒说明进行检测,BCA法蛋白定量。
1.10 数据处理
实验数据采用Prism 9.3.0软件进行统计分析,数据表示为平均值(mean)±标准差(SD),多样本间采用one way-ANOVA进行单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果与讨论
2.1 CLE中总多糖、总三萜、总多酚及总黄酮含量
由表1可知,CLE中总多糖的含量最高,为205.01 mg/g,其次是总三萜和总多酚,并且含有一定的总黄酮成分。已有较多研究表明,海藻中富含多糖、萜类和酚类等活性物质,是其作为自由基清除剂发挥作用以及预防生物体氧化损伤的物质基础[30]。Jesumani等[31]从马尾藻中提取得到的多糖和多酚,均具清除羟自由基作用。梁惠等[32]研究表明凹顶藻萜提取物表明具有较强的抗氧化活性,可有效阻止脂质过氧化反应,提高机体抗氧化能力。李静等[33]从大叶藻提取得到的大叶藻黄酮可有效清除羟自由基。另外,有研究表明,以乙醇为溶剂对冷冻干燥后的长茎葡萄蕨藻进行提取,获得的醇提物总酚含量为2.04 mg/g[34],黄酮类化合物的含量为4.93 mg/g[35]。本研究以水为溶剂获得的提取物中含有丰富的水溶性多糖成分和一定的萜类物质,而且总多酚(27.02 mg/g)和总黄酮(15.72 mg/g)的含量均高于醇提物。

表1 CLE中总多糖、总三萜、总多酚及总黄酮含量Table 1 Contents of total polysaccharides, total triterpenes,total phenols and total flavonoids of CLE
2.2 CLE的抗氧化活性
生物体内的氧自由基是含有不成对电子的原子或基团,其中最主要、最具破坏性的是羟自由基和超氧阴离子自由基。在生物系统中,酶的正常催化过程或氧化压力下产生的超氧阴离子自由基是自由基连锁反应的启动者,促使其他类型自由基的形成,引发各种生理和病理过程,如衰老、癌变等[36]。羟自由基是氧自由基中最活泼的自由基,去除羟自由基对于防止机体内蛋白质、DNA和核酸等化合物的损伤至关重要。自由基清除剂可以保护细胞免受或减缓自由基引发的氧化损伤。由图1可知,CLE具有清除超氧阴离子和羟自由基的能力,当质量浓度为0.5 mg/mL时的清除能力均强于相同浓度的Vc。在0.5~3.0 mg/mL的范围内,CLE对超氧阴离子和羟自由基的清除能力随着浓度的增加逐渐增强,在1.0~3.0 mg/mL的质量浓度范围内清除能力低于Vc。当质量浓度为3.0 mg/mL时,CLE对超氧阴离子和羟自由基清除率分别达到69.30%和77.05%。通过曲线拟合得到CLE对超氧阴离子和羟自由基的IC50值分别为0.94、2.20 mg/mL。陈琳琳等[37]以不同方法从长松藻、铁钉菜和鼠尾藻获得的提取物对羟自由基具有明显的清除作用。邵海艳等[38]研究了总状蕨藻水溶性成分的抗氧化活性,当质量浓度为3 mg/mL时对羟自由基的清除率为70.86%。Fauziee等[39]从喇叭藻提取得到褐藻糖胶,质量浓度为2 mg/mL时对超氧阴离子和羟自由清除率分别是8.9%和53.4%。本研究以长茎葡萄蕨藻水提物为研究对象,发现其在低浓度下即对羟自由基和超氧阴离子均表现出良好的清除能力。长茎葡萄蕨藻有较强的抗氧化活性,具有开发成天然抗氧化产品的潜力。
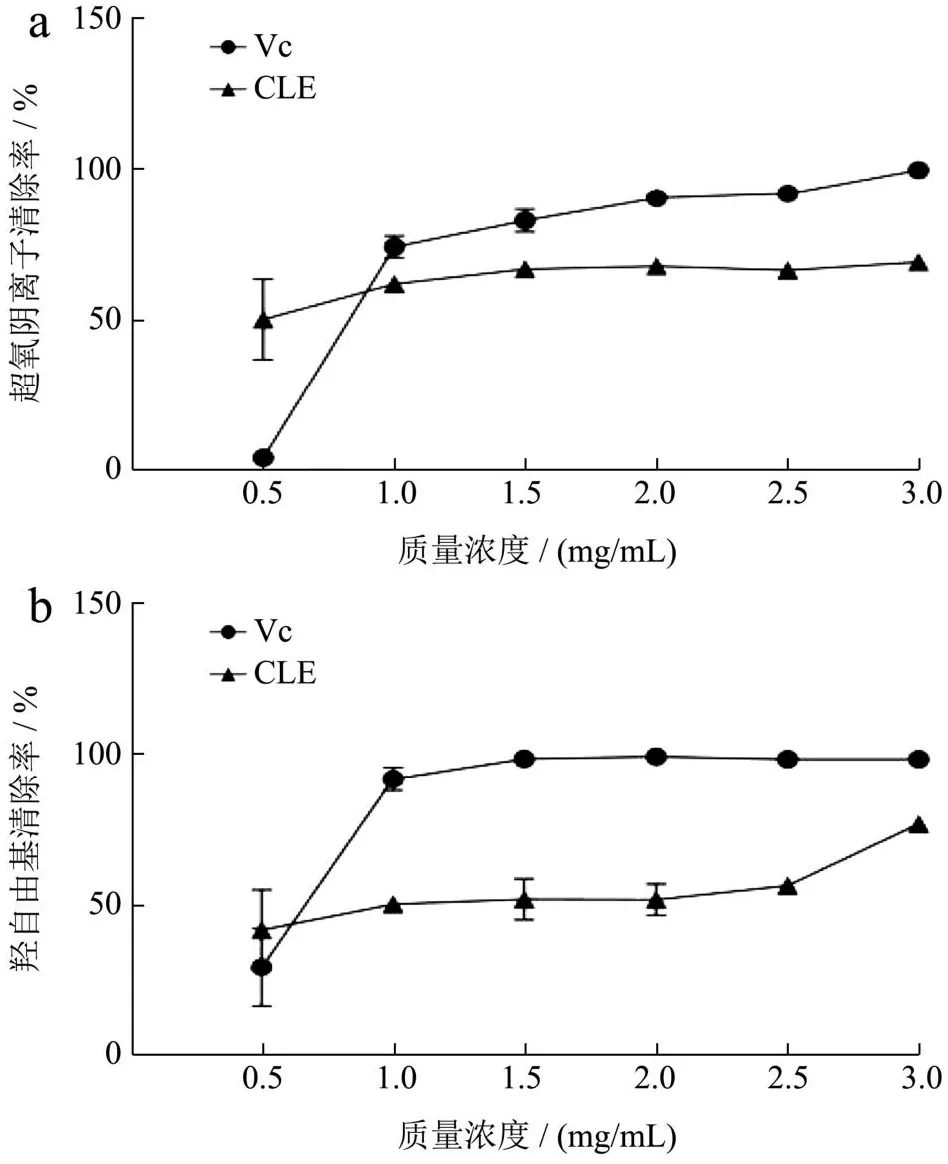
图1 CLE对超氧阴离子(a)和羟自由基(b)的清除能力Fig.1 The scavenging capacity of CLE for superoxide anion (a)and hydroxyl radical (b)
2.3 不同浓度的CLE对L02细胞存活率影响
采用CCK8法研究CLE对L02细胞增殖率的影响,结果见图2。在CLE质量浓度为0.0~180.0 μg/mL范围内,其细胞存活率与对照组相比均无显著性差异(P>0.05)。结果表明当CLE的质量浓度低于180.0 μg/mL时不影响L02细胞的增殖,对细胞无毒性。
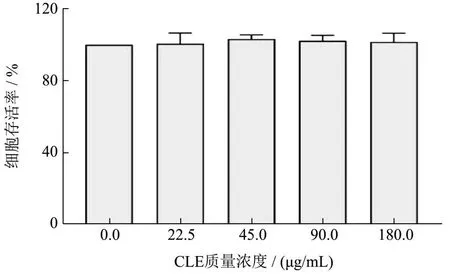
图2 CLE对L02细胞存活率的影响Fig.2 Effects of CLE on the survival rate of L02 cells
2.4 CLE对H2O2诱导L02细胞氧化损伤的影响
以0~1 000 μmol/L不同浓度的H2O2处理L02细胞8 h,结果如图3所示,随着H2O2浓度的升高,细胞活力逐渐下降。当H2O2浓度为400 μmol/L时细胞存活率显著降低,细胞存活率为51.67%(P<0.01)。当浓度达到1 000 μmol/L时,L02细胞的存活率仅为26.33%(P<0.01)。H2O2浓度过高时会对细胞造成不可逆转的损伤,不利于药物干预对其进行修复。因此,选择浓度400 μmol/L为H2O2诱导L02细胞氧化损伤的最佳浓度。
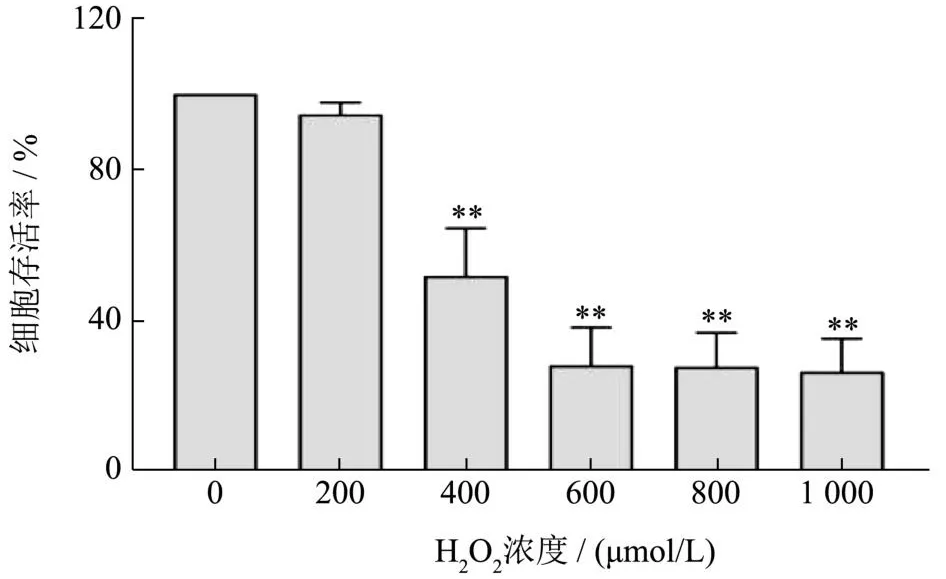
图3 H2O2处理对L02细胞存活率的影响Fig.3 The effect of H2O2 treatment on the survival rate of L02 cells
CLE对L02细胞氧化损伤的保护作用如图4。与对照组相比,H2O2培养组的存活率显著降低,其存活率为49.81%(P<0.01);在经过22.5 μg/mL、45.0 μg/mL和90.0 μg/mL的CLE干预之后,L02细胞存活率均有不同程度地回升,分别为60.87%、69.90%和62.50%,质量浓度为45.0 μg/mL的CLE对L02细胞氧化损伤保护能力最强,细胞存活率与模型组相比显著提升。当再继续加大CLE的质量浓度至90 μg/mL时,对氧化损伤的L02细胞保护作用略有降低。可能是由于造模后致细胞受损,此时过多的外源物质对细胞造成较大负担,导致存活率出现下降[40]。吴伟等[41]采用H2O2致细胞氧化损伤后,低浓度枸杞多糖的保护效果优于高浓度的枸杞多糖。梁曾恩妮等[42]研究表明圣草次苷对H2O2致HUVEC细胞氧化损伤的保护作用未表现出剂量关系,随着圣草次苷浓度的增大,保护作用有所降低。故而采用22.5 μg/mL和45.0 μg/mL的CLE作为干预浓度进行后续实验。
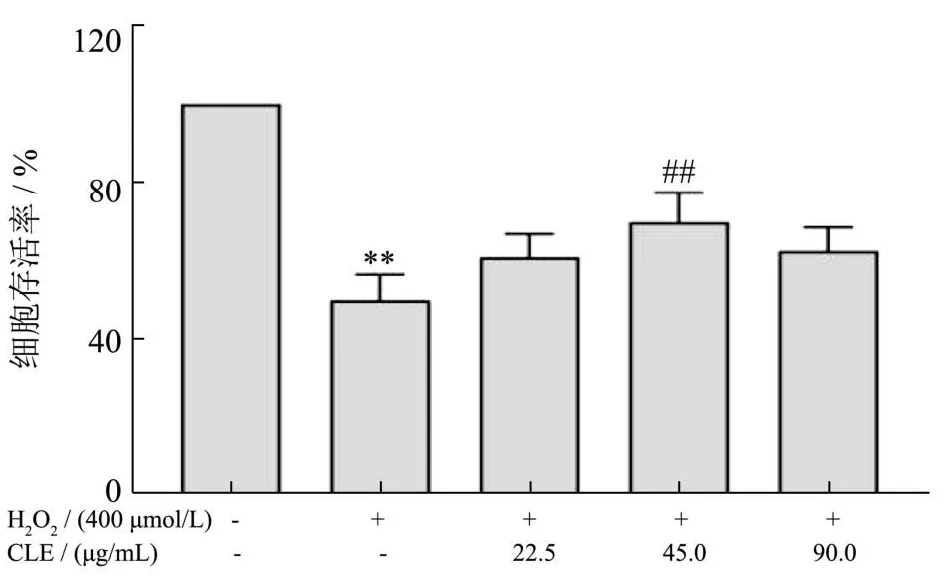
图4 CLE对H2O2损伤L02细胞存活率的影响Fig.4 Effects of CLE on the survival rate of H2O2-injured L02 cells
2.5 CLE对氧化损伤L02细胞培养上清中LDH、AST、ALT活性的影响
当细胞受到氧化应激、炎症等因素影响时,细胞膜被破坏,细胞内的酶类物质大量释放到体液中,使细胞外LDH、AST、ALT水平急剧升高[43]。由图5可见,与对照组相比,经H2O2处理后,LDH活力升高至158.77%,AST和ALT活力分别升高至197.54%和328.34%(P<0.01)。使用22.5 μg/mL和45.0 μg/mL CLE干预后,L02细胞培养上清中的LDH活力降低到81.14%(P<0.05)和51.16%(P<0.01);AST活力降到53.94%和45.64%(P<0.01),ALT活力降到43.95%和34.41%(P<0.01)。细胞培养上清中的LDH、AST、ALT释放量可反映出细胞氧化损伤程度。郑峰等[44]建立H2O2诱导L02细胞氧化损伤模型,H2O2组细胞上清液中LDH、AST、AST显著升高,大豆异黄酮处理后,活性水平显著降低。在王倩等[45]的研究中发现番茄红素能显著降低H2O2诱导L02细胞培养上清中LDH、AST、AST酶活性。本实验结果与上述研究类似,H2O2诱导的模型组LDH、AST、ALT漏出明显增多,CLE干预后均出现显著降低,说明CLE可以缓解H2O2引起的肝细胞氧化损伤。
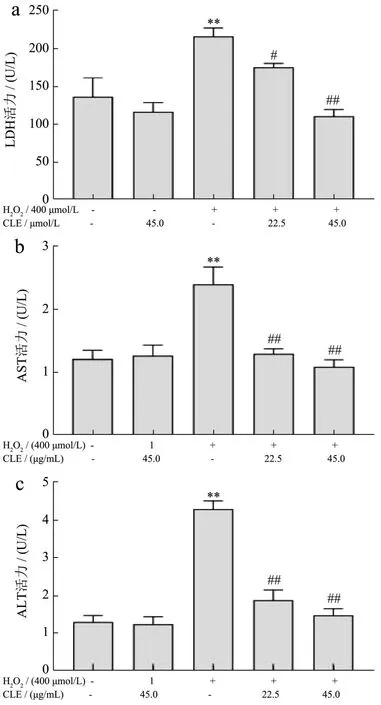
图5 CLE对H2O2培养条件下L02细胞培养上清中LDH(a)、AST(b)、ALT(c)水平的影响Fig.5 Effects of CLE on LDH (a), AST (b) and ALT (c) levels in the supernatant of L02 cells cultured with H2O2
2.6 CLE对H2O2诱导L02细胞内ROS、MDA和GSH含量的影响
ROS是生物有氧代谢过程中产生的一种中间产物,在机体内发挥着重要作用。细胞内抗氧化系统通过清除氧自由基或抑制细胞氧化过程,从而保持ROS的平衡[46]。ROS作为一种常见的细胞氧化损伤标志性因子,常用来判断外源性物质对机体的影响情况[47]。由图6可见,加入H2O2刺激的细胞荧光明显增强,荧光强度是正常组的2.50倍。经CLE孵育后的细胞,分别降为模型组的68.97%、63.23%(P<0.01),说明CLE可以抑制H2O2诱导L02细胞中ROS的产生。
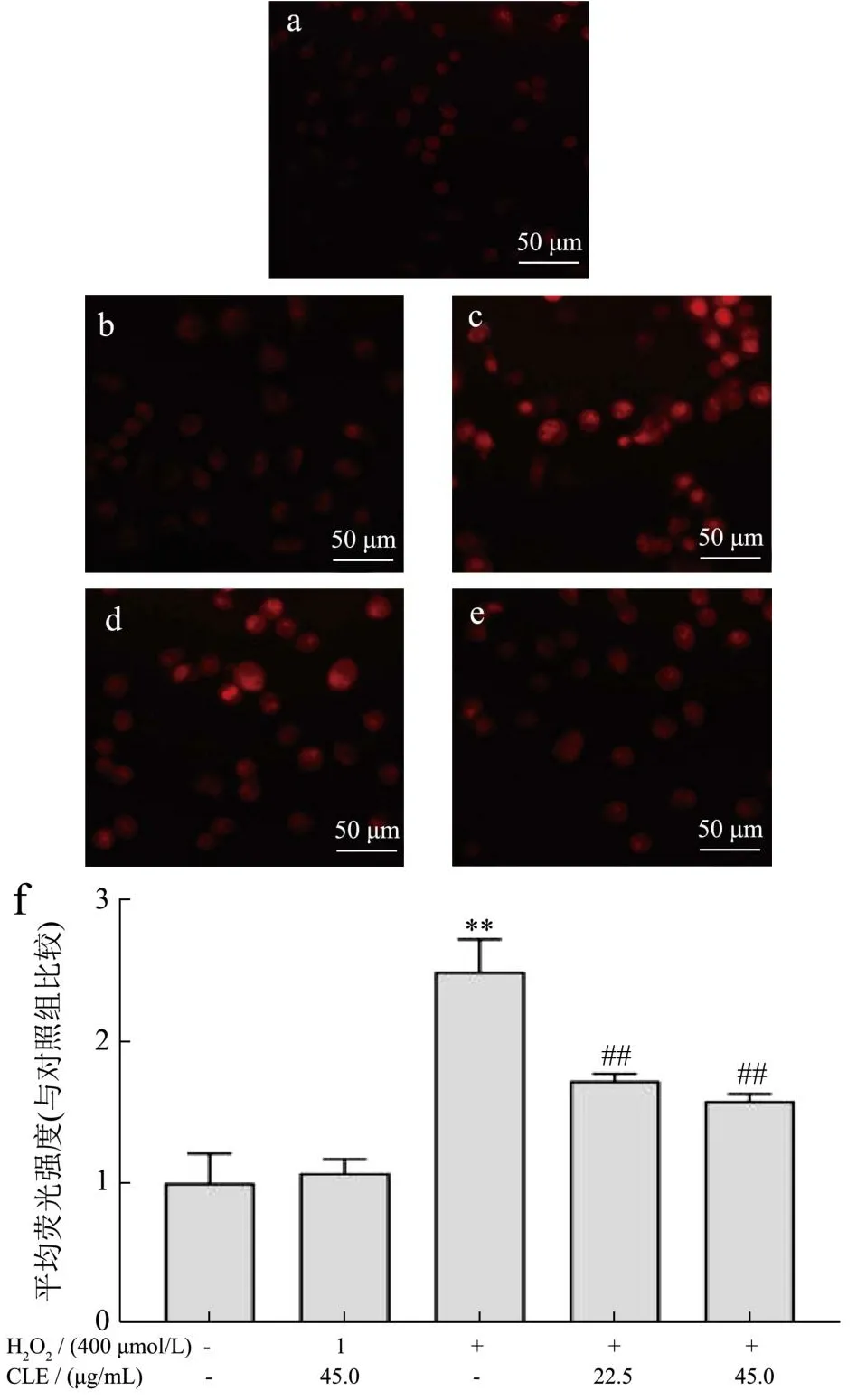
图6 CLE对L02细胞内ROS含量的影响Fig.6 Effects of CLE on intracellular ROS content in L02 cells
CLE对L02细胞内MDA、GSH含量的影响如图7。H2O2诱导氧化损伤组的细胞内GSH水平明显降低,MDA含量明显升高,与对照组相比均有显著性差异(P<0.01)。与H2O2的诱导氧化损伤组相比,22.5 μg/mL和45.0 μg/mL CLE组的MDA分别降至84.71%(P>0.05)和63.20%(P<0.01);细胞内的GSH含量显著增加,分别是模型组GSH含量的1.45和1.64倍(P<0.01)。MDA作为体内脂质过氧化的标志性产物,其含量的高低反应出机体受到氧化损伤程度[48]。GSH是细胞内重要的非酶类抗氧化物质,具有清除自由基、降低ROS水平和阻断组织氧化损伤等多种生理功能[49]。细胞内MDA和GSH的水平可以反应细胞所处的氧化还原状态。杜毅超等[50]研究发现芹菜素显著降低L02细胞内ROS和MDA含量。在Ou等[51]的研究中,C-藻蓝蛋白干预能够降低四氯化碳诱导L02细胞氧化损伤产生的ROS以及MDA水平,提高GSH含量,发挥保护细胞的作用。本研究中,CLE干预显著提高L02细胞内具有还原能力的GSH含量,有效清除过多的ROS,并阻止细胞内脂质过氧化,从而缓解氧化应激、保护细胞免受氧化损伤。
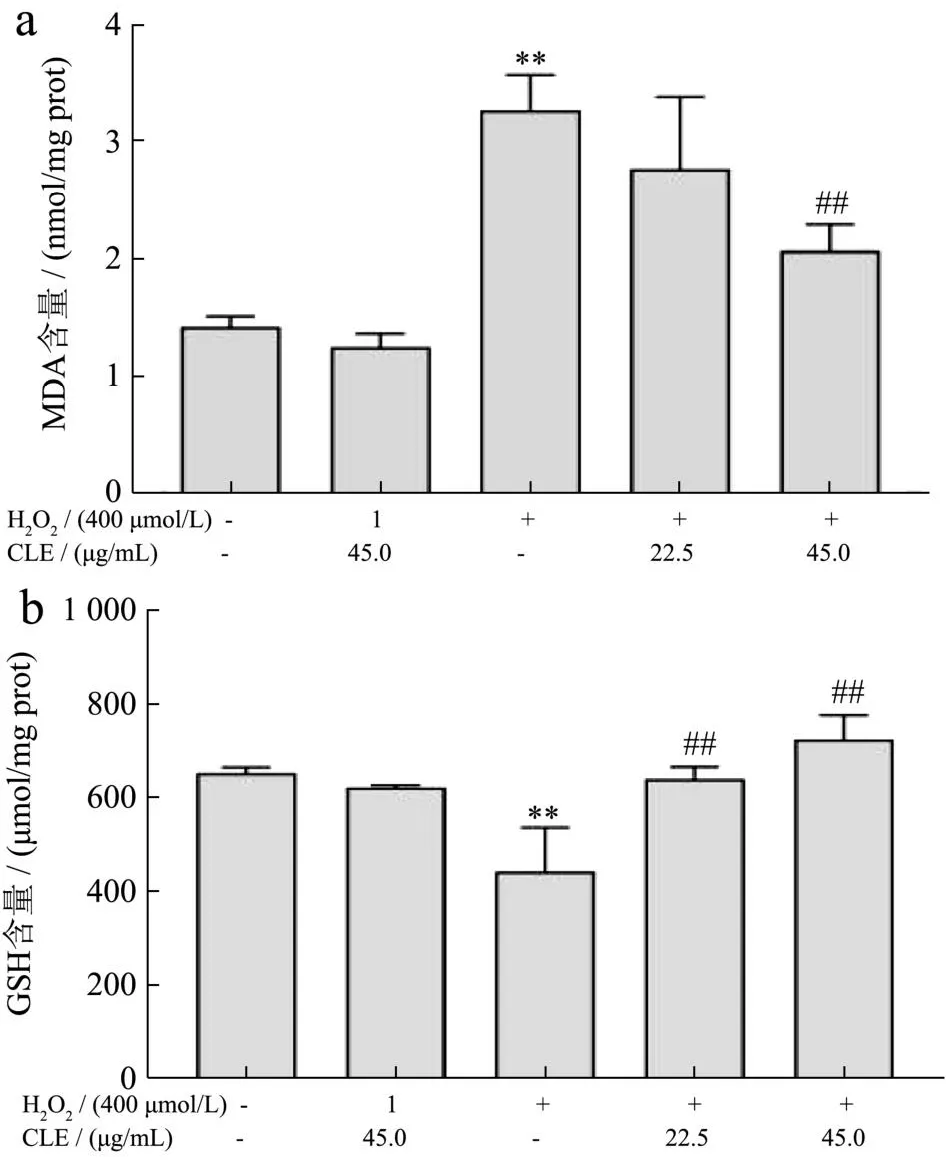
图7 CLE对H2O2培养条件下L02细胞MDA(a)、GSH(b)含量的影响Fig.7 Effects of CLE on MDA (a) and GSH (b) content of L02 cells under H2O2 culture
3 结论
CLE中含有丰富的多糖、萜类、多酚和黄酮类活性成分,在体外对超氧阴离子和羟自由基均有一定的清除作用。CLE在质量浓度为0.0~180.0 μg/mL的范围内,对正常的L02细胞活力无影响。对受到H2O2诱导产生氧化应激损伤的L02细胞,CLE能够显著提高细胞生存率。CLE使H2O2培养条件下的细胞培养液上清中LDH、AST、ALT活性显著降低,提示CLE处理能够改善氧化损伤导致的细胞膜通透性改变、减少酶类漏出。同时,CLE处理组细胞内的ROS显著减少,GSH含量显著增加,MDA含量显著降低,表明CLE能够增强细胞抗氧化防御能力、降低细胞脂质过氧化水平,减轻ROS生成增多引起的L02细胞损伤。
综合以上结果,CLE有较好的抗氧化能力,可增加L02细胞内非酶类抗氧化物质水平并抑制脂质过氧化反应导致的膜系统损伤,增强细胞对氧化应激的耐受能力。本研究结果展现了以水为溶剂获得的长茎葡萄蕨藻提取物具有良好的抗氧化效果,为进一步探索其抑制氧化应激的作用机制奠定了理论基础,为后续长茎葡萄蕨藻抗氧化功能产品的开发提供参考依据。
