益气活血化浊解毒方对脑缺血再灌注损伤大鼠脑组织VEGF、Notch1、Dll4表达的影响
2023-09-08谢占维孙玲玲石瑞孙亚萍崔怡娴田军彪
谢占维 孙玲玲 石瑞 孙亚萍 崔怡娴 田军彪
卒中是全球第二大死亡原因,也是导致疾病负担增加的第三大原因[1],其中缺血性卒中(cerebral ischemic stroke,CIS)占比约为62.4%,属中医学“中风病”范畴。静脉溶栓是急性缺血性卒中治疗的基石,尽管血管内治疗已经得到长足发展,但诸多患者仍因时间窗和禁忌症无法从中获益[2]。即使闭塞血管再通,缺血区恢复血流灌注,仍有神经功能受损风险,这与发生了脑缺血再灌注损伤(cerebral ischemic reperfusion injury,CIRI)有关[3]。有效保护神经血管单元(neurovascular unit,NVU)是改善中风患者神经功能最主要的策略。NVU主要由神经元、神经胶质细胞(少突胶质细胞、小胶质细胞和星形胶质细胞)、血管细胞(内皮细胞、周细胞和平滑肌细胞)和基底层组成,在卒中发生后的信号转导过程中发挥重要作用[4]。血管内皮生长因子(vascular endothelial growth inhibitor,VEGF)和Notch信号通路参与了神经、血管再生过程, 对于卒中后NVU的修复有调节作用[5-6]。益气活血化浊解毒方是依据“气虚血瘀,浊瘀毒损”的病机制定的中药复方。课题组前期化浊解毒活血通络方的研究表明[7-8],该方可以抑制Toll样受体4/核因子-κB(Toll-like receptor 4/nuclear factor-kappa B,TLR4/NF-κB)通路过度激活,降低促炎因子白细胞介素-1β(interleukin 1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)表达,调控Beclin1等自噬相关蛋白表达,发挥神经保护作用。本课题拟建立大鼠脑缺血再灌注损伤模型,探讨益气活血化浊解毒方对脑组织VEGF、Notch1、Dll4表达的影响,初步探究益气活血化浊解毒方对NVU的保护作用及相关机制。
1 材料与方法
1.1 实验动物
96只SPF级健康雄性SD大鼠,6~8周周龄,体质量(240±20)g,购于北京维通利华实验动物技术有限公司,动物许可证号:SCXK-(京)2021-0011。所有实验动物分笼饲养于河北中医学院实验动物中心屏蔽环境内,实验动物使用许可证号:SYXK(冀)2017-005,室温21~25℃,湿度50%~70%,均自由进食及饮水,实验动物于造模前适应性喂养7天,术前12小时禁食不禁水。本实验通过河北中医学院伦理委员会批准,伦理编号为:DWLL202205006。
1.2 实验药物
益气活血化浊解毒方药物组成:黄芪20 g、川芎15 g、石菖蒲15 g、地龙12 g、丹参15 g、赤芍15 g、黄连6 g、郁金12 g、茯苓12 g、泽泻10 g。为广东一方制药有限公司免煎颗粒制剂,批号分别为1040403、1043403、1030043、0113893、1012413、1031133、1052213、1051183、1050913、1041763。尼莫地平片规格为20 mg/片,批准文号为:国药准字H13022049,由河北医科大学制药厂生产。以上药物均购于河北省中医院药房。
1.3 主要试剂
2636A4型MCAO线栓(北京西浓科技有限公司),2%TTC染色液(G3005-500,北京索莱宝科技有限公司),4%细胞组织固定液(C01-06002-500ML,北京博奥森生物技术有限公司),苏木素—伊红染色液(珠海贝索生物技术有限公司),TRNzol总RNA提取试剂(天根生化科技北京有限公司),TaKaRa反转录试剂盒(RR047A,宝日医生物技术北京有限公司),TaKaRa qPCR反应体系(RR820A,宝日医生物技术北京有限公司),VEGF、Notch1、DLL4抗体(BA12086103、BJ12239265、AE042920,北京博奥森生物技术有限公司),β-actin(12w2944,江苏亲科生物研究中心有限公司),山羊抗兔二抗(BE0101,深圳易瑞生物技术有限公司),DAB显色试剂盒(216180927,北京中杉金桥生物技术有限公司)。
1.4 实验仪器
高速离心机(LDZ5-2型,北京离心机厂),干燥箱(MIR-153型,日本三洋公司),切片机(RM2015,德国莱卡公司),数码显微镜(BX43型,日本奥林巴斯公司),NanoDrop分光光度计(ND-2000型,Thermo fisher),荧光定量PCR仪(ABI7500型,Applied Biosystems),电泳仪、凝胶玻璃板、固定夹、垂直电泳槽、转移槽(北京六一仪器厂)。
1.5 动物模型制备
本实验采用Zea-longa线栓法制备大鼠大脑中动脉闭塞模型[9]。造模大鼠体质量250~280 g。用2%戊巴比妥钠(100 mg/kg)腹腔注射麻醉大鼠,仰卧位固定,颈部备皮,碘伏消毒后于颈部正中切口,逐层分离组织,暴露右侧颈总动脉,并将继续向远心端分离出一段颈内动脉和颈外动脉。于颈总动脉近心端和颈外动脉起始部穿线系活结,颈外动脉远心端系两个死结。用微动脉夹夹闭颈总动脉和颈内动脉,于颈外动脉中部剪一倒“v”型小口,用镊子将线栓插入血管,当线栓头部通过颈外动脉起始部进入颈总动脉,系紧颈外动脉起始部的线。在颈外动脉远端两个死结之间剪断,提起颈外动脉残端,打开颈内动脉处的微动脉夹,将线栓小心送至颈内动脉,线栓头端部朝着内上方小心向血管内推进,从颈内动脉和颈外动脉分叉处开始计算线栓插入长度约18~22 mm,当感觉有轻微阻力时停止进栓,此时线栓头部的小球即到达大脑中动脉的起始部。再次系紧颈外动脉起始部,打开颈总动脉处的微动脉夹,缺血2小时后拔出线栓,结扎血管并消毒缝合。假手术组仅进行血管分离及缝合,不插入线栓。待实验动物清醒后进行Zea-Longa神经功能评分[10],该评分分为0~4分:0分,无神经功能缺损症状;1分,瘫痪侧前爪不能完全伸展;2分,行走时向瘫痪侧偏移甚至转圈;3分,行走时向瘫痪侧倾倒;4分,不能自发行走并出现意识障碍。剔除0分和4分的动物,评分≥1分即可从神经缺损评分角度认为造模成功。
1.6 分组与给药
造模前随机选取12只作为假手术组,其余84只大鼠进行造模。本实验中,大鼠造模失败共19只,模型制备成功率约为77.4%。随机选取造模成功的60只大鼠,采用随机数字表法分为模型组、中药低剂量组、中药中剂量组、中药高剂量组和尼莫地平组,每组12只。中药低、中、高剂量组分别按照13.75g/(kg·d)、27.5 g/(kg·d)、55.0 g/(kg·d)进行中药灌胃,尼莫地平组按照9.375 mg/(kg·d)进行灌胃,假手术组和模型组予等量生理盐水灌胃,连续灌胃3天。连续再灌注72小时后腹腔注射2%戊巴比妥钠麻醉,断头获取脑组织,一部分-80℃冰箱保存,另一部分固定于4%多聚甲醛溶液。
1.7 观察和检测指标
1.7.1 神经功能缺损评分 脑缺血再灌注72小时后采用改良版大鼠神经功能评分(mNSS评分)进行评估,mNSS评分能从宏观上反映脑缺血大鼠病理状态的严重程度,是目前评价局灶性缺血模型构建和评价潜在治疗方案的“金标准”[11]。主要根据运动试验、感觉试验、反射丧失和不正常运动以及肌张力障碍等四项内容进行评分,共计18分。1~6分为轻度神经功能损伤,7~12分为中度神经功能损伤,13~18分为重度神经功能损伤。
1.7.2 脑梗死面积测定 脑缺血再灌注72小时后每组取3只大鼠腹腔注射2%戊巴比妥钠麻醉,3分钟内迅速断头取脑,放置于特定脑模装置内,-20℃冰箱内冷冻10分钟,冠状位将大脑用脑模均分为5片。将切好的脑片放入2% TTC 染液中,37℃避光染色20分钟,4%多聚甲醛固定,将染好的脑片排列于平板上拍照,正常脑组织着深红色,梗死脑组织成白色。随后应用Image J软件进行图像处理,测量脑片面积及梗死灶面积,并计算梗死灶面积占整脑面积百分比。
1.7.3 免疫组化检测脑组织VEGF蛋白表达 每组取3只固定于4%多聚甲醛溶液中的大鼠脑组织,石蜡包埋后切片,对切片进行脱蜡和水化处理。进行抗原热修复,双氧水去除内源性的过氧化物酶,分别滴加一抗VEGF(稀释比例1∶100),4 ℃冰箱过夜孵育,滴加山羊抗兔二抗工作液,使用DAB 显色,复染细胞核,返蓝后封片。以胞核及(或)胞浆中呈黄色至棕黄色表达为阳性细胞,每张切片随机选取3个高倍镜视野(×400),应用Image J软件测定阳性区光密度值,取其均值作为该鼠的平均光密度值。
1.7.4 q-PCR检测脑组织Notch1、Dll4 mRNA表达 从-80℃冰箱中取每组3只大鼠脑组织50 mg,剪碎放入研钵中研磨,采用TRNzol总RNA提取试剂进行样本RNA提取,使用NanoDrop分光光度计测定RNA浓度和纯度,采用TaKaRa PrimeScript RT reagent Kit进行反转录,以此cDNA作为荧光定量模板,引物由GENEWIZ提供,引物序列见表1,通过TaKaRa TB Green Premix Ex Taq II(2X)反应体系进行扩增。根据q-PCR检测结果,按照2-△△ct相对定量计算公式计算出各样品的目的基因相对定量结果。

表1 引物序列
1.7.5 Western blot检测脑组织VEGF、Notch1、Dll4蛋白表达 从-80℃冰箱中取每组3只大鼠脑组织100 mg,研磨至细粉末状,加入RIPA裂解液,离心提取上清液,测定蛋白浓度,95℃变性后SDS-PAGE 凝胶电泳,转模至PVDF膜上,封闭液中封闭1小时,将封闭后的膜放入一抗工作液中(VEGF、Notch1、Dll4稀释比例为1∶1000,β-actin稀释比例为1∶10000),4℃反应过夜。洗膜3次后放入二抗工作液中室温孵育1小时,再次洗膜后进行曝光洗片,扫描胶片,采用Image J软件测定Western blot条带灰度值。
1.8 统计学分析
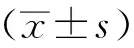
2 结果
2.1 各组大鼠神经功能缺损评分比较
假手术组无神经功能缺损,其余各组均有不同程度神经功能缺损表现。与假手术组相比,模型组神经功能缺损评分显著提高(P<0.05);与模型组相比,中药低、中、高剂量组及尼莫地平组大鼠神经功能缺失评分均有所降低(P<0.05),其中中药高剂量组神经功能缺失评分下降最为明显。各治疗组组间比较结果显示,除中药低、中剂量组与尼莫地平组无统计学意义外,余治疗组间均有显著差异。结果见表2。
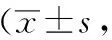
表2 各组大鼠神经功能缺失评分比较鼠只=12)
2.2 各组大鼠脑梗死面积比较
假手术组大鼠脑组织TTC染色通体呈深红色,其余各组均可见白色梗死灶。与假手术组相比,模型组大鼠脑梗死面积显著增加(P<0.05);与模型组相比,中药低、中、高剂量组及尼莫地平组大鼠脑梗死面积均显著缩小(P<0.05),其中中药高剂量组梗死面积缩小最为显著。各治疗组组间比较结果显示,中药中剂量组与尼莫地平组组间无统计学差异,其余各治疗组间均有明显差异。结果见表3、图1。

图1 各组大鼠脑组织TTC染色
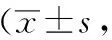
表3 各组大鼠脑梗死面积百分比比较鼠只=3)
2.3 各组大鼠脑组织VEGF蛋白免疫组化比较
光镜下观察到VEGF蛋白主要表达于脑缺血区神经细胞胞浆中,呈现棕黄色。与假手术组相比,模型组大鼠平均光密度值显著增大(P<0.05);与模型组相比,中药低、中、高剂量组及尼莫地平组平均光密度值显著增大(P<0.05),其中中药高剂量组平均光密度值增大最为明显,中药低剂量组、中药中剂量组、尼莫地平组组内比较无统计学意义,但与中药高剂量组比较均有统计学意义(P<0.05),结果见表4、图2。

图2 各组大鼠脑组织VEGF蛋白表达免疫组化(×400)
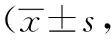
表4 各组大鼠脑组织VEGF蛋白表达的平均光密度值比较鼠只=3)
2.4 各组大鼠脑组织Notch1、Dll4 mRNA表达水平比较
与假手术组相比,模型组大鼠脑组织Notch1、Dll4 mRNA表达增加(P<0.05);与模型组相比,中药低、中、高剂量组及尼莫地平组大鼠脑组织Notch1、Dll4 mRNA表达明显增加(P<0.05)。其中中药高剂量组大鼠脑组织Notch1、Dll4 mRNA表达最显著,中药低剂量组、中药中剂量组、尼莫地平组与中药高剂量组相比有统计学意义(P<0.05)。结果见表5。
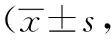
表5 各组大鼠脑组织Notch1、Dll4 mRNA表达比较鼠只=3)
2.5 各组大鼠脑组织VEGF、Notch1、Dll4 蛋白表达水平比较
与假手术组相比,模型组大鼠脑组织VEGF、Notch1、Dll4蛋白表达增加(P<0.05);与模型组相比,中药低、中、高剂量组及尼莫地平组大鼠脑组织VEGF、Notch1、Dll4 蛋白表达明显增加(P<0.05)。中药高剂量组大鼠脑组织VEGF、Notch1、Dll4 蛋白表达最为显著,中药低剂量组和尼莫地平组大鼠脑组织VEGF、Notch1、Dll4蛋白表达与中药高剂量组相比有统计学意义(P<0.05),中药中剂量组大鼠脑组织的VEGF与Dll4蛋白表达与中药高剂量组相比亦有统计学意义(P<0.05)。结果见表6、图3。

注: A 假手术组;B 模型组;C 中药低剂量组;D 中药中剂量组;E 中药高剂量组;F 尼莫地平组。图3 各组大鼠脑组织VEGF、Notch1、Dll4 蛋白表达比较
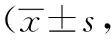
表6 各组大鼠脑组织VEGF、Notch1、Dll4蛋白相对表达量比较鼠只=3)
3 讨论
缺血性中风患者以老年人多见,患者年老气虚或久病体虚导致血运无力,瘀血阻滞经脉,脑失所养、神机失守,发为中风。脑为“元神之府”,是主宰生命活动的重要器官,卒中发生后气机逆乱,血不行则生瘀血,津不化则酿生痰浊,痰热瘀血酝酿化毒,火热毒邪盘踞于内,进一步损伤脑络,使病情加重或反复发作,遂认为“气虚血瘀”是CIS的重要病理基础,“浊瘀毒损”是CIS的主要病机特点,故提出益气活血化浊解毒方。方中黄芪益气补虚,旨在“气旺则血行”,川芎为血中之气药,通达脑络气血,石菖蒲化痰开窍,三药为君。地龙息风通络,丹参去瘀生新,赤芍凉血活血,茯苓健脾滲湿,共为臣药。郁金活血理气,清心开窍。黄连苦能去浊,泽泻渗湿泄热,为方中之佐药,川芎又可引诸药上达头目,为方中之使药,全方共奏益气通络化浊解毒之功。本方在传统益气活血方药的基础上,增强对风、火、痰、瘀、毒等病理因素及其成因的干预,将益气活血与化浊解毒功效的常用中药酌量配伍,已在临床中取得良好的临床效果,但其具体作用机制尚不明确,遂对其开展基础研究。
CIRI是CIS发生后最主要的病理生理过程,血脑屏障(blood-brain barrier,BBB)损伤、炎症反应、氧化应激、兴奋性氨基酸释放、钙超载等诸多环节参与其中,各环节相互关联和重叠,最终导致缺血区细胞的凋亡或坏死[12]。神经与血管功能之间的密切联系是脑血循环最显著的特征之一。有研究表明,CIS会导致NVU稳态遭到破坏,NVU中的细胞和非细胞基质组分相互作用联系,共同引起BBB通透性破坏,神经元功能障碍,神经传导束传导异常[13]。BBB是NVU表现出的一种功能表型,其紧密连接结构被认为是构成BBB的重要结构和功能基础[14-15]。课题组前期研究表明[16-17],化浊解毒活血通络方通过增加闭锁小带蛋白1(zonula occludens protein,ZO-1)、闭合蛋白(Occludin)等紧密连接蛋白表达,减少水通道蛋白4(aquaporin 4,AQP4)、水通道蛋白9(aquaporin 9,AQP9)等水通道蛋白表达,来调节血管内皮间紧密连接,减轻血管源性水肿,进而调节NUV各组分间的关系,发挥神经保护作用。维持NVU稳态是改善缺血性卒中的要点,VEGF和Notch信号通路在保护NVU,减轻CIRI损伤方面发挥重要作用[18-19]。
VEGF是一种具有血管通透性的蛋白质,是血管和淋巴管发育的主要调节因子,参与脑缺血后的血管生成、能量代谢、轴突生长等一系列神经损伤修复的过程[20-21]研究表明,在缺血、缺氧和低灌注的刺激下,VEGF在神经元、血管内皮、小胶质细胞、星形胶质细胞的表达显著上调,通过促进血管新生以改善局部血流发挥脑保护作用。VEGF作为神经营养因子家族成员,可以调节神经元的可塑性,增强神经元的生存活性来发挥神经修复功能[22-23]。Notch信号通路是在进化上高度保守的单次跨膜信号受体蛋白家族,它可由VEGF激活,亦可刺激VEGF表达[24]。Notch信号通路由Notch受体(Notch1-Notch4)、Notch配体(Dll1、Dll3、Dll4,Jagged 1和Jagged 2)和转录因子CBF1/RBP-Jκ组成[25]。有研究表明[26-27],Notch1可以诱导梗塞周围区域的血管生成,抑制小胶质细胞活化减轻脑缺血后的炎症反应,阻断Notch1的表达会导致神经营养作用消失。He Huang等人的研究还证实[28],Notch1还可通过促进神经干细胞分化改善神经功能。Dll4主要在新生血管尖端细胞中表达,可以与邻近细胞的Notch受体结合,激活Notch信号通路促进新生血管形成[29]。Dll4也可以通过调控Notch信号诱导神经生发的过程[30]。
本研究结果表明,益气活血化浊解毒方可以改善大鼠神经功能缺损,减少大鼠脑梗死面积,增加脑皮质缺血区VEGF、Notch1、Dll4蛋白表达和Notch1、Dll4 mRNA的表达,推测益气活血化浊解毒方可以通过VEGF/Notch通路保护NVU发挥脑保护作用。中药具有多组分、多靶点、多机制的作用特点,符合NVU多细胞的结构、功能特点及“多细胞保护”治疗策略。课题组将进一步研究益气活血化浊解毒方对NVU的作用机制,为其在临床中使用和推广提供实验基础和理论依据。
