针刺对抑郁大鼠海马FKBPs/GR/BDNF信号通路相关因子表达的影响
2023-09-08李佳豪王建云李静兰李北平王海军
李佳豪 王建云 李静兰 李北平 王海军
抑郁症是一种临床常见的精神障碍疾病,以持续情绪低落、思维认知障碍、运动减缓为主要临床特征[1]。不仅严重影响着人们的生活,甚至对整个家庭带来各种程度的伤害。近几年有关抑郁症的研究都紧扣着海马神经元的损伤与修复这一重要环节。海马是一个十分容易受损的边缘结构,长时间的慢性应激刺激会极易导致海马神经元细胞减少,引起情绪和认知的改变,在多数抑郁症发生的过程中扮演着突出作用[2]。研究发现,海马组织能否实现对神经功能的调节,取决于大脑海马内各个神经因子能否启动神经细胞内的信号传导[3]。
FKBP51与FKBP52是应激蛋白Hsp90的分子伴侣蛋白,发挥着调节类固醇激素受体活性的作用,它们能够调控糖皮质激素受体(glucocorticoid receptor,GR)的敏感度,抑制了GR的核转移[4-5],同时,FKBP51还可以催化GR成熟,调在应激反应的中起调节作用[6]。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是神经生长存活的重要分子,研究证据表明BDNF参与情绪障碍,在慢性应激活动中,GR/BDNF通路是引发相关抑郁症发生的关键[6]。BDNF的缺失可致使神经元数量减少,多巴胺受体在低水平的BDNF介导下,导致神经元发育异常[7]。此信号通路被视为治疗抑郁的下游靶标,通过将BDNF补充到大脑中可以在动物实验中观测到其能够发挥类同与抗抑郁剂样效应[8]。并且,对于慢性应激模型动物的行为学检测可以证实海马BDNF的蛋白表达出现下降趋势,这也体现出在情绪障碍疾病中BDNF的重要意义[9]。
通过以上论述,我们有理由认为应激伴侣蛋白FKBP51和FKBP52可以调节GR的敏感性,进一步影响着BDNF的表达,腧穴“解郁方”是否可以通过此途径治疗抑郁症,由此我们可以通过动物实验深入观察基于FKBPs-GR-BDNF信号通路,探求腧穴“解郁方”在治疗抑郁症时发挥的效应机制。
1 材料与方法
1.1 实验动物
由北京斯贝福生物技术有限公司[许可证号:SCXK(京)2019-0010]提供SPF级SD雄性大鼠40只,均重(200±20)g。本实验方案经过本单位伦理委员会批准(批号:2020E2M07)。在山西中医药大学实验中心清洁级动物实验室开展实验饲养观察,预养1周后进行均衡随机化分为4组,空白组、模型组、针刺组,药物组,每组10只。空白组大鼠同笼饲养,其余3组采用单笼孤养的方式进行实验。
1.2 主要仪器
切片机(湖北,亚光YGQ-Ⅲ);石蜡包埋机(湖北,亚光YB-6LF);数显恒温水浴锅(上海,邦西HH-4);凝胶成像分析仪(美国,Bio-rad U-niversalHood);光学显微镜(日本,尼康 Nikon H550L);自制旷场实验箱(100 cm×100 cm);大鼠笼和大鼠固定板(由山西中医药大学实验室提供);一次性针灸针(0.3 mm×13 mm)由北京中研太和医疗器械有限公司提供。电泳仪(BIO-RAD,mini protean 3 cell);电转仪(HOEFER,TE77XP);酶标仪(芬兰雷勃,MK3);成像系统(Tanon,Tanon-5200)。
1.3 主要试剂
盐酸帕罗西汀(由浙江尖峰药业有限公司生产,201102)。伊红/苏木素染色液(北京雷根生物技术有限公司);AR0030 PBS 缓冲液(博士德);二甲苯/多聚甲醛(天津市北辰方正式试剂厂);裂解液(碧云天);氯化钠注射液(石家庄四药有限公司);BCA蛋白定量试剂盒(Thermo,PICPI23223);发光液(Millipore,WBKLS0100);RIPA组织细胞快速裂解液(WKSUBIO,YC0020)。
1.4 造模方法
本实验使用慢性不可预知性的温和刺激法进行模型制备,要保证动物无法预料刺激的发生,同时还需要避免连续使用相同的刺激。经预实验检验能够造模成功,且避免因刺激过于强烈导致动物死亡的情况。实验选取了7种不同的温和刺激方式一起配合使用,包括有:4℃冷水游泳5分钟、24小时禁水、24小时禁食、昼夜颠倒、吹热风5分钟、3小时束缚,夹尾5分钟,对模型组三针刺组和药物组大鼠每天随机选择1种应激刺激方式,并保证1周内平均每一种应激方式均被选择1次,按照随机原则将每种应激方式安排在28天当中。参考文献进行制备[10]。
1.5 干预方法
空白组:不施加任何应激刺激因素,每笼五只,正常喂养。模型组:孤养,每笼一只,给予28天的不可预见应激刺激。针刺组:孤养,每笼一只,施加28天的应激刺激,选取燕平教授团队前期通过实验论证治疗抑郁症的经验腧穴组方:“百会”“神门(双)”“太冲(双)”[11]。参照《实验动物针灸穴位图谱》取穴。“百会”位于大鼠头顶骨正中;“神门”位于大鼠前肢内侧腕部横纹尺骨桡侧缘凹陷中;“太冲”定位在大鼠足背第一、二跖骨间凹陷处。从造模第1天开始行针刺治疗,针刺角度均为平刺,深度为0.2~0.5 cm,留针20分钟,1次/天。药物组:孤养,每笼一只,进行28天的应激刺激,从实验开始当天给予药物盐酸帕罗西汀,给药剂量为3.3 mg/kg,临用时溶于蒸馏水配成混悬液,以1 mL/100 g灌胃给药。
1.6 观察指标和检测方法
1.6.1 大鼠体质量的测定和一般情况观察 在每天上午8点安静状态下观察记录大鼠的基本活动情况,对各组大鼠的排便和精神活动状态进行观察记录;并在造模实验开展前1天和第28天对各组大鼠进行称重。
1.6.2 行为学检测 旷场实验:自制敞箱,将箱底等分5×5共25格,观察者避免大声惊吓动物,单只单箱开展实验。分别于造模开始的前1天及实验第28天记录各组每只大鼠的水平跨越移动格数与上肢直立的次数。
糖水消耗实验:在造模开展的前3天适应性给予1%蔗糖水,第一天每笼2瓶,第二天1瓶,第3天禁水1晚;造模的前1天,每笼分别给1瓶1%蔗糖水和纯水;24小时后,取出水瓶,称重计量。实验第28天后,重复此糖水消耗实验,对每只大鼠的糖水消耗量称重记录。
1.6.3 免疫蛋白印迹法检测GR、BDNF、FKBP51和FKBP52表达情况 大鼠取血完成后,迅速暴露其脑组织,在冰块上小心地将大鼠海马组织完整取出,用生理盐水冲洗后,将海马脑段分成左右两段,将其中一段置入标记好的EP管中,置于液氮中速冻备用;另一段海马组织用4%多聚甲醛固定液固定6小时以上(4℃),标记。
在冰上将组织剪成小碎片,将0.5 mL裂解液与40 mg组织放入匀浆器中使组织完全裂解。裂解后的样品4℃ 12000 r/min离心15分钟,取上清,进行蛋白质定量。先准备酶标板各孔标好,将配制比例为50∶1的BCA工作液,加入到酶标板中震荡混匀,测定吸光值,并绘制标准曲线。将样品溶液稀释,所得溶液共20 mL,与200 mL的BCA工作液混匀,37℃下静置0.5小时后,以0号管做为参照,测定吸光值。再将样品的吸光值代入标准曲线计算出相应的蛋白含量(mg),进而得到样品实际蛋白浓度(实际蛋白浓度=蛋白含量×稀释倍数/20)。然后依据蛋白分子量的大小确定凝胶浓度,配置聚丙烯酰胺下层分离胶与浓缩胶,完成蛋白电泳后进行转模。将NC膜放平皿中,加入封闭液,摇床振荡2小时,用TBST洗膜5分钟,重复三次,稀释一抗,放至平皿中,放NC膜置摇床上,在4℃下过夜,第2日取出NC膜,使用TBST洗涤3次,每次10分钟,加二抗稀释液稀释二抗,把NC膜放置二抗中,室温摇床振荡反应2小时,将NC膜夹出,TBST洗涤3次,每次5分钟。配ECL显色液,取ECL显色液A和B等量混匀加在膜的正面暗室避光5分钟,使用G:BOX chemiXR5扫描成像;使用Gel-Pro32软件对结果进行灰度分析。
1.6.4 HE染色观察大鼠海马CA3区锥体细胞的变化 从抗冻缓冲液中选取大鼠脑组织切片,先二甲苯脱蜡,再用酒精梯度浓度浸泡,最后蒸馏水冲洗。然后入苏木精水溶液中进行染色,根据染色程度调整时间,约为5分钟。再在乙酸水和氨水中分化颜色,流水冲洗。然后用伊红染色,时间2分钟。分别以70%、80%、90%、纯酒精进行梯度脱水,用二甲苯透明切片,晾干加胶后压盖玻片封固。在光镜下观察海马组织,并用BX53荧光显微成像系统拍照记录。
1.7 统计学处理
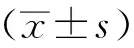
2 结果
2.1 各组大鼠的一般情况
在进行适应性喂养1周以后,各组大鼠的精神体貌和活跃度均表现良好,施加应激前各组大鼠体质量对比无明显差异。在持续的慢性应激过程中:空白组大鼠因未施加任何干预,其毛色、活动度均表现良好,大便无异常;模型组与之进行比较,精神状态、活跃度差,出现焦躁、啃咬鼠笼等情况,大便稀溏时有出现,且毛色欠光;针刺组精神状态相对良好,大鼠反应基本灵敏,毛色尚有光泽,大小便正常;药物组精神状态一般,毛色缺乏光泽,出现大便时干时稀的情况。
大鼠实验前后体质量的变化:实验后,模型组与空白组大鼠体质量增长明显降低,存在显著差异(P<0.05);针刺组与药物组同模型组相比较,具有统计学差异(P<0.05)。见表1。

表1 实验前后各组大鼠体质量的变化
2.2 各组大鼠行为学检测结果比较
2.2.1 各组大鼠旷场实验结果的比较 实验开始前,各组大鼠旷场实验水平运动和直立次数没有表现出明显的差别(P>0.05);经过28天的应激干预后,空白组大鼠较之前的行为学表现上没有发生明显改变,而模型组大鼠水平与直立运动较第1天所测频次明显减少(P<0.05),说明造模成功。施加28天应激刺激并进行治疗干预的针刺组与模型组相比较,水平与直立次数存在差异(P<0.05),同时也可以观察到药物组与模型组的行为学检测对比差异具有统计学意义(P<0.05)。见表2。
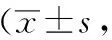
表2 各组大鼠旷场实验水平运动和站立次数应激前后比较次)
2.2.2 各组大鼠糖水摄入量的结果比较 由表3可见,实验开始前,各组大鼠糖水摄入量对比无明显差异(P>0.05),施加应激刺激28天后,各组大鼠的糖水摄入量发生明显改变,模型组大鼠糖水摄入明显降低,并且显著低于空白组(P<0.05),针刺组与药物组糖水摄入量明显高于模型组,差异有统计学意义(P<0.05)。但是针刺组与药物组之间的糖水摄入差异不明显(P>0.05)。

表3 各组大鼠糖水摄入量实验前后比较
2.3 各组大鼠海马的GR、BDNF、FKBP51和FKBP52的蛋白表达结果
如表4、图1所示,模型组比空白组大鼠的FKBP51蛋白表达有所增加,而GR、BDNF、FKBP52的蛋白表达降低;针刺组与模型组相比,GR、BDNF、FKBP52平均光密度值显著提升,FKBP51的蛋白表达有所降低(P<0.05);药物组与模型组比较其上调GR、BDNF、FKBP52与降低FKBP51的蛋白表达能够取得类同与针刺组的治疗效益,但针刺组与药物组治疗所产生的效应趋势无统计学差异(P>0.05)。

图1 各组大鼠海马GR、BDNF、FKBP51和FKBP52的蛋白表达情况

表4 各组大鼠海马GR、BDNF、FKBP51、FKBP52水平的比较
2.4 各组大鼠海马CA3区锥体细胞的形态结构、数目的影响
在400倍镜视野下可观察到空白组大鼠海马CA3区大量的锥体细胞排列有序,细胞核蓝染均匀,核仁明显,胞质均匀,细胞形态结构未见异常改变;与之相对比,模型组的锥体细胞数目明显减少,细胞畸形、间隙增大,且细胞排列不规则。许多的细胞胞浆空泡状明显,细胞核呈脊状、三角形或不规则突起,出现了明显的形态结构病理改变。与模型组比较,药物组大部分椎体细胞相对完整、细胞与周围组织联系较为紧密、虽然有部分胞核出现固缩呈不规则形,但形态优于模型组,有部分胞核出现固缩呈不规则形,细胞核蓝染欠均匀、细胞质较为均匀致密;针刺组锥体细胞整体形态要优于模型组和药物组,偶有胞浆空泡状染色质边集、个别细胞胞核固缩呈三角形,见图2。

注:A为空白组;B为模型组;C为药物组;D为针刺组。图2 镜下观察各组大鼠海马CA3区锥体细胞的形态结构的差异(HE,×400)
3 讨论
本实验选用腧穴“解郁方”由百会、神门、太冲三穴组成,是山西中医药大学燕平教授团队筛选出的对抑郁症有明确疗效的组穴,并且进行了大量的实验论证[12-14]。百会,位巅上,属督脉,称“三阳五会”,手足三阳经之阳气汇聚之处。宋代《铜人腧穴针灸图经》中记载:“惊悸健忘针百会二分,得气即泻,可灸……又治思虑过多,心下怔仲,或自悲感慨。”《针灸大成》中有“百会心烦闷,惊悸健忘,忘前失后,心神恍惚”。百会从属督脉,督脉为阳脉之海,与大脑关系密切。针刺百会穴可振奋阳气、醒脑开窍、安神定志;神门穴为手少阴心经的输穴、原穴,为心气出入之门户,有益气宁心、通络安神之功,《灵枢·五邪》篇论:“邪在心,则病心痛喜悲,时眩仆,视有余不足而调之其输也。”心主血脉,又主神明。刺本穴可开心气之郁结,可以减少抑郁焦虑症状,治疗各种情志疾病;太冲穴属阴主血为足厥阴肝经的输穴、原穴,厥阴经多血少气;五脏有疾当取之十二原,针灸该穴可以调整肝脏气机从而起到保护肝脏,平稳情志,发挥“肝主疏泄,调情志”的作用,使情志和调,气血和畅;三穴相配能振奋心阳,益气和血,疏肝解郁从而治疗抑郁症。
本实验通过免疫蛋白印迹法测定各组海马GR、BDNF、FKBPs蛋白的表达水平情况,动物应激模型中,大鼠海马GR、BDNF水平均出现了降低,且比较空白组有明显差异。说明在慢性应激刺激下,导致GR受体表达下降,不能完全介入HPA轴进行负反馈调节,与此同时GR的表达可能会影响脑神经营养因子BDNF的表达,我们观察针刺组与药物组可以帮助应激大鼠海马GR和BDNF的表达增高,这与观察到的行为学抑郁状态的改善是一致的。BDNF作为非常重要的脑神经营养因子,它对大脑神经元的保护是十分明确的,BDNF能够通过多种分泌方式与其受体结合,是5-HT能神经元的生长因子[15-16]。当机体BDNF的水平迅速下降,会导致神经元树突状结构异常促使中枢神经神经元减少,进一步导致神经元损伤、神经的可塑性发生改变[17-18]。本次实验结果显示,慢性应激会升高FKBP51的蛋白表达,降低GR、BDNF、FKBP52的蛋白表达,促使海马神经元的可塑性下降,导致海马神经的功能受损。针刺“解郁方”可以提高FKBP52、GR和BDNF的表达,提高神经元的可塑性,从而发挥抗抑郁效益。
海马区是主要调控一些情绪反应与学习记忆的重要脑区,其中海马CA3区含有丰富的椎体神经细胞,对神经反射调节极其敏感,同时该区的神经元突触结构也最易发生可塑性改变[19-20]。既往的研究发现CUMS干预会引起大鼠脑内海马神经元超微结构出现损伤,导致海马神经元萎缩和凋亡,是抑郁症的重要原因[21]。通过本实验微观形态上观察可以清楚地看出,慢性应激会使大鼠海马CA3区大量的锥体细胞形态结构出现不同程度的损伤,细胞数量减少,出现许多锥体细胞肿胀,胞浆呈空泡状,细胞核呈脊状、三角形或不规则突起。
本研究观察到针刺“解郁方”和给予药物帕罗西汀对应激大鼠海马CA3椎体细胞形态有着不同程度的改善。在肯定针刺治疗疗效的同时,我们也应更多的关注海马神经元及其功能的修复在治疗中的重要性,可以基于此方面,进一步挖掘当前有关精神障碍类疾患的发病与治疗机制。
