苦参抗水产病原哈氏弧菌活性物质的提取、鉴定及作用机制
2023-09-06郭斯崖郑慧芳张淼蔡静王鑫彤郭雷
郭斯崖,郑慧芳,张淼,蔡静,王鑫彤,郭雷
(1.江苏海洋大学江苏省海洋生物产业技术协同创新中心,江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005;2.江苏海洋大学海洋食品与生物工程学院,江苏省海洋生物技术重点实验室,江苏 连云港 222005;3.江苏海洋大学药学院,江苏省海洋药物活性分子筛选重点实验室,江苏 连云港 222005)
随着世界水产养殖业的不断发展,特别是高密度养殖技术的推广,水产养殖动物疾病的暴发和流行已日益成为影响水产养殖业的主要因素[1]。由哈氏弧菌(Vibrio harveyi)等弧菌属细菌所引起的暴发性弧菌病是危害水产养殖动物最严重的疾病之一。该病可感染多种鱼、虾、贝类,造成大量死亡,给水产养殖业带来巨大的经济损失[2-4]。目前,主要用抗生素预防和治疗弧菌病。但是,长期使用抗生素会导致耐药菌株的出现,给水生动物疾病的治疗带来困难和水产品、环境和人体一定危害[5,6]。因此,对海水养殖病原弧菌开展防治至关重要。
中草药具有资源丰富、残留少、副作用小、安全性高等优点[7],已成为替代水产抗生素的重点药物[8,9]。中草药苦参(Sophora flavescenes Ait)为豆科植物苦参的干燥根,含有种类丰富的化合物,包括生物碱、黄酮、三萜皂苷、木质素及酚酸等[10]。苦参作为传统中药材,有几千年的药用历史,临床应用广泛,有抗肿瘤、抗病毒、抗病原微生物、抗氧化、抗炎等作用[11],已被中国农业农村部批准用于防治水生动物疾病[12]。但其抗菌活性物质尚不清楚,整体疗效也不稳定。
鉴于此,本文采用单因素实验、Box-Behnken 设计和响应面法优化苦参抗水产病原哈氏弧菌活性物质(ASSF)的提取工艺以富集其抗菌活性物质,利用高效液相色谱法(HPLC)和牛津杯法对其主要抗菌化学成分进行鉴定,最后通过细菌生长曲线、紫外吸收、电导率和扫描电镜法研究ASSF 对哈氏弧菌的作用机制,以期为苦参在水产病害防治中的应用提供依据。
1 材料和方法
1.1 材料
苦参购自安徽亳州中药厂;苦参酮购自成都埃法生物科技有限公司;哈氏弧菌1.8690 购自中国普通微生物菌种保藏管理中心(CGMCC,北京);MH肉汤培养基购自杭州百思生物技术有限公司;碱性磷酸酶测定试剂盒购自南京建成生物工程研究所;除色谱级甲醇外,其他有机试剂均为分析纯,购自上海国药集团化学试剂有限公司。
1.2 方法
1.2.1 单因素实验
苦参经粉碎后过40 目筛,每次实验准确称量1.0 g 苦参粉末。首先考察了提取溶剂(蒸馏水、50%甲醇、甲醇、50%乙醇、乙醇)对提取物抑菌活性的影响。将20 mL 不同提取溶剂和1.0 g 苦参粉加入250 mL 磨口锥形瓶中,上置冷凝器。提取过程在80 ℃下HH-4 恒温水浴锅中进行,提取120 min。其次,考察不同浓度乙醇对提取物抑菌活性的影响。将20 mL 不同浓度的乙醇(60%~100%)和1.0 g 待提取粉末加入250 mL 磨口锥形瓶中。在80 ℃下恒温水浴提取120 min。第三,将20 mL 无水乙醇和1.0 g 待提取粉末加入250 mL 磨口锥形瓶中,在不同提取温度(60 ℃、70 ℃、80 ℃、90 ℃、100 ℃)下水浴提取120 min,考察提取温度对提取物抑菌活性的影响。第四,将20 mL 无水乙醇和1.0 g 待提取粉末加入250 mL 磨口锥形瓶中,在90 ℃条件下提取60 min、90 min、120 min、150 min 和180 min,考察提取时间对提取物抑菌活性的影响。最后,分别向250 mL 磨口锥形瓶中加入不同体积的无水乙醇(10 mL、20 mL、30 mL、40 mL、50 mL)和1.0 g 待提取粉末,在90 ℃条件下提取120 min,考察液料比对提取物抑菌活性的影响。进行上述步骤后,将提取物以5 000 r/min 转速离心10 min,然后抽滤。将滤液稀释或浓缩至20 mL,用于测定抗哈氏弧菌的活性。
1.2.2 Box-Behnken 设计
采用Box-Behnken 设计优化提取条件,利用Design Expert 7.0.0(Stat-Ease,Minneapolis,USA)分析实验数据,建立模型[4]。BBD 由17 个测试点组成,其中12 个是阶乘点,5 个是中心点的重复。以提取温度(X1)、提取时间(X2)、液料比(X3)为自变量,以提取物对哈氏弧菌的抑菌圈直径为响应变量(Y,mm)。表1 给出了自变量的范围和级别以及响应变量的值。
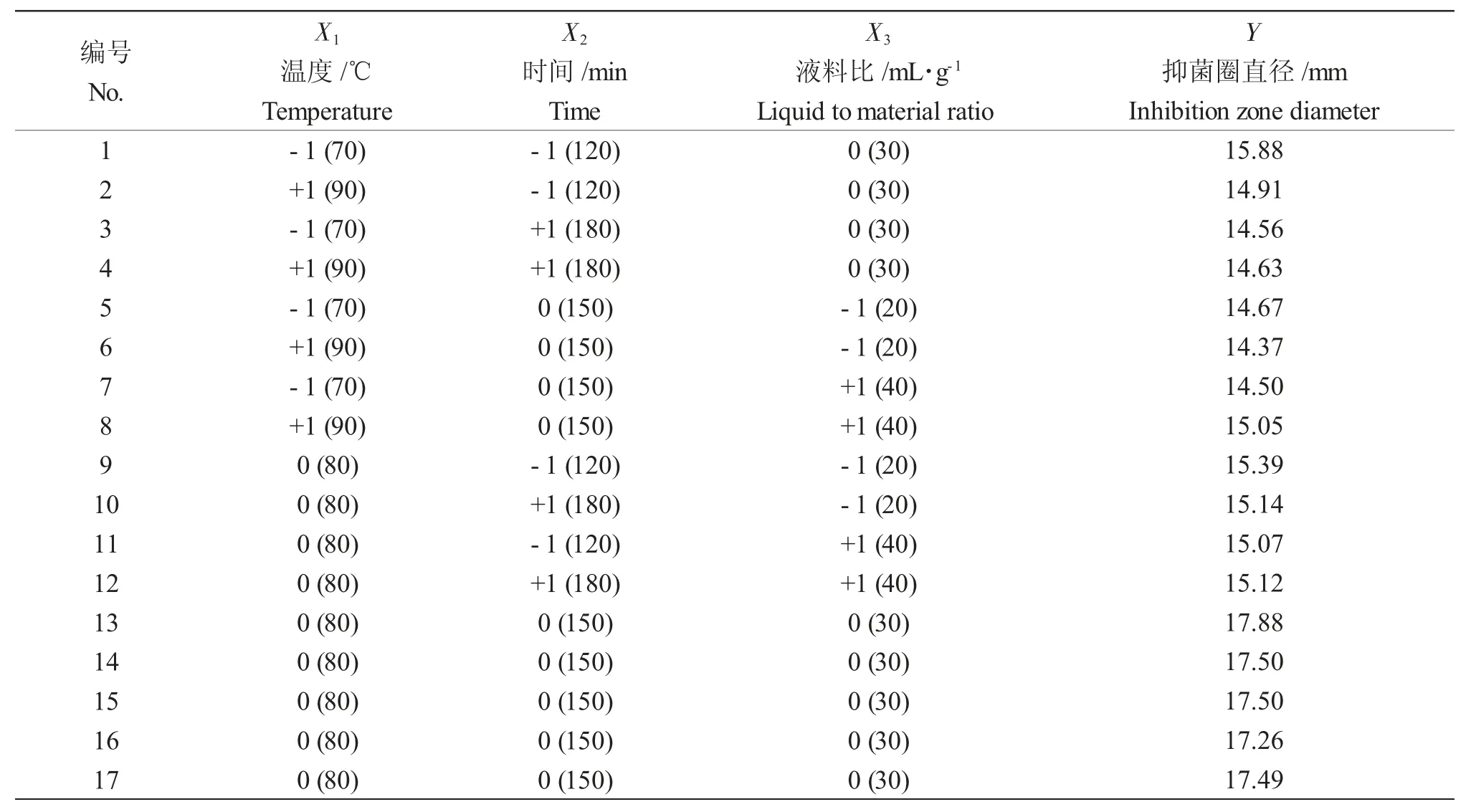
表1 Box-Behnken 设计方案与结果Tab.1 The range and level of the independent variables and the observed values of Box-Behnken design
使用Design Expert 7.0.0 软件获得提取物对哈氏弧菌抑菌圈的最大直径,采用以下二阶多项式方程来评价系统模型:
式中,Y 为预测的响应值;β0,βi,βii和βij为截距、线性、二次项中的回归系数;Xi和Xj是独立因子。
1.2.3 高效液相色谱法鉴定ASSF 中的化学成分
通过查询文献发现,苦参中含有苦参酮等有效成分。本实验采用苦参酮标准品作为参考化合物,通过高效液相色谱法(HPLC)比较参考化合物和ASSF 的色谱图来鉴定ASSF 的主要化学组成[13]。使用Agilent 1260 高效液相色谱仪,色谱柱CLC-ODS(10.0 mm×250 mm,5 μm,1.5 mL/min),检测波长为295 nm。流动相为水、0.1%磷酸(溶剂A)和甲醇(溶剂B)。梯度洗脱程序如下(v/v):0 min 30% B,20 min 80% B,45 min 90% B,60 min 100% B,70 min 100% B。
1.2.4 牛津杯法
采用牛津杯法测定提取物抗哈氏弧菌的活性[7]。将20 mL MH 肉汤培养基倒入平板,凝固后,取100 μL 哈氏弧菌菌悬液(1×106cfu/mL)均匀涂布在培养基上。将牛津杯放置在培养基上,然后向杯中加入200 μL 样品溶液,37 ℃培养24 h,测定抑菌圈直径。以抑菌圈直径的平均值(mm,n=3)作为样品抗哈氏弧菌的活性。通过上述方法测定ASSF 及其主要化学成分(苦参酮等)对哈氏弧菌的最小抑菌浓度(MIC)。将ASSF 及苦参酮等化合物分别溶于甲醇中,用二倍稀释法制成系列浓度的样品溶液,测定抑菌圈直径。以该化合物能产生抑菌圈的最低浓度定义为MIC[14]。
1.2.5 试管稀释法
采用试管稀释法测定ASSF 和苦参酮对哈氏弧菌的MIC。将ASSF 和苦参酮分别溶于甲醇中,采用二倍稀释法进行稀释。向装有4 mL MH 肉汤培养基的试管(20.5 cm×2.5 cm)中加入1.0 mL 哈氏弧菌菌悬液(1×106cfu/mL)和50 μL 不同浓度的样品溶液,同时以甲醇50 μL 作为阴性对照。将试管充分混合并在37 ℃和160 r/min 下培养。24 h 后,肉眼观察无细菌生长的最低化合物浓度定义为MIC,48 h后,视肉眼无菌生长的最小化合物浓度定义为MBC[15]。
1.2.6 细菌生长曲线
将100 倍MIC 浓度的ASSF 和100 倍MBC 浓度的ASSF 溶于甲醇中配制样品溶液。然后分别向装有20 mL MH 肉汤培养基的50 mL 锥形瓶中加入200 μL 100 倍MIC 浓度的ASSF 和100 倍MBC 浓度的ASSF 样品溶液,以甲醇作为阴性对照。将溶液充分混匀后,分别向锥形瓶中加入200 μL 哈氏弧菌菌悬液(1×106cfu/mL)。在37 ℃和160 r/min 下水浴振荡培养24 h,培养0 h、3 h、6 h、9 h、12 h,及24 h 时分别取样200 μL,测定620 nm 处的吸光度,实验设三组重复。以吸光度的平均值为纵坐标,培养时间为横坐标绘制细菌生长曲线。
1.2.7 细胞膜的完整性和通透性
当细菌细胞膜被破坏时,蛋白质、DNA 和RNA等生物内源性紫外线吸收材料会泄漏。测定细菌上清液在260 nm 处的吸光度可以分析细胞膜的完整性[16]。将100 倍MIC浓度和100 倍MBC浓度的ASSF溶于400 μL 甲醇中,将样品溶液及阴性对照400 μL 甲醇加入到装有40 mL 的MH 肉汤培养基的100 mL 的锥形烧瓶中。向锥形瓶中分别加入400 μL 哈氏弧菌悬液(1×106cfu/mL)后充分混匀。在37 ℃和160 r/min 下水浴振荡培养,分别在0 h、1 h、2 h、3 h 和4 h 收集4.0 mL 细菌样品装入10 mL 离心管,在5 000 r/min 下离心10 min,测定上清液在260 nm 处的吸光度。实验设三组平行,分别以平均吸光度和培养时间为纵坐标和横坐标,研究ASSF对哈氏弧菌细胞膜完整性的影响。
通过测定ASSF 处理的哈氏弧菌悬液的电导率来评估细胞膜的渗透性。在260 nm 处测定吸光度后,将2.0 mL 上清液和8.0 mL 蒸馏水添加到20 mL烧杯中。充分混匀后用电导率测定笔测量其电导率,以电导率值为纵坐标,培养时间为横坐标绘制ASSF 对哈氏弧菌细胞膜通透性的影响曲线。
1.2.8 细胞壁的通透性
碱性磷酸酶(AKP)存在于细胞壁与细胞膜之间,正常情况下在细胞外不能检测到其活性,如果细胞壁被破坏,增加通透性,便可检测到AKP 的泄露。AKP 检测试剂盒的原理是AKP 会分解磷酸苯二钠进而产生游离酚和磷酸,然后在碱性溶液中,酚与4-氨基安替吡啉通过铁氰化钾氧化生成最大吸光度为520 nm 的红色醌衍生物[15]。将100 倍MIC浓度的ASSF 和100 倍MBC 浓度的ASSF 溶于400 μL 甲醇中。向装有40 mL MH 肉汤培养基的100 mL 的锥形瓶中分别加入100 倍MIC 浓度和100 倍MBC 浓度的ASSF 甲醇溶液400 μL,以等体积甲醇作阴性对照。分别向锥形瓶中加入400 μL 哈维氏弧菌悬液(1×106cfu/mL)后充分混匀。在37 ℃和160 r/min 下水浴振荡培养,分别在0 h、3 h、6 h、9 h和12 h 收集4.0 mL 细菌样品装入10 mL 离心管,在5 000 r/min 下离心10 min,取上清液0.1 mL 于1.0 mL 离心管中,分别加入100 μL 缓冲液和基质液充分混匀后,37 ℃下水浴加热15 min 后加入400 μL 显色剂混匀。吸取100 μL 加入96 孔微量滴定板中,平行三组,测定在520 nm 处的吸光度。以吸光度平均值为纵坐标,培养时间为横坐标绘制ASSF 对哈氏弧菌细胞壁通透性的影响曲线。
1.2.9 数据分析
实验均重复进行3 次,结果用均值±标准差表示。采用T 检验确定组间的显著性差异。星号(*)表示P <0.05,有显著性差异。
2 结果与分析
2.1 苦参抗哈氏弧菌活性物质(ASSF)的提取工艺优化
提取溶剂、溶剂浓度、提取温度、提取时间和液料比等因素对苦参提取物抗哈氏弧菌活性的影响见图1。乙醇较甲醇、蒸馏水作提取溶剂时,抗菌活性物质的提取效果较好(图1-a)。随着乙醇浓度的升高,提取物的抑菌圈直径增大,这表明ASSF 主要为疏水性物质(图1-b)。在60 ℃~80 ℃下,ASSF 抑菌圈直径随温度升高而增大,但温度过高ASSF 某些活性物质分解,抑菌效果随之降低(图1-c)。提取120~150 min 时,ASSF 抑菌圈直径随时间延长而增加,提取180 min 时,抑菌圈直径降低,表明时间太久破坏了ASSF 某些活性物质(图1-d)。当液料比从10∶1 mL/g 增长为30∶1 mL/g 时,抑菌圈的直径随之增加。但随着比例的增加,抑制区直径不再增加(图1-e)。
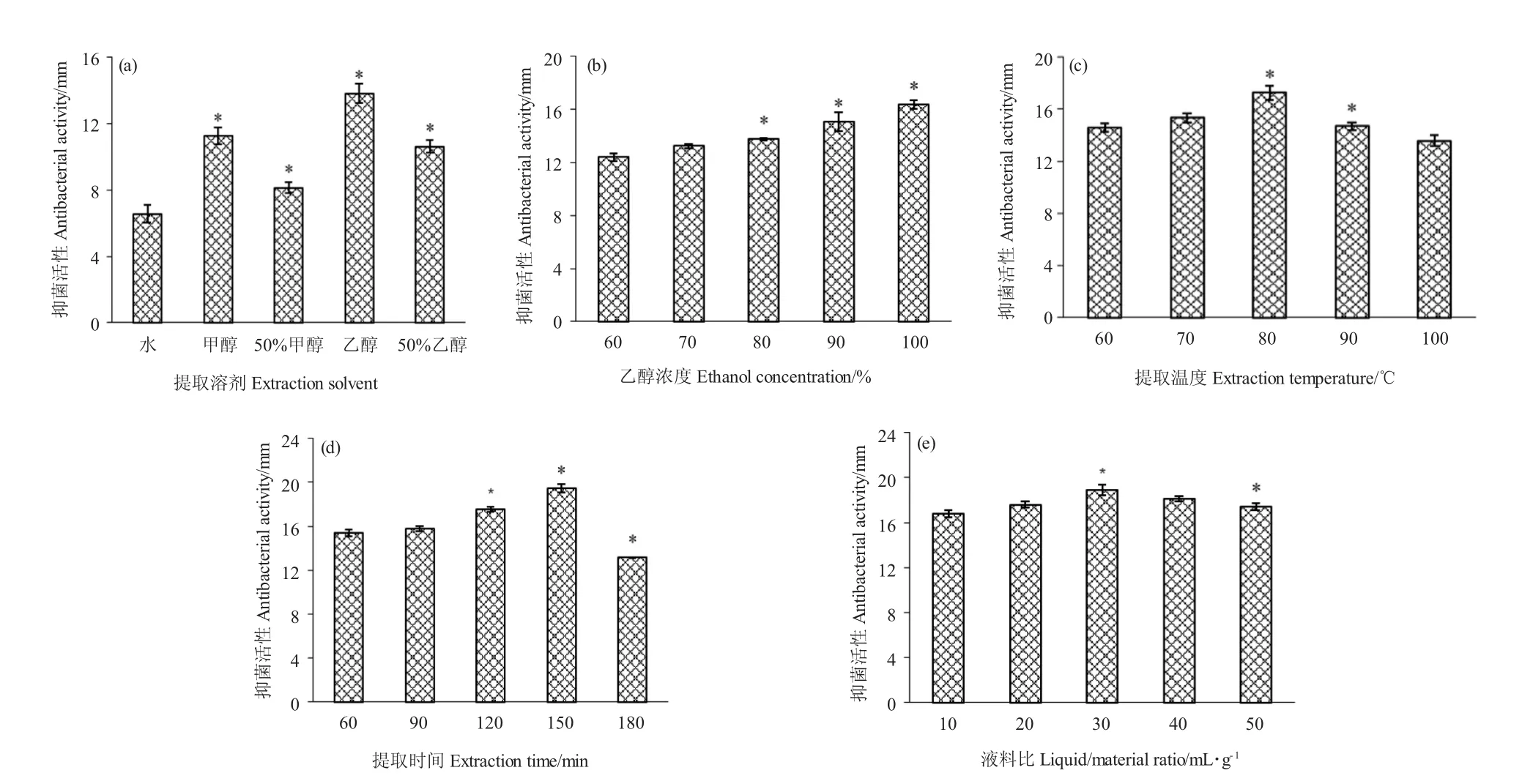
图1 不同因素对苦参提取物抗哈氏弧菌活性的影响Fig.1 Effect of different variables on the antibacterial activity of the extracts against V.harveyi
因此,将提取溶剂确定为无水乙醇,提取温度80℃、提取时间150 min、液料比30∶1 mL/g 作为Box-Behnken 设计中三个自变量的中心点用于ASSG 提取工艺的优化。
Box-Behnken 设计由17 个测试点组成,其中12 个是阶乘点,5 个是中心点的重复。以提取温度(X1)、提取时间(X2)、液料比(X3)作为自变量,以苦参提取物对哈氏弧菌的抑菌圈直径为响应变量(Y,mm),设计的因素组合及响应值如表1 所示。
通过对实验数据的多元回归分析,建立的多元二次回归方程如下:
方差分析结果如表2 所示,模型的P 值(0.0001)非常显著,而失拟项值(0.1362)不显著,表明构建模型的适应性非常显著。模型的相关系数R2(0.9729)非常接近于1,表明回归模型很好地定义了系统的真实行为。此外,提取温度的线性影响显著(P<0.05),提取温度、提取时间和液料比的二次效应影响极显著(P<0.01)。
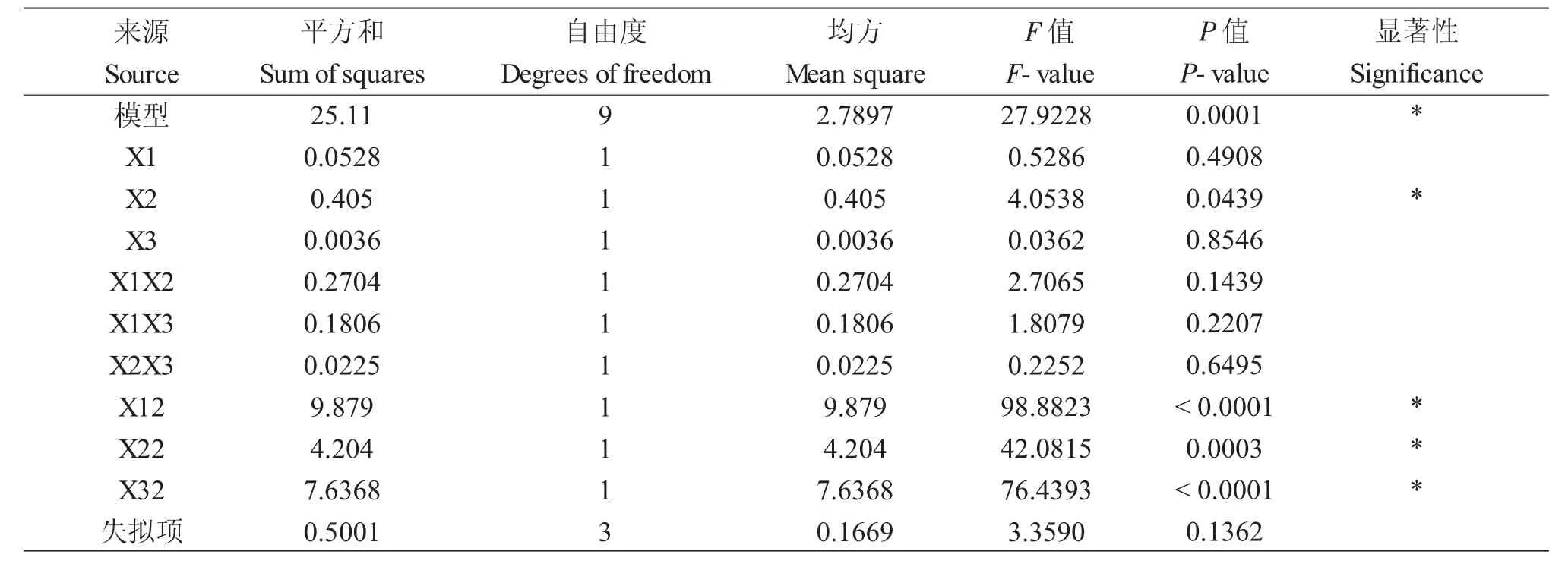
表2 方差分析表Tab.2 Variance analysis table
通过回归模型预测得到的ASSF 提取工艺最佳参数为:X1=79 ℃,X2=146 min,X3=30 mL/g,抑菌圈直径预测最大值为17.54 mm。按上述优化条件进行验证试验,实际得到的ASSF 抑菌圈的平均值为(17.64±0.22)mm(n=3),与预测值无显著差异。这说明单因素试验、Box-Behnken 设计结合响应面法用于ASSF 提取工艺优化的可行性。随后,将提取物减压蒸发干燥得到固体ASSF,得率为(21.17±0.91)%(n=3)。
2.2 ASSF 化学成分的鉴定及抑菌活性研究
采用高效液相色谱法,以苦参酮标准品作为对照鉴定了ASSF 中的化学成分。图2-a 显示苦参酮的HPLC 图中,保留时间(tR)为45.097 min。同一条件下,ASSF 的HPLC 图中具有包括苦参酮在内的多种化学成分,比较峰的吸收光谱鉴定出ASSF 中保留时间(tR)为44.239 min 的峰为苦参酮(图2-b)。
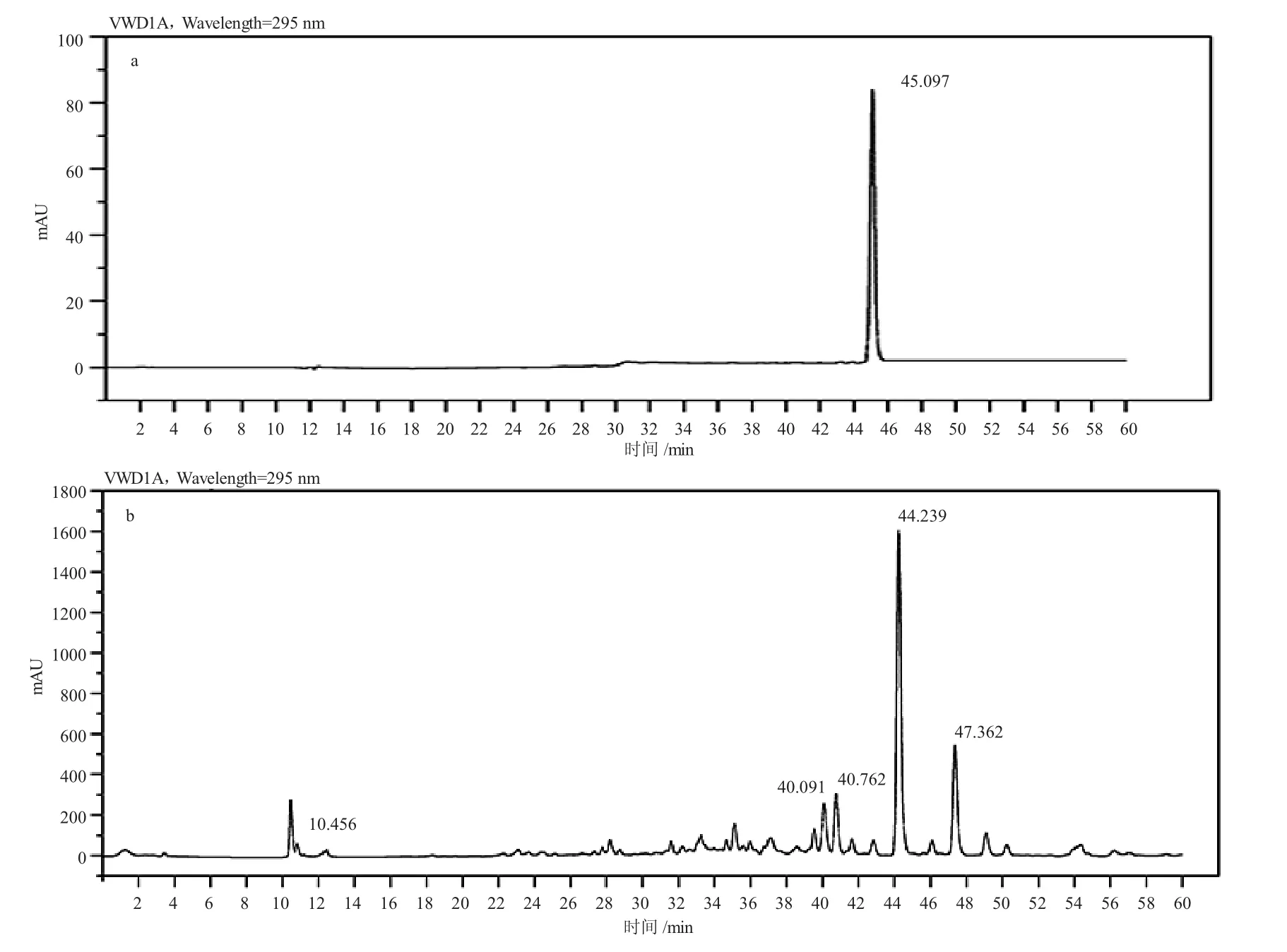
图2 苦参酮标准品(a)和ASSF(b)的高效液相色谱图Fig.2 HPLC chromatograms of kurarinone standard (a) and ASSF (b)
分别将保留时间为10.456 min、40.091 min、40.762 min、苦参酮及47.362 min 的吸收峰的洗脱液收集后,减压浓缩干燥。用牛津杯法测定ASSF 及其5 个化学成分抑制哈氏弧菌的活性,ASSF 和苦参酮对哈氏弧菌的MIC 分别为0.125 mg/mL 和0.062 5 mg/mL,而其他4 个化学成分的MIC 均大于2 mg/mL,说明苦参酮是ASSF 的主要抑菌活性分子。试管稀释法测定ASSF 对哈氏弧菌的MIC 和MBC 分别为0.125 mg/mL 和0.25 mg/mL。
2.3 ASSF 抗哈氏弧菌的作用机理
2.3.1 ASSF 对哈氏弧菌生长的影响
对照组的哈氏弧菌菌株在前6 h 缓慢增长,在6~12 h 时达到对数生长期。1 倍MIC 浓度下的ASSF 组在0~9 h 内未见明显增长,9 h 后开始明显增长(图3),这表明ASSF 在MIC 浓度下可以抑制哈氏弧菌的生长,但随着时间的延长,ASSF 被消耗,抑制作用逐渐减弱。MBC 浓度下的ASSF 组在24 h 内仍未见明显增长,说明ASSF 浓度越高,对哈氏弧菌生长的抑制效果越明显。

图3 ASSF 对哈维氏弧菌生长曲线的影响Fig.3 Effect of ASSF on the growth of V.harveyi
2.3.2 ASSF 对哈氏弧菌细胞膜完整性和通透性的影响
ASSF 对哈氏弧菌细胞膜完整性的影响结果如图4 所示。对照组的吸光度几乎没有变化,MIC 和MBC 浓度下ASSF 处理组的细菌培养物在260 nm处的吸光度值随时间的延长明显增加,说明菌液中有生物大分子(核酸、蛋白质)发生泄漏,即细胞膜完整性遭到破坏。MBC 浓度下ASSF 组的吸光度值明显高于MIC 浓度下的ASSF 处理组,说明ASSF对哈氏弧菌细胞膜完整性的破坏效应具有浓度依赖性。
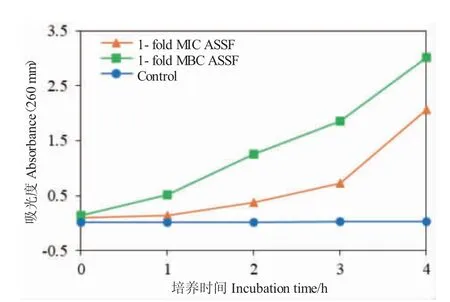
图4 ASSF 对哈维氏弧菌细胞膜完整性的影响Fig.4 Effect of ASSF on the cell membrane integrity of V.harveyi
ASSF 对哈氏弧菌细胞膜通透性的影响结果如图5 所示。MIC 和MBC 浓度下ASSF 处理组的电导率明显高于对照组,且随着时间的延长,电导率值不断增大。说明ASSF 能够破坏哈氏弧菌的细胞膜,增大了细胞膜的通透性。MBC 浓度下ASSF 处理组的电导率明显高于MIC 处理组,说明ASSF 对细胞膜通透性的破坏效应具有浓度依赖性。
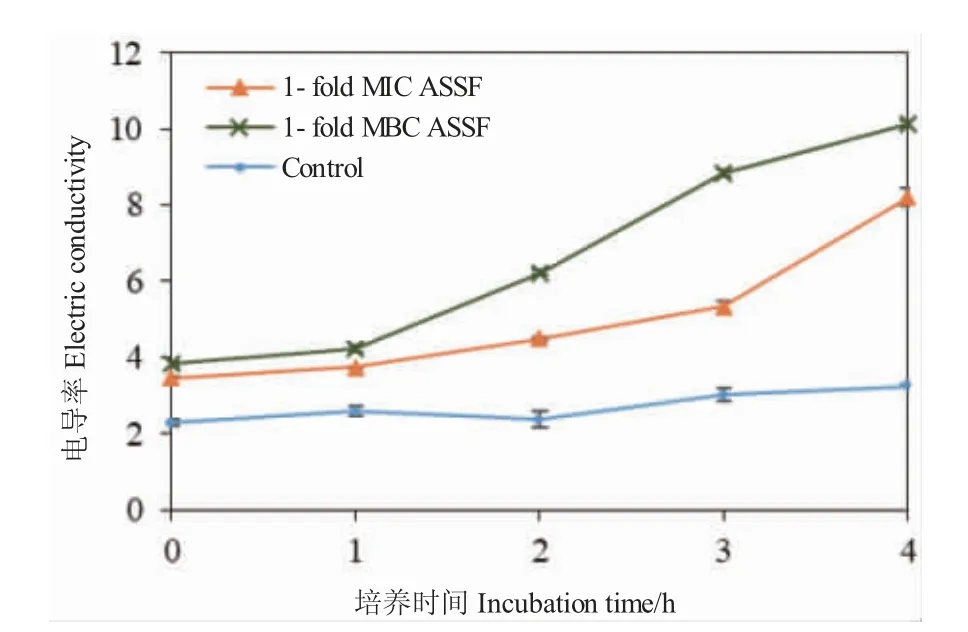
图5 ASSF 对哈维氏弧菌细胞膜通透性的影响Fig.5 Effects of ASSF on the cell membrane permeability of V.harveyi
2.3.3 ASSF 对哈氏弧菌细胞壁通透性的影响
ASSF 对哈氏弧菌细胞壁通透性的影响结果见图6。在520 nm 处,MIC 和MBC 浓度下ASSF 处理组的吸光度值均高于对照组,且吸光度值随着时间增加而逐渐增大。由此可推测,ASSF 增大了哈氏弧菌细胞壁的通透性,导致碱性磷酸酶泄漏量上升。MIC 浓度下ASSF 处理组的吸光度值低于MBC 浓度下ASSF 处理组的吸光度值,说明ASSF 增加哈氏弧菌细胞壁通透性的效应具有浓度依赖性。
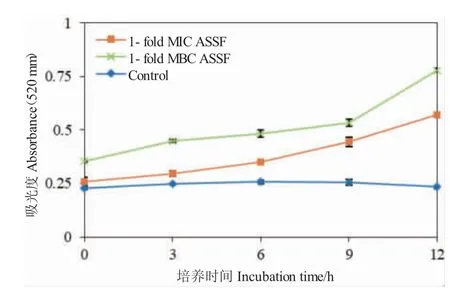
图6 ASSF 对哈氏弧菌细胞壁通透性的影响Fig.6 Effects of ASSF on the cell wall permeability of V.harveyi
3 讨论
目前水产养殖抗生素替代品的开发主要集中在益生菌[17]、微生物代谢产物[4,18]、植物及其提取物[19,20]。中草药应用于人类疾病防治已有数千年的历史。药用植物的粗粉、提取物或混合物具有预防和治疗水产动物疾病的良好前景,并已进行了一定的研究[19,20]。但在实际应用中存在许多困难,如疗效不稳定、有效成分不明等。因此,提高药用植物抗水产病原菌活性物质的纯度、鉴定其活性化合物,有助于水产抗生素替代品的研发。前期工作中,笔者已研究了中草药大黄和五倍子抗哈氏弧菌活性物质的提取工艺、鉴定出芦荟大黄素和大黄酸是大黄的主要抗菌活性成分和没食子酸是五倍子的主要抗菌活性分子[7,16]。本研究采用单因素实验和Box-Behnken 设计优化了苦参抗哈氏弧菌活性物质的提取工艺,并进一步鉴定出苦参酮是苦参抗哈氏弧菌的主要活性分子。
苦参酮是一种天然生物活性黄酮类化合物,可从中草药苦参和秦艽中分离得到[21,22]。据报道,苦参酮具有抗肿瘤[21]、抗炎[23]、抗菌[24]、抗氧化[25]和调节免疫等活性[26]。尽管已有研究表明苦参酮对人病原菌具有抗菌作用,但尚无关于其抗水产病原菌作用的报道。本文首次证明了苦参酮具有抗水产病原哈氏弧菌的作用,可用于防制水生动物疾病。进一步探讨苦参酮在水产养殖实践中作为生物防治剂的可行性,还需要进行更深入的研究。有必要比较苦参酮与水产养殖中常用的抗生素对水产养殖动物生长、健康和对病原菌抵抗力的影响。
结论
采用单因素实验、Box-Behnken 法和响应面法优化了苦参抗哈氏弧菌活性物质的提取工艺。优化的提取工艺为:无水乙醇为溶剂,液料比30∶1 mL/g,提取温度79 ℃,提取时间146 min。固态提取物的得率为(21.17±0.91)%(n=3)。苦参抗水产病原哈氏弧菌的主要活性分子为苦参酮,苦参抗菌提取物和苦参酮对哈氏弧菌的MIC 分别为0.125 mg/mL和0.0625 mg/mL。作用机理研究表明,抗菌提取物通过破坏哈氏弧菌细胞膜的完整性和通透性、细胞壁的通透性而影响细胞的生长,表现出良好的抗哈氏弧菌活性。本研究成果为苦参酮在水产动物细菌性病害防治中的开发和应用提供了依据。
