InDel分子标记WC656的开发及其在鉴别小麦-簇毛麦5VS纯合易位中的应用
2023-08-31郭江涛吕远大赵姝楠周淼平姚金保杨学明
郭江涛,吕远大,赵姝楠,周淼平,姚金保,杨学明
(1.江苏省农业科学院粮食作物研究所/江苏省农业生物学重点实验室,江苏南京 210014;2.江苏省农业科学院卓越创新中心,江苏南京 210014;3.南京农业大学作物遗传与种质创新国家重点实验室,江苏南京 210095)
小麦是我国重要粮食作物,其安全生产对我国粮食安全具有重要意义。优质高产多抗高效新品种选育与配套生产技术推广应用,使小麦单产大幅度提高。在小麦品种遗传改良中,培育突破性品种往往与突破性种质的挖掘和应用密切相关。20世纪60年代,矮秆基因的利用使小麦品种株高降低,单产大幅度提高[1]。小麦近缘物种蕴含丰富的有益基因,已成为小麦品种改良的重要基因资源,如黑麦含有锈病和白粉病抗性基因[2-4];长穗偃麦草不仅抗旱、抗寒能力很强,而且抗小麦白粉病、锈病、条纹花叶病、黄矮病、赤霉病等多种病害[5-7];簇毛麦高抗锈病、白粉病,对眼斑病、全蚀病、梭条花叶病等具有较好的抗性,同时具有籽粒硬度低等优良性状[8-17]。通过远缘杂交,可以将来自于近缘属种的优异基因转移给小麦,创制附加系、代换系和易位系等异染色体系[18]。与抗锈病和白粉病相关的小麦-黑麦T1RS.1BL、小麦-簇毛麦T6VS.6AL等易位系种质的创制与应用, 已培育出许多抗病高产的小麦品种[19-23]。
簇毛麦5V染色体短臂上含有抗白粉病基因Pm55、抗条锈病基因Yr5V和籽粒硬度基因Dina/Dinb等有益基因[17,24],南京农业大学细胞遗传研究所通过染色体工程技术创制了普通小麦-簇毛麦5V添加系、5V代换系和5VS易位系。其中,创制的普通小麦-簇毛麦5VS.5AL、5VS.5DL易位系,为进一步高效利用5VS上的有益基因进行品种改良奠定了物质基础。目前,鉴定普通小麦背景中簇毛麦染色体的主要方法包括基因组原位杂交(genomicinsituhybridization,GISH)、荧光原位杂交(fluorescenceinsituhybridization,FISH)、分子标记等[25-30]。利用原位杂交方法可以分析普通小麦背景下簇毛麦染色体的大小及变异类型,但实验操作相对繁琐、费时,开发应用簇毛麦染色体或染色体臂特异分子标记,可以显著提高普通小麦-簇毛麦异染色体系的鉴定效率。
为了利用分子标记鉴别簇毛麦5VS染色体臂,曹亚萍等[31]根据水稻、小麦的 EST序列,开发了可追踪簇毛麦5VS染色体的STS引物CINAU411-745。Zhang等[32]利用普通小麦7个部分同源群上的276对SSR标记引物对普通小麦中国春、簇毛麦和中国春-簇毛麦二体附加系的基因组DNA进行扩增分析,筛选出可用来追踪簇毛麦5VS染色体的引物wmc233。利用中国春与簇毛麦间扩增出多态性的597对小麦EST引物,对亲本及普通小麦-簇毛麦二体附加系进行扩增分析,获得具有簇毛麦5VS特异条带的标记2个,其中CINAU211-700(该标记亦称为5EST-237[33])标记引物可以扩增出5VS、5AS、5BS、5DS条带[34]。付必胜等[35]通过簇毛麦5VS的基因组序列信息与中国春小麦染色体 5AS、5BS、5DS 上的基因进行比对,开发了具有簇毛麦5VS特异条带的保守直系同源基因序列(COS)标记引物59对。上述已开发的标记中,标记CINAU411-745、wmc233,只能检测5VS特异条带;付必胜等[35]开发的59对COS标记中,19个只能检测5VS特异条带,40个为3种类型的共显性标记,可以区分5VS与5AS、5BS、5DS中1~3个条带,条带大小之间最大差异为20 bp,PCR扩增产物需经聚丙烯酰胺凝胶电泳检测。CINAU211-700标记可以同时区分5VS、5AS、5BS、5DS条带,但其扩增产物也需经聚丙烯酰胺凝经胶电泳检测。
本研究利用普通小麦中国春基因组序列,通过mInDel软件开发小麦第5同源群短臂的InDel共显性分子标记,其扩增产物经琼脂糖凝胶电泳,检测第5同源群短臂特异条带是否缺失,快速、简便地筛选出普通小麦-簇毛麦5VS.5AL、5VS.5DL易位系为供体亲本的分离后代中5VS纯合易位单株,为利用普通小麦-簇毛麦5VS易位系进行种质创制和品种改良提供新的分子标记。
1 材料与方法
1.1 试验材料
普通小麦-簇毛麦T5VS.5AL易位系zrq5V-2、T5VS.5DL易位系NAU415-2,含有簇毛麦5VS染色体臂;普通小麦中国春,21个长江中下游冬麦区推广的小麦品种(宁麦9号、宁麦13、宁麦18、扬麦13、扬麦15、扬麦20、宁紫麦1号、扬麦16、扬麦25、扬麦29、扬辐麦4号、镇麦168、镇麦9号、镇麦10号、镇麦12、泰麦901、华麦1092、盐麦1号、农麦88、瑞华麦596、宁麦资166),这些材料均不含有5VS染色体臂,用于分子标记的开发验证。94个zrq5V-2/4*宁麦9号 BC4F2单株及BC4F2∶3家系,180个宁麦13*4/NAU415-2 BC4F2单株及BC4F2∶3家系,这些材料用于标记的验证与筛选。17个T5VS.5DL和5个T5VS.5AL高代品系,用于标记的应用检测。zrq5V-2(NAU421衍生系)、NAU415-2由南京农业大学细胞遗传研究所创制[17, 24],中国春、小麦品种由江苏省农业科学院粮食作物研究所收集保存。zrq5V-2/4*宁麦9号、宁麦13*4/NAU415-2 BC4F2群体及BC4F2∶3家系,T5VS.5AL、T5VS.5DL高代品系,由江苏省农业科学院粮食作物研究所创制和保存。
1.2 试验方法
1.2.1 标记引物WC656序列
通过mInDel软件[36]分析普通小麦中国春参考基因组序列(版本:IWGSC RefSeq v2.1,https://wheat-urgi.versailles.inra.fr/Seq-Repository/Assemblies),在第5同源群短臂开发出265对InDel标记引物,其中WC656标记用于本研究,该标记引物对为WC656-F:5′-GAGCACCAGCAGAGCAAGATG-3′和WC656-R:5′-ACCAACAGCACCTAGACAACAC-3′。
1.2.2 分子标记检测
利用植物基因组DNA提取试剂盒(Karroten K2304)提取试验小麦材料的叶片DNA。分子标记检测采用Bio-Rad C1000扩增仪,PCR反应体系为20 μL,其中DNA模板1 μL(浓度40 ng·L-1),引物WC656-F、WC656-R各 1 μL(浓度10 μmol·L-1),2×Taq Plus Master Mix Ⅱ(Vazyme)10.0 μL,ddH2O 7 μL。PCR反应循环程序为:94 ℃预变性3 min,94℃变性30 s,62 ℃退火45 s,72 ℃延伸70 s,34个循环;72 ℃延伸10 min。PCR产物以1% 的琼脂糖凝胶(含体积比1∶10 000的Tanon核酸染料)电泳,电泳电压100 V,电泳时间1.5 h,以凝胶成像系统(Tanon 3500)扫描成像并存入计算机。
1.2.3 细胞遗传学分析
根尖细胞有丝分裂中期染色体制片,参照Chen等[37]的方法并作修改。在22 ℃培养箱中,小麦种子在垫有滤纸的培养皿中用水浸泡24 h,露白后转到4 ℃冰箱中处理22~24 h,再转到22 ℃培养至根长1~2 cm,剪取根尖置于一氧化二氮(N2O)中处理2 h,再将处理过的根尖用90%冰醋酸固定10 min后,取出放于70%乙醇中保存。制片时,将固定的根尖用45%醋酸解离10 min,然后切取少许根尖生长点组织压片,相差显微镜下预检。取染色体分散良好的制片用液氮处理,揭片后用70%、90%和100%乙醇梯度脱水,气干后用于原位杂交。
荧光原位杂交的寡核苷酸探针套包括12个寡核苷酸探针,其序列组成参照Chen等[37]。所用寡核苷酸探针套包括pAs1-1、pAs1-3、pAs1-4、pAs1-6、AFA-3、AFA-4、pSc119.2-1、Grass-5S-1、Grass-5S-2、(GAA)10、BSCL135-1、BSCL135-2,其中(GAA)10、BSCL135-1、BSCL135-2为FAM修饰,其余探针为TAMRA修饰。簇毛麦基因组DNA探针采用缺口平移法,利用Fluorescein-12-dUTP进行标记。荧光原位杂交及顺序基因组原位杂交流程参照Chen等[37]和Yang等[38]的方法。利用Olympus BX60型荧光显微镜观察染色体及杂交信号,使用SPOT CCD(SPOT Cooled Color Digital)获得图像。
1.2.4 田间试验与成株期白粉病接种鉴定
田间试验在江苏省农业科学院院部基地进行,BC4F2分离群体于2019-2020年度粒播种植,行长1.75 m,行距27 cm,株距15 cm;BC4F2∶3家系和5VS易位系高代品系于2020~2021年度种植,每个家系50粒/行,行长1.6 m,行距27 cm。在被鉴定材料四周种植高感白粉病小麦品种苏麦3号作为诱发行,在每年2月初用感白粉病(用白粉病混合菌种感染)的幼苗种植于苏麦3号诱发行中,使苏麦3号发生白粉病,从而进一步诱发田间白粉病。当感病对照品种宁麦9号倒二叶上的白粉病严重度达到70%以上时进行白粉病调查,7 d后进行第二次调查,白粉病抗性评价标准按0~4级分类[39],0~2级为抗病(R),3~4级为感病(S)。田间试验管理与大田生产一致。
1.2.5 籽粒硬度测定
将收获晒干的小麦籽粒样品在同一条件下放置1个月后,利用Perten 4100 型单籽粒谷物特性测试仪(Single Kernel Characterization System,SKCS)测定籽粒硬度指数,单株材料检测50 粒,高代品系检测300 粒。
2 结果与分析
2.1 InDel分子标记WC656的开发
通过mInDel软件,开发小麦第5同源群短臂的InDel分子标记。基于普通小麦中国春参考基因组序列,针对5A、5B、5D基因组序列,利用滑动窗算法(sliding windows)设计覆盖全部染色体的大规模探针池,进而针对第5同源群短臂,高通量预测染色体臂间的InDel变异,采用邻近InDel聚合的策略,设计开发出高效、易检测的InDel分子标记265个。进一步对265对第5同源群短臂的InDel标记引物预测扩增条带片段大小的分析,筛选出5AS、5BS、5DS片段小于600 bp,不同片段大小之间差异较大(大于25 bp)、易于琼脂糖凝胶电泳检测的65个标记,其中WC656的标记引物最大扩增片段为471 bp(5BS条带),5BS与5DS、5DS与5AS之间条带大小相差分别为49和43 bp,易于区分5AS、5BS、5DS条带,因而利用该标记用于鉴别5VS纯合易位系。
2.2 小麦遗传材料的标记引物WC656分析
2.2.1 小麦-簇毛麦5VS易位系、小麦品种标记引物WC656分析
以普通小麦中国春,T5VS.5AL易位系zrq5V-2,T5VS.5DL易位系NAU415-2,以及长江中下游麦区育成和推广的21个小麦品种DNA为模板,以WC656引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测。结果表明,在T5VS.5AL易位系zrq5V-2中扩增出471 bp(5BS)和422 bp(5DS)2条条带(图1a,泳道2),缺失379 bp(5AS)条带,说明zrq5V-2中5AS染色体臂已被代换。在T5VS.5DL易位系NAU415-2中扩增出379 bp(5AS)和471 bp(5BS)2条条带(图1a,泳道3),缺失422 bp(5DS)条带,说明NAU415-2中5DS染色体臂已被代换。在中国春和21个小麦品种中均扩增出379 bp(5AS)、471 bp(5BS)422 bp(5DS)3条条带(图1a,泳道4~24),说明这些材料第5同源群染色体短臂均没有被代换。因而,利用WC656引物进行检测,可以鉴别T5VS.5AL、T5VS.5DL等纯合易位系及其与其他普通小麦品种杂交而产生的纯合易位后代。
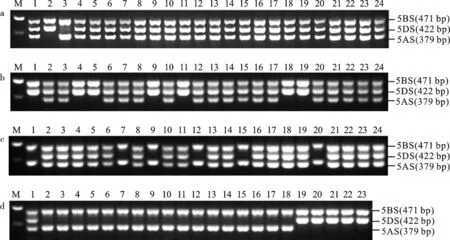
M:100bp DNA ladder;a:小麦品种(系)的WC656检测结果; 1:中国春;2:zrq5V-2;3:NAU415-2;4:宁麦9号;5:宁麦13;6:宁麦18;7:宁紫麦1号;8:扬麦13;9:扬麦15;10:扬麦16;11:扬麦20;12:扬麦25;13:扬麦29;14:扬辐麦4号;15:镇麦168;16:镇麦9号;17:镇麦10号;18:镇麦12;19:泰麦901;20:华麦1092;21:盐麦1号;22:农麦88;23:瑞华麦596;24:宁麦资166。b:BC4F2群体5VS.5AL纯合易位单株的标记引物WC656检测结果; 1~24:(zrq5V-2/4*宁麦9号)BC4F2代单株,1、4、5、9、11、18、19为纯合易位。c:BC4F2群体5VS.5DL纯合易位单株的标记引物WC656检测结果;1~24:(宁麦13*4/NAU415-2)BC4F2代单株,1、7、9、12、15、20为纯合易位。d:小麦-簇毛麦5VS高代纯合易位系的标记引物WC656检测结果; 1:中国春;2~18:以T5VS.5DL为供体亲本的高代品系;19~23:以T5VS.5AL为供体亲本的高代品系。M: 100bp DNA ladder; a: Identification of different wheat cultivars or lines by WC656 marker; 1: Chinese Spring; 2: zrq5V-2; 3: NAU415-2; 4: Ningmai 9; 5: Ningmai 13; 6: Ningmai 18; 7: Ningzimai 1; 8: Yangmai 13; 9: Yangmai 15; 10: Yangmai 16; 11: Yangmai 20; 12: Yangmai 25; 13: Yangmai 29; 14: Yangfumai 4; 15: Zhenmai 168; 16: Zhenmai 9; 17: Zhenmai 10; 18: Zhenmai 12; 19: Taimai 901; 20: Huamai 1092; 21: Yanmai 1; 22: Nongmai 88; 23: Ruihuamai 596; 24: Ningmaizi 166. b: Identification of 5VS.5AL homozygous translocation individuals in BC4F2 genetic population; 1-24: Individuals of zrq5V-2/4*Ningmai 9 F2 population, 1, 4, 5, 9, 11, 18 and 19 are homozygous. c: Identification of 5VS.5DL homozygous translocation individuals in BC4F2 genetic population; 1-24: Individuals of Ningmai 13*4/NAU415-2 F2 population, 1, 7, 9, 12, 15 and 20 are homozygous. d: Identification of 5VS homozygous advanced translocation lines; 1: Chinese Spring; 2-18: T5VS.5DL advanced translocation lines; 19-23: T5VS.5AL advanced translocation lines.图1 不同小麦遗传材料的WC656标记引物PCR扩增产物琼脂糖凝胶电泳检测结果Fig.1 Agarose-gel electrophoresis of PCR products amplified by WC656 marker in different materials
2.2.2 回交F2代分离群体中纯合易位单株的鉴定
以T5VS.5AL易位系zrq5V-2、T5VS.5DL易位系NAU415-2为供体亲本,分别与宁麦9号、宁麦13杂交、回交,构建了回交4次的F2(BC4F2)遗传群体,分别有94、180个单株,以这些单株DNA为模板,用WC656引物进行PCR扩增、电泳检测,图1b和图1c所示部分单株的结果。图1b为zrq5V-2为供体亲本的BC4F2单株检测结果,单株B10-2、B10-4、B10-5、B10-11、B10-18、B10-19、B10-32(分别对应泳道1、4、5、9、11、18、19)的5AS条带缺失,表明这7个单株的5VS代换了5AS,为T5VS.5AL纯合易位系单株。图1c为NAU415-2为供体亲本的BC4F2单株检测结果,单株B21-5、B21-25、B21-27、B21-58、B21-61、B21-65(分别对应泳道1、7、9、12、15、20)的5DS条带缺失,表明这6个单株的5VS代换了5DS,为T5VS.5DL纯合易位系单株。
2.3 5VS纯合易位的细胞学鉴定
利用寡核苷酸探针套,对通过标记WC656鉴别出的部分5VS纯合易位单株的染色体组成进行FISH分析。图2b、图2e分别为T5VS.5AL易位单株B10-2、T5VS.5DL易位单株B21-5的原位杂交结果,这2个单株(2n=6x=42)均含有一对易位染色体,在5VS染色体臂端部具有1对较强的红色信号,近着丝粒区域有1对绿色信号。5AL染色体近着丝粒区域有1对绿色信号、近中部有1对红色信号,5DL上有3对红色信号,箭头分别所示5VS.5AL、5VS.5DL易位染色体。以簇毛麦基因组DNA为探针进行顺序GISH,确认易位染色体的短臂来源于簇毛麦(图2c、图2f)。

a、b、c分别为T5VS.5AL单株B10-2白粉病抗性鉴定、FISH及GISH检测图;d、e、f分别为T5VS.5DL单株B21-5白粉病抗性鉴定、FISH及GISH检测图。箭头示易位染色体,比例尺为10 μm。a, b, c: Powdery mildew resistance and sequential FISH and GISH identification of T5VS.5AL single plant B10-2; d, e, f: Powdery mildew resistance and sequential FISH and GISH identification of T5VS.5DL single plant B21-5. Arrow head indicates translocation chromosome, scale bar=10 μm.图2 T5VS.5AL(a, b, c)、T5VS.5DL(d, e, f)单株白粉病抗性鉴定及顺序FISH-GISH检测Fig.2 Powdery mildew resistance and sequential FISH and GISH identification of T5VS.5AL and T5VS.5DL individuals
2.4 小麦-簇毛麦5VS易位染色体单株的成株期白粉病抗性表现及遗传特点

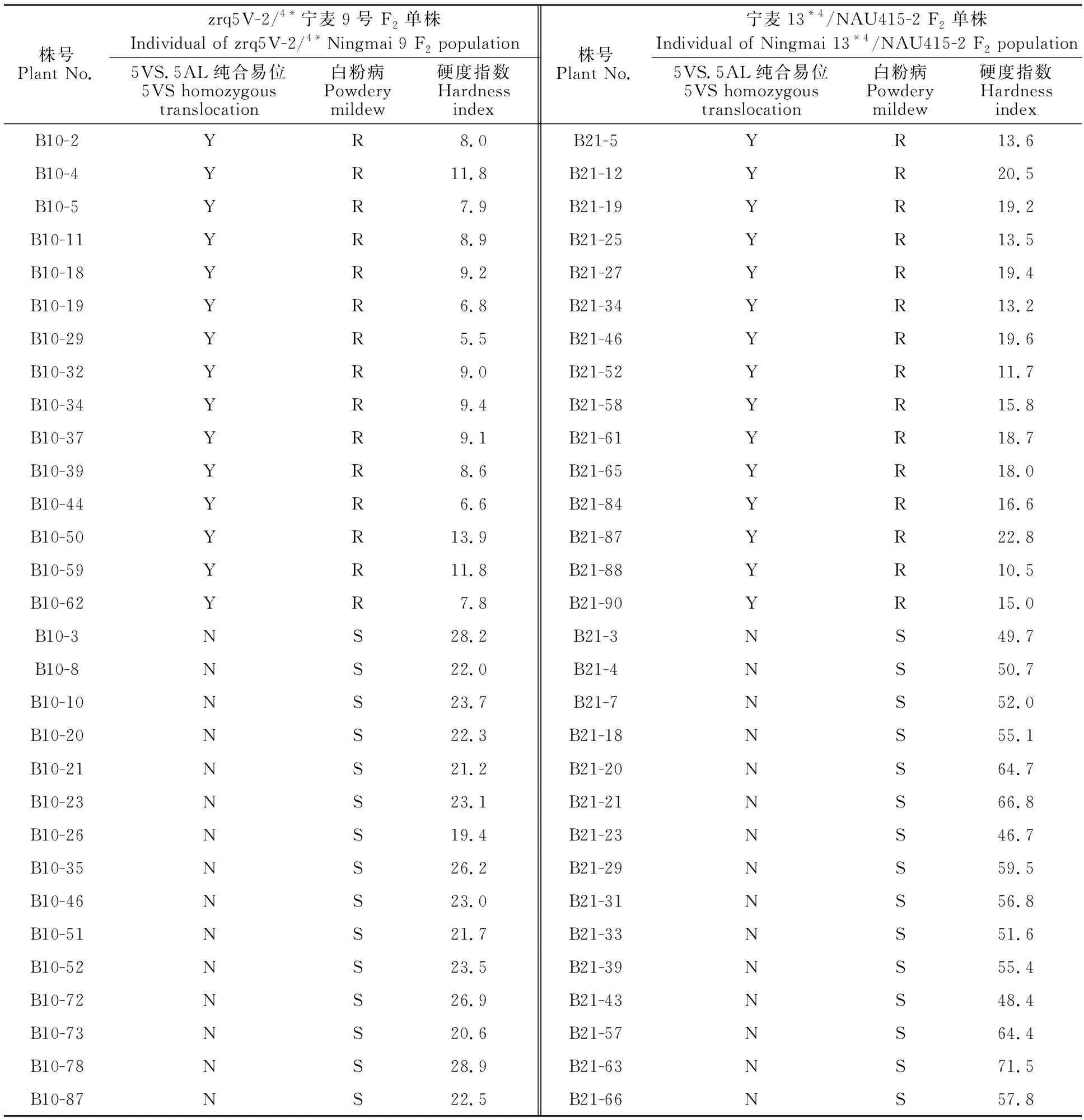
表1 BC4F2群体部分5VS纯合易位和无5VS易位单株的白粉病抗性及籽粒硬度指数Table 1 Powdery mildew resistance and grain hardness index of 5VS homozygous translocation and 5VS non-translocation in BC4F2 partial individuals
表2 BC4F2单株的WC656标记分析及白粉病抗性鉴定Table 2 WC656 analysis and identification of powdery mildew resistance in BC4F2 individuals
2.5 籽粒硬度分析
利用Perten 4100型单籽粒谷物特性测试仪(SKCS 4100),对回交F2单株籽粒进行测定,回交群体受体亲本宁麦9号、宁麦13籽粒硬度指数分别为24.0±0.8、58.2±0.6。表1所示两个回交群体部分5VS纯合易位和无5VS易位F2单株籽粒的硬度指数,标记WC656鉴别出的5VS纯合易位单株的籽粒硬度指数,显著低于无5VS易位单株的硬度指数。对zrq5V-2/4*宁麦9号、宁麦13*4/NAU415-2所有F2代单株的籽粒硬度进行分析,5VS.5AL、5VS.5DL纯合易位单株的平均籽粒硬度指数分别为9.4、14.9,比无5VS易位的单株分别降低59.3%、74.0%(表3)。
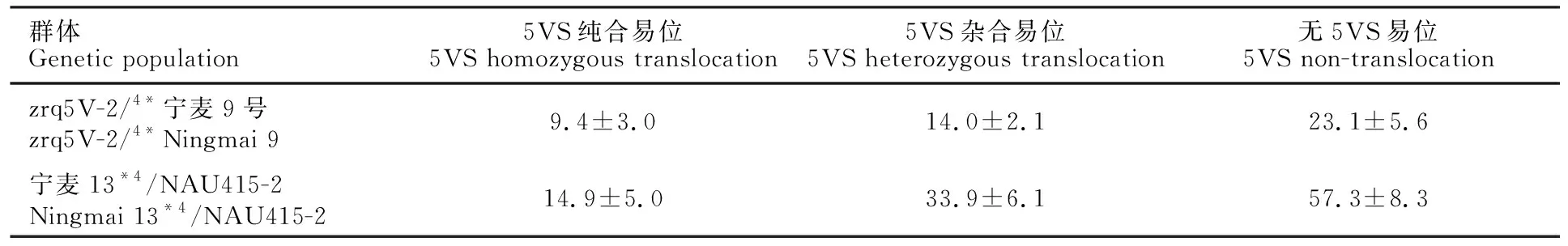
表3 BC4F2不同易位类型单株的籽粒硬度指数Table 3 Grain hardness index of different translocation types in BC4F2 individuals
2.6 标记引物WC656在5VS易位系高代品系选育中的应用
以zrq5V-2、NAU415-2为供体亲本,与本地区宁麦9号、宁麦13、扬麦15、扬麦20等感白粉病弱筋小麦品种杂交、回交,在F2、F3等早代利用WC656筛选5VS纯合易位单株,后续世代对白粉病抗性、籽粒质地、农艺性状、产量等进行选择与鉴定,育成携有5VS染色体臂、抗白粉病的高代品系22个。以这些品系的DNA为模板,利用WC656引物进行PCR扩增,电泳检测结果所示(图1d),泳道1为中国春,扩增出379 bp(5AS)、471 bp(5BS)、422 bp(5DS)3条条带。泳道(样品)2-18的5DS条带缺失,表明这17个品系的5VS代换了5DS,为T5VS.5DL纯合易位系。泳道(样品)19-23的5AS条带缺失,表明这5个品系的5VS代换了5AS,为T5VS.5AL纯合易位系。22个T5VS.5DL和T5VS.5AL易位系籽粒硬度指数在9.8~25.0之间,同样表现出较低的硬度指数。白粉病接种鉴定,新育成的5VS易位系高代品系均抗白粉病。
3 讨论
普通小麦是由A、B、D 3个染色体组组成的异源六倍体,染色体分带、基因组原位杂交(GISH)、荧光原位杂交(FISH)等细胞遗传学方法已广泛应用于普通小麦的起源与进化研究,也已用于普通小麦背景中簇毛麦染色体(臂)的鉴别[11,28]。与细胞遗传学方法相比,利用分子标记方法鉴别染色体具有便捷、不受小麦生长发育条件限制等优点。鉴别普通小麦-簇毛麦5VS易位系为供体亲本的分离世代植株的纯合易位类型,一是可以利用普通小麦5AS、5BS、5DS与簇毛麦5VS染色体臂共显性分子标记进行直接鉴别[29, 33-35],二是可以利用普通小麦5AS、5BS、5DS共显性分子标记进行间接鉴别。
由于当前尚无小麦-簇毛麦5VS易位系基因组信息,严重阻碍了5VS与5AS、5BS、5DS共显性分子标记的大规模开发和应用。同时,已开发的可以追踪5VS的分子标记中,只有CINAU211-700标记引物可以扩增出5VS、5AS、5BS、5DS条带[34],但扩增产物需用聚丙烯酰胺凝胶电泳检测,还没有可以经琼脂糖凝胶电泳检测、高效鉴别这4个染色体短臂的分子标记报道。InDel分子标记是基于基因组中插入/缺失位点两侧的序列设计特异引物进行PCR扩增的标记,具有分布广、重复性好、开发成本低、结果准确等优点,已用于对基因型简单快速判别。本研究中的供体亲本为普通小麦-簇毛麦5VS.5AL、5VS.5DL易位系,由于5VS染色体臂分别替换了普通小麦5AS、5DS染色体臂,因而利用普通小麦第5同源群染色体短臂的共显性InDel分子标记WC656进行检测,通过分析5AS、5DS电泳条带是否缺失,可以用来鉴别普通小麦-簇毛麦5VS.5AL、5VS.5DL纯合易位。WC656扩增产物的电泳条带大小分别为379 bp(5AS)、471 bp(5BS)、422 bp(5DS),5AS与5DS、5DS与5BS之间条带大小相差分别为43 bp、49 bp,通过琼脂糖凝胶电泳很容易将这3个条带区分开。顺序FISH-GISH分析结果与WC656鉴别的纯合易位一致。笔者以CINAU211-700(5EST-237)标记引物对5VS纯合易位进行分析,其结果也与WC656标记分析结果一致。
在减数分裂过程中,由于5VS与普通小麦5AS、5BS、5DS不配对,难以发生重组交换,因而位于5VS上的基因总是伴随5VS.5AL或5VS.5DL易位染色体传递。本研究以分子标记WC656分别对zrq5V-2/4*宁麦9号、宁麦13*4/NAU415-2的回交F2分离群体检测,5VS纯合易位单株、5VS杂合易位单株、无5VS易位单株的数量之比均符合1∶2∶1理论比值,表明5VS/5AL、5VS/5DL易位染色体在普通小麦背景中能够正常遗传,同时5VS纯合易位单株表现抗白粉病和低籽粒硬度指数特性。由于簇毛麦5VS上携有抗白粉病基因Pm55、籽粒硬度基因Dina/Dinb等有益基因,因而可以将普通小麦-簇毛麦5VS.5AL和5VS.5DL易位系以及InDel分子标记WC656,应用于软质弱筋小麦品种分子标记辅助选择的遗传改良研究。
4 结论
利用普通小麦第5同源群染色体短臂共显性InDel分子标记WC656,PCR扩增产物经琼脂糖凝胶电泳,可以区分小麦5AS、5BS、5DS染色体臂,通过分析5AS、5DS电泳条带是否缺失,能够鉴别出以T5VS.5AL、T5VS.5DL易位系为供体亲本的杂交分离后代中的5VS纯合易位单株。
