杂色曲霉菌的分离鉴定及鹅源乳杆菌对其抑制作用研究
2023-08-31陶燕子王秋菊王纪元孟令滢李畅洋
■ 陶燕子 王秋菊 王纪元 孟令滢 李畅洋
(黑龙江八一农垦大学动物科技学院,黑龙江省寒区饲料资源高效利用与营养调控重点实验室,黑龙江大庆 163319)
霉菌通过寄生或者腐生的方式在食品和饲料中生存,霉菌可产生毒素,其中,黄曲霉毒素对人体和动物健康的危害最大,除了常见的黄曲霉毒素有危害外,还有杂色曲霉毒素、烟曲霉毒素、玉米赤霉烯酮都是危害畜禽健康的物质[1]。有研究表明,杂色曲霉毒素中由二呋喃环和氧杂蒽酮组成的基本结构与黄曲霉毒素的结构相似,杂色曲霉毒素的毒性不亚于黄曲霉毒素[2]。杂色曲霉毒素普遍存在于谷物类饲料中,在高温、高湿情况下容易滋生霉菌,若霉菌在禽畜饲料中大量产生,对禽畜生产性能影响较大。禽畜食用霉变饲料或者吸入发霉垫料中的霉菌孢子,时间一长会导致禽畜患曲霉病。罗伊氏乳杆菌是一种异源发酵乳杆菌,具有调节肠道微生物群,消除炎症的作用[3]。发酵乳杆菌作为乳酸菌也能促进畜禽生长,改善肠道内环境[4]。现市面上有许多乳酸菌制剂已经成功代替抗生素被使用,菌制剂的应用减少了抗生素残留和动物耐药问题。
如今益生菌防治霉菌受到重视,如何有效地防治霉菌的产生对人类健康和禽畜健康有着极其重要的意义。本试验从发霉玉米中分离出杂色曲霉菌,并使用实验室保存的发酵乳杆菌和罗伊氏乳杆菌,检测乳杆菌对杂色曲霉的抑菌性能,同时对分离的杂色曲霉的抗药性进行检测。
1 材料与方法
1.1 材料
1.1.1 菌株来源
发酵乳杆菌(L.fermentum)和罗伊氏乳杆菌(L.reuteri)由实验室在鹅源中分离鉴定保存。杂色曲霉从发霉玉米中分离。
1.1.2 培养基
PDA培养基(马铃薯葡萄糖琼脂培养基)、察氏培养基、营养琼脂培养基、营养肉汤培养基、药敏试验琼脂培养基均购于青岛高科技工业园海博生物技术有限公司,乳酸酚棉蓝染色液购于北京索莱宝科技有限公司,DL 2000 Marker购于TaKaRaq公司。
1.1.3 主要仪器
恒温培养箱(DHP-9272)购自上海一恒科学仪器有限公司;PCR 基因扩增仪(GE9612T-S)购自杭州柏恒科技有限公司;电泳仪(DYY-6C)购自北京市六一仪器厂,光学显微镜购自宁波舜宇仪器有限公司。
1.2 方法
1.2.1 样品处理
称取发霉玉米10 g,用100 mL 无菌水搅匀作为原液,然后吸取1 mL 原液放置于离心管中,依次进行10、102、103、104、105、106、107、108倍的稀释。分别取各浓度的稀释液200 μL 涂布于高压灭菌后的察氏培养基平板上,在28 ℃恒温培养箱中培养5~6 d。挑取单一菌落进行划线培养,重复此步骤3~4 次,直到平皿上出现单一菌落为止[5-6]。
1.2.2 形态学鉴定
肉眼观察:通过肉眼观察菌株的外部形态,观察正面以及背面。
显微镜下观察:在无菌操作台中,于载玻片中央滴加1~2 滴乳酸酚棉蓝染色,用一次性接种环,取一小块菌落,将其放在50%的无水乙醇中浸润,再用纯水轻轻冲洗,随后将冲洗后的菌丝放于染色液中,将菌丝分散开,加盖洁净的盖玻片,轻轻按压不要有气泡,在光学显微镜低倍、高倍或油镜下观察菌丝和孢子的形态。
1.2.3 煮沸法提取霉菌DNA
在1 mL离心管中加200 μL的生理盐水,取纯化好的单个菌落接到其中,使液体浑浊即可,12 000 r/min离心3 min,弃去上清液,加1 mL 的生理盐水混匀,12 000 r/min 离心3 min 弃去上清,清洗过程重复2~3 次。在清洗后的管中加100 μ L 的生理盐水离心5 min。放入锅中煮沸20 min或以上,离心12 000 r/min,15 min。取上清液加到新的离心管中,保存备用。
1.2.4 曲霉分离菌株的PCR鉴定
菌株采用真菌核糖体基因转录间隔通用的引物。上游引物序列ITS5:5'-TCCGTAGGTGAACCTGCGG-3',下游引物序列ITS4:5'-TCCTCCGCTTATTGATATGC-3'。
PCR 反应体系:Premix Taq 12.5 μL,上、下游引物各1 μL,ddH2O 9.5 μL,模板DNA1 μL。PCR 反应程序:94 ℃预变性90 s,94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,共30 个循环,72 ℃延伸5 min。PCR产物经1.0%琼脂糖凝胶电泳检测后,阳性样品送至生工生物工程(上海)股份有限公司进行测序,待结果返回进行分析。
1.2.5 测序及序列分析
将测序结果与NCBI数据库上的菌序列进行blast比对分析,找出与其相似性最高的菌株。用MEGA-64软件对其序列进行分析,构建进化树,比较其同源性。将序列分析结果与形态学观察结合进行综合鉴定。
1.3 杂色曲霉孢子悬浊液的制备
将纯化后的杂色曲霉接种在PDA 培养基上,28 ℃培养5~7 d,待菌株孢子成熟,在培养基中加入适量无菌水,用接种环轻轻将孢子刮取下来,用8 层无菌纱布过滤菌丝,将过滤后的孢子液收集在离心管中,3 000 r/min 离心5 min,加入无菌磷酸盐缓冲液(PBST)洗涤,重复3 次,完成后用细胞计数板在显微镜下进行计数,用无菌的PBST 将杂色曲霉孢子液浓度调整到1×108CFU/mL备用[7-8]。
1.4 杂色曲霉生长抑制试验
将活化好的发酵乳杆菌和罗伊氏乳杆菌浓度调整在1×108CFU/mL,将两种菌按1:1 混合,制成发酵乳杆菌和罗伊氏乳杆菌的混合菌液[9],即混合乳杆菌组。将灭菌牛津杯分别放置于涂有杂色曲霉菌的PDA 培养基上,并让底部与培养基表面贴合。每个牛津杯内加入200 μL 的发酵乳杆菌、罗伊氏乳杆菌、混合乳杆菌,每组菌做3 个重复,37 ℃恒温培养箱培养24~48 h 后测量抑菌圈,以抑菌圈直径(DIZ)大小判断抑菌活性。判定标准:DIZ≥15mm,指示致病菌对益生菌高度敏感;10 mm≤DIZ<15 mm,指示致病菌对益生菌中度敏感;6 mm≤DIZ<10 mm,指示致病菌对益生菌低度敏感;DIZ<6 mm,指示致病菌对益生菌不敏感[10]。
1.5 杂色曲霉菌药敏试验
药敏试验采用纸片琼脂扩散法(Kirby-Bauer disc diffusion method,K-B 法),选择S1099 成套药敏片四环素、新霉素、红霉素等作为试验药物。将浓度为1×108CFU/mL的杂色曲霉孢子液取100 μL涂布在琼脂培养基上,用无菌镊子将药敏片贴到培养基表面,轻轻压实,每种药敏片做3个重复,置于37 ℃恒温培养箱培养24 h。参考美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)推荐的判定方法,根据抑菌圈的直径(Φ)大小判定其药物敏感性,对应标准分别为:Φ≥20 mm为敏感(S),15 mm≤Φ<20 mm为中度耐药(I),Φ<15 mm为耐药(R)[11]。
1.6 数据统计与分析
使用SPSS 22.0 软件进行单因素方差分析(oneway ANOVA),用“平均值±标准误差(SEM)”表示,P<0.05有统计学意义。
2 结果与分析
2.1 形态学特征
肉眼观察菌落呈淡绿色,外圈呈白色,中圈呈深绿色,内圈呈淡绿色,直径2~3 cm,绒状,如图1A。经乳酸酚棉蓝染色在40 倍显微镜下可看到孢子呈放射状,如图1B。
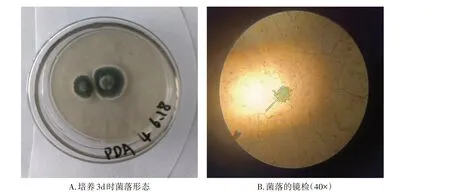
图1 分离菌株4号菌形态
2.2 霉菌rDNA-ITS序列分析结果
选择真菌通用引物ITS/ITS4对分离菌株4号霉菌的rDNA-ITS 进行特异性扩增,PCR 产物经1%琼脂糖凝胶电泳检测,检测结果如图2 所示,4 号菌的rDNAITS序列PCR产物片段在500~700 bp,产物条带单一,浓度高,与ITS序列条带相符。

图2 4号霉菌的PCR产物电泳图
据图3所示,分离菌株4号菌与MH869201.1杂色曲霉菌(Aspergillus versicolor)处于同一分支并且遗传距离最近。结合形态学与ITS 结果进行分析,分离菌株4号菌为杂色曲霉菌。

图3 分离菌株4号菌基于rDNA-ITS序列的系统发育树
2.3 杂色曲霉生长抑制结果
由表1和图4可知,在相同条件下培养24 h后,杂色曲霉菌对罗伊氏乳杆菌、发酵乳杆菌、混合乳杆菌高度敏感。罗伊氏乳杆菌和混合乳杆菌组对杂色曲霉生长菌落抑菌圈直径均大于发酵乳杆菌,且差异显著(P<0.05);罗伊氏乳杆菌和混合乳杆菌组对杂色曲霉菌落生长抑菌圈直径差异不显著(P>0.05)。

表1 不同类型的益生菌对杂色曲霉菌抑菌圈直径(n=3)

图4 三个处理组对杂色曲霉的抑菌试验
2.4 杂色曲霉菌药敏试验
每种药物进行3个重复,根据CLSI药敏试验判定标准,结果如表2 所示,分离的杂色曲霉菌株对头孢曲松、米诺环素、卡那霉素、庆大霉素、头孢拉定和氨苄西林耐药,对其他14种药物敏感(表2)。
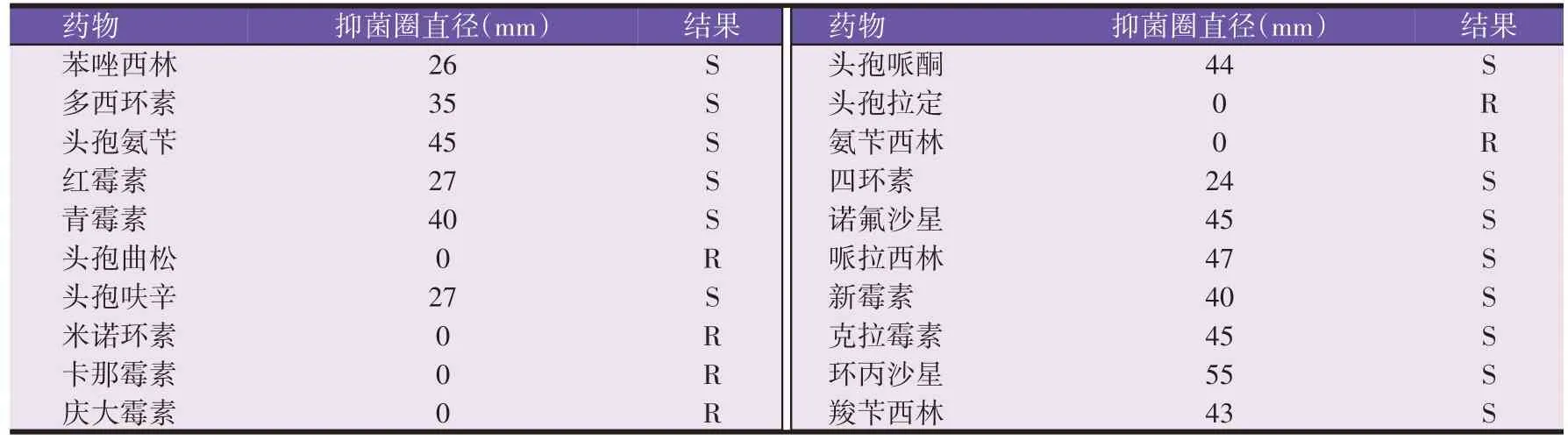
表2 杂色曲霉菌药敏试验结果(n=3)
3 讨论
3.1 杂色曲霉的分离鉴定
杂色曲霉属于一类氧杂蒽酮类化合物,在饲粮的储存期间易产生,不仅会引起工业器材出现霉腐现象,还会引起动物肝脏损伤和癌变发生[12]。据14C 示踪技术文献报道,杂色曲霉毒素在某种情况下会转变为黄曲霉毒素B1[13-14]。它的结构跟黄曲霉毒素相似,它的毒性和致癌性也是不容小觑的[15]。有资料显示,在1954年,首次从杂色曲霉培养物中分离出一种微黄色针状晶体有毒化合物,这种物质由二呋喃环和氧杂蒽酮组成。有学者认为,杂色曲霉毒素导致癌症的原因是二呋喃环末端的双键与DNA分子的尿嘧啶形成加合物,使DNA结构改变,复制错误,损害DNA[16-17]。
本研究中对发霉玉米储存中产生的霉菌进行分离纯化,通过传统的培养基下的真菌形态特征、显微镜下观察、PCR 扩增和rDNA-ITS 序列检测方法分离出杂色曲霉菌[18-20]。分离的4 号菌的rDNA-ITS 序列PCR产物片段在500~700 bp,与ITS序列条带相符,经比对最后判断为杂色曲霉菌。
3.2 益生菌对杂色曲霉菌抑制作用
发酵乳杆菌和罗伊氏乳杆菌都是属于益生菌,现在许多益生菌都具有抑制有害菌生长的作用。徐丹等[21]研究发现,乳杆菌对霉菌有较好的抑制作用,全菌液的抑制效果优于上清液或沉淀液。刘春娟等[22]研究表明,罗伊氏乳杆菌是具有抑制青霉菌能力的优势菌株。发酵乳杆菌和罗伊氏乳杆菌对杂色曲霉的抑制作用,发酵乳杆菌会产生抑菌活性物质[23],罗伊氏乳杆菌则是靠其代谢产物罗伊氏菌素发挥作用,罗伊氏菌素可以抑制多种有害菌如沙门氏菌等[24]。本试验结果表明,通过发酵乳杆菌和罗伊氏乳杆菌以及混合乳杆菌对杂色曲霉菌进行抑菌试验检测,发现3 组的培养基上都有抑菌圈,其中罗伊氏乳杆菌与混合乳杆菌组抑制效果较好,有明显的抑菌圈。发酵乳杆菌对杂色曲霉菌的抑菌圈虽然比较小,但结果也可以说明发酵乳杆菌具有抑制霉菌的作用,可以作为抑制饲料霉菌添加剂使用。
3.3 杂色曲霉药敏试验
关于杂色曲霉药敏试验,本试验使用了常用20种抗生素药物进行药敏试验,结果表明,该分离的杂色曲霉菌株对头孢曲松、米诺环素、卡那霉素、庆大霉素、头孢拉定和氨苄西林耐药,对其他14 种药物敏感,表明杂色曲霉对14 种抗生素表现出非典型耐药性。其中,环丙沙星对杂色曲霉的抑菌圈最大,红曲霉、头孢呋辛、四环素的抑菌圈较小,可以看出绝大多数抗生素药物是可以抑制杂色曲霉的生长,可以为探究抗霉药物的使用提供一定的参考。
4 结论
本研究分离了一株杂色曲霉菌,并采用牛津杯法评估了两株乳杆菌及混合乳杆菌对杂色曲霉菌的抑制作用,结果显示,3个处理组对杂色曲霉均具有抑制作用,并且高度敏感,其中,混合乳杆菌组抑菌效果较好,这可以为抑制饲料发霉提供数据参考。
