尼罗罗非鱼Rab11-FIP5的原核表达及多克隆抗体制备
2023-08-28宋漫玲潘传燕王则奋冯鹏霏张永德罗洪林
宋漫玲 潘传燕 王则奋 冯鹏霏 张永德 罗洪林
尼罗罗非鱼Rab11-FIP5的原核表达及多克隆抗体制备
宋漫玲1潘传燕2王则奋1冯鹏霏2张永德2罗洪林2
(1.广西产研院生物制造技术研究所有限公司,广西 南宁 530201;2.广西水产科学研究院/广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021)
为研究尼罗罗非鱼Rab11效应因子FIP5(Rab11-FIP5)的基因功能,试验设计了Rab11-FIP5基因序列用于原核表达载体,构建原核表达载体pET-B2m-Rab11-FIP5,随后诱导表达融合蛋白Rab11-FIP5,表达产物纯化后免疫日本大耳兔制备Rab11-FIP5多克隆抗体,采用ELISA和Western Blot方法分析鉴定目的蛋白。结果:Western Blot检测结果显示有清晰目的条带,且条带单一,分子量约为62 KD,与预期分子量一致;ELISA检测抗体效价为1:2 048 000,说明效价符合抗体标准,性能良好。结论:成功制备了Rab11-FIP5多克隆抗体,为开展Nt-Rab11-FIP5的定位和功能研究提供了基础工具。
尼罗罗非鱼;原核表达;多克隆抗体
引言
罗非鱼是我国优势水产养殖品种,具有蛋白含量高、生长快、环境适应性强等特点,罗非鱼相关产业在沿海地区的经济发展和带动农民增收、脱贫致富方面做出了重要贡献。近年罗非鱼养殖频发的病害制约着相关产业健康发展,造成的经济损失无可计数。Rab11家族相互作用蛋白(Rab11-FIPs,也被称为FIPs)是一个进化保守的蛋白家族,研究确认FIPs在调控真核细胞内吞循环中扮演着关键角色[1,2]。至今为止,鱼类Rab11基因相关功能研究鲜有报道。Rab11基因被发现在斑马鱼神经系统发育过程中起着重要但截然不同的作用,该研究结果为Rab11基因在斑马鱼胚胎发育中起功能作用提供了新的证据[3]。张宇等[4]发现大黄鱼全身组织均有Rab11蛋白表达,溶藻弧菌刺激后大黄鱼的肝脏、肾脏和脾脏组织中Rab11蛋白水平均明显上升,表明了Rab11基因在大黄鱼的抗病免疫反应中存在重要作用。夏正龙[5]在发掘罗氏沼虾(Macrobrachium rosenbergii)免疫相关基因时,发现了Mr Rab11基因在肝胰腺中的表达量最高,其次是肌肉和肠道;阴沟肠杆菌感染12 h后,罗氏沼虾肝胰腺中Mr Rab11的表达量相比于对照组显著提高,推测Mr Rab11参与罗氏沼虾在肝胰腺中的应激免疫过程。上述文献报道均有表明Rabll基因参与了机体对细菌和病毒免疫,且Rabll基因对细菌和病毒的免疫机制可能存在差异。
Rab11-FIP5是FIPs家族的一种效应蛋白分子,也被称为Rip11或者Gaf-1/Gaf1b和pp75,其蛋白质的N端包含与膜磷酸肌醇结合的C2结构域,大部分位于极化的上皮细胞中,并与Rab11 GTPases发生相互作用,在细胞骨架重排、铁摄取、胞吐等多种细胞生命活动中发挥作用。最初Rab11-FIP5是在系统性红斑狼疮患者的血清中发现[6],随后发现其可调节内吞蛋白的运输和靶向[1]。研究发现Rab11-FIP5在脂肪细胞对胰岛素治疗的反应中负责易位,把含有GLUT4转运体的囊泡易位至细胞表面,同时也调节其他膜转运调节蛋白的募集[7]。敲除siRNA的蛋白表明了Rab11-FIP5存在于外周核内体,调节内在受体的分类到缓慢的循环途径,还发现了一种与Rip11/fip5结合的蛋白激肽II,这证明了Rab11-FIP5是引导内吞胞内蛋白进入相同循环通路所必需分子[8]。文献研究显示,Rab11-FIP5与两栖类胚胎的端脑发育密切相关,Rab11-FIP5的敲除降低了端脑的细胞增殖[9]。综上所述,Rab11-FIP5的功能研究涉及机体发育等生命活动,但鱼类Rab11-FIP5的功能研究尚未见相关报道,更缺少用于后续研究的商业化抗体。为研究尼罗罗非鱼Rab11-FIP5的功能特性,本研究将尼罗罗非鱼Rab11-FIP5基因克隆至原核表达系统,构建原核表达载体pET-B2m-Rab11-FIP5进行表达和纯化,免疫日本大耳兔获得Rab11-FIP5多克隆抗体,为进一步研究尼罗罗非鱼Rab11-FIP5的生物学功能打下基础。
1 材料与方法
1.1 主要材料与仪器
1.1.1 样品
尼罗罗非鱼cDNA(由广西水产遗传育种与健康养殖重点实验室保存)。
1.1.2 主要菌株及试剂
主要菌株:表达载体pET-B2m和表达宿主菌B21(购自武汉金开瑞生物工程有限公司)。
主要试剂:限制性内切酶、T4 DNA连接酶、蛋白marker和DNA聚合酶(Fermentas,美国),异丙基-β-D硫代半乳糖苷诱(IPTG)(MERCK,德国),弗式完全佐剂和弗氏不完全佐剂(Sigma,美国),PVDF膜(聚偏氟乙烯膜)(ThermoFisher,美国),羊抗兔-HRP抗体(Jackson,美国),亲和层析柱料(GE Healthcare,美国)。
1.1.3 主要仪器
高速冷冻离心机Avanti J-26XP(购自贝克曼公司),恒温摇床TS-211C(购自上海天呈实验仪器制造有限公司),梯度PCR仪(购自德国Biometra公司),快速蛋白纯化系统AKTA Purifier UPC 100(购自GE Healthcare)等。
1.2 试验方法
1.2.1 蛋白结构分析和抗原预测
利用在线软件ExPASy中的ProtScale模块(网址:https://web.expasy.org/protscale/)对Rab11-FIP5蛋白质疏水性分析,TMHMM server v.2.0(网址:http://www.cbs.dtu.dk/ services/TMHMM-2.0/)预测蛋白序列的跨膜区间,DNAstar软件的Protean模块预测蛋白的亲水性、抗原指数等参数。
1.2.2Rab11-FIP5基因扩增及原核表达质粒构建
根据尼罗罗非鱼Rab11-FIP5基因序列(NCBI No. XP_019204508.1),使用Primer Premier 5.0设计特异性引物,在引物5' 端添加一段载体同源性序列。交由上海生工生物工程技术服务有限公司合成。引物序列为Rab11-FIP5-F:5'-TCCACTGGGTTCTCGGACTATGTTTACCCGTGATA-3';Rab11-FIP5-R:5'-TAAGGCCGCACTCGAGCACCACTTATT TACTACGAACCTGC-3'。
聚合酶链式反应后进行产物检测。采用无缝克隆技术,构建pET-B2m-Rab11-FIP5原核表达系统继续培养,之后进行产物测序鉴定。
1.2.3重组蛋白的表达和纯化
将重组质粒(pET-B2m-Rab11-FIP5)转化至大肠杆菌B21中,挑取单菌落接种于100 g·mL-1LB/Amp+培养基培养,过夜。收集过夜菌液,并超声破碎,运用聚丙烯酰胺凝胶电泳方法分析所得上清液和沉淀。采用Ni-NTA树脂层析柱纯化重组蛋白,聚丙烯酰胺凝胶电泳方法检测蛋白纯度。
1.2.4动物免疫和重组蛋白Rab11-FIP5多抗制备及效价检测
用纯化后的融合蛋白Rab11-FIP5作为抗原免疫两只成年日本大耳白兔,抗原注射量为500 μg/只,首次免疫将目的蛋白乳化,和弗氏完全佐剂等体积混匀后背部皮下多点注射大耳白兔进行免疫,之后每隔14天将目的蛋白与弗氏不完全佐剂等体积混匀注射大耳白兔做加强免疫,免疫次数至少4次/只,对每次免疫1周后的大耳白兔耳静脉采血于室温静置2 h,或者是放置温度为4 ℃的冰箱中过夜,收集析出血清于-20 ℃下保存;阴性对照为日本大耳白兔免疫前血清。根据说明书使用酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)测定分析阴性、阳性血清的效价。
1.2.5抗体特异性的Western blotting分析
将制备的蛋白样品进行聚丙烯酰胺凝胶电泳,以免疫前血清为阴性对照,所得的抗Rab11-FIP5蛋白多克隆抗血清稀释液(稀释1000倍)为一抗,37 ℃孵育1小时,洗涤后再加入HRP标记的羊抗兔IgG(稀释10 000倍)继续孵育30分钟,之后进行多克隆抗体特异性条带检测。
1.2.6抗体纯化
根据张永德等[10]的方法对Nt-Rab11-FIP5多抗进行纯化,用2×PBS含有0.02% NaN3以及1 m M EDTA的缓冲液收集洗脱产物,浓缩到所需体积,置于-20 ℃环境下保存,同时对样品进行SDS-PAGE分析。
2 结果与分析
2.1 Rab11-FIP5抗原预测
对Rab11-FIP5基因进行了抗原预测(图1)显示,Rab11-FIP5蛋白原子数为9 261,编码氨基酸605个,分子量为66 100.90 u,理论pI为7.25,不稳定性指数(II)为53.00,为不稳定蛋白;脂肪指数为71.85,水溶性总平均值(GRAVIY)为-0.660,该蛋白为亲水性蛋白;跨膜区以及信号肽分析结果显示,Rab11-FIP5蛋白存在跨膜区1个为第90-113氨基酸序列,该段序列有较强的疏水性,无信号肽序列;Rab11-FIP5蛋白二级结构显示主要含有α-螺旋(Hh)、随机线圈(Cc)和延伸链(Ee),三级结构显示蛋白序列含超家族为序列17-149aa。本研究选取了150-605aa表达蛋白进行多抗免疫,该段抗原指数得分适中(图1),可以引起较好的免疫。
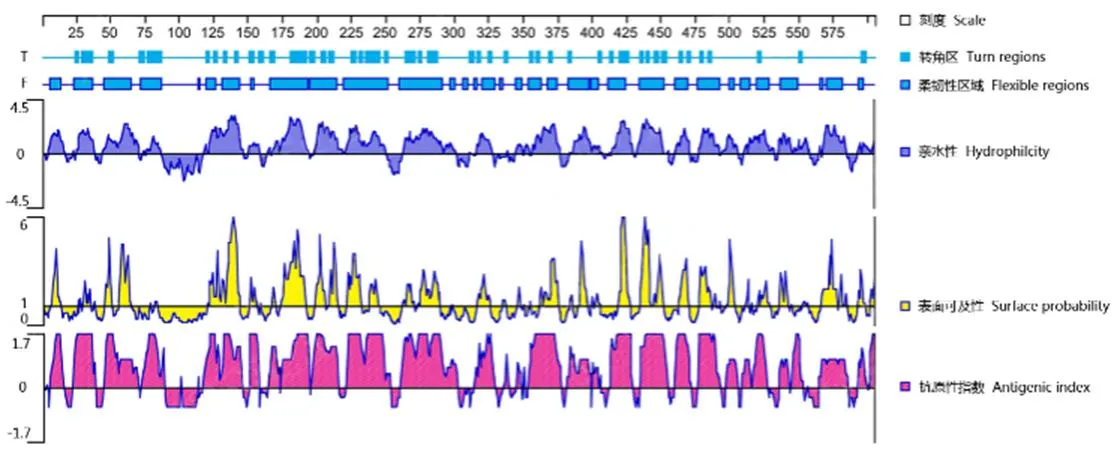
图1 尼罗罗非鱼Rab11-FIP5抗原表位分析
2.2 重组质粒Rab11-FIP5的构建与鉴定
在重组质粒pET-B2m-Rab11-FIP5目的基因片段用SalⅠ和BamHⅠ进行双酶切和鉴定,可以清楚看到1条大小为1368 bp(图2)的条带,符合目的条带预期,表明目的基因片段已成功导入表达系统Nt-Rab11-FIP5- pET-B2m构建成功。
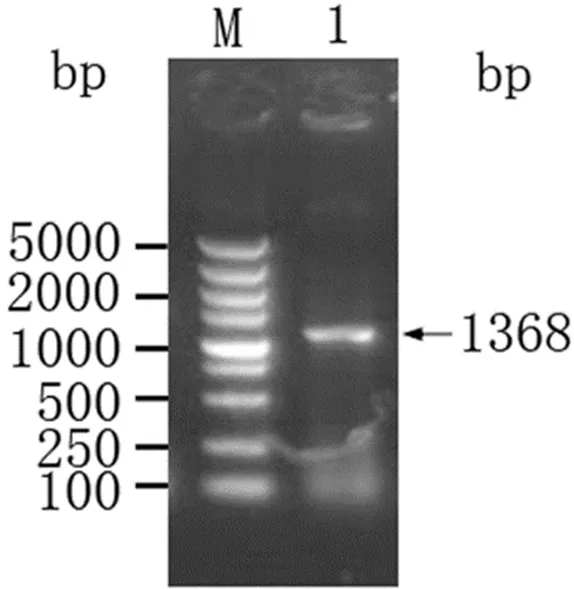
M:DL2000 DNA Marker;1:Rab11-FIP5 扩增产物
2.3 重组蛋白Rab11-FIP5的表达与纯化
将已导入重组质粒pET-B2m-Rab11-FIP5的表达菌E.coli BL21置于100g·mL-1LB/Amp+培养基培养液中进行培养,加入诱导剂IPTG)诱导Rab11-FIP5蛋白表达,从图3可以看出,上清液和沉淀泳道出现了与Rab11-FIP5蛋白分子量大小一致的蛋白,清晰可见且蛋白条带粗细相当,表明目的蛋白在上清与沉淀均有表达且分子量表达接近,并且在0.5 mmol·L-1诱导剂、30℃下,3 h时有较高水平的表达量。同时说明pET-B2m-Rab11-FIP5重组表达载体构建成功明,表达的重组蛋白有两种形式,分别是包涵体蛋白和可溶性蛋白存在,分子量约为62 KD。SDS-PAGE电泳对经收集、破碎、和纯化后的诱导菌液进行进行分析鉴定,结果显示经洗脱下来的重组蛋白的纯度较好,杂蛋白明显减少,可作为抗原用于后续多克隆抗体制备实验材料(图4)。
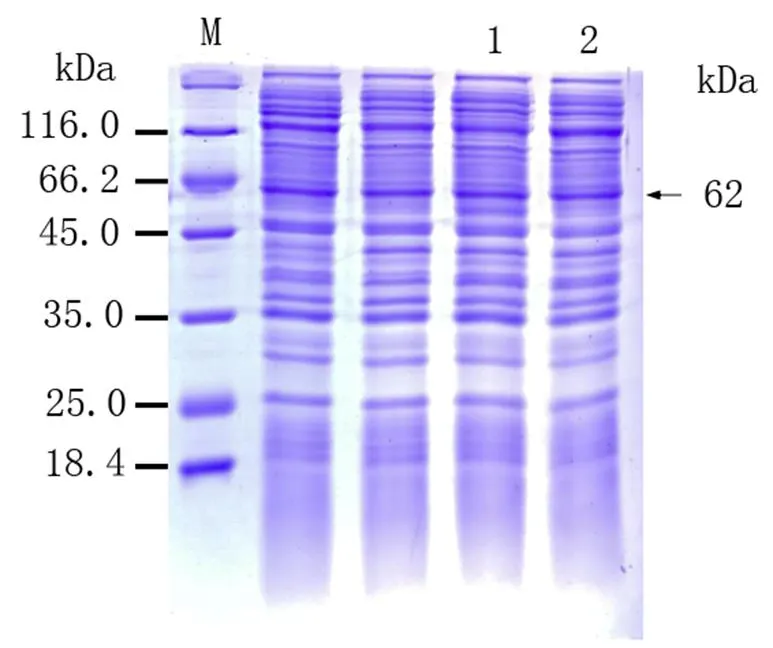
M:蛋白质Marker;1:沉淀中的目的蛋白;2:上清中的目的蛋白
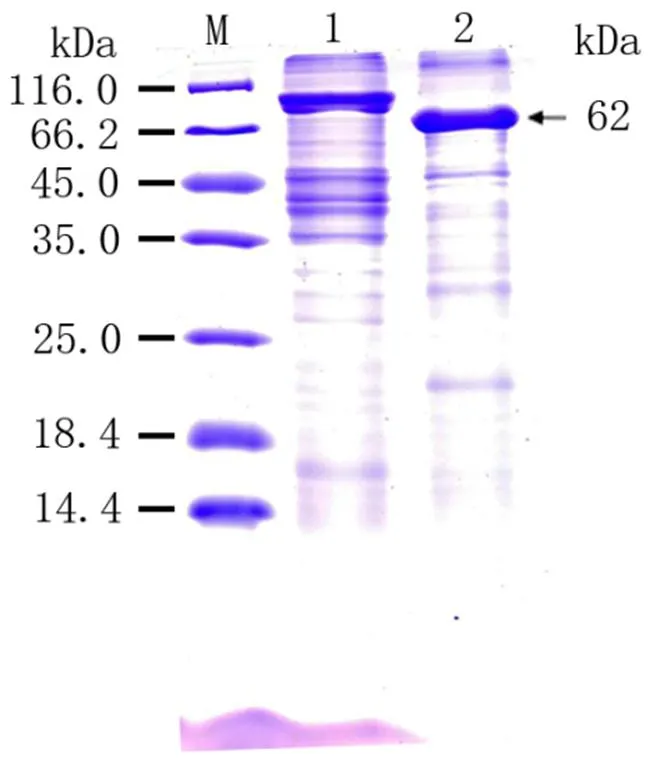
M:蛋白质Marker;1:其他蛋白;2:纯化后的重组Rab11-FIP5蛋白
2.4 抗血清效价检测
收集经至少4次免疫的兔源Rab11-FIP5抗血清,用间接酶联免疫吸附方法检测抗血清效价达到了1∶2 048 000(图5),表明纯化后的Rab11-FIP5重组白可以诱导日本大耳白兔产生效价高的多克隆抗体。
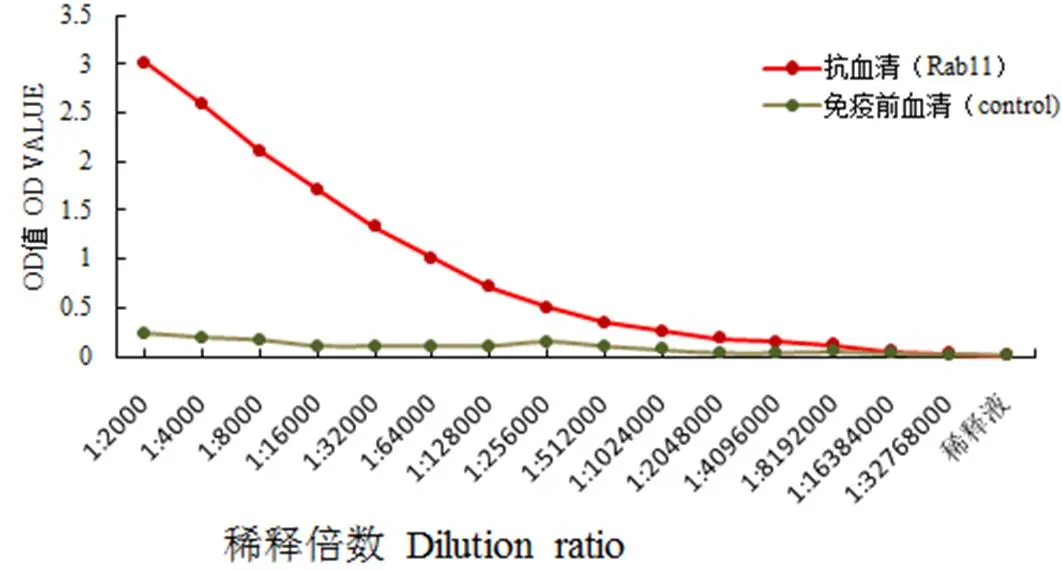
图5 尼罗罗非鱼Rab11-FIP5多肽多克隆抗体效价曲线
2.5 抗体特异性检测结果
Western blotting结果显示,日本大耳白兔免疫前所得抗血清为阴性对照,重组Rab11-FIP5蛋白样品泳道检测到蛋白分子量约62 kD蛋白(见图6),蛋白条带清晰,无杂带,说明制备的抗体能够识别并结合Rab11-FIP5蛋白,性能良好,可用于检测尼罗罗非鱼的Rab11-FIP5蛋白变化。
2.6 Rab11-FIP5多克隆抗体纯化分析
将经效价分析和抗体鉴定后的抗血清进行纯化,采用0.1 M柠檬酸液洗脱,用含有0.02% NaN3以及1 mM EDTA的PBS缓冲液收集。对纯化后的抗体进行SDS-PAGE分析,结果表明纯化效果较好,目的蛋白条带清晰,无明显杂带(图7)。
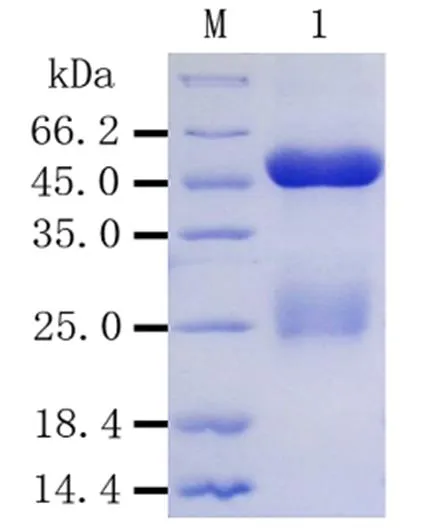
M:蛋白质Marker;1:纯化的Rab11-FIP5抗体
3 讨论
3.1 Rab11-FIP5的生物功能分析
Rab11-FIPs是一种高度保守的支架蛋白家族,随着FIP功能的分子细节研究结果的公布,Rab11-FIPs被证实是细胞内多个内小体循环过程的关键调控者。此外,随着研究的深入,FIP这一系列功能不断扩大,Rab11-FIPs被证明在细胞分裂,细胞迁移,对胰岛素、记忆过程、免疫和免疫的反应、炎症反应、水的再吸收、生育、视网膜细胞发育和各种人类癌症等生理过程中起作用[1,11-20]。由于这些细胞过程与疾病相关,因此在未来FIPs可能被确定为潜在的目标用于人类疾病的治疗干预。弓形虫在入侵哺乳动物细胞可自制膜结合室内繁殖,即寄生液泡(PV),而Ⅰ类(FIP1C、FIP2、FIP5)和Ⅱ类(FIP3、FIP4)在弓形虫PV囊泡内存在不同含量的FIPs,说明哺乳动物Rab11参与PV蛋白形成[21]。在研究前列腺癌机制时,证据显示Rab11-FIP5表现与胞质α6β1整联蛋白密切联系,α6β1是参与肿瘤转移的重要蛋白,推测α6β1整联蛋白通过Rab11-FIP5参与前列腺癌细胞向富含层黏连蛋白组织的迁移[22]。最新证据发现RAB11FIP5过表达调节NK细胞参与HIV-1广泛中和抗体的产生[23]。TRIM21可介导的多聚泛素化Rab11-FIP1和Rab11-FIP5协同促进pIgA跨膜转运,介导黏膜的免疫反应[24]。我国是罗非鱼生产大国,其产业前景非常广阔,罗非鱼近年病害严重,本研究旨在研究Rab11-FIP5对尼罗罗非鱼的生物功能关系,通过制备其多克隆抗体,进一步研究其与尼罗罗非鱼的某种生物功能是否关联。
3.2 Rab11-FIP5的生物信息学分析
生物信息学分析是一种基于核酸和蛋白质序列分析其表达的结构功能的生物信息,从而进一步了解机体的基因组学和蛋白质组学信息的方法。本研究从尼罗罗非鱼cDNA文库中筛选出Rab11-FIP5基因,设计合成尼罗罗非鱼Rab11-FIP5基因,并进行了生物信息学分析。Nt-Rab11-FIP5基因具有典型的Rab结构域,属于Rab11蛋白家族。同时,该基因在结构上高度保守,可能与不同物种间的某种相似功能有关。蛋白预测分析表明Rab11-FIP5蛋白编码氨基酸有605个,存在跨膜结构区域1个,为第90~113氨基酸序列段,推测Rab11-FIP5蛋白活动不局限于胞内,其可能活跃于胞内外参与机体的生命活动。其他抗原性分析,该基因编码的蛋白序列无信号肽存在,局部蛋白亲水性好,含17~149氨基酸序列段为超家族,综上研究选取了150~605氨基酸序列段,用于抗原抗体的制备,抗原表位较好。因此选择了上述基因序列进行克隆,开展多克隆抗体制备工作。
3.3 Rab11-FIP5多克隆抗体制备分析
原核表达系统因其易培养、生长快、操作方便且能产生足量的目标蛋白等优势,常作为外源基因融合表达。本研究通过设计并克隆出编码尼罗罗非鱼Rab11-FIP5蛋白基因序列,连接到原核表达载体pET-B2m上进行诱导表达,以获得Rab11-FIP5重组蛋白。在诱导环节中,诱导温度、诱导时间和诱导剂浓度是影响重组目的蛋白表达的重要因素,提前诱导菌体太少,外源蛋白产量低;诱导太迟,细菌过老,也不利于基因表达。为使得表达的外源蛋白更具备活性,产量高且质量好,本次实验选择确定最佳实验条件,即37 ℃、0.5 mmoL/L IPTG、A 600 mm=0.6时进行诱导尼罗罗非鱼Rab11-FIP5蛋白表达。实验中收集并离心诱导后的细菌进行裂解,获得重组蛋白并进行SDS-PAGE电泳,结果显示加上清液和沉淀泳道均约有分子量62 KD出现,说明该重组蛋白以可溶性蛋白和包涵体蛋白两种形式表达。包涵体出现的原因可能是Rab11-FIP5蛋白表达过高,或者是原核表达载体pET-B2m缺少蛋白正确折叠的影响因子,也有缺乏蛋白翻译修饰的酶类等因素。当然,包涵体的形成并不影响抗多克隆抗体的制备,反而更有助于外源蛋白的表达与纯化[22]。亲和层析法是融合蛋白纯化的方式之一,且其不受尿素干扰,可直接在变性条件下纯化蛋白。为除去包涵体中的脂质和部分膜蛋白等杂质,对其进行洗涤和纯化,本研究利用Ni-NTA树脂层析柱纯化重组蛋白,获得了纯度高达85%的重组蛋白。
免疫坏节,选择日本大耳白兔作为免疫动物,该研究中用500 μg纯化的重组蛋白和弗氏完全佐剂(1∶1)混匀后注射日本大白耳兔腹部皮下进行免疫。首次免疫后,动物机体正进行抗原刺激、识别抗原及效应B细胞增殖阶段,大约7天可检测到抗体,在10天左右达到最大值,如果第二次注入抗原时间过短,极易造成免疫抑制,因此间隔10~20天为好,以保持刺激强度,增强抗体效价。本实验选择间隔为两周,共免疫5~6次,提高大耳白兔的免疫应答水平。本研究将获得的兔抗Rab11-FIP5多克隆抗体,通过Western blot 检测验证,结果显示有清晰的条带,表明成功制备了兔抗Rab11-FIP5多克隆抗体,同时为进一步深入研究Rab11-FIP5在尼罗罗非鱼中的表达及生物功能研究提供了重要工具。
4 结论
本研究据EST序列设计得到了尼罗罗非鱼Rab11-FIP5 cDNA序列,该序列含有Rab家族典型保守的结构域。成功构建了尼罗罗非鱼Rab11-FIP5原核表达载体,重组质粒转入大肠杆菌B21并进行诱导表达,表达产物纯化后免疫日本大耳兔制得了效价高、特异性强的多克隆抗体,为Rab11-FIP5在尼罗罗非鱼的异免疫机制研究提供基础工具,为今后其生长发育、病害防治等方面研究奠定了基础。
[1]HORGAN C, MCCAFFREY M. The dynamic Rab11-FIPs [J]. Biochemical Society Transactions, 2009, 37(5): 1032.
[2]李琳. Rab11A效应因子FIP5在FLCN-Rab11A结合中的作用[D]. 杨凌: 西北农林科技大学,2019.
[3]ZHANGg H J, GAO Y, QIAN P P, et al. Expression analysis of Rab11 during zebrafish embryonic development.[J]. BMC Developmental Biology, 2019, 19(1): 25.
[4]张宇,韩芳,刘岚萍,等. 大黄鱼Rab11基因的克隆与表达分析[J]. 集美大学学报(自然科学版),2016,21(3): 167-174.
[5]夏正龙,黄雪娜,黄振远,等. 罗氏沼虾Rab11基因cDNA克隆及其组织表达分析[J]. 水生生物学报,2016,40(3): 443-450.
[6]WANG D, BUYON J P, ZHU W, et al. Defining a novel 75-kDa phosphoprotein associated with SS-A/Ro and identification of distinct human autoantibodies[J]. The Journal of Clinical Investigation, 1999, 104(9): 1265-1275.
[7]WELSH G I, LENEY S E, BETHAN L L, et al. Rip11 is a Rab11- and AS160-Rab GAP-binding protein required for insulin-stimulated glucose uptake in adipocytes[J]. Journal of Cell Science, 2007, 120(120): 4197-4208.
[8]SCHONTEICH E, WILSON G M, BURDEN J, et al. The Rip11/Rab11-FIP5 and kinesin II complex regulates endocytic protein recycling[J]. Journal of Cell Science, 2008, 121(22): 3824-3833.
[9]YOON J, GARO J, LEE M, et al. Rab11fip5 regulates telencephalon development via ephrinB1 recycling.[J]. Development, 2021, 148(3): dev196527.
[10]张永德,林勇,冯鹏霏,等. 尼罗罗非鱼Lck多克隆抗体的制备及鉴定[J]. 南方农业学报,2018,49(11): 2304-2310.
[11]MUTO A, AOKI Y, WATANABE S. Mouse Rab11-FIP4 regulates proliferation and differentiation of retinal progenitors in a Rab11-independent manner[J]. Developmental Dynamics, 2010, 236(1): 214-225.
[12]HORGAN C P, OLELSY A, ZHDANOV A V, et al. Rab11-FIP3 Is Critical for the Structural Integrity of the Endosomal Recycling Compartment[J]. Traffic, 2007, 8(4): 414-430.
[13]WELSH G I, LENEY S E, LLOYD-LEWIS B, et al. Rip11 is a Rab11- and AS160-RabGAP-binding protein required for insulin-stimulated glucose uptake in adipocytes[J]. Journal of Cell Science, 2007, 120(23): 4197-4208.
[14]FAN G H, LAPIERRE L A, GOLDENRING J R, et al. Rab11-family interacting protein 2 and myosin Vb are required for CXCR2 recycling and receptor-mediated chemotaxis[J]. Molecular Biology of the Cell, 2004, 15(5): 2456-2469
[15]WANG Z, EDWARDS J G, RILEY N, et al. Myosin Vb mobilizes recycling endosomes and AMPA receptors for postsynaptic plasticity[J]. Cell, 2008, 135(3): 535-548.
[16]LINDSAY A J, MCCAFFRET M W. Purification and functional properties of Rab11-FIP3[J]. Methods in Enzymology, 2005, 403(403): 499-512.
[17]DAMIANI M T, PAVAROTTI M, LEIVA N, et al. Rab coupling protein associates with phagosomes and regulates recycling from the phagosomal compartment[J]. Traffic, 2010, 5(10): 785-797.
[18]BEHRENDS U, SCHNEIDER I, ROSSLER S, et al. Novel tumor antigens identified by autologous antibody screening of childhood medulloblastoma cDNA libraries.[J]. International Journal of Cancer Journal International Du Cancer, 2003, 106(2): 244-251.
[19]GARCIA M J, POLE J C M , CHIN S F, et al. A1 Mb minimal amplicon at 8p11-12 in breast cancer identifies new candidate oncogenes[J]. Oncogene, 2005, 24(33): 5235-5245.
[20]PATILV S. Rab coupling protein (RCP): a novel target of progesterone action in primate endometrium[J]. Journal of Molecular Endocrinology, 2005, 35(2): 357-372.
[21]HARTMAN E J, ASADY B, JULIA D R, et al.. The Rab11-family interacting proteins reveal selective interaction of mammalian recycling endosomes with the Toxoplasma parasitophorous vacuole in a Rab11-and Arf6-dependent manner[J]. Molecular Biology of the Cell, 2022, 33(5): ar34.
[22]DAS L, GARD J M C, PREKERIS R, et al. Novel regulation of integrin trafficking by Rab11-FIP5 in aggressive prostate cancer[J]. Molecular Cancer Research, 2018, 16(8): 1319-1331.
[23]BRADLEY T, PEPPA D, PEDROZA P I, et al. Rab11-FIP5 expression and altered natural killer cell function are associated with induction of HIV broadly neutralizing antibody responses[J]. Cell, 2018, 175(2): 387-399.
[24]Fan X X, ZHOU D H, ZHAO B L, et al. Rab11-FIP1 and Rab11-FIP5 regulate pIgR/pIgA transcytosis through TRIM21-mediated polyubiquitination[J]. International Journal of Molecular Sciences, 2021, 22(19): 10466-10466.
Prokaryotic Expression of Rab11-FIP5 in Nile Tilapia and Preparation of Its Polyclonal Antibody
In order to study the gene function of Rab11 effect factor FIP5 (Rab11-FIp5) in nile tilapia, the Rab11-FiP5 gene sequence was designed for prokaryotic expression vector, and the prokaryotic expression vector pET-B2m-Rab11-FIP5 was constructed, and then the fusion protein Rab11-Fip5 was induced. After purification, Rab11-FIP5 polyclonal antibody was prepared by immunizing Japanese rabbits with large eared rabbits. The target protein was analyzed by ELISA and Western Blot. Results: Western Blot analysis showed that there was a clear target band with a single band, and the molecular weight was about 62 KD, consistent with the expected molecular weight. The titer of the antibody detected by ELISA was 1:048000, indicating that the titer met the antibody standard and had good performance. Conclusions: Rab11-FIP5 polyclonal antibody was successfully prepared, which provides a basic tool for the localization and functional study of Nt-Rab11-FIP5.
nile tilapia; prokaryotic expression; purification; polyclonal antibody
S917.4
A
1008-1151(2023)07-0064-05
2023-01-26
国家自然科学基金(31372553;31760765)。
宋漫玲(1991-),女,广西产研院生物制造技术研究所有限公司工程师,硕士,研究方向为水生动物遗传育种。
