原核漆酶的研究进展及其应用
2023-08-15张馨刘功良白卫东梁景龙
张馨,刘功良,白卫东,梁景龙,刘 锐,
(1.仲恺农业工程学院轻工食品学院,广东广州 510225;2.广东省岭南特色食品科学与技术重点实验室,广东广州 510225;3.农业农村部岭南特色食品绿色加工与智能制造重点实验室,广东广州 510225)
漆酶(苯二酚:氧氧化还原酶,EC1.10.3.2)是一种多功能的氧化还原酶,能够氧化多种酚类和非酚类化合物,同时伴随四个氢质子转移,将氧分子转化为水。第一种漆酶是1883 年在日本漆树的渗透液中发现的,因此命名为漆酶[1]。漆酶在动物、植物、地衣、真菌和细菌中广泛分布,不同来源的漆酶其性质也存在差异,但在活性、催化反应机制以及底物广泛性上具有相似性。真菌漆酶氧化还原电位高,催化活性强,在多个领域已被广泛应用。但真菌漆酶存在以下缺点:一、真菌发酵生产漆酶所需的时间较长,生产成本较高;二、适合在温和和酸性条件下使用,在高温、高碱和高盐条件下不稳定;三、真菌漆酶容易被金属离子、有机溶剂等多种物质抑制活性,上述的种种缺点阻碍了真菌漆酶的工业化应用[2−3]。而原核漆酶可以在很大程度上弥补真菌漆酶的各种缺点,如在高温和高碱条件下具有很好的稳定性,对抑制剂的敏感性较低,对金属离子的依赖性较低,并易于异源表达。与真菌相比,原核漆酶的缺点在其氧化还原电位较低,催化活性较弱。而这些缺点可以通过定向进化、蛋白质工程改造等多种技术手段改善。因此近年来对原核漆酶的研究和应用迅速增长[4]。同时,原核漆酶在工业应用中具有发酵时间短、生产成本低、应用广泛和经济效益高等优势[5−6]。
原核漆酶可以用于食品工业[7]、环境保护和治理[8−9]、纺织染料脱色和降解[10]、纸浆和造纸工业[11]以及生物传感器的开发[12]等领域。本文回顾了原核漆酶的来源、结构、催化机制及其理化性质并对原核漆酶的应用及其最新进展进行了概述,以期可以为今后原核漆酶的应用研究提供参考。
1 原核漆酶的来源
漆酶曾经在很长的时间内被认为只存在于真核生物中[13]。直到1993 年,Givaudan 等[14]才在水稻根瘤细菌的脂肪固氮螺菌(Azospirillum lipoferum)中检测到漆酶活性,这也是第一次在原核生物中发现漆酶活性。2000 年,Alexandre 等[15]通过生物信息学技术,提出漆酶也普遍存在于原核生物中。迄今为止,人们已经在多种原核生物中发现了大量不同种类的漆酶。
原核漆酶的筛选主要是通过两种方法。第一种方法是在自然环境中筛选具有产漆酶活性菌种的传统方法。主要是利用漆酶可以将ABTS(2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸)、SGZ(丁香醛连氮)、愈创木酚等底物氧化成为有色产物的方式,快速地筛选鉴定具有产漆酶活性的菌种。目前采用这种方法已经在自然界中筛选鉴定出多种产漆酶的原核微生物,包括假单胞菌属(Pseudomonas)[16−17]、地衣芽孢杆菌属(Geobacillus)[18]、枯草芽孢杆菌(Bacillus subtilis)[19]、海洋单胞菌(Marinomonas mediterranea)[20]、大肠杆菌(Escherichia coli)[21−22]等。这种方法带来的主要问题有两个,第一个问题是重复筛选,相同的微生物往往会具有几乎相同特性的漆酶,由不同学者在不同时间,不同地点,相互独立的筛选同种漆酶,从而造成大量的重复工作;第二问题是后续研究困难,由于产漆酶的天然菌种,其漆酶产量较低,在后续漆酶提纯,基因克隆过程中困难重重,深入研究较为艰难。
筛选的第二种方法则是从基因库中进行漆酶资源的挖掘。随着基因测序技术的高速发展,各种基因数据库和基因组数据中数据呈现指数般的快速增长。而通过漆酶结构及其机理的研究,人们对漆酶的结构特点具有了更深入的了解。根据漆酶基因的特点可以直接从基因库获得漆酶基因。Endo 等[23]在2002 年以基因库中的同源序列作为探针,克隆了灰链霉菌的完整EpoA基因,并根据序列相似性和底物选择性,预测EpoA 为漆酶氧化酶,并在2003 年对其进行了酶学性质的研究[24]。Fang 等[25]在2010 年从南海海洋微生物宏基因组中获得了一个1.32 kb的新的细菌漆酶基因,并根据漆酶和铜离子结合的保守序列设计引物,通过PCR 直接扩增出完整的漆酶基因,将其命名为lac15。并证实该酶具有对氯元素的良好耐受性,以及能降解多种染料。Henne 等[26]在2004 年从极端嗜热菌Thermus thermophilus的基因组注释中,根据漆酶的基因序列特点推测标号为TTC1370 的阅读框为漆酶,进行了漆酶标注。在2005 年Miyazaki[27]证实TTC1370基因编码蛋白是具有超级耐热特性的漆酶。Fernandes 等[28]在2007 年从极端嗜热菌Aquifex aeolicus中鉴别出McoA为漆酶基因,并成功地在大肠杆菌中进行了异源表达,证实该蛋白具有典型的漆酶活性。Uthandi等[29]在2010 年从极端嗜盐菌(Haloferax volcanii)中鉴别出一个漆酶基因LccA,该基因含有小于7%的糖基化基团,对高盐具有极好的耐受性,并在2012年成功地在大肠杆菌中进行了异源表达[30]。2021年Motamed 等[31]在皮革厂废水中的宏基因组中,根据MeTarEnz、CDD 和Phyre2 等工具筛选出了一个PersiLac2的漆酶基因,并证实该漆酶具有良好的耐热稳定性和耐盐稳定性,能够有效地去除多种染料。
另外可以在宏基因组中筛选漆酶基因,脱离菌种的局限性,直接在环境中进行筛选。可以采用第一种类似于传统的菌种筛选方法,在构建的可表达宏基因组库中,添加漆酶氧化底物如ABTS、丁香醛连氮、愈创木酚等,使其在培养基中培养,直接筛选可以将漆酶底物氧化变色的阳性克隆。这种方法不需要对漆酶基因结构有深入的了解,就可以在众多的基因库包括宏基因组、宏转录组中筛选漆酶基因。Yang 等[32]在2018 年从海洋宏基因组60000 个克隆里面筛选出一个可以将ABTS 氧化成为绿色阳性克隆,并将其携带的基因命名为lac1326。该漆酶具有较好的耐热稳定性和较高的有机溶剂耐受性等一系列的优良特性。
2 原核漆酶的结构特征
在2003 年Enguita 通过X 结晶衍射方法解析枯草芽孢杆菌CotA 漆酶[33],这也是第一个被解析出具有四个铜离子的完整原核漆酶。在2004 年Enguita课题组又进一步解析出来含有催化底物ABTS 和氧气分子的CotA 漆酶的完整漆酶[34]。截至到现在,在PDB 数据库中已经可以检索到包括链霉菌属、枯草芽孢杆菌、片球菌属、嗜热栖热菌甚至不可培养微生物等将近20 多种不同来源的漆酶的晶体结构。
CotA 是芽孢杆菌形成的芽孢外膜的一种蛋白,具有漆酶活性,拥有极好的耐热和热稳定性[35]。CotA是一种单体纯蛋白酶,不需要进行额外的如糖基化等蛋白修饰。CotA 漆酶也是第一种被解析出三维结构的原核漆酶。CotA 具有的这些良好性能,使其成为了研究氧化还原过程中质子转移机理的理想模型蛋白[36]。也是迄今为止研究的最为深入,理解最透彻的原核漆酶。
CotA 蛋白全长共含有513 个氨基酸残基,分子量为65 kDa[35]。CotA 的整条蛋白链由三个同源的铜氧还蛋白结构域组成,所有的结构域几乎都是由八个β折叠形式形成的桶状结构组成。结构域1(氨基酸残基2-176,图1 中用青色表示)和结构3 共同形成三核三角区的铜离子区域;结构域2(残基183-340,图1 中用绿色表示)充当结构域1 和结构域3 之间的桥梁。结构域3(残基369-501,图1 中用灰色表示)包括单核铜中心,并且有助于形成位于结构域1 和3 界面之间的三核三角区的铜中心结合位点。三个结构域虽然同源,但是相似性较低,大约只有10%左右[37]。该蛋白的氨基酸序列含有多铜氧化酶所特有的四个氨基酸基序,分别为HXHG,HXH,HXXHXH 和HCHXXXHXXXXM/L/F(其 中X 表示氨基酸)[38],四个基序中含有的10 个组氨酸,1 个半胱氨酸和1 个蛋氨酸都是漆酶中铜离子的结合氨基酸。CotA 蛋白的这些结构特征是几乎所有漆酶共同具有的结构特征。
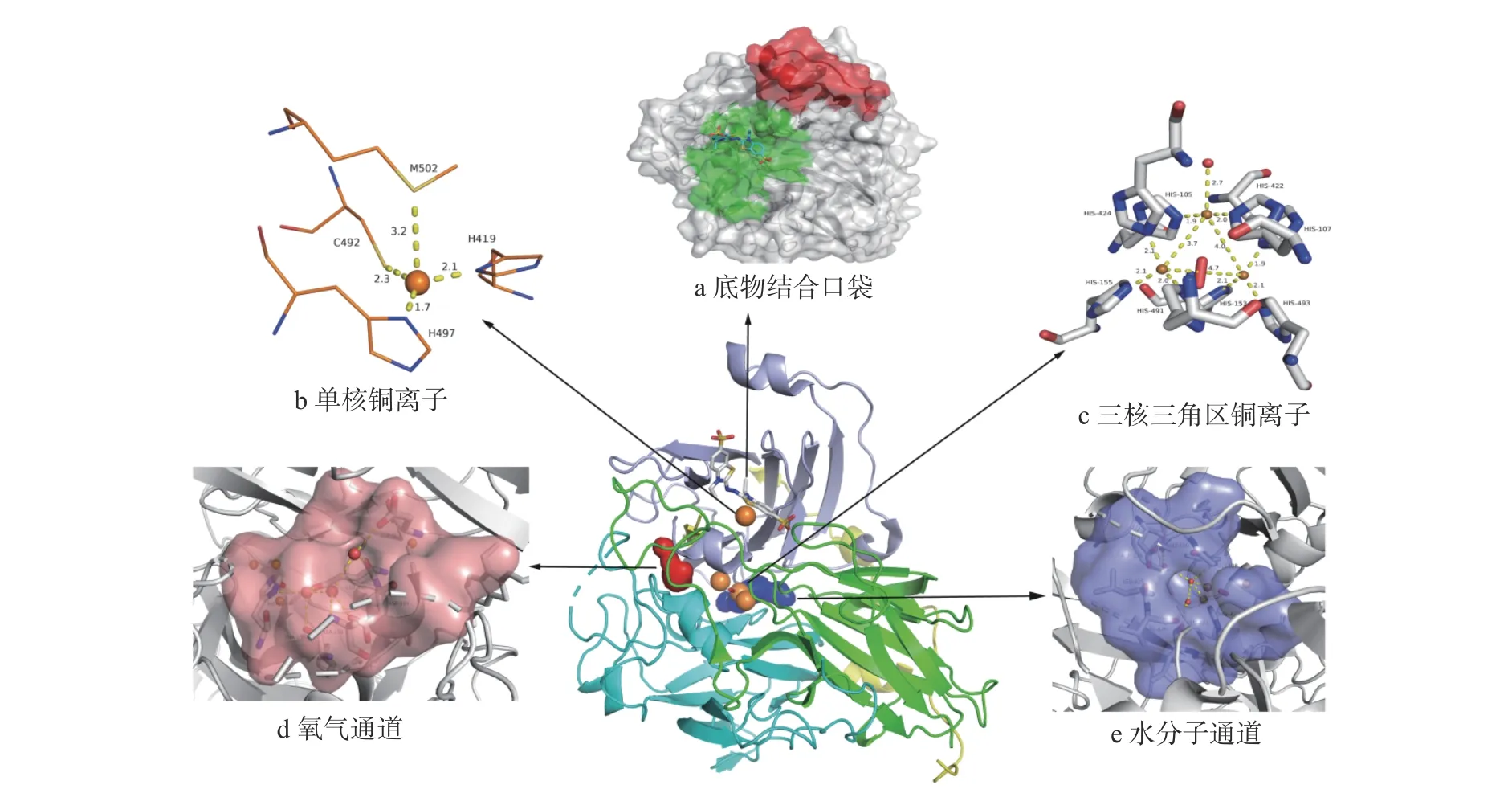
图1 枯草芽孢杆菌CotA 三级结构Fig.1 Tertiary structure of Bacillus subtilis CotA
CotA 酶的整体结构符合Dwivedi 等[39]通过对比已知的所有漆酶(细菌、真菌和植物)而提出的结构模型。漆酶由三个顺序排列的铜氧还蛋白结构域组成,铜结合基序在所有序列中都是高度保守的。在N-末端和C-末端,对应于结构域1 和3,相似性更加明显,因为铜相互作用基序存在于结构域1 和3,而不是结构域2。这种保守结构反映了这些酶中铜氧化和O2还原的共同反应机制。
对CotA 蛋白的整体结构进行分析,可以认为CotA 酶存在5 个重要的酶催化部位(如图1 所示)。第一部分为结合口袋,即催化底物与酶结合的位置;第二部分为铜离子的单核中心;第三部分为由3 个铜离子组成的三核中心;第四部分是辅助催化底物氧气由外面进入催化中心的氧气通道;第五部分是唯一副产物水分子从催化中心排出到蛋白外的水分子通道。
2.1 结合口袋
根据Enguita 课题组[33]提出的CotA 酶的结构模型,CotA 酶与其他漆酶相比,拥有一个硕大的底物结合口袋(图1a),其结合表面积为468 Å2,结合体积高达508 Å3,而且在结合口袋上方具有一个独特的盖子形状的结构(如图1a 所示红色显示部分)。CotA的结合口袋位于结构域3 范围内[33]。底物ABTS位于蛋白酶的结合区域,整体呈现U 型形状,ABTS的一半暴露在酶的外部空间,另外一部分埋在CotA结合口袋里面。包埋在CotA 内部中的磺酸盐部分非常靠近由Cys-229 和Cys-322 之间形成的二硫键,同时磺酸盐部分还和Gly-323 之间形成氢键。在U 型结构中包埋在蛋白酶内部的底物接近于T1 铜配体之一His-497 的芳香环。这种几何形状有利于电子从底物通过His-497 转移到T1 铜中心[34]。
Enguita 报道[34]的底物与酶的结合模型也在随后的研究中有一定程度的证实。Gupta 等[40]根据Enguita 提出的结晶结构,对催化底物ABTS 附近6 Å以内的19 个氨基酸进行随机突变,最终筛选出了两个可以强烈影响酶和底物结合的氨基酸残基L386 和G417,G417L 和L386W 的双重突变可以将CotA 酶与ABTS 的Km值由野生型CotA 的32.5 μmol/L降低到16.9 μmol/L,而将与丁香醛连氮(SGZ)的Km值由野生型的37 μmol/L 提高到84 μmol/L,说明这两个氨基酸残基会明显影响酶活催化底物的结合。而这一结果进一步被Chen 等[41]证实,Chen 等通过对与CotA 酶高度相似的突变短小芽孢杆菌W3中相同的L386、G417 两个氨基酸残基进行定点诱变,得到L386W 和G417L 双突变体,此双突变体能改变酶和底物ABTS 的亲和力,使其Km值由野生型漆酶中的0.252 mmol/L 降低到0.098 mmol/L。Enguita 报道[34]结合口袋里面位于227、208、418 和442 的氨基酸残基也会影响底物与酶的亲和力。Xu 等[42]对短小芽孢杆菌W3CotA 漆酶的S208G 和F227A 的双重突变,提高ABTS 与酶的亲和力,将Km值由0.241 mmol/L 降低到了0.073 mmol/L,进而提高催化效率;T418K/Q442A 的双重突变可以降低ABTS 和燃料活性黑5 的Km值,提高催化效率[43]。
但是也有学者指出,上面由Enguita 等[34]提出的底物与酶的结合模型并不符合理论计算出的电子云的分布[44]。2016 年,Liu 等[45]也汇报了CotA 酶结合ABTS 的一个新的结合位点,Liu 等推测Enguita等[34]提出的结合口袋可能是底物氧化后的产物与酶结合的位点。利用酶的结合口袋预测网站[46]对CotA 酶的结合位点进行预测,预测结果显示有两个得分相等且最高的结合位点,而这两个结合位点分别为Liu 等[45]和Enguita 报道[34]的结合位点。此外,用AutoDock-Vina 虚拟对接软件[47],在两个结合位点上进行虚拟对接,结果显示在两个位点均能形成稳定的结合形态。
由于漆酶能够氧化各种不同性质和大小的芳香族化合物,以及多种无机化合物,如低价金属离子等。因此,漆酶往往缺乏独特的底物结合方式,而具有广阔的结合袋,其往往能够容纳一种以上的底物。酶和底物结合部位往往会靠近单核中心,底物会与单核中心铜结合的His 残基中的咪唑环相互作用[48]。根据这些结构特点及定点诱变的实验结果推测,Enguita 等[34]报道的结合口袋似乎更加合理。但是我们也注意到,Xu 等[42]证实的可以强烈影响底物与酶结合的207 和442 的两个位点的氨基酸,并不处于Enguita 报道[34]ABTS 分子6Å[40]以内范围。在Enguita 报道[34]的结合位点进行虚拟对接,模拟出来的ABTS 能量最低的分子构象与报道的晶体结构中的构象不同。所以CotA 与底物的具体结合形式仍然需要进一步的深入研究。
2.2 铜离子中心
一般情况下,漆酶中一个分子的蛋白会结合四个铜离子。而铜离子结合位点为多铜氧化酶类最保守的位置。根据铜离子结合位点可以将铜离子分成两类。一类为单核中心,位于结构域3 内部,靠近底物氧化部位。一类为铜离子三核三角区,位于结构域1 和结构域3 的结合界面,是氧气还原为水的催化部位[36](图1)。
2.2.1 单核中心 CotA 中的单核I 型铜位点具有其他多铜氧化酶在该位点的典型几何结构(图1b),单核I 型铜离子与两个组氨酸、一个半胱氨酸和一个蛋氨酸结合,呈现出扭曲的双锥体几何结构,还有一个空置的轴向位点用于结合还原底物。其中半胱氨酸和铜原子之间形成配体-金属的S(π)→Cu(dx2-dy2)电荷转移,使得单核I 型铜离子在600 nm 左右具有一个的强烈吸收带,赋予CotA 酶强烈的蓝色,同时在电子顺磁共振(EPR)光谱中具有一个狭窄的平行超精细分裂[A_=(43−90)×10−4cm−1][49]。这也是漆酶又被称之为蓝酶的原因。
而与铜离子结合较弱的轴向配体氨基酸,在CotA 中第502 号的氨基酸残基的种类和周围环境却是决定该部位氧化还原电位的主要因素,且可以显著地影响漆酶酶活。高的氧化还原电位有助于电子从底物向单核中心铜离子进行转移,一般认为高的氧化还原电位可以提高漆酶活性[50],但是其氧化还原电位的高低与催化能力又并非简单的线性关系,如来自Myceliophthora thermophila的MtL 漆酶的氧化还原电位比来自Rhizoctonia solani的RsL 漆酶低250 mV,但是其转化常数却高8 倍以上[51],这一现象在CotA 中也有所体现。Durão 等[52]将502 号位置的氨基酸进行了突变,研究此位点对氧化还原电位和催化能力的影响,结果证实M502L 和M502F 突变可以将单核中心铜离子的氧化还原电位提高100 mV左右,却使CotA 酶的kcat 降低了2~4 倍。另外单核中心铜离子周围氨基酸的疏水特性会大幅度地影响氧化还原电位的高低。Durão 等[53]研究附近微环境的疏水性对氧化还原电位的影响,通过将附近的疏水氨基酸386 位的亮氨酸和494 位的异亮氨酸突变成为亲水性的丙氨酸,发现这种突变将会导致氧化还原电位分别下移约60~100 mV,并伴随着该酶活的大幅下降。Koschorreck 等[54]对和CotA 同源且高度相似的地衣芽孢杆菌漆酶进行研究,发现紧挨轴向配体氨基酸的邻近氨基酸的种类也会明显影响漆酶酶活和表达量。Bu 等[55]通过易错PCR 和定点突变对地衣芽孢杆菌的漆酶基因研究结果和Koschorreck等[54]的结论基本一致,相同位点的氨基酸由天冬氨酸突变为甘氨酸后,酶活力、稳定性和脱色能力均优于野生型漆酶。
2.2.2 三核中心 铜离子三核三角区为氧气还原成水的反应部位。主要组成是三个铜离子呈现一个不等边三角的平面结构,三条边的长度分别为4.7 Å、4.0 Å和3.7 Å。氧气通过氧气通道进入催化中心,分布在最长边的中点附近的位置,在两个铜离子之间起到一个桥接作用。两个铜离子和氧气的桥接配体结构赋予反铁磁耦合,因此在电子顺磁共振(EPR)光谱中没有信号,但是在330 nm 处存在一个显著的特征吸收带。氧分子中的一个氧原子靠近第三个铜离子。而第三个铜离子在光谱中无任何吸收带,但是在电子顺磁共振(EPR)光谱中表现出较一个较大的平行超正弦分裂[A_=(150−201)×10−4cm−1][49]。
在漆酶中存在的四个铜离子,根据他们的光谱特性将其分成三类。其中具有600 nm 吸收峰特征,并且赋予漆酶蓝色的单核中心的铜离子为type1;而在三核三角区的铜离子,无任何吸收峰的铜离子为type2;而与氧分子进行桥接,且在330 nm 处有一个肩峰特性的两个铜离子,为type3。三核三角区的三个铜离子和四个HXH 的序列基序中的8 个组氨酸相结合。在CotA 一级结构的四个特征蛋白基序,都是漆酶中的铜离子结合特征。105~108 位置的HLHG基序中,H105 与type2 铜离子结合,而H107 与type3(1)铜离子结合;153~155 位置的HDH 基序,H153 与type3(1)铜离子结合,而H155 与type3(2)铜离子结合;419~424 位置的HPIHLH 基序,H419与type1 铜离子结合,H422 与type2 铜离子结合,H424 与type3(2)铜离子结合;491~502 位置的HCHILEHEDYDM,其中H491 与type3(2)铜离子结合,C492 与type1 铜离子结合,H493 与type3(1)铜离子结合,H497 与type1 铜离子结合,M502 与type1 铜离子结合。491~493 位置上的HCH 基序是连接type1 铜离子与三核三角区之间的一个电子连接桥。HCH 也是这类酶中最保守的序列,任何氨基酸的改变都将引起三核三角区的变形或者type1 铜离子的还原,进而导致酶活的丧失[56]。
2.3 通道
在CotA 酶中,存在两个直接到达三核三角区的分子通道(如图1 所示)。这两个通道都充满了溶剂分子。其中一个通道靠近type3 铜离子,被看作是氧气通道(图1d),通道内被用氢键连接的3 个水分子占据,其中Asp501 位于蛋白表面,随后是D499 和E498。最靠近蛋白表面的水分子同时与D501 和E498 形成氢键,中间的水分子与D499、A158 之间形成氢键,而在通道最内部的水分子则可以和E498、S160 和H155 之间形成氢键,其中H155 同时与三核三角区连接。氧气通过这个通道到三核三角区并在此处发生催化反应而将氧气还原成水分子。氧气分子推测是采用扩散的方式通过通道到达铜离子的三核三角区[33]。水通道表面501 位氨基酸残基种类可能会通过影响氢键的形成及蛋白质折叠的方式,进而影响漆酶的催化活性及漆酶在大肠杆菌中的表达[57]。在氧气通道底部的Glu498 可能参与了氢质子的传递,此位置氨基酸的改变将直接导致漆酶活性丧失[36]。
另外一个通道靠近type2 铜离子,一般被认为是产物水分子排出蛋白质内部的通道(图1e)。最靠近蛋白表面的水分子同时与L423 和V426 形成氢键,中间的水分子同时与H422、G108 和一个type3 铜离子之间形成氢键,而在通道最内部的水分子则可以和 L425、D116 和 G109 之间形成氢键,其中 D116对漆酶酶活具有重要影响,虽然D116 是靠近三核三角区的第二个存在质子化可能的氨基酸残基,但是在反应体系中并未被质子化,没有参与氢质子的传递,而是通过改变三核三角区的微环境进而调节Glu498的质子化和TypeII 铜离子和羟基结合的方式而影响漆酶酶活性[58]。
3 原核漆酶的催化过程
漆酶催化反应可以分为两种方式,第一种是与其它酶类一样的直接催化方式,底物和酶的催化中心结合,然后被酶直接氧化成为底物的氧化态,这样的催化方式针对的是小分子底物,如各种酚类等。第二种是漆酶所特有的一种氧化方式,主要是漆酶通过化学介导物将一些因为体积太大无法接触到酶活性中心的大分子物质,或氧化还原电位高于漆酶本身的一些高氧化态底物进行氧化的方式。
3.1 对底物直接催化反应过程
CotA 酶作为原核漆酶中研究最为透彻的一种漆酶,其催化反应过程也较为清晰(见图2)。一般可以认为底物ABTS 处于CotA 酶中的结合口袋中,其中的氨基酸残基Gly323 通过氢键将底物ABTS 固定到催化位点(图2);然后电子将从底物出发,借助His497 传递给单核中心的铜离子;单核中心的铜离子又通过一个His-Cys-His 的电子桥将电子传递给固定在三核三角区内的氧分子。氧气还原过程中需要的氢质子,可能来源于位于氧气通道底部的被质子化的氨基酸残基Glu498[36]。在三核三角区附近,只有两个氨基酸残基存在提供氢质子的可能性,一个是位于氧气通道底部的Glu498,一个是位于水通道底部的Asp116。而这两个氨基酸在反应的体系中,只有Glu498 可以被质子化,所以Glu498 可能是氢质子的唯一提供者[36]。氧分子则是通过充满溶剂的一个水溶性通道,从蛋白表面扩散到了三核三角区内部的两个type3 铜离子中间位置[59],在那里氧气经过一系列的复杂反应被还原为水分子[60−62]。生成水分子,将会被type2 铜离子带入水分子通道,进而排出蛋白质内部[63]。
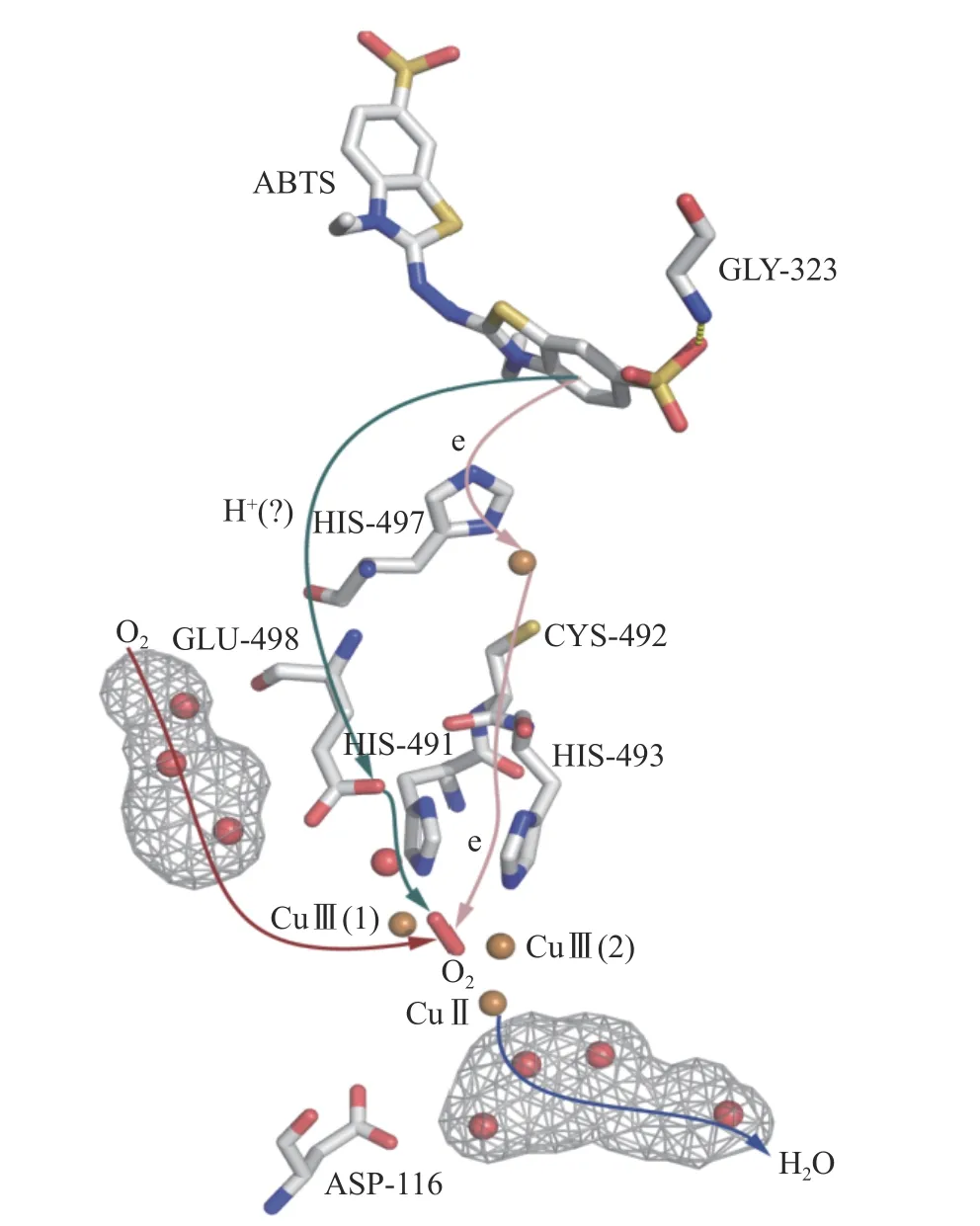
图2 CotA 漆酶的反应机制Fig.2 Reaction mechanism of CotA laccase
氧气在三核三角区还原成水的反应是一个复杂的反应体系。现在推测其过程大概为,氧气进入还原态的三核三角区两个type3 铜离子之间,和两个type3 的铜离子形成桥联配体;两个电子的传入使得氧气形成过氧化物中间物(Peroxide intermediate,PI);再传入两个电子和两个氢质子后,该中间物将分裂为两个羟基;其中一个羟基分子向水分子出口通道迁移,被质子化后生成水进入水通道排出蛋白体外;另外一个羟基和两个type3 铜离子连接形成所谓的本地中间物(Native intermediate,NI),本地中间物随后迁移到type2 的铜离子上,被质子化后生成水分子,最后作为第二个水分子被释放,同时酶恢复到原始状态[36,58−59,64−65]。
3.2 化学介导体系的催化机理
1990 年Bourbonnais 等[66]首先报道了在添加ABTS的情况下,可以利用漆酶氧化非酚类木质素的实验结果。在此基础上发展建立了漆酶的化学介导反应体系(Laccase mediator system,LMS)。LMS 体系极大地扩大了漆酶的作用范围,也是漆酶最引人注意的特性之一。LMS 体系的催化机理迄今为止还不是十分清楚。但其催化反应过程一般认为漆酶是单电子氧化还原酶,它催化底物机理表现在底物自由基的形成和漆酶分子中4 个铜离子的互相协同作用[67]。漆酶催化氧化多种酚类或者非酚类底物时,可以将其氧化成相应的自由基[68]。这些形成自由基的化学物质,成为重要的中间体,能够从漆酶上面游离到反应溶剂中,再与体积庞大或高氧化还原电位的底物相互作用[7]。天然及合成的介体物质有100 多种,其中研究最多的介体是ABTS 和1-羟基苯并三唑(HBT)。在氧化过程中,ABTS 被氧化为ABTS+中间体;而HBT氧化为 HBT+,然后立即去质子化形成 N-氧自由基[69],ABTS+中间体和N-氧自由基进一步将底物氧化,中间体再次转化为漆酶氧化底物。
4 原核漆酶的理化性质
4.1 温度
原核漆酶是一种可以在较为广泛的温度范围下发挥作用的氧化酶。原核漆酶最适反应温度在40~92 ℃之间。部分原核漆酶可以在高温条件下保留较高的酶活性。但不同种类原核漆酶的反应最适温度存在显著差异,这与漆酶的不同来源有关。Lu等[70]从土壤中的地衣芽孢杆菌中分离纯化出LS04漆酶。该漆酶的反应最适温度为60 ℃,在40~70 ℃维持较高活性,在60 ℃下放置10 h 仍有44.56%的酶活力,在70 ℃半衰期超过4 h,在80 ℃放置10 h仍保持约16%的活性。Xiao 等[71]首次从白蚁肠道分离出一株具有木质纤维素分解活性的平流层芽孢杆菌BCMC2,从菌株中克隆了一个漆酶基因BaCotA,该漆酶基因在大肠杆菌中得到功能性高效表达,并对其进行酶学性质的研究。实验结果表明:其BaCotA漆酶最适反应温度为70 ℃,在50 ℃下的半衰期大约3 h。Sherif 等[72]对天蓝色链霉菌的一种漆酶SLAC进行研究。SLAC 漆酶最适反应温度为60~70 ℃,在80 ℃半衰期超过10 h,90 ℃半衰期超过7 h,具有良好的热稳定性。Sonica 等[73]发现在龙舌兰芽孢杆菌(Bacillus tequilensisSN4)中有一种新的胞外漆酶SN4LAC 具有较高的热稳定性,该酶的最适反应温度为85 ℃,在70 ℃下放置24 h 可以保持80%以上的活性,100 ℃的半衰期为24 h。来自极端嗜热菌的Thermus thermophilus[27]的漆酶其最适反应温度为92 ℃,在80 ℃下的半衰期超过了14 h。从极端嗜热菌Aquifex aeolicus[28]中鉴别出McoA 漆酶最适反应温度为75 ℃,在80 ℃下的半衰期将近15 h。大多数真菌漆酶的最适温度在30~50 ℃之间,热稳定性较差,适宜在温和的环境条件使用。然而,大多数工业操作是在极端条件下进行的,真菌漆酶通常无法在这些极端环境中工作,因此原核漆酶在工业应用上有巨大的研究潜力。
4.2 pH
在实际工业应用中,环境pH 的范围具有不确定性。为了在实际应用中保证漆酶的有效性,确定漆酶的最适pH 和不同pH 条件下的稳定性非常重要。Guan 等[74]从茴香蜂蜜样品中分离出一株具有漆酶活性的枯草芽孢杆菌X1,并从中克隆出来漆酶基因,该基因可以在大肠杆菌中有效表达。结果表明:该漆酶显示出在广泛pH 范围均具有较高的酶活,和在碱性pH 环境下的高稳定性。该漆酶对不同底物反应的pH 范围不同,最适pH 也有所不同。该漆酶以ABTS、SGZ、2,6-DMP(2,6-二甲氧基苯酚)为底物反应最适pH 分别为4.4、6.9、7.3。其稳定性研究表明该酶在pH7.0 和pH9.0 下高度稳定,37 ℃ 下放置10 d 后分别保留约 126% 和 163% 的初始活性。Lu等[70]研究来自地衣芽孢杆菌的LS04 漆酶,该酶以ABTS、SGZ、2,6-DMP 为底物最适pH 分别为4.2、6.6、7.4。在 30 ℃下放置10 d,该酶在 pH7.0 和 pH9.0条件下分别保有初始活力的123%和102%。说明该酶在中性和碱性条件下都具有较高的稳定性。Singh 等[75]研究的耐碱性c-蛋白杆菌JB 漆酶在pH9.0(Tris-HCl,0.1 mol/L)、10.6(甘氨酸-氢氧化钠,0.1 mol/L)和4.0(柠檬酸,0.1 mol/L)条件下,4 ℃放置60 d,分别可以保留初始酶活100%、60%和49%。原核漆酶的最适pH 通常是中性和碱性,而大多数真菌漆酶的最适pH 为2~5。在中性和碱性的环境下,相比于真菌漆酶,原核漆酶更加适用。
4.3 金属离子
金属离子是常见的环境污染物,很多金属离子对酶的活性及其稳定性有一定的影响。Xiao 等[71]研究了三种浓度(1、5、10 mmol/L)的金属离子对BaCotA 漆酶活性的影响。BaCotA 漆酶在1 mmol/L浓度金属离子下相对稳定,在Ba2+、Ca2+、K+、Li2+、Mg2+、Mn2+、Na+和Zn2+存在时,25 ℃放置30 min能保持初始酶活的80%以上,5 mmol/L 和10 mmol/L浓度金属离子则对漆酶活性具有明显的抑制作用。Fe2+在任何浓度下对BaCotA 的都具有较强的抑制作用。据报道,Cu2+能够提高漆酶活性[76],然而该研究中Cu2+在所有受试浓度下都对漆酶活性有抑制作用。Javadzadeh 等[77]从白蚁肠道中分离的共生芽孢杆菌中分离纯化了一种漆酶,命名为CF96。在60℃下将漆酶CF96 放置在1、5、10 mmol/L 浓度的Cu2+、Mn2+、Zn2+、Fe2+、Ba2+、Na+、Mg2+和Ni2+下1 h 后,发现氧化离子Cu2+、Mn2+、Zn2+和Fe2+提高了漆酶活性,Ba2+、Na+、Mg2+和Ni2+降低了漆酶活性。Sonica 等[73]研究发现SN4LAC 漆酶在37 ℃、含有5 mmol/L Cu2+和Co2+的环境下酶活分别提高了126%和150%,在其他金属离子Ca2+、Ni+、Li2+、Mg2+、Mn2+、Na+和Zn2+存在的情况下,SN4LAC 漆酶能保持初始酶活的70~80%活性。Hg2+和Fe2+对SN4LAC 漆酶活性有抑制作用,抑制率分别达到27%和40%。Zhang 等[78]从枯草芽孢杆菌 fmb-103 中纯化了一种FMB-L103 漆酶。在37 ℃、Cu2+浓度在5 mmol/L 浓度下放置10 min,可以将FMBL103 漆酶酶活提高约60%;而金属离子由Cu2+替换成了Ca2+、Mg2+和Mn2+时,漆酶活性只有少量提高,而换成Zn2+、Fe2+和K+时,酶活受到了抑制,其中Zn2+抑制作用最强。真菌漆酶会受到铜离子、铁离子、锰离子等金属离子的抑制从而降低活性[79],而原核漆酶在这一方面有较好的表现。
4.4 有机溶剂及抑制剂
研究发现部分有机溶剂和抑制剂对漆酶活力有一定影响。原核漆酶在有机溶剂和抑制剂中有极大的稳定性,在含有有机溶剂和抑制剂的恶劣环境下可以起到很大作用。Siroosi 等[80]从伊朗西北部的高盐湖乌尔米亚湖中分离得到一株产漆酶的耐盐芽孢杆菌WT,研究显示:该漆酶在1 mmol/L 的NaN3中仍保持97.5%的酶活力,NaN3是有效的漆酶抑制剂。但漆酶在1 mmol/L 的L-半胱氨酸中受到抑制,丧失了87%的活力。Uthandi 等[29]从嗜盐古细菌中分离得到一种耐热、耐盐、耐溶剂的LCCA 漆酶,对LCCA 漆酶进行重组并在其原生物体嗜盐古细菌中高效表达,纯化后的LCCA 漆酶在常用的水溶性有机溶剂甲醇和乙醇中反应24 h 保持约75%的活性、在DMSO(二甲基亚砜)和DMF(二甲基甲酰胺)中反应24 h 后仍保持50%以上的活性。1 mmol/L NaN3可以抑制50%的漆酶活性,0.1~1 mmol/L 的L-半胱氨酸和DTT(二硫苏糖醇)都对LCCA 有强抑制作用。一般的螯合剂EDTA(乙二胺四乙酸)在50 mmol/L 对LCCA 活性无抑制作用,但过渡金属螯合剂2,2-联吡啶和1,10-菲洛啉在10 mmol/L 浓度下可抑制LCCA 活性,分别降低了25%和90%。马小建[81]对大肠杆菌中的CueO-p 漆酶进行突变,突变体的酶活力都有所提高。对突变体进行有机溶剂和抑制剂的测定,在4 ℃放置30 min 测其酶活。CueO-p 漆酶在2.5 mmol/L 浓度的DTT 下仍保持68%的初始活性,NaN3和EDTA 都对其有强抑制作用,10 mmol/L 的NaN3抑制了漆酶97%左右的活性,2.5 mmol/L EDTA 降低了93%的酶活。CueO-p漆酶在常用有机溶剂甲醇和乙醇中保持了约90%的活性。在10%的丙酮和异丙酮中有较好的稳定性。在30%的乙腈中受到抑制,损失了58%的初始活性。
5 原核漆酶的应用
5.1 食品行业
5.1.1 葡萄酒稳定 葡萄酒中含有高浓度的酚类化合物,如苯乙烯酸、肉桂酸衍生物、儿茶酚、花色素黄烷、香豆酸衍生物和花色素等。酚类物质的存在对葡萄酒的质量具有重要影响。Czyzowska 等[82]发现多酚物质的含量随着葡萄酒酿造或储存时间的延长而减少,从而改变葡萄酒的色泽。酚类物质的氧化,也是导致葡萄酒质量下降主要因素。传统上采用交联聚乙烯吡咯烷酮去除酚类物质,但是这种方法缺少选择性,不能较好地保留葡萄酒的风味、色泽,还会增加工业废水排放污染环境。采用漆酶进行多酚去除,可以达到选择性的去除的效果,在提高产品质量的同时,避免葡萄酒的感官特性发生不必要的改变,成为传统工艺中有效的一种替代方案。在葡萄酒生产过程中添加适量的漆酶,其氧化酚类物质后其产物会聚合并通过澄清工艺去除,进而起到稳定葡萄酒的作用。在葡萄酒保存期间,可以添加漆酶选择性地氧化分解酚类物质,进而延长葡萄酒货架期[83]。Conrad 等[84]还将嗜热支原体的漆酶用于制备酒瓶的软木塞。在这个过程中,漆酶氧化酚类物质,释放的苯氧基自由基进行非酶促均聚,避免了导致软木味道的2,4,6-三氯苯甲醚的产生。这种氧化聚合还修饰了软木塞的表面,增加了软木塞的疏水性,降低了陈年瓶装葡萄酒中经常出现的软木塞污染。而这种工艺已经成功的商业化。
5.1.2 啤酒稳定化 啤酒经长期储存后,里面的多酚物质会发生聚合形成大颗粒,从而产生沉淀变得浑浊,影响啤酒品质。啤酒的储存期雾气形成取决于多酚与蛋白质含量、温度和氧气含量等因素,雾气是由于自然产生的原花青素和多酚物质和蛋白结合而生成的沉淀,这种雾气通常是在冷却过程中出现,在常温或更高温度下就会自动溶解[85],Pezzella 等[86]在成品啤酒中通过加入微生物漆酶,去除酚类物质的同时也可以达到去除多余的氧气效果,防止生产异味产物反应的发生,减少异味化合物如反式-2-壬烯醛的生产量,使啤酒达到长期储存的效果。
5.1.3 果汁加工 从20 世纪30 年代开始,人们就研究通过酶制剂来澄清果汁。在研究中使用漆酶来去除由蛋白质和多酚之间相互作用形成的浑浊和沉淀,从而达到澄清果汁的效果。除此之外,在储藏过程中果汁会二次沉淀从而影响果汁的澄清度[87]。乔晓兰等[88]在浓缩苹果汁的酶解过程中加入漆酶利用其专一性除去酚类,并研究了漆酶的酶解温度和时间以及漆酶的添加量对去除酚类物质的影响。最近Huang 等[89]制备了一种基于铜离子和一磷酸腺苷的漆酶模拟酶(AMP-Cu 纳米酶),采用这种漆酶模拟酶反应5 h 时,对果汁中苯酚的去除率可以达到65%。结果表明:AMP-Cu 纳米漆酶模拟酶可以有效去除果汁中的酚类物质,有良好的应用前景。
另外,漆酶还被研究用于烘焙行业,可以改善面团的稠度和可加工性[90];合成止痛药、镇静剂、消炎药和抗生素[91];通过模拟工业化生产的过程评估了漆酶对搅拌牛奶酸奶的影响[92]等。与真菌漆酶相比,原核漆酶更加稳定,应加大原核漆酶在食品应用的研究,发挥原核漆酶的优势。
5.2 造纸行业
在纸的工业制备中,木浆中木质素的分离和降解通常使用氯和氧基化学氧化剂,但是具有很高的危险性,并且会污染环境。Sondhi 等[93]探索了来自龙舌兰芽孢杆菌(Tequilensis)SN4 的胞外热碱稳定漆酶用于纸浆生物漂白。在无N-羟基苯并三唑介体的情况下,纸张白度提高了7.6%,木质素含量降低了28%;在介体的存在下,纸张白度提高了12%,木质素含量降低了47%。Virk 等[94]研究表明,旧新闻纸可以通过物理方法和酶法(漆酶和木聚糖酶)相结合的方法进行回收,使纸张白度提高28.8%,ERIC 含量降低73.9%。郑志强[95]从极端嗜热细菌(Thermus thermophilus)HB27 菌株中分离出一株耐热性胞内Tth-laccase 漆酶,通过定点突变技术使漆酶活力提高了86 倍,并且首次在麦草浆生物漂白中应用Tthlaccase 重组漆酶。结果表明:在最佳酶漂白条件下将纸浆处理1.5 h,纸浆白度增加3.3%,ISO 卡伯值降低了5.6,在不损伤纸浆纤维的情况下提高了麦草浆的漂白度。原核漆酶在造纸工业中的漂白应用虽然得到关注和研究,但想再造纸工业中大规模实际应用仍需努力。需要对原核漆酶的机理和对纸浆纤维的作用有更多更好的了解,改进工艺,使其在现有的操作条件下重复使用。也可以研究原核漆酶在造纸工业中更多的应用,在生物制浆和生物漂白以及处理造纸厂废水中有更多的创新解决方案。
5.3 纺织行业
纺织工业废水造成了很严重的污染问题,并且需要用大量的水和化学品去除,而合成的染料很难脱色,漆酶能够降解酚类、芳香胺、各种官能团的取代化合物以及非酚类化合物。因此,漆酶可以在纺织工业中用于去除纺织品中的染料和酚类物质。因真菌漆酶有更大的氧化还原潜力而被广泛用于降解纺织废水中存在的染料。但由于原核漆酶具有产酶时间短、性质稳定等优点,原核漆酶也被应用于降解纺织染料。张应玖等[96]发现枯草芽孢杆菌ZXN4 中细菌漆酶CAH4 在工业染料脱色上有较高的实用价值,对偶氮类染料、靛蓝类染料和三苯甲烷类染料有很强的脱色能力,容易实现工程化制备,有广阔的应用前景。Verma 等[10]使用热链地杆菌MS5 的漆酶成功地脱色了纺织品染料,特别是溴酚蓝和刚果红,在不同的碳源中对商用的纺织品染料进行脱色,也有良好的脱色效果。Wang 等[97]研究表明:CotA 重组漆酶对模拟纺织废水(STE)48 h 的脱色率为77.0%,在中性pH 缓冲条件下,纯化后的CotA 漆酶比粗制CotA 漆酶的脱色率要高得多。Panwar 等[98]分离出一株耐热、耐盐、嗜酸的漆酶LACT,将其应用于牛仔的漂白中。LACT 的牛仔漂白效果很好,其漂白效果明显优于已报道的其他漆酶[78,99]。LACT 对水溶性对健康有害的偶氮染料也有显著的脱色效果,是一种很有前途的生物漂白和染料脱色剂。Liu 等[100]为了改善纺织染料的去除,通过氧化应激增强短小芽孢杆菌ZB1 的生物活性,添加甲磺酸甲酯(MMS)进行诱导,促进了短小芽孢杆菌ZB1 的漆酶表达,并改善了漆酶对合成染料的脱色,可以实现对偶氮染料的有效降解。原核漆酶可以在高温、高碱、含有机溶剂等极端环境的纺织厂废水中进行生物修复,可以对原核漆酶在这一领域进行进一步的研究和创新,以开发快速生物降解技术。
5.4 降解污染物和生物传感器
空气、土壤和水等自然环境中都分布着污染物,漆酶参与生物降解主要是由于它的催化性能,细菌漆酶可以降解土壤中的外源化合物。刘锐等[101]发明公开了一种利用细菌漆酶降解有机磷农药的方法,主要是在25~35 ℃,pH8~10 条件下,在产漆酶的培养基中加入Cu2+和介体,分别加入浓度为0.2%左右的有机磷农药,包括乐果、敌敌畏、敌百虫、毒死蜱、氧化乐果,在几个小时内有机磷农药降解率可高达15%以上。Cheng 等[102]克隆了枯草芽孢杆菌CotA漆酶基因,并在大肠杆菌中高效表达,以提高其在水产养殖中修复孔雀石绿(MG)的浓度。CotA 漆酶能有效,安全地降解文蛤和罗非鱼养殖废水中的MG,并在淡水和盐水条件脱色率高达90~94%。同时CotA 漆酶处理的MG 溶液在石斑鱼鳍细胞上的脱色率达90%以上,且无细胞毒性,证实了其安全性。Murugesan 等[103]从造纸厂废水中筛选出了一株芽孢杆菌属的细菌漆酶PK4,它具有良好热稳定性,对其产量进行优化。通过对培养基的优化,漆酶产量提高了11.8 倍,可以更有效地应用于工业废水的生物修复和废水处理。氯酚是生产染料、防腐剂、农药和化学品的重要工业原料。然而,工业废水中含有氯酚等难降解有机物,对环境和人体健康危害严重。漆酶介导的氯酚去除是一种低成本、环保、高效的生化法。Menaka 等[104]筛选出一株可以降解2,4-二氯苯酚的细菌漆酶并鉴定出其为枯草芽孢杆菌。该酶对外源化合物2,4-二氯苯酚有良好的降解能力,并且有酶处理周期短的优点,在废水降解方面有潜在用途。由于漆酶能够催化直接电子转移,多年来人们一直在研究漆酶在生物燃料电池和生物传感器中的应用[105]。在生物传感器方面,漆酶将O2还原为H2O,然后生物传感器记录分析氧化过程中的耗氧量。漆酶基于传感器已广泛应用于食品行业尝试检测果汁、葡萄酒和茶中的多酚,并量化葡萄汁中的真菌污染[106]。Chawla 等[107]将漆酶共价键固定在银纳米颗粒和氧化锌纳米颗粒的纳米复合材料上,去除多酚物质,并构建了一种高敏感电流型生物传感器,用于葡萄酒中总酚类化合物的测定。酶的生产成本是基于酶的生物质降解过程中经济性的主要因素,取决于宿主细胞和纯化方法。如果酶通过固定化在多个工艺循环中重复使用,这种成本可以降到最低。因此,可以将原核漆酶与固定化相结合,使原核漆酶可以应用于开发具有成本效益的生物技术工艺。
6 展望
虽然现在已经发现了非常多的原核漆酶,但是关于原核漆酶的生理功能仍然不清楚。具体的生理功能有待于进一步研究。原核漆酶具有良好的性质在工业上更有发展潜力,但在其应用方面的研究还有待加强。与真菌漆酶相比,原核漆酶大规模应用的缺点是表达水平和催化活性较低,介体价格高、低成本生产大量高活性酶的能力不足。为了满足工业化对高表达水平、高催化活性、高稳定性和降低生产成本的需求,原核漆酶工程受到了众多研究人员的关注。原核漆酶的未来研究方向可以考虑以下方面:一、挖掘新的原核漆酶基因或将现有的漆酶转化为新的酶;二、通过定点突变提高原核漆酶的功能表达和催化效率,降低成本;三、使用易于重复使用和回收的新型环保纳米材料开发固定化漆酶,提高原核漆酶稳定性和活力。
