基于毛细管凝胶电泳与DNA 条形码技术鉴别可食用动物内脏掺假方法的研究
2023-08-15励炯扈明洁金朦娜闫金花
励炯,吴 琼,江 海,扈明洁,金朦娜,闫金花
(杭州市食品药品检验研究院,浙江杭州 310017)
食用动物内脏一直是我国几千年饮食文化中重要的一部分,爆炒鸡心、熘肝尖、红烧鸭肠等等,很多可食用内脏是我国各种菜系中的经典之作,同时,近年来特别流行的火锅、烧烤及卤味文化,更是把各种动物内脏的吃法发挥到极致[1]。动物内脏不仅美味,而且营养丰富[2],能有效补充人体各种微量元素和维生素等营养元素的需求,防止由于这些营养元素的缺失而导致的各种疾病[3]。市面上常见的畜禽类内脏食材通常以整个部位进行销售,而猪牛羊畜类动物以及鸡鸭鹅等禽类动物内脏,由于其体型和种属相近的缘由,再加上不法商家会采用香精等对其原有的气味进行掩盖,经过粉碎、烟熏、腌制等深加工处理的可食用内脏,使其原有的感官性状发生改变,普通消费者很难用感官进行判断鉴别[4−6]。其次,不同来源内脏的价格差异,增加了用低价内脏来替代高价内脏的风险性。
近年来,越来越多基于分子水平的技术研究应用于食品掺假鉴别中,一般包括蛋白分析技术或者基于DNA 分析[7−12]。由于基于蛋白的掺假技术存在无法区分相近物种或者深加工食品掺假等问题,基于DNA 的技术具有较强的特异性和灵敏度,也可以对深加工食品进行鉴别,越来越多的掺假研究集中在基于DNA 分析的技术方面[13−15]。
由于缺乏标准化和通用性等问题,大多数基于DNA 分析的鉴别技术没有得到广泛的应用,局限性较明显,可靠性和专属性不强[16−17]。DNA 条形码技术(DNA Barcoding)作为一种可靠快速的鉴定手段,越来越多的应用于各种领域的物种的鉴别,其是利用一段相对较短的DNA 片段,该片段容易扩增且有足够的变异性[18−20]。很多研究采用线粒体细胞色素C 氧化酶亚基Ι(Cytochrome Coxidase Subunit I,COI)基因的650 bp 左右大小的片段区域来研究可食用动物内脏的掺假,该片段符合DNA 条形码技术对目标基因需具有足够的特异性和种间足够的多样性的要求,被用于多种动物源食品的掺假鉴别与应用中,也称全片段DNA 条形码技术(Full-length DNA Barcoding)[21−22]。毛细管凝胶电泳分析系统是利用高压电场下,由于各DNA 片段的大小、带电荷数、等电点等性质不同,在凝胶电泳上的迁移速度不一致,各组分依次移动至毛细管输出端附近的光检测器,检测和记录其吸光度,并将各组分以吸收峰的形式动态直观地记录下来,自动分析出各目的片段的碱基数[23−24]。毛细管凝胶电泳分析技术极大的简化了PCR 产物的分析步骤,提高了检测效率,其检测分辨率低至3~5 bp,记录的吸光值使得PCR 产物的分析更加直观并可以进行量化分析[25−26]。
目前关于可食用动物内脏的掺假研究有限,未曾有对整个可食用动物内脏掺假风险进行系统性研究和评估,也没有一套完整的掺假鉴别技术来提供相关的技术支持,特别是可食用内脏复杂的基质以及掺假鉴别技术对样品前处理的特殊要求(比如防止漏检和误检),给可食用内脏鉴别带来一定的困难,再加上经济利益驱动,给一些不法商家提供了可乘之机,市售可食用内脏掺假行为层出不穷。本文以常见的7 种动物源的5 类可食用内脏为研究对象,首次将毛细管凝胶电泳分析系统与DNA 条形码技术结合,建立基于COI 序列的鉴别可食用动物内脏掺假的检测技术,以期能为市售可食用动物内脏的质量监督提供技术支持和保障。
1 材料与方法
1.1 材料与仪器
为了保证研究的动物内脏没有掺假,所用的5类可食用动物内脏(包括胃、肠、肝、肾、肺)于屠宰场屠宰整只猪、牛、羊、鸡、鸭、鹅、兔时取样,作为本研究方法学建立与优化的原料;共计25 批次新鲜动物内脏及其制品 研究所用的实际样品来自杭州市农贸市场及超市,置于−20 ℃保存。
血液与组织DNA 提取试剂盒、QIAxcel DNA High Resolution Kit(1200)、QX Alignment Marker 15/600 bp、QX DNA Size Marker 15~1500 bp 均购自德国Qiagen 公司;即用PCR 扩增试剂、扩增产物回收试剂盒 购自上海生工公司;T4连接试剂盒、DH5α感受态细胞 购自TaKaRa 公司。
QIAxcel 全自动毛细管凝胶电泳分析系统 购自德国Qiagen 公司;Veriti 96 孔梯度PCR 仪 购自美国ABI 公司;EYELA FDU-1100 真空冷冻干燥器购自日本东京理化公司;NanoDrop 1000 微量核酸蛋白测定仪、冷冻高速离心机 均购自美国Thermo公司。
1.2 实验方法
1.2.1 样品预处理 将7 种动物的5 类可食用内脏以及25 批次可食用动物制品分别用刀切成小块或小段后,取100 g 样品泡于250 mL 生理盐水中,超声处理30 min,过滤,去掉滤液,反复处理后直至除去血水,残渣用料理机进行粉碎处理,在−80 ℃下预冷4 h 后的样品置真空冷冻干燥箱(温度≤−50 ℃,真空度≤1×10−4Pa)处理24 h,冷冻干燥处理后的样品经粉碎过筛后,室温存放于干燥器中,备用。
1.2.2 DNA 提取与纯化 由于动物内脏基质较复杂,需要一定的DNA 纯化步骤才可以保证7 种动物的5 类内脏的DNA 的扩增效率,本文在DNeasy 血液与组织提取试剂盒的操作规程的基础上进行一定的改进,具体操作如下:0.5 g 样品中加入2 mL ATL缓冲溶液和0.2 mL 蛋白酶K,56 ℃裂解至溶液澄清。取裂解液0.25 mL,纯化过程按照试剂盒说明进行操作。最后将纯化的DNA 用37 ℃预热的AE 缓冲液洗脱DNA,−20 ℃储存备用。
1.2.3 COI 基因的扩增 本文最终选用了Ivanova等[27]公开发表的一对引物(COI-A,详细序列见表1),为了方便DNA 测序,在每对引物上连接M13,引物合成由杭州擎科生物技术有限公司提供支持。

表1 基因引物序列Table 1 Primer sequence of genes
本文采用了25 μL 的PCR 扩增体系,每个体系由以下试剂组成:12.5 μL 即用PCR 扩增试剂(上海生工公司),9.5 μL 重蒸水,0.5 μL 10 μmol/L 正向引物,0.5 μL 10 μmol/L 反向引物,2 μL DNA 模板。DNA 条形码片段扩增程序:95 ℃预变性2 min;95 ℃变性1 min,46 ℃退火1 min,72 ℃延伸30 s(5 个循环);95 ℃变性1 min,53 ℃退火1 min,72 ℃延伸30 s(35个循环);最后72 ℃延伸10 min。将扩增片段储存于−20 ℃,备用。
1.2.4 毛细管凝胶电泳确认 采用QIAxcel 毛细管凝胶电泳分析系统对PCR 扩增产物进行确认分析,对可食用动物内脏的COI 基因的扩增效率进行初步确认。将Alignment Marker 校准过并进行平衡的凝胶卡夹置于仪器内,样品分析盘内分别放入已加入10 μL DNA size marker 以及动物内脏的扩增产物的小管,由于本文采用的扩增条件的扩增效率很高,本文最终将扩增产物用缓冲液稀释至100 倍后再进行分析,毛细管凝胶电泳分析时间为5 min。PCR 扩增产物经DNA High Resolution Kit(1200)凝胶电泳分离后进行确认分析。确认后的PCR 产物送公司进行测序(杭州擎科生物技术有限公司),所得的测序结果经删除两端引物序列,获得最终的扩增序列。
1.2.5 PCR 产物克隆测序 切胶回收纯化后的PCR产物与pGEM-T 载体连接后,导入DH5α感受态细胞。36 ℃培养箱培养12 h,经过蓝-白筛选后,挑取10 个不同的白色菌落接种到LB 液体培养基培养过夜(36 ℃,150 r/min 摇床),取菌液1 mL 提取质粒DNA,送杭州擎科生物技术有限公司进行测序。
1.2.6 测序结果分析 将经删除两端引物和质粒序列后的测序结果提交本地数据库进行比对,进行DNA 序列比对,便可以得到掺假样品中混有其他不同动物来源的内脏的序列,从而准确的分析出掺假样品中含有的动物源种类。同时利用美国国家生物信息中心(National Center for Biotechnology Information,NCBI)数据库对样品的COI 序列进行鉴定和相似度分析。
2 结果与分析
2.1 掺假样品预处理方法的优化
相对其他生物样本,动物内脏的基质较为复杂,一般在DNA 提取纯化之前,需要采用一定的预清理方式,将含有的组织液和血液进行清除[28−30]。本文将切成小块的动物内脏用生理盐水浸泡并进行超声清洗处理。DNeasy 血液与组织提取试剂盒的说明书的取样方式是采用一次性镊子直接从样品上取一定量的样品,由于本文是针对掺假样品的研究,取样的均一性和代表性直接影响最终实验结果。掺混样品预处理方式的选择会直接决定取样之前样品的均一性,是影响被取样品的代表性的最重要的因素。一般动物组织的分子生物学实验的预处理方式有2 种,即料理机粉碎混匀和液氮研磨法。而现代高科技技术的不断进步,涌现出很多先进的样品前处理技术和设备,真空冷冻干燥技术也越来越多的应用于各个领域的前处理技术中。本文采用含10%鸡源性成分的鸭肠,来考察上述三种预处理方式的可靠性,具体操作如下:各取5 组含10%鸡源性成分的鸭肠(每组20 份样品),分别经三种预处理方式,前处理和分析参照1.2 节,结果用鸡肠检出率来对样品均一性进行分析,由图1 可知:采用真空冷冻干燥法进行预处理的样品检测结果,与其他两种预处理检测结果有显著性差异(P<0.001),鸡源性成分检出率达到100%,采用真空冷冻干燥处理后的掺假样品,由于将样品直接冷冻干燥,再用粉粹机处理成均一性较好的粉末混合样品,而其他两种方式处理的样品,有不同程度的漏检情况发生,所以本文最终选择真空冷冻干燥法对样品进行预处理。
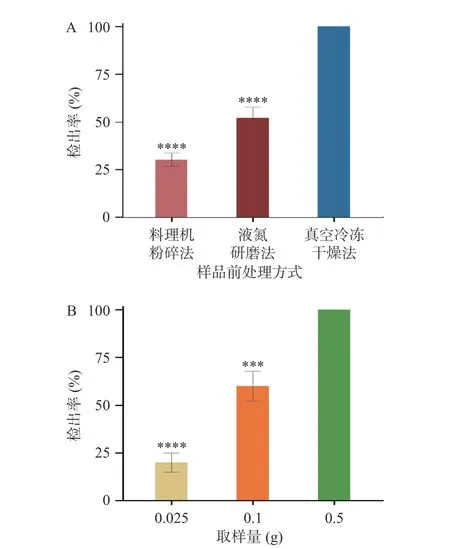
图1 不同前处理方式(A)和不同取样量(B)对鸭肠掺假模型(含10%鸡源性成分)中的掺假成分检出率的影响Fig.1 Effect of different pretreatment methods (A) and sampling volumes (B) on the detection rate of adulterated ingredients in the duck sausage adulteration model (containing 10% chicken-derived ingredients)
一般生物样品的DNA 提取与净化均可以完全按照DNA 提取试剂盒的说明进行操作,比如样品的取样,用一次性镊子取10~25 mg 即可。由于掺假样品对均一性的要求,取样量太少会影响样品的代表性,从而影响掺假检出情况,造成实验结果误判。本文采用含10%鸡源性成分的鸭肠考察动物内脏掺假样品中的最佳取样量,采用0.025、0.1、0.5 g 三个取样量进行研究,结果发现,当取样量为0.5 g 时,样品中检出鸡源性成分的比例为100%,而取样量为0.025 g和0.1 g 时,均有不同程度的漏检情况,所以本文最终采用0.5 g 的取样量对可食用内脏掺假样品进行DNA提取。
2.2 掺假样品DNA 提取方式的优化
近年来实验室常用的商业化DNA 提取试剂盒一般有两种类型,即快速提取法和柱模法提取试剂盒,快速提取试剂盒的优点是简单、快、效率高,缺点是没有去杂质步骤,可能会影响PCR 扩增效率,而柱模法增加了深度纯化DNA 的步骤,但是提取过程比较耗时[31−32]。本文采用两种提取试剂盒对7 种动物的5 类可食用内脏的DNA 提取纯化效率进行考察,纯化效率用A260和A280的比值进行判断判断,如果比值在1.8~2.0 之间,可以认为该DNA 比较纯,质量较好[33],具体数据见图2。
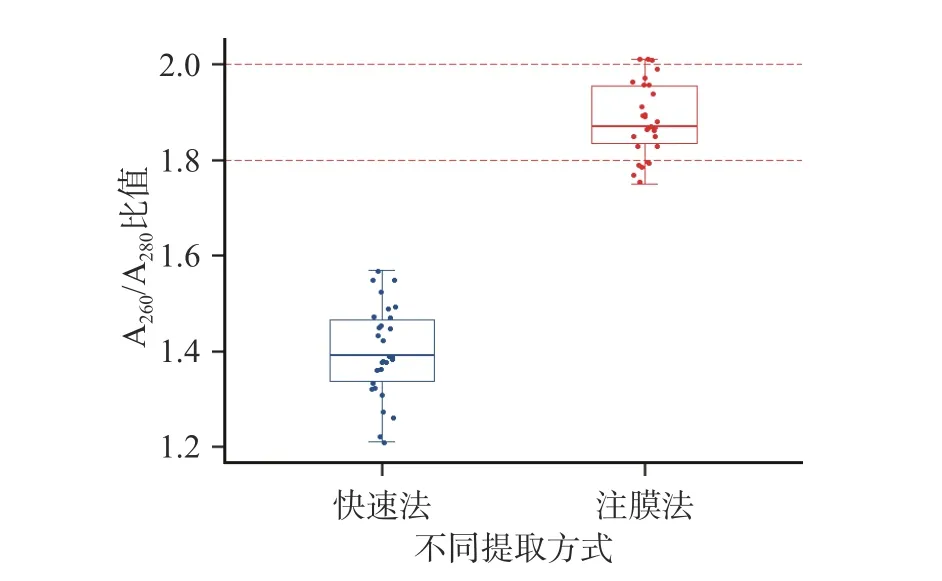
图2 不同DNA 提取方法对可食用动物内脏DNA纯度的总体影响统计Fig.2 Statistics on the overall effect of different DNA extraction methods on the purity of DNA from edible visceral
从图2 的统计图中可以看出,柱膜法提取的可食用内脏的DNA 的A260/A280比值要比快速提取法高,纯度较高,质量较好,A260与A280的比值主要集中在1.8~2.0 之间,而快速提取法提取DNA 的A260与A280的比值在1.2~1.6 之间,纯度较差,所以本文最终采用柱膜法对各种动物源的可食用内脏的DNA进行提取净化。
2.3 COI 基因片段的扩增条件优化
影响目标DNA 片段扩增效率关键因素主要包括引物的选择、扩增体系中DNA 模板浓度以及扩增程序中的退火温度[34−35]。DNA 条形码技术的关键也是选择合适的引物,作为通用引物,在同一个扩增体系和条件下,能有效的扩增出研究的几种物种的目标DNA 片段。本文选用了三对通用引物COI-A、COIB 和COI-C(具体引物序列详见表1),分别对7 种动物源内脏进行扩增效率进行考察,三对引物扩增的目标片段均是线粒体COI 基因上大小为658 bp 的片段。7 种动物的5 类可食用内脏DNA 经提取纯化并扩增后,扩增产物经QIAxcel 毛细管凝胶电泳分析系统进行确认分析,结果发现,引物COI-B 虽然能非常有效的扩增出7 种动物的5 类可食用内脏的基因片段,但是鹅的5 类内脏的扩增效率低,相对于的条带的荧光值较低;引物COI-C 几乎对所有7 种动物的5 类内脏的扩增效率都很低,从条带的荧光值可以判断扩增失败;而引物COI-A 能全部高效的扩增出658 bp 的目标片段,所以本文最终采用COIA 作为可食用内脏掺混研究的引物(具体见图3)。

图3 7 种动物源的可食用内脏(肝)DNA 条形码的PCR 扩增电泳图Fig.3 Electrophoresis images of DNA barcoding fragments amplified by PCR from liver of 7 anmials
选择了合适的通用引物后,本文继续对扩增体系中的DNA 模板量及PCR 扩增程序中的退火温度进行优化。由于毛细管凝胶电泳上的毛细管输出端配置了光检测器,扩增产物条带在每个泳道上吸光度(荧光值)会被检测器记录,并转化为相应的条带信号,所以可以利用毛细管凝胶电泳分析系统记录的各个产物条带的荧光值,对扩增效率进行量化考察。在一定的扩增体系中,DNA 模板的浓度过高或者过低,都会影响扩增效率,从而降低PCR 扩增产物浓度,影响检测结果的灵敏度和有效性。本文考察了三个体积的DNA 模板量,分别为1、2、3 μL,在同样的扩增条件下进行扩增后,扩增产物经毛细管凝胶电泳分析系统后读取相应的目标条带的荧光值(RFU),结果见图4。同时,在PCR 扩增程序中,合适的退火温度是保证扩增效率以及产物特异性的关键因素,退火温度太低,会影响扩增产物的特异性,反之则会大幅度降低扩增效率。本文采用50、53 以及57 ℃,3 个退火温度分别对7 种动物的5 类内脏进行扩增效率的考察,扩增产物经毛细管凝胶电泳分析系统后读取相应的目标条带的荧光值(RFU),结果见图4。
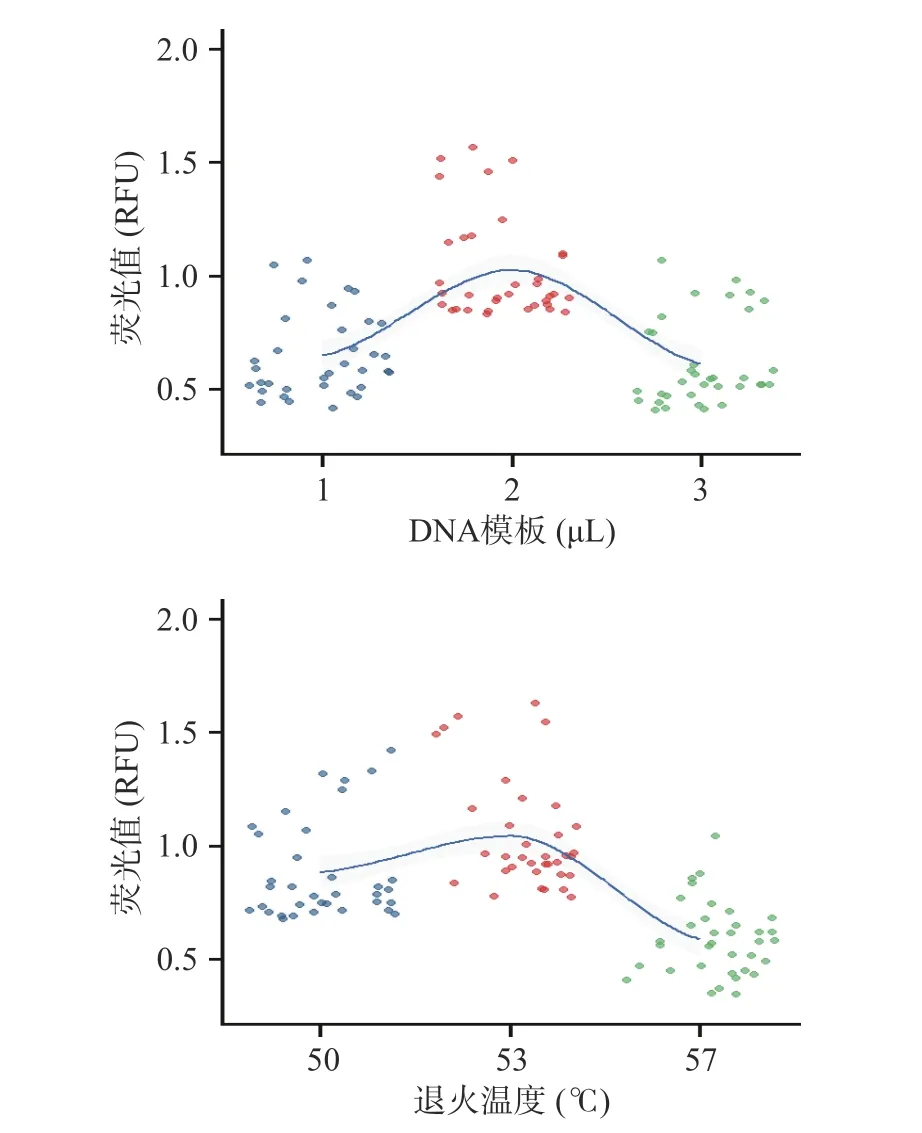
图4 DNA 模板量与不同退火温度对7 种动物源的可食用内脏DNA 条形码的PCR 扩增效率的影响Fig.4 Effect of DNA template amount and different annealing temperatures on the PCR amplification efficiency of edible visceral DNA barcodes from seven animal source
从图4 可以看出,当DNA 模板量为1 μL 和3 μL时,7 种动物源的5 类内脏的凝胶条带的荧光值较模板量2 μL 时小,而荧光值大小与扩增效率成正比;选择退火温度为53 ℃,7 种动物源的5 类内脏的凝胶条带的荧光值最高。所以本文最终选择DNA 模板量为2 μL、退火温度为53 ℃的扩增条件作为7 种动物源的5 类内脏DNA 条形码基因的最佳扩增条件。从毛细管凝胶电泳系统中可以看出,7 种动物源的5 类内脏在700 bp 左右均有一条较明显的扩增条带(见图3)。然后将7 种动物源的5 类内脏的PCR扩增产物送至生物公司进行克隆测序,测序结果见表2。
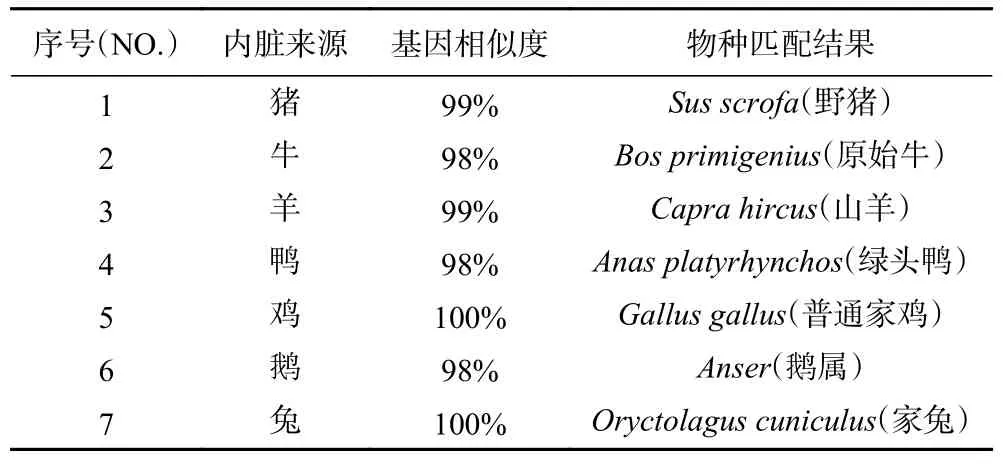
表2 7 种动物源内脏的DNA 条形码检测结果Table 2 DNA barcoding results for 7 samples found to contain one species
2.4 可食用动物内脏掺假模型灵敏度和稳定性检测
本文根据常见的可食用动物内脏的掺假类型,根据经济价值的高低,对可能存在的掺假模式进行模拟,具体见表3。
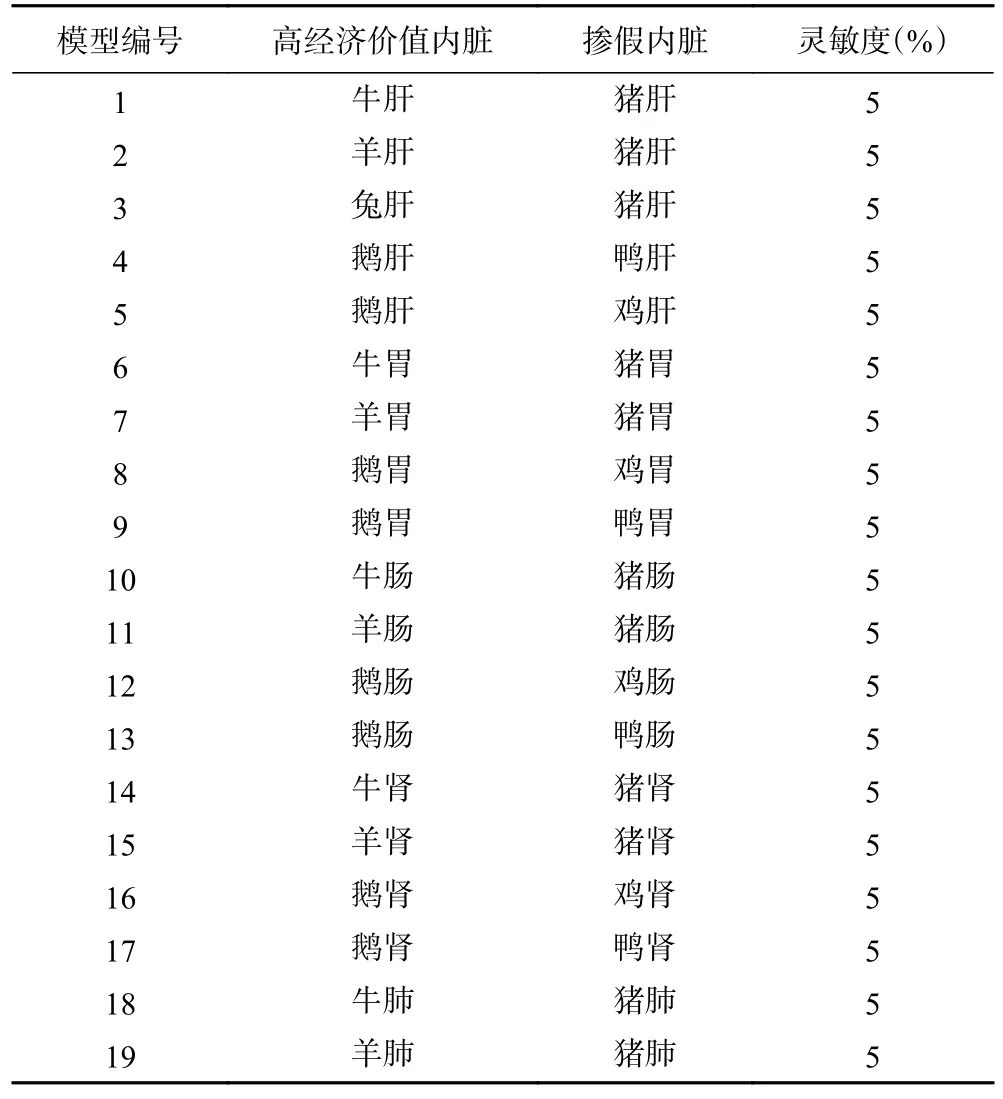
表3 可食用内脏掺假模型Table 3 Animal viscera adulteration model
本文根据现有的可食用内脏的市场价格,根据其价格与供给量进行评估可食用内脏的经济价值,分成高经济价值可食用内脏和低经济价值可食用内脏,根据类型和感官性状等,建立了19 个可食用内脏掺假模型,对可食用动物内脏中有可能掺假的其他动物源内脏进行掺假灵敏度的考察。结果发现,19 个可食用内脏的掺假模型中的掺假成分检出灵敏度较合理,最低检出比例均能达到5%,能满足日常的检测要求。同时本文对19 个掺假模型,分别采用5%、10%、15%三个掺假比例,进行稳定性考察。将上述扩增产物置−20 ℃进行保存,分别在第1、3、7 d 进行检测,结果保持一致。
2.5 建立基于BLAST+的7 种可食用动物内脏的DNA条形码本地数据库
基本局域连配检索工具(Basic local alignment search tool,BLAST)是由NCBI 开发的序列查找和比对工具,BLAST 及其相关数据库是快速进行数据查询匹配的有力工具[36]。目前BLAST 本地化工具(BLAST+)及其数据库可以通过自行构建的方法脱机运行,即通过本地数据库进行查找,而无需连接到美国NCBI 中央数据库[37]。本文根据测定的7 种动物源的可食用动物内脏的COI 基因序列,构建了常见的可食用内脏掺假的内脏DNA 条形码本地数据库。将11 种肉的微条形码片段核酸序列存为单一的FASTA 格式文件viscera07,然后使用BLAST+工具包的makeblastdb 命令(makeblastndb-in.viscera07.fasta-dbtype nucl-parse_seqids-out Viscera),对上述序列文件进行数据格式化和索引化,形成可供BLAST检索的本地数据库Viscera。
取本文研究的可食用内脏的掺假模型、实际样品的测序结果,使用本地数据库的blastn 命令将待检索序列结果对数据库进行检索,结果自动保存于result.txt 文件。在结果目录下打开result.txt 文件,根据比对得分(Score)情况进行结果分析。
2.6 可食用内脏制品检测
按照本文建立的方法,对25 批次可食用内脏制品进行掺假鉴别,将克隆测序结果经建立的可食用动物内脏的DNA 条形码本地数据库进行blast 比对分析,结果见表4。

表4 实际样品检测结果Table 4 Actual sample test results
本文利用建立的检测和分析方法对25 批次可食用内脏制品进行掺假鉴别研究,25 批次可食用内脏制品包括6 批次的牛百叶(牛胃)、5 批次的鹅肝、4 批次的鹅肠、3 批次的牛肝、2 批次的羊肝、2 批次的牛肠、2 批次的羊肺以及1 批次的牛肺。所有的样品经预处理、DNA 提取纯化扩增后,在毛细管凝胶色谱分析上700 bp 左右的位置均有一条较清晰的条带。将扩增产物进行切胶纯化后,进行克隆测序,测序结果经建立的可食用动物内脏的DNA 条形码本地数据库进行blast 比对分析。比对结果发现,25 批次的可食用内脏制品检出2 批次的猪源性成分和2 批次的鸭源性成分,掺假比例为16%:其中6 批次的牛百叶制品中检出2 批次的猪源性成分,不合格率为33%;4 批次的鹅肠制品中检出1 批次的鸭源性成分,不合格率为25%;5 批次的鹅肝制品中检出1 批次的鸭源性成分,不合格率为20%。为了验证本检测方法的可靠性,我们对上述4 批次的掺假样品参照农业部标准NY/T 3309-2018《肉类源性成分鉴定 实时荧光定性PCR 法》进行检测,结果与本方法一致(见表4)。从上述检测结果可以看出,市售可食用内脏制品中,牛百叶、鹅肠、鹅肝等三类内脏制品比较容易有掺假问题,需要重点关注。
3 结论
本文建立了基于QIAxcel 毛细管凝胶电泳分析系统结合DNA 条形码技术对7 种可食用内脏进行掺假鉴定,优化了样品前处理、DNA 提取和PCR 扩增条件。扩增产物进行克隆测序所得的COI 基于序列在建立的可食用动物内脏的DNA 条形码本地数据库Viscera 进行BLAST 比对,进行掺假鉴别。本方法检出灵敏度较合适,适合正常的可食用内脏掺假鉴别,又不会出现误判。传统的基于DAN 分析的鉴定技术一般使用特异性引物进行扩增,方法的通用性不强,掺假筛选能力一般;而DNA 条形码技术采用通用型引物,可以一次性检测可食用动物内脏中的7 种动物源成分,效率高,通用性强。但是本方法也存在一定的缺点,比如DNA 条形码扩增产物的后续分析和确认需要较昂贵的设备和需要较专业的技术人员,且克隆测序的时间较长,所以今后在动物源成分的掺假鉴定技术研究方向,亟需开发一种耗时短、效率高、特异性强的DNA 条形码扩增产物确认技术手段。
