扶正祛邪方加减治疗失眠症的药效及其对脑组织内GABA ARα1、5-HT1AR、mGluR7表达的影响
2023-08-14刘艳霞,李雁
刘艳霞,李雁
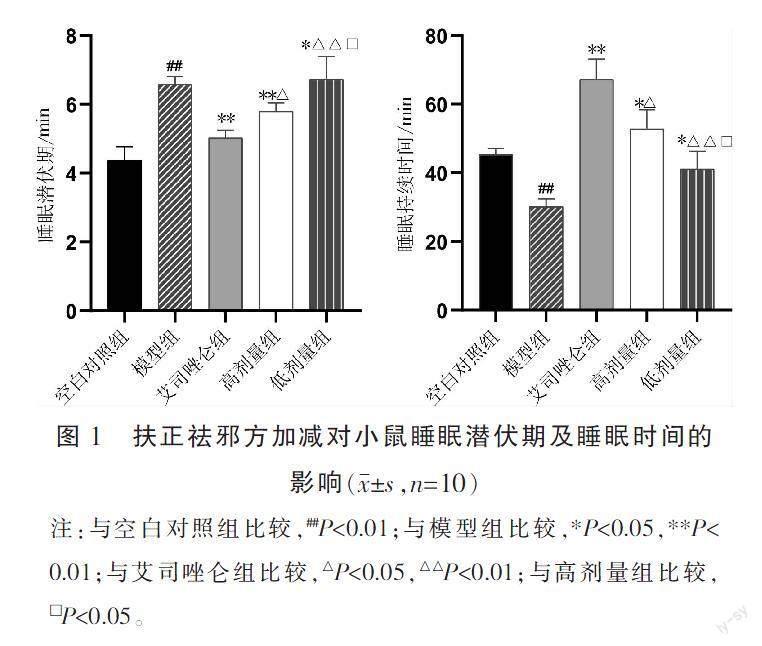
〔摘要〕 目的 探究扶正祛邪方加減对氯苯丙氨酸(para-chlorophenylalanine, PCPA)失眠模型小鼠的镇静催眠作用及其对脑组织内γ-氨基丁酸A受体α1(gamma-aminobutyric acid A receptor subtype α1, GABA ARα1)、5-羟色胺1A受体(5-hydroxytryptamine 1A receptor, 5-HT1AR)、代谢型谷氨酸受体7(metabotropic glutamate receptor 7, mGluR7)表达的影响。方法 将50只小鼠随机分为空白对照组、模型组、艾司唑仑组、高剂量组和低剂量组,连续灌胃给药7 d后,各组小鼠进行戊巴比妥钠协同睡眠实验和旷场试验的行为学测试,分别采用RT-qPCR和Western blot法检测脑组织中GABA ARα1、5-HT1AR、mGluR7 mRNA和蛋白的表达以及mGluR7/GABA ARα1的比值。结果 与空白对照组比较,模型组小鼠睡眠潜伏期延长(P<0.05),睡眠时间缩短(P<0.05),旷场试验中总的区域路程延长(P<0.05),中心区停留时间缩短(P<0.05),脑组织中GABA ARα1、5-HT1AR mRNA和蛋白的表达均降低(P<0.05),mGluR7 mRNA和蛋白的表达升高(P<0.05),mGluR7/GABA ARα1上升(P<0.05)。与模型组比较,艾司唑仑组和高剂量组、低剂量组小鼠睡眠潜伏期缩短(P<0.05),睡眠时间延长(P<0.05),总的区域路程减少(P<0.05),中心区停留时间增加(P<0.05),脑组织中GABA ARα1、5-HT1AR mRNA和蛋白的表达上升(P<0.05),mGluR7 mRNA和蛋白表达降低(P<0.05),mGluR7/GABA ARα1下降(P<0.05)。与艾司唑仑组比较,高剂量组、低剂量组小鼠睡眠潜伏期和总区域路程增加(P<0.05),睡眠持续时间和中心区停留时间减少(P<0.05),GABA ARα1、5-HT1AR mRNA和蛋白表达下降(P<0.05)、mGluR7 mRNA和蛋白表达上升(P<0.05),mGluR7/GABA ARα1上升(P<0.05)。与高剂量组比较,低剂量组小鼠睡眠潜伏期、总区域路程增加(P<0.05),睡眠持续时间、中心区停留时间减少(P<0.05),GABA ARα1、5-HT1AR mRNA和蛋白表达下降(P<0.05)、mGluR7 mRNA和蛋白表达上升(P<0.05),mGluR7/GABA ARα1上升(P<0.05)。结论 扶正祛邪方加减可以改善PCPA失眠模型小鼠的睡眠,有较好的镇静催眠作用,其机制可能是通过调节脑组织内GABA ARα1、5-HT1AR、mGluR7水平发挥作用。
〔关键词〕 扶正祛邪方加减;失眠;氯苯丙氨酸;γ-氨基丁酸A受体α1;5-羟色胺1A受体;代谢型谷氨酸受体7
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.001
Efficacy of modified Fuzheng Quxie Formula in treating insomnia and its influence on GABA ARα1, 5-HT1AR, and mGluR7 expressions in brain tissue
LIU Yanxia, LI Yan*
Department of Oncology, Municipal Chinese Medicine Hospital of Shanghai University of Chinese Medicine, Shanghai 200071, China
〔Abstract〕 Objective To explore the sedative and hypnotic effects of modified Fuzheng Quxie Formula (FZQXF) on insomnia model mice induced by para-chlorophenylalanine (PCPA) and its influence on gamma aminobutyric acid A receptor subtype α1 (GABA ARα1), 5-hydroxytryptamine 1A receptor (5-HT1AR), and metabotropic glutamate receptor 7 (mGluR7) expressions in brain tissue. Methods Fifty mice were randomly divided into blank control group, model group, estazolam group, high- and low-dose modified FZQXF groups. After 7 d of continuous intragastric administration, the mice in each group were subjected to behavioral tests including pentobarbital sodium synergistic sleep experiment and open field experiment. Meanwhile, the mRNA and protein expressions of GABA ARα1, 5-HT1AR, and mGluR7 in brain tissue and the ratio of mGluR7/GABA ARα1 were determined by RT-qPCR and Western blot, respectively. Results Compared with blank control group, the mice in model group showed prolonged sleep latency (P<0.05), shortened sleep time (P<0.05), longer total regional distance in the open field experiment (P<0.05), shorter residence time in the central area (P<0.05), lower mRNA and protein expressions of 5-HT1AR and GABA ARα1 in brain tissue (P<0.05), higher mRNA and protein expressions of mGluR7 (P<0.05), and increased mGluR7/GABA ARα1 ratio (P<0.05). Compared with model group, the mice in estazolam, high- and low-dose modified FZQXF groups showed shortened sleep latency (P<0.05), prolonged sleep time (P<0.05), reduced total regional distance (P<0.05), extended residence time in central area (P<0.05), higher mRNA and protein expressions of GABA ARα1 and 5-HT1AR in brain tissue (P<0.05), lower mRNA and protein expressions of mGluR7 (P<0.05), and increased mGluR7/GABA ARα1 ratio (P<0.05). Compared with estazolam group, the mice in high- and low-dose modified FZQXF groups showed prolonged sleep latency and total regional distance (P<0.05), shortened sleep time and residence time in central area (P<0.05), lower mRNA and protein expressions of GABA ARα1 and 5-HT1AR, higher mRNA and protein expressions of mGluR7 (P<0.05), and increased mGluR7/GABA ARα1 ratio (P<0.05). Compared with high-dose modified FZQXF group, the mice in low-dose modified FZQXF group showed longer sleep latency and total regional distance (P<0.05), shorter sleep time and residence time in central area (P<0.05), lower mRNA and protein expressions of GABA ARα1 and 5-HT1AR, and increased mGluR7/GABA ARα1 ratio (P<0.05). Conclusion Modified FZQXF can exert its sedative and hypnotic effects on PCPA-induced insomnia model mice, and its mechanism of sleeping-improving may be related to regulating the levels of GABA ARα1, 5-HT1AR and mGluR7 in brain tissue.
〔Keywords〕 modified Fuzheng Quxie Formula; insomnia; para-chlorophenylalanine; gamma-aminobutyric acid A receptor subtype α1; 5-hydroxytryptamine 1A receptor; metabotropic glutamate receptor 7
失眠是臨床常见的身心疾病,全球发病率为10%~50%,是多种疾病发生的危险因素,其发病年龄逐渐年轻化[1-2]。失眠患者多伴有睡眠异常的特征,如入睡困难、睡眠持续时间短、多梦易醒,醒后难以再次入睡等睡眠障碍,多伴有头晕头痛、乏力、易怒、健忘、注意力无法集中、焦虑等表现,长期失眠会影响患者的生活、工作和学习,引发焦虑抑郁状态、代谢性疾病及心血管疾病等[3-4]。目前,现代医学治疗失眠以苯二氮■类镇静安眠药为主,短期效果明显,但长期服用不良反应较多,会产生耐药性,影响临床疗效和患者的身心健康[5]。近年来,中医从整体观念和辨证论治出发,在治疗失眠上取得较好的效果,且无成瘾性和耐药性,安全性高,是临床重要的治疗手段[6-7]。扶正驱邪法治疗失眠有良好的效果[8]。扶正祛邪方加减是上海市名中医李雁教授临床上治疗失眠的经验方。本研究拟探讨扶正祛邪方加减对氯苯丙氨酸(para-chlorophenylalanine, PCPA)诱导失眠模型小鼠的药效及其作用机制,为临床诊疗提供实验依据。
1 材料
1.1 实验动物
健康SPF级雄性C57小鼠50只,体质量(20±2) g,购于上海杰思捷实验动物有限公司,动物生产许可证号码:SCXK(沪)2018-0004,动物质量合格证编号:20180004067009,动物伦理审批号:2022046。动物饲养于上海市中医医院SPF级别实验室中,于昼夜12 h交替,室温为(21±2) ℃,相对湿度50%~70%,自由饮水摄食,于清洁干燥的环境中适应性喂养1周。
1.2 药品及主要试剂
扶正祛邪方组成:生黄芪30 g,生白术15 g,茯苓15 g,陈皮9 g,天冬15 g,麦冬15 g,北沙参15 g,酸枣仁15 g,五味子20 g,合欢皮20 g。以上中药均购买自上海市中医医院,加4倍量的水,浸泡30 min,大火加热至沸腾后转小火煎煮40 min。再加4倍量的水,大火加热至沸腾后转小火煎煮40 min。两次的药液混匀,浓缩为4.18 g/mL的水煎剂,置于4 ℃冰箱保存以备用。艾司唑仑片(四川大冢制药有限公司,批号:H20170205)。
PCPA(美国Sigma公司,批号:C6506);戊巴比妥钠(北京中生瑞泰科技有限公司,批号:130326);γ-氨基丁酸受体Aα1(γ-aminobutyric acid A recep?鄄tor α1, GABA ARα1)抗体、代谢型谷氨酸受体7(metabotropic glutamate receptor 7, mGluR7)抗体(美国Affinity抗体公司,批号:DF8548、AF0171);5-羟色胺1A受体(5-hydroxytryptamine 1A receptor, 5-HT1AR)抗体(北京博奥森生物技术有限公司,批号:bs-1124R);GAPDH抗体(杭州贤至生物科技有限公司,批号:AB-P-R001);RNA提取液、逆转录试剂盒、2×实时荧光定量PCR扩增预混液(武汉赛维尔生物科技有限公司,批号:G3013、G3330、G3322)。
1.3 主要仪器
小鼠自主活动测试仪(南京威美特科学仪器有限公司,型号:SPT-CM72ZZ-6);PCR扩增仪、化学发光凝胶成像系统、电泳仪(美国Bio-Rad公司,型号:CFX 96、1708280、1645050);全自动样品快速研磨仪(上海净信科技有限公司,型号:JXFSTPRP-48L)。
2 方法
2.1 分组、造模及给药方法
C57雄性小鼠50只,随机抽出10只为空白对照组,其余40只每天上午腹腔注射吐温-80配制的PCPA混悬液(300 mg/kg),持续2 d,建立小鼠失眠模型[9],空白对照组小鼠用等体积的生理盐水腹腔注射。在末次注射PCPA混悬液12 h后,小鼠昼夜节律消失,白天活动增加,对外界刺激异常敏感,易惊恐打斗,饮食量减少,饮水量明显增加,提示造模成功[10]。造模成功后,根据随机数字表法将小鼠分为模型组、艾司唑仑组、低剂量组、高剂量组,每组10只。造模分组后第2天,根据《中药药理研究方法学》[11]中人日用量与动物临床等效剂量的比值计算中药给药剂量,高剂量组:生药量为261 g,即0.784 g/20 g,浓度为1.568 g/mL;低剂量组为高剂量组的一半,即用药量为0.392 g/20 g,浓度为0.784 g/mL;艾司唑仑组按1 mg/kg灌胃;空白对照组和模型组小鼠每日灌胃等体积的生理盐水。每天1次,连续7 d,给药体积均为0.5 mL/20 g。
2.2 行为学检测
2.2.1 睡眠潜伏期及睡眠持续时间测定 采用戊巴比妥钠协同睡眠法[12],在最后一次灌胃给药30 min后,各组小鼠腹腔注射戊巴比妥钠(45 mg/kg),使小鼠进入睡眠状态。小鼠翻正反射消失1 min以上即可认为小鼠进入睡眠状态,观察睡眠潜伏期(腹腔注射戊巴比妥钠后至翻正反射消失的时间)和睡眠持续时间(翻正反射消失至翻正反射恢复的总时间)。
2.2.2 旷场试验 各组小鼠在连续灌胃的第6天给药30 min后进行旷场试验[13],将小鼠放在自主活动仪中适应5 min,用仪器记录各组小鼠6 min内的总区域路程、总区域停留时间。
2.3 标本采集
末次给药24 h后,快速断头将小鼠处死,保留脑组织,在冰上迅速剥离小鼠海马、下丘脑组织,快速存放于-80 ℃冰箱备用。
2.4 RT-qPCR检测小鼠大脑皮质中GABA ARα1、5-HT1AR、mGluR7 mRNA表达水平
取50 mg组织,Trizol法提取总RNA,根据逆转录试剂盒说明书以42 ℃ 60 min,70 ℃ 5 min为反应条件逆转录为cDNA,后根据荧光定量PCR试剂盒说明书,配成20 μL的反应体系,于PCR仪中以95 ℃ 10 min;95 ℃ 15 s;60 ℃ 30 s共40个循环的反应条件进行扩增。结果采用2-ΔΔCt相对定量法计算,引物由上海生工生物工程有限公司合成。引物序列GABA ARα1:正向5'-AGTGCCAGAAATTCCCTCCCAAAG-3',反向5'-CAATCAGAGCCGAGAACACGAAGG-3';5-HT1AR:正向5'-AAGGTGGAAAAGAAGGGAGC-3',反向5'-AATAACTGGGTTGAGCAGGG-3';mGluR7:正向5'-ATTGGGCAGTGGACAGATGA-3';反向5'-GGTATCCATCACAGGGCTCA-3';β-actin:正向5'-AGGGAAATCGTGCGTGAC-3',反向5'-ATACCCAGGAAGGAAGGCT-3'。
2.5 Western blot法检测小鼠海马组织GABA ARα1、5-HT1AR蛋白表达量
取50 mg组织,研磨后提取蛋白质,用BCA法进行蛋白质浓度定量,煮8 min使蛋白质变性。蛋白质上样质量为30 μg,以分离胶100 V、浓缩胶80 V的恒压条件进行电泳,以200 mA、60 min的恒流条件进行PVDF转膜;转完膜后用5%脱脂奶粉于摇床上缓慢摇匀封闭120 min,根据Marker指示裁剪条带,加入一抗(GABA ARα1、5-HT1AR、GAPDH,1∶1 000)4 ℃孵育过夜;TBST洗涤30 min(10 min/次),加入二抗(HRP标记山羊抗兔,1∶1 000)室温孵育120 min,TBST洗涤30 min(10 min/次),采用ECL法显影检测目的条带,用凝胶成像系统分析目标蛋白灰度值,与内参比较作为目标蛋白相对表达量。
2.6 统计学分析
采用SPSS 26.0统计软件分析数据,计量资料用“x±s”表示,数据符合正态分布用独立样本Student's t-test检测统计差异,数据不符合正态分布用Mann-Whitney U test进行统计分析。组间比较用方差分析,方差齐者用LSD检验,方差不齐者用Dunnett-t检验,P<0.05為差异有统计学意义。
3 结果
3.1 各组小鼠戊巴比妥钠协同睡眠实验比较
腹腔注射戊巴比妥钠后,小鼠表现出不同程度的睡眠状态。与空白对照组比较,模型组小鼠睡眠潜伏期显著延长(P<0.01),睡眠持续时间显著缩短(P<0.01);与模型组比较,艾司唑仑组、高剂量组、低剂量组睡眠潜伏期缩短(P<0.05),睡眠持续时间延长(P<0.05);与艾司唑仑组比较,高剂量组、低剂量组睡眠潜伏期延长(P<0.05),睡眠持续时间缩短(P<0.05);与高剂量组比较,低剂量组睡眠潜伏期延长(P<0.05),睡眠持续时间缩短(P<0.05)。详见图1。
3.2 各组小鼠旷场试验比较
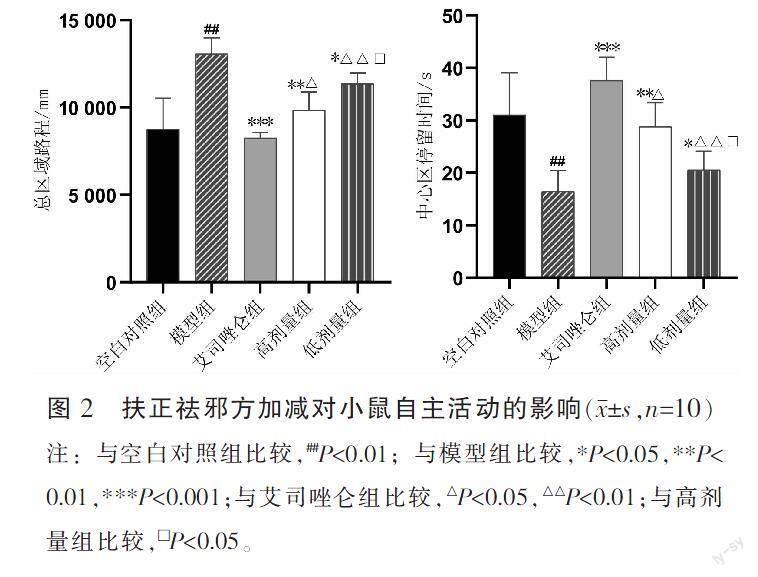
与空白对照组比较,模型组小鼠总区域路程显著增加(P<0.01),中心区停留时间显著降低(P<0.01);与模型组比较,艾司唑仑组、高剂量组、低剂量组总区域路程减少(P<0.05),中心区停留时间增加(P<0.05);与艾司唑仑组比较,高剂量组、低剂量组总区域路程增加(P<0.05),中心区停留时间减少(P<0.05);与高剂量组比较,低剂量组总区域路程增加(P<0.05),中心区停留时间减少(P<0.05)。详见图2。
3.3 各组小鼠脑组织中GABA ARα1、5-HT1AR、mGluR7 mRNA的相对表达量比较
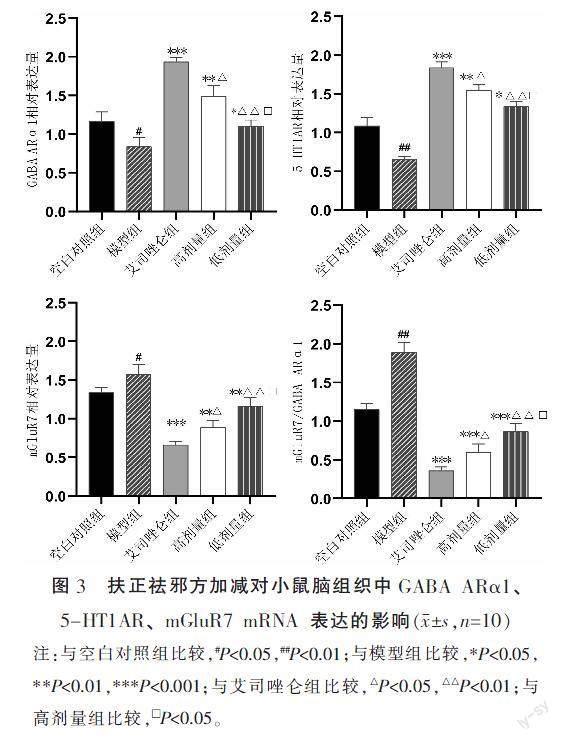
与空白对照组比较,模型组小鼠脑组织中GABA ARα1、5-HT1AR mRNA表达降低(P<0.05),mGluR7 mRNA表达升高(P<0.05),mGluR7/GABA ARα1上升(P<0.05);与模型组比较,艾司唑仑组、高剂量组、低剂量组GABA ARα1、5-HT1AR mRNA表达上升(P<0.05),mGluR7 mRNA表达下降(P<0.05),mGluR7/GABA ARα1下降(P<0.05);与艾司唑仑组比较,高剂量组、低剂量组GABA ARα1、5-HT1AR mRNA表达下降(P<0.05),mGluR7 mRNA表达上升(P<0.05),mGluR7/GABA ARα1上升(P<0.05);与高剂量组比较,低剂量组GABA ARα1、5-HT1AR mRNA表达下降(P<0.05),mGluR7 mRNA表达上升(P<0.05),mGluR7/GABA ARα1上升(P<0.05)。详见图3。
3.4 各组小鼠脑组织中GABA ARα1、5-HT1AR、mGluR7蛋白相对表达量的比较
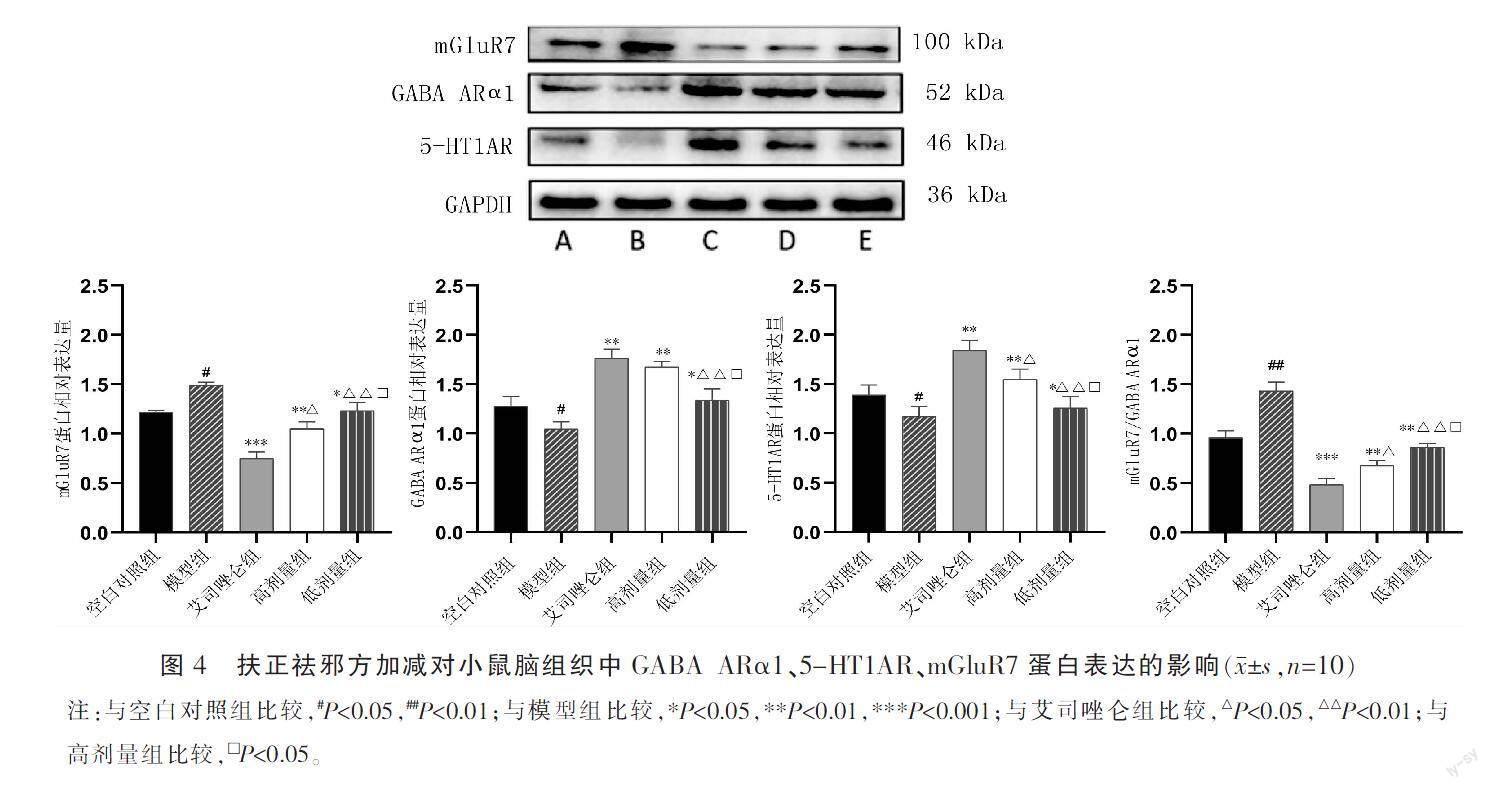
与空白对照组比较,模型组小鼠脑组织中GABA ARα1、5-HT1AR蛋白表达降低(P<0.05),mGluR7蛋白表达升高(P<0.05),mGluR7/GABA ARα1升高(P<0.05);与模型组比较,艾司唑仑组、高剂量组、低剂量组GABA ARα1、5-HT1AR蛋白表达升高(P<0.05),mGluR7蛋白表达降低(P<0.05),mGluR7/GABA ARα1降低(P<0.05);与艾司唑仑组比较,高剂量组、低剂量组GABA ARα1、5-HT1AR蛋白表达降低(P<0.05),mGluR7蛋白表达升高(P<0.05),mGluR7/GABA ARα1升高(P<0.05);与高剂量组比较,低剂量组GABA ARα1、5-HT1AR蛋白表达降低(P<0.05),mGluR7蛋白表达升高(P<0.05),mGluR7/GABA ARα1升高(P<0.05)。详见图4。
4 讨论
失眠在中医学中属“不寐”范畴,其病机在于阳不入于阴,卫不入于营,阴阳失和,阳盛阴衰[14]。阳指太阳、少阳和阳明三阳,阴为太阴、少阴和厥阴三阴,阴阳正常出入交接的基础在于三阴三阳开阖枢功能的正常。开阖枢理论源于《黄帝内经》,是三阴三阳阴阳运动的形式[15],若开阖枢功能失调,阴阳无法正常出入交接,则会导致失眠的发生。根据睡眠觉醒周期规律并结合“三阴三阳开阖枢”时辰理论,从阴阳气机的动态变化过程中认识失眠发生的机制,在失眠的治疗上取得了良好的效果[16-17]。太阴病失眠是常见的失眠类型,其病机多与阴虚血少,阳气不能潜藏于内有关。太阴归属脾、肺二脏,主司气、血、阴津的化生。太阴脾脏气机为开,主升清,在阳气的推动下,运化、布散水谷精微,脾脏功能正常,则阳气得以收藏,人可睡眠正常。若太阴受到秽浊之气的影响而导致清阳受阻,则气机运行受阻发为不寐。脾主水谷之气,肺司呼吸之气,肺、脾与营卫之气的化生和运行密切相关,脾肺二脏功能失常则引发失眠。扶正祛邪方加减中重用黄芪以增强补气生血、养心安神之功,白术、茯苓、陈皮相配以益气健脾、化湿祛痰,天冬、麦冬、北沙参合用,滋补肺阴以降肺气,酸枣仁、五味子、合欢皮合用,酸甘敛阴,使阴引而下,阳合于阴。诸药合用,健脾益肺以开太阴,调和阴阳以助睡眠。
旷场试验中,总运动距离、中心区域停留时间可以反映动物的紧张、焦虑程度[18]。本实验结果表明,造模后模型组小鼠睡眠潜伏期延长、睡眠持续时间缩短、总的区域路程增加、中心区停留时间减少,表明小鼠兴奋性增高,具有明显的紧张、焦虑行为。给药后高剂量组、低剂量组以及艾司唑仑组小鼠睡眠潜伏期缩短、睡眠时间延长、总的区域路程减少、中心区停留时间延长,说明药物可以缓解小鼠烦躁焦虑情绪,改善睡眠。
研究发现,大脑内的γ-氨基丁酸、5-羟色胺、谷氨酸、多巴胺、褪黑素等多种神经递质与失眠的发生和进展密切相关[19]。谷氨酸是中枢神经系统中重要的兴奋性神经递质,失眠时会伴随大量谷氨酸释放[20]。mGluR7属于代谢型谷氨酸受体,可以调节谷氨酸以及γ-氨基丁酸神经递质的释放,调节睡眠过程[21]。γ-氨基丁酸是谷氨酸脱羧后形成的产物,对神经元兴奋有抑制作用[21]。谷氨酸与γ-氨基丁酸比值的动态失衡与失眠的发生密切相关[22]。有研究发现,上调GABA AR水平,可以改善大鼠失眠症状[23]。5-HT1AR是5-羟色胺家族受体中的研究热点,与调节焦虑及睡眠有关[24]。有研究证实,接受大剂量5-HT1A受体激动剂注射的大鼠,脑组织中5-羟色胺的释放减少,觉醒增加[25]。本研究进一步对失眠小鼠脑组织进行检测,结果显示,PCPA造模成功后,小鼠脑组织中GABA ARα1和5-HT1AR的含量降低,mGluR7含量升高,脑组织中mGluR7/GABA ARα1的比值上升,表明PCPA诱导了小鼠脑内单胺类神经递质水平的失衡,引发小鼠紧张焦虑、失眠状态;艾司唑仑和扶正祛邪方加减治疗可以升高脑组织中GABA ARα1和5-HT1AR含量,下调mGluR7水平,降低mGluR7/GABA ARα1的比值,逆转脑组织中GABA ARα1和mGluR7的动态紊乱,维持兴奋性和抑制性神经递质之间的平衡,缓解小鼠紧张焦虑、失眠状态。
综上所述,扶正祛邪方加减可以缩短PCPA失眠模型小鼠的睡眠潜伏期、延长睡眠时间,有镇静催眠的作用,其机制可能是通过调节脑内GABA ARα1、5-HT1AR、mGluR7神经递质受体发挥作用。然而本实验只研究了脑组织中部分单胺类神经递质受体,其他神经递质蛋白表达以及活化情况有待后续进行深入研究。
参考文献
[1] 郝雅楠, 吴晓青. 中青年失眠的流行病学及发病机制研究进展[J]. 中国疗养医学, 2023,32(5): 481-485.
[2] 刘一然, 周 薇. 腹针联合艾灸治疗心脾两虚型失眠症患者的疗效观察[J]. 湖南中医药大学学报, 2021, 41(4): 552-557.
[3] 夏 婧, 徐 波, 谢光璟, 等. 安神类中药调控能量代谢治疗睡眠障碍性疾病的研究进展[J]. 中国实验方剂学杂志, 2022,28(7): 40-48.
[4] 赵红亮, 赵秀杰, 张慧杰, 等. 基于倾向性得分匹配分析自述失眠对冠心病心绞痛患者的预后价值[J]. 临床心血管病杂志, 2022, 38(11): 864-870.
[5] CURADO D F, DE BARROS V V, NOTO A R, et al. Dependence on hypnotics: A comparative study between chronic users of benzodiazepines and Z-drugs[J]. Revista Brasileira De Psiquiatria, 2022, 44(3): 248-256.
[6] 劉 琼, 关 双, 陈亚飞, 等. 中西医治疗顽固性失眠的研究进展[J]. 中国中医基础医学杂志, 2021, 27(10): 1670-1674.
[7] 赵 倩, 李劲草, 黄 婷, 等. 经典名方天王补心丹治疗失眠的研究现状[J]. 中国药房, 2022, 33(18): 2295-2298, 2304.
[8] 谢颖兰, 丁砚兵. 凃晋文扶正驱邪治疗失眠验案2则[J]. 湖南中医杂志, 2020, 36(10): 75-76.
[9] 兰 天, 汪 玲, 余贤娴, 等. 蜂王浆及其提取物对失眠小鼠的睡眠改善作用[J]. 食品研究与开发, 2022, 43(20): 83-90.
[10] 许晓丽, 南丽红, 刘玉凤, 等. 半夏秫米汤对PCPA致失眠大鼠下丘脑中Glu/GABA比值及GAD67蛋白表达量的影响[J]. 福建中医药, 2021, 52(12): 39-41, 44.
[11] 陈 奇,邓文龙,孙瑞元, 等. 中药药理研究方法学[M]. 3版. 北京: 人民卫生出版社, 1993: 227.
[12] 胡文卓, 贾力莉, 马 澜, 等. 佛手柑内酯对PCPA失眠大鼠神经递质及学习记忆的影响[J]. 时珍国医国药, 2020, 31(4): 821-823.
[13] 刘 昊, 韩昌胜, 迟显苏, 等. 酸枣仁汤对氯苯丙氨酸诱导失眠大鼠模型治疗机制的研究[J]. 山东科学, 2021, 34(6): 32-40.
[14] 郭天灏, 周红光, 霍介格. 基于癌毒理论探讨肿瘤患者兼见不寐的相关治疗[J]. 陕西中医, 2020, 41(10): 1455-1457.
[15] HOXHAJ G, MANNING B D. The PI3K-AKT network at the interface of oncogenic signalling and cancer metabolism[J]. Nature Reviews Cancer, 2020, 20(2): 74-88.
[16] 樊 蕾, 周 雪, 刘馨雁. 顾植山“三阴三阳开阖枢”与“六经病欲解时”辨识失眠不同时间节律经验[J]. 世界睡眠医学杂志, 2022, 9(1): 46-49.
[17] 付燕来, 杲春阳, 邱林杰, 等. 张晋基于三阴三阳开阖枢理论从时空论治失眠[J]. 中医学报, 2022, 37(3): 578-581.
[18] 林晓春, 李云鹏, 卞艳芳, 等. 大鼠旷场实验指标检测及参考值的探讨[J]. 毒理学杂志, 2010, 24(3): 224-225.
[19] 周 磊, 朱丽云, 周 维, 等. 复方安神精油缓解睡眠障碍的安全性及相关药理学机制探讨[J]. 中国药理学通报, 2023, 39(3): 580-587.
[20] 王秀峰, 唐娜娜, 张 瑜, 等. 基于阴阳寤寐学说的交泰丸调节失眠大鼠GABA信号通路的药理作用机制研究[J]. 世界睡眠医学杂志, 2021, 8(11): 1861-1866, 1870.
[21] 王 慧, 藏印竹, 武 静, 等. 酸枣仁汤对PCPA失眠大鼠大脑皮质代谢型谷氨酸受体和受体后cAMP、PKA的干预作用[J]. 中国中医基础医学杂志, 2018, 24(1): 34-37, 93.
[22] 刘丽莎, 董宝强, 刘旭来, 等. 针刺三阴交、神门、内关对失眠大鼠下丘脑5-HT含量及Glu/GABA比值影响机制的探究[J]. 中华中医药学刊, 2022, 40(3): 65-68.
[23] 刘 灿, 黄会珍, 赵洪庆, 等. 复方柴金解郁片对抑郁症失眠大鼠脑内GABA受体表达的影響[J]. 中国药理学通报, 2021, 37(5): 724-730.
[24] WANG M Y, LI N, JING S, et al. Schisandrin B exerts hypnotic effects in PCPA-treated rats by increasing hypothalamic 5-HT and γ-aminobutyric acid levels[J]. Experimental and Therapeutic Medicine, 2020, 20(6): 142.
[25] 靳照宇, 库宝善, 姚海燕, 等. 5-HT1A和5-HT2受体功能与觉醒、睡眠成分关系的研究[J]. 中国药理学通报, 2000,16(2): 208-211.
