不同初始pH对猪粪水酸化贮存过程及氮素损失的影响①
2023-08-02陈广银董金竹王恩慧郑嘉伟
陈广银,吴 佩,董金竹,王恩慧,郑嘉伟
不同初始pH对猪粪水酸化贮存过程及氮素损失的影响①
陈广银1,2,吴 佩2,董金竹2,王恩慧2,郑嘉伟2
(1 安徽省水土污染治理与修复工程实验室,安徽芜湖 241002;2 安徽师范大学生态与环境学院,安徽芜湖 241002)
为减少猪粪水贮存过程中氮素损失,提高还田安全性,采用酸化贮存技术,以磷酸为酸化剂,比较了不同初始pH对猪粪水酸化贮存过程及氮素损失的影响。结果表明:试验用猪粪水中重金属浓度大小顺序为:Cu>Pb>Zn>Cd>As,贮存后重金属浓度均降低,符合GB/T 40750—2021《农用沼液》标准,但贮存180 d后猪粪水氮素损失率达68.55%,贮存后猪粪水中氮素以氨氮为主,占比达51.73%;猪粪水酸化pH与酸化剂用量的相关性公式为:= –3.3113+ 22.999,2=0.985;酸化贮存大幅减少了猪粪水氮素损失,损失率较对照降低了5.98 ~ 62.77个百分点,且贮存后氨氮在总氮中占比大幅提高24个百分点以上,酸化贮存保氮效果与pH负相关;磷酸酸化提高了猪粪水总磷和水溶性磷浓度,增加幅度与磷酸用量正相关;酸化贮存后猪粪水EC值、Cd和Pb浓度偏高,抑制小麦根和茎生长,其负面效应与贮存pH负相关;酸化贮存降低了猪粪水Cu浓度,Cu浓度与pH正相关,对As和Zn的作用无明显规律。综上,建议将猪粪水pH调至6.0后贮存,其酸化剂成本为每吨13.89元。
酸化贮存;氮素损失;pH;猪粪水;氨挥发
2021年,全国年产猪肉5 296万t(按每头猪100 kg,产肉率0.7计,年出栏生猪75 657.14万头),猪肉产量占当年畜禽肉类总产量的59.59%[1]。生猪养殖过程中产生大量养殖粪污,如果处置不当将成为环境污染的重要来源。据估计,规模化猪场1头猪从断奶仔猪到出栏共产生粪污约 0.70 m3[2],则2021年我国生猪养殖排放粪污约5.30亿t,猪场粪污处理压力巨大。
2017年12月7日,全国畜牧总站等单位首次提出将畜禽养殖粪污贮存后直接还田的技术模式[3],该模式具有投资省、门槛低、运行管理方便、易复制推广等特点,受到中小型畜禽养殖业主的欢迎。然而,猪粪水还田前需经较长时间贮存以达到稳定化和无害化,欧洲国家大多要求养殖粪污贮存4 ~ 6个月后方可还田[4]。研究表明,畜禽养殖粪水贮存过程中氮素损失严重,肥料价值下降,如Dexter 等[5]发现,将粪水贮存81 d后氮素损失率达62%;丁京涛等[6]发现,粪水经自然贮存 6 个月后,氨氮损失率达 68% 以上;陈广银等[7]发现,将猪粪水直接贮存180 d,秋季和冬季猪粪水的氮素损失率分别为79.44% 和52.60%;姜晨润等[8]发现,猪粪水贮存180 d后,总氮含量降低了58.38%。为减少猪粪水贮存过程中的二次污染,提高贮存后粪水的肥料价值,欧洲国家早在21世纪初就提出采用酸化技术用于养殖粪水贮存,该技术已在丹麦等国推广应用,取得了较好的社会经济效益。粪水酸化打破了粪水中NH4+和NH3间的平衡,有效减少了氨挥发[9-12]。然而,酸化pH是影响酸化贮存效果的最主要因素[13-14],且酸化贮存减少氨挥发的效果与酸化pH负相关[13]。Rodrigues等[15]比较了不同酸化pH猪粪水贮存60 d氮素损失情况,发现对照、pH 5.14、 pH 7.09和pH 9.41条件下的氮素损失率分别为13.71%、0%、30.47% 和 33.12%;Dai等[16]发现,将猪粪水pH调节至6.0、5.8和5.5后贮存,平均氨挥发率降低了50%、62% 和77%;Park等[17]将猪粪水pH调至6.5和5.5后贮存96 h,累积氨挥发量较对照分别降低了49.4% 和92.3%。可以看出,降低猪粪水pH对减少氨挥发和氮素损失效果明显,且与酸化pH负相关。然而,酸化需要消耗酸化剂,且酸化pH与酸化剂用量负相关,即酸化pH越低,酸化剂用量越大,酸化成本越高。因此,从酸化成本和环境生态效益等角度综合考虑,选择最佳的酸化pH对降低酸化贮存成本非常必要。欧洲国家一般采取将猪粪水pH调至5.5后贮存[18]。考虑到中国生猪品种、饲料组成、管理水平、气候条件等与欧洲国家有较大差异,研究中国猪粪水酸化贮存最优pH尤为必要。
本研究以猪粪水为原料,比较了猪粪水不同酸化pH下贮存氮素损失情况,并对贮存过程中猪粪水理化特性、氮素转化、磷素转化、重金属浓度及对种子发芽情况的影响等进行了分析,以期为猪场粪污资源化利用提供理论指导。
1 材料与方法
1.1 试验材料
试验用猪粪水取自安徽省阜南县某养猪场,为采用干清粪工艺收集的粪污经固液分离后的污水。取回的猪粪水于4℃下保存备用,使用前过10目筛。猪粪水pH为7.02,EC为5.28 mS/cm,硝态氮(NO3–-N)为175.59 mg/L,氨氮(NH3-N)为583.00 mg/L,总氮(TN)为912.92 mg/L,化学需氧量(COD)为6 416 mg/L,总磷(TP)为121 mg/L,水溶性磷(SP)为108 mg/L。供试磷酸为分析纯,纯度85%,密度1.88 g/cm3,由国药集团化学试剂有限公司(沪试)提供。
1.2 试验方法
试验在总容积1 L的玻璃容器内进行,加入猪粪水900 mL,分别用磷酸将pH调至4.0(pH4.0)、5.0(pH5.0)、6.0(pH6.0)、7.0(pH7.0)以及不调节(CK),混匀取样后用纱布覆盖瓶口,并用橡皮筋固定,避免杂物掉入,于室外(避雨但不避光)进行贮存试验。每个处理3个平行,取平均值进行分析。试验于2021年3月22日至2021年9月18日进行,共180 d。贮存期间最高水温27℃,最低水温8℃,平均18℃。试验过程中,于0、2、6、14、25、60、90、120、150和180 d取样测定相关指标,每次取样量控制在25 mL以内,并记录。除试验0 d和180 d采取混匀后取样外,其余时间采样的采样点均位于液面以下液位总高度约1/3的上清液。此外,由于是敞口贮存,贮存过程中猪粪水因蒸发作用损失较大,故取等量自来水于相同条件下贮存,在试验结束时测定剩余的自来水体积,以计算猪粪水蒸发量。
1.3 测定指标及方法
猪粪水取样后立刻测定pH和EC;TN、NH3-N、NO3–-N、COD、TP和SP在取样24 h内测定;重金属(Cu、Zn、Pb、As、Cd)和小麦种子发芽率在取样后1个月内测定,样品于–18℃下保存。
pH采用上海大普pHS-3C型pH计测定;EC采用台湾衡欣AZ8303电导率仪测定;TN采用硫酸–过氧化氢消解凯氏定氮法测定;NH3-N采用纳氏试剂法测定;NO3–-N采用紫外分光光度法测定;COD采用重铬酸钾容量法测定;TP采用过硫酸钾消解–钼锑抗分光光度法测定;水样经0.45 µm滤膜过滤后测定SP,方法同TP。采用原子荧光光度计测定As,采用火焰原子吸收法测定Cu、Zn、Pb、Cd;种子培养:在直径9 cm的培养皿中铺入两层滤纸,放入10颗小麦种子,每个培养皿中加入5 mL猪粪水(贮存0、90、150 d的猪粪水),于人工气候箱(25℃,光照16 h/黑暗8 h,光强5 000 lx,湿度70%)中培养4 d,每天补充约2 mL猪粪水,记录种子发芽数、根及茎长度。
1.4 数据处理与分析
贮存后猪粪水COD去除率的计算公式如下:
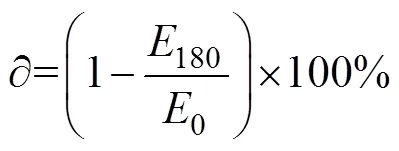
贮存后猪粪水氮素损失率的计算公式如下:
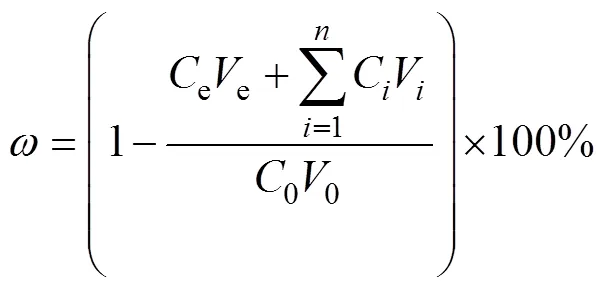
种子发芽率的计算公式如下:
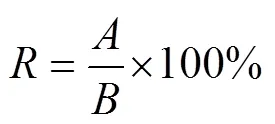
式中:为种子发芽率,%;为种子发芽数,个;为供试种子数量,个。
试验数据采用Excel 2016处理,Origin 2017绘图,SPSS 24.0对试验结果进行统计分析,邓肯新复极差法检验差异显著性,<0.05。
2 结果与讨论
2.1 贮存过程中猪粪水理化特性的变化
试验过程中各处理猪粪水理化特性的结果见图1。由图1A可以看出,各处理猪粪水pH的变化趋势相似,均为先增加后保持相对稳定。试验前14 d是各处理pH增加较快的阶段,但初始pH越低增幅越小。试验过程中,各处理猪粪水pH大小顺序总体为:CK>pH7.0>pH6.0>pH5.0>pH4.0,pH与氨挥发率正相关[15]。试验结束时,CK、pH4.0、pH5.0、pH6.0和pH7.0处理猪粪水的pH分别为7.85、6.02、6.87、7.53和7.61,较第0 d分别增加了0.83、2.00、1.87、1.50和0.62,表明降低初始pH对维持猪粪水贮存过程中低pH效果较好,低pH是减少氨挥发的基础。Iria等[19]将猪粪水pH调至5.5后贮存,在前15 d猪粪水pH快速增加,之后逐步稳定在7.0 ~ 8.0,远高于本试验,这可能与猪粪水特性有关。
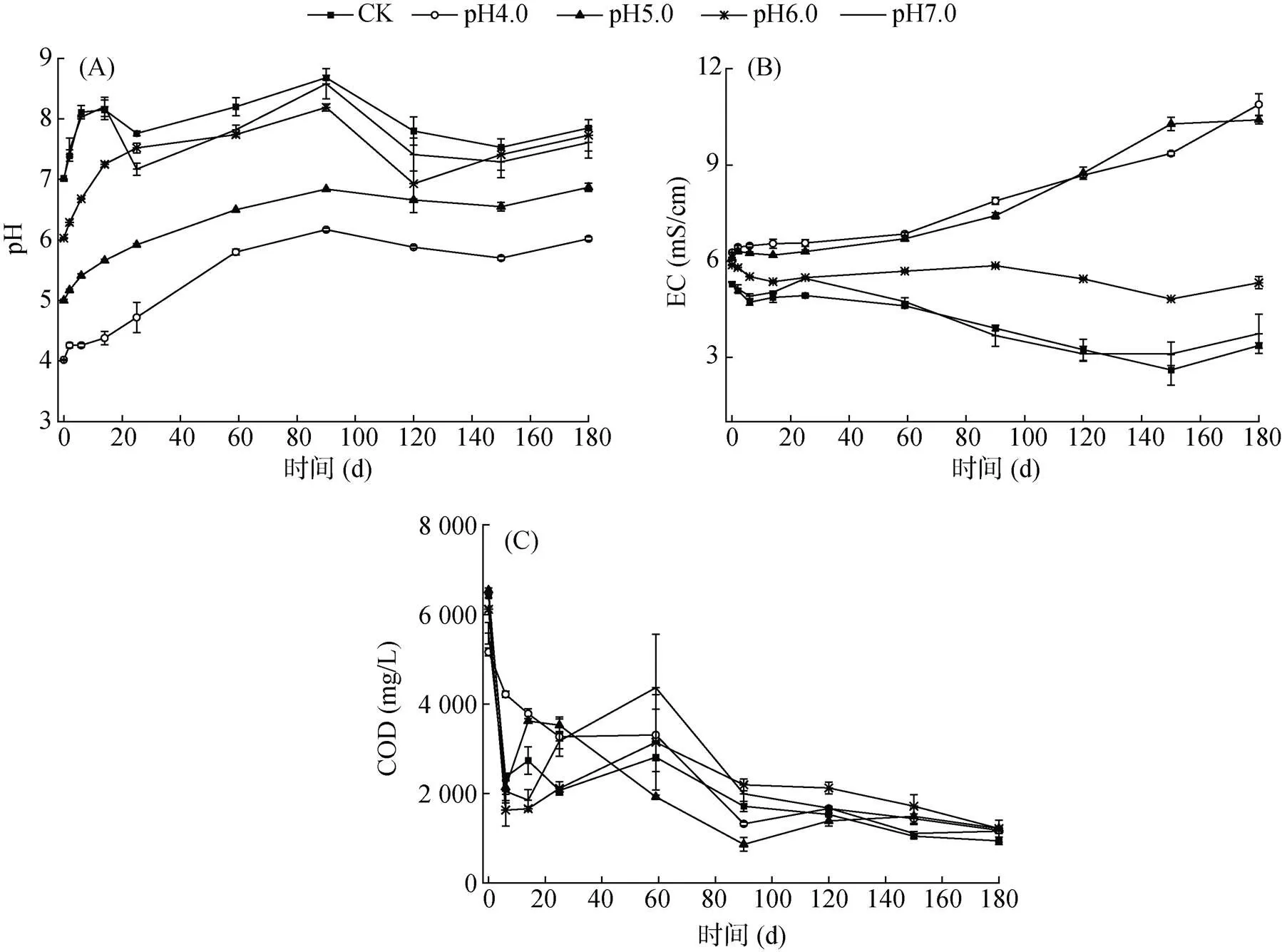
图1 试验过程中猪粪水理化特性的变化
从图1B可以看出,试验启动后不同处理EC值出现两种截然不同的变化趋势,pH4.0和pH5.0处理猪粪水 EC值始终逐渐增加至试验结束,且二者间差异不显著(>0.05),这与Fangueiro等[20]的结果一致;试验结束时pH4.0和pH5.0处理猪粪水EC值分别为10.89和10.41 mS/cm,远大于GB/T 40750—2021《农用沼液》[21]标准。CK、pH6.0和pH7.0处理猪粪水在试验启动后EC值逐渐下降,但pH6.0处理的下降速度和幅度均低于pH7.0和CK处理,pH7.0与CK处理间差异不显著(>0.05);CK、pH6.0和pH7.0处理分别从试验第0 d的5.28、5.88和5.35 mS/cm下降至第180 d的3.37、5.33和3.74 mS/cm,降幅分别为1.91、0.55和1.61 mS/cm。可以看出,猪粪水初始pH与贮存后EC值呈负相关,即初始pH越低,贮存后猪粪水EC值越高。低pH导致猪粪水中矿物质溶出,EC值升高[20]。GB/T 40750—2021《农用沼液》[21]规定,农用沼液的总盐浓度(以EC值计)需≤1.5 mS/cm,远低于本研究中猪粪水的EC值,因此,猪粪水还田前需稀释。
从图1C可以看出,试验启动后各处理猪粪水COD浓度均逐渐下降,主要有两方面原因:一是微生物分解有机物,二是猪粪水中的悬浮固体上浮或下沉,而试验取样是液面以下的上清液。在试验前25 d,由于各处理pH相差较大,尤其是低pH对微生物的抑制作用,pH4.0和pH5.0处理的COD浓度下降速度明显低于其他处理,但随着pH逐渐升高,COD浓度下降速度随之增加。试验结束时,CK、pH4.0、pH5.0、pH6.0、pH7.0处理猪粪水COD去除率分别为88.73%、85.80%、87.18%、87.43%、88.85%,各处理间差异不显著(>0.05),表明不同初始pH贮存不影响猪粪水COD去除。
2.2 贮存过程中猪粪水氮素转化及损失
2.2.1 NH3-N浓度变化 试验过程中猪粪水NH3-N浓度的变化见图2A。由图2A可以看出,除pH4.0和pH5.0处理外,各处理NH3-N浓度变化趋势相似,均为先缓慢下降后快速下降。在前90 d NH3-N浓度下降较慢,之后下降速度较快,可能是试验前90 d猪粪水中含氮有机物分解产生大量NH3-N,加之该阶段pH相对较低,氨挥发较少,故NH3-N浓度降低较慢;90 d后,猪粪水中含氮有机物已被大量分解,含氮有机物分解补充NH3-N的速率降低,加之较高的pH,氨气大量挥发,NH3-N浓度下降较快,pH随之降低(图1A)。pH4.0和pH5.0处理在试验启动后,由于强酸对微生物的抑制,加之少量氨挥发损失,造成试验前几天NH3-N浓度小幅降低,与Dexter等[5]发现现象类似;随着猪粪水pH逐渐回升,猪粪水中微生物活性增加,分解含氮有机物产生NH3-N,当产生NH3-N的速度大于氨挥发时猪粪水NH3-N浓度逐渐增加直至试验结束。180 d时,CK、pH4.0、pH5.0、pH6.0和pH7.0处理的猪粪水NH3-N浓度分别为82.08、1 042.71、966.94、392.37和72.16 mg/L,表明酸化贮存对保存猪粪水NH3-N有较好效果,且保存效果与初始pH呈负相关。
对比图1B发现,各处理NH3-N浓度与EC值的变化趋势极其相似。通过相关性分析发现,CK、pH4.0、pH5.0、pH6.0和pH7.0处理的EC值与NH3-N浓度的决定系数²分别为0.795 9、0.787 5、0.789 7、0.636 7和0.804 7,表明猪粪水EC值与NH3-N浓度间存在较好的正相关,这归因于低pH下NH3-N大多以NH4+形式存在。
2.2.2 NO3–-N浓度变化 试验过程中猪粪水NO3–-N浓度的变化见图2B。由图2B可以看出,各处理NO3–-N浓度变化趋势相似,总体均为逐渐下降(pH4.0和pH5.0处理在120 d后NO3–-N浓度增加)。在试验前25 d 各处理NO3–-N浓度降低较快,这可能与该阶段猪粪水COD浓度较高形成厌氧环境,利于反硝化作用有关。试验结束时,CK、pH4.0、pH5.0、pH6.0和pH7.0处理的NO3–-N浓度分别为63.02、91.55、134.35、58.18和62.77 mg/L,pH4.0、pH5.0处理显著高于其他处理,pH5.0处理显著高于pH4.0处理,CK、pH6.0和pH7.0处理间差异不显著,表明与NH3-N相比,酸化对猪粪水NO3–-N浓度的影响相对较小,且主要影响发生在150 d后,这可能与该阶段pH4.0和pH5.0处理中仍含有较高浓度的NH3-N有关。
2.2.3 TN浓度变化及氮素损失 试验过程中各处理猪粪水TN浓度的变化见图2C。由图2C可以看出,不同处理TN浓度的变化截然不同,pH4.0和pH5.0处理的TN浓度总体上逐渐增加,且二者间无显著差异(>0.05),这可能是因为较低的pH减少了氨挥发(图2A),加之贮存过程中蒸发作用(试验后期为夏季,气温高,蒸发量大)对猪粪水TN起到浓缩作用,且由于粪水蒸发面积不变,试验后期猪粪水体积越小浓缩效应越大,故贮存过程中猪粪水TN浓度增加;CK、pH6.0和pH7.0处理在试验过程中TN浓度始终降低,尽管存在蒸发浓缩作用,但由于pH较高,氨挥发等造成的氮素损失大于蒸发浓缩效应,故仍表现为猪粪水TN浓度降低,且pH6.0处理的TN浓度始终高于pH7.0和CK处理,pH7.0和CK处理间无显著差异(>0.05)。试验结束时,CK、pH4.0、pH5.0、pH6.0和pH7.0处理的TN浓度分别为221.69、1 407.55、1 388.35、529.51、286.77 mg/L,表明猪粪水酸化贮存可明显减少贮存过程中氮素损失,且保氮效果与初始pH呈负相关。将猪粪水pH调至4.0和5.0具有最好的保氮效果,二者间差异不显著(>0.05),其次是调节pH至6.0的处理,pH7.0处理与CK处理间差异不显著(>0.05)。
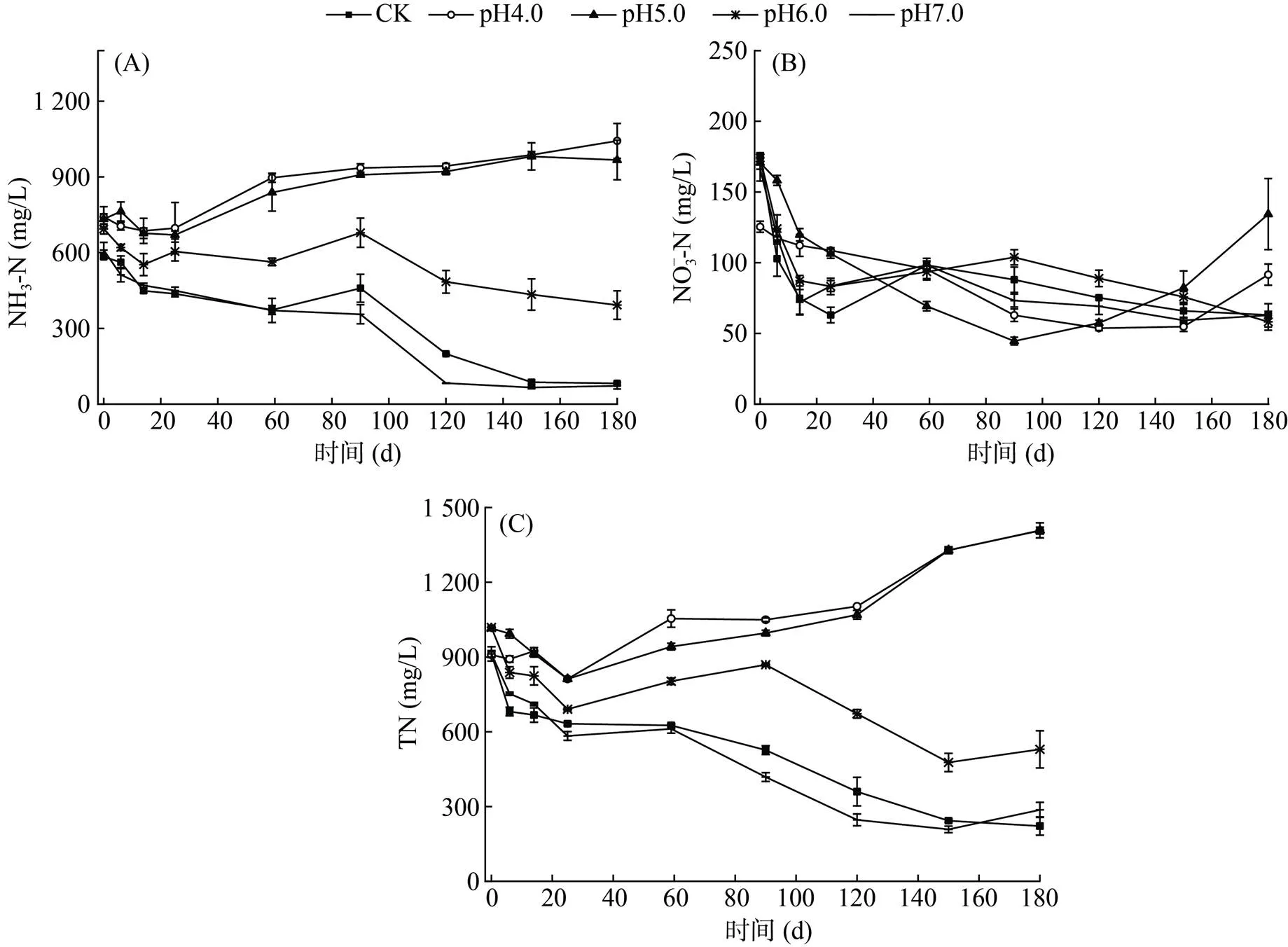
图2 试验过程中猪粪水NH3-N(A)、NO3–-N(B)和TN(C)浓度的变化
经180 d贮存后,各处理猪粪水中氮素形态与氮素损失的结果见表1。由表1可以看出,除pH7.0处理外,各处理猪粪水中氮均以NH3-N为主,占比均在50% 以上(pH7.0处理为32.21%),而NO3–-N占比均明显低于NH3-N;贮存后猪粪水中TN浓度与初始pH呈负相关,CK、pH4.0、pH5.0、pH6.0和pH7.0处理的氮素损失率分别为68.55%、5.78%、6.42%、38.69% 和62.57%,表明猪粪水酸化贮存可大幅减少氮素损失,且贮存pH与氮素损失率呈正相关,但将pH降至5.0时,继续降低pH对减少氮素损失效果不明显。Molloy 和Tunney[11]发现,将猪粪水pH调至5.0可完全阻断氨挥发,本文的结果与之略有不同(pH5.0处理氮素损失率为6.42%),这可能是试验误差所致(如取样、蒸发等,且pH5.0与pH4.0处理氮素损失率非常接近)。Frost等[9]发现,用硫酸将牛粪水pH调至5.5可减少85% 的氨挥发;Regueiro等[22]发现,用浓硫酸将猪粪水pH调至5.5可以减少75% 的氨挥发。丹麦采用浓硫酸将粪水pH调至5.5后贮存,取得较好的保氮效果[18]。从本试验猪粪水氮素损失率结果看,将猪粪水pH调至5.0后贮存具有较好的保氮效果。
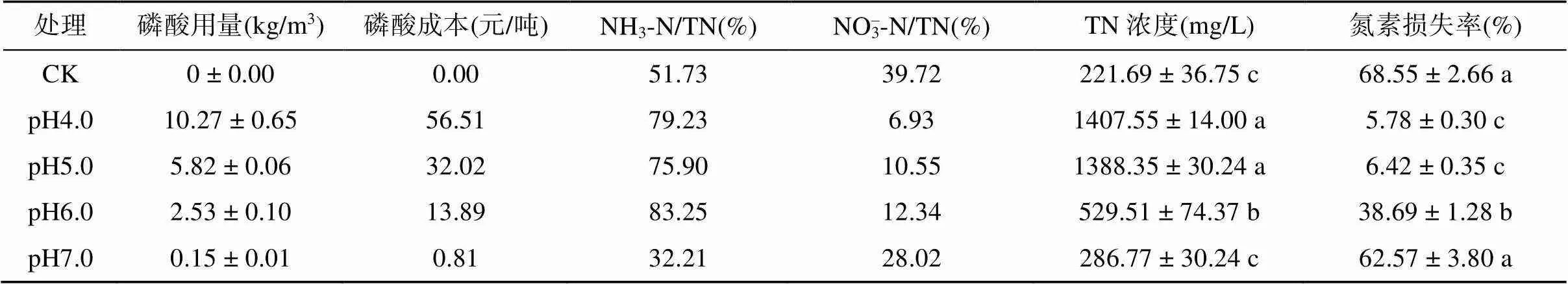
表1 各处理酸化剂成本及贮存后氮素形态与损失
注:磷酸单价按照工业级磷酸5 500元/吨计;同列不同小写字母表示不同处理间差异显著(<0.05)。
本试验以磷酸作为酸化剂,磷酸用量与猪粪水pH呈负相关,相关性公式为:= –3.3113+ 22.999,2=0.985,表明较低的猪粪水贮存pH需要消耗更多的磷酸。从表1中酸化剂成本看,将猪粪水pH调至4.0经济性较差,酸化剂成本较pH5.0处理增加了24.49元/吨,但氮素损失率二者间差异不显著,故pH4.0处理不适合。尽管pH5.0处理具有较好的保氮效果,但酸化剂成本偏高,达32.02元/吨。以年出栏1 000头生猪的养殖场计,每头猪整个生育期排放粪污0.7 m3[2],则猪场年排放粪污700 t,用磷酸将粪污pH调节至5.0,年磷酸成本约2.24万元;如果将pH调至6.0,则年磷酸成本仅为0.97万元,每头猪不到10元费用,氮素损失率为38.69%。综合考虑猪粪水氮素损失率及酸化剂成本,建议将猪粪水pH调至6.0。
2.3 贮存过程中猪粪水磷素转化
试验过程中猪粪水TP和SP浓度的变化见图3。由图3可以看出,各处理TP浓度总体均为先降低后逐渐增加,且各处理TP浓度大小为:pH4.0>pH5.0> pH6.0>pH7.0>CK。由于加入磷酸带入了磷,故各处理TP浓度与初始pH呈负相关。试验启动后,酸化剂带入的磷酸根与猪粪水中金属离子结合,生成难溶或不溶的盐沉淀,且TP浓度下降幅度与猪粪水pH呈负相关,加之蒸发造成的“浓缩”作用,TP浓度逐渐增加,而各处理在180 d后 TP浓度大幅增加还因为混合取样带入大量沉淀所致。有研究认为,贮存过程中理论上不存在磷损失,贮存前后猪粪水中TP浓度变化不大,酸化对TP浓度没有影响[23]。然而,由于本试验装置瓶口较大,贮存期较长,造成水分蒸发量较大,故贮存造成猪粪水磷“浓缩”,贮存后各处理TP浓度较贮存前均增加,CK、pH4.0、pH5.0、pH6.0和pH7.0处理的TP浓度较贮存前分别增加了119.21%、37.76%、78.63%、35.11% 和125.20%。
酸化技术通过降低猪粪水pH至酸性条件,部分磷酸盐或磷酸氢盐以磷酸根或磷酸氢根的形式存在,且酸性越强以磷酸根存在的磷越多,故酸化贮存可提高猪粪水中SP浓度[24-25]。Regueiro等[23]发现,酸化后粪水中100 μm以下颗粒中磷的百分占比增加,而大于1 000 μm的颗粒占比显著降低,导致酸化后粪水中SP浓度增加。从各处理试验过程中SP浓度的变化看(图3B),SP的变化与TP相似,均为先降低后增加。磷酸带入的磷均为水溶性磷,故酸化后猪粪水SP浓度与酸化剂用量呈正相关,以磷酸作为酸化剂可有效提高猪粪水SP浓度,提高猪粪水肥料价值。经180 d贮存后,CK、pH4.0、pH5.0、pH6.0和pH7.0处理猪粪水中SP占TP的百分比分别从0 d的89.86%、94.30%、98.15%、93.27% 和93.63% 增加为180 d的96.06%、95.89%、98.40、98.48% 和98.52%,这与通常认为贮存后部分SP转化为磷酸盐沉淀,造成贮存后磷的有效性下降的结果不一致,这可能与本试验在大口瓶内进行,经180 d贮存后粪水蒸发严重,对SP的“浓缩”作用造成SP/TP比值增加。酸化处理提高了贮存后猪粪水中TP和SP浓度,对后续农田利用是有利的。
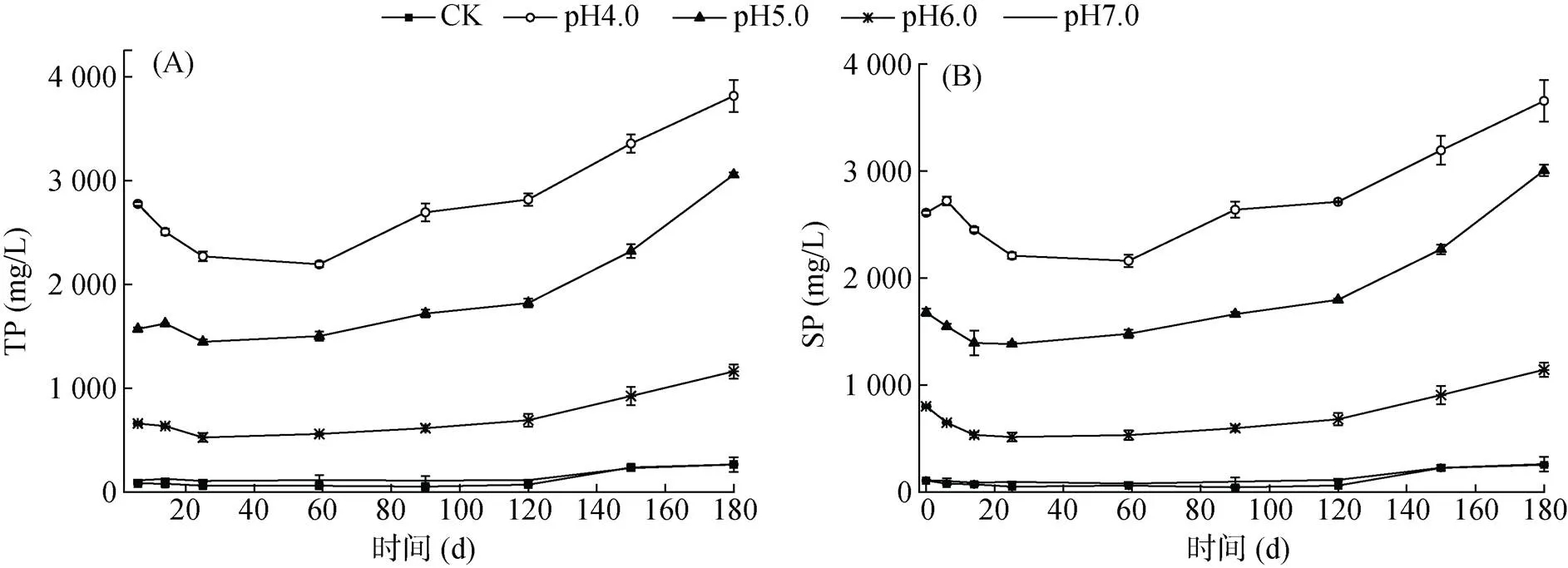
图3 试验过程中猪粪水TP(A)和SP(B)浓度的变化
2.4 贮存过程中猪粪水无害化效果
2.4.1 对猪粪水重金属含量的影响 由于第180 d的猪粪水采用的是混合取样,测得的重金属含量偏高,故采用第150 d的取样进行分析。各处理贮存前后猪粪水重金属含量的结果见表2。从表2可以看出,在测定的5种重金属中,浓度大小顺序为:Cu>Pb> Zn>Cd>As。贮存150 d后,各处理重金属浓度均降低。酸化贮存减缓了猪粪水Pb和Cd浓度下降速度,造成贮存后Pb和Cd浓度偏高,且Pb和Cd浓度与pH呈负相关,但降低了Cu浓度,pH越低Cu浓度越低,对As和Zn的作用无明显规律。
目前,针对农用畜禽养殖粪水中重金属限量尚无国家标准。表3罗列了中国已发布的农用肥水/液态肥标准中重金属的限量,可以看出,GB 5084—2021《农田灌溉水质标准》[26]对灌溉水中As、Zn、Cu、Pb和Cd浓度均作了限定,而GB/T 40750—2021《农用沼液》[21]与NY/T 2596—2014《沼肥》[27]对Zn和Cu浓度均未作限定,As、Pb和Cd浓度限定大小均为NY/T 2596—2014大于GB/T 40750—2021大于GB 5084—2021,且相差较大,如NY/T 2596—2014中Pb的浓度限值是GB/T 40750—2021的250倍。根据猪粪水高COD、高氮磷特点,结合不同标准中对沼肥、农用沼液和农田灌溉水概念的限定,本研究认为贮存后猪粪水更接近农用沼液的特点,故本文参考GB/T 40750—2021《农用沼液》对重金属的限定。根据该标准,各处理As浓度均符合要求,但pH4.0处理的Pb超标85.83%,pH4.0、pH5.0和pH6.0处理的Cd分别超标300%、150% 和50%,贮存初始pH越低超标越严重,表明低pH导致固体颗粒中部分Pb和Cd溶解。因此,酸化贮存时应尽量选择较高的pH,但这对减少氨挥发是不利的,故二者间需寻求平衡。
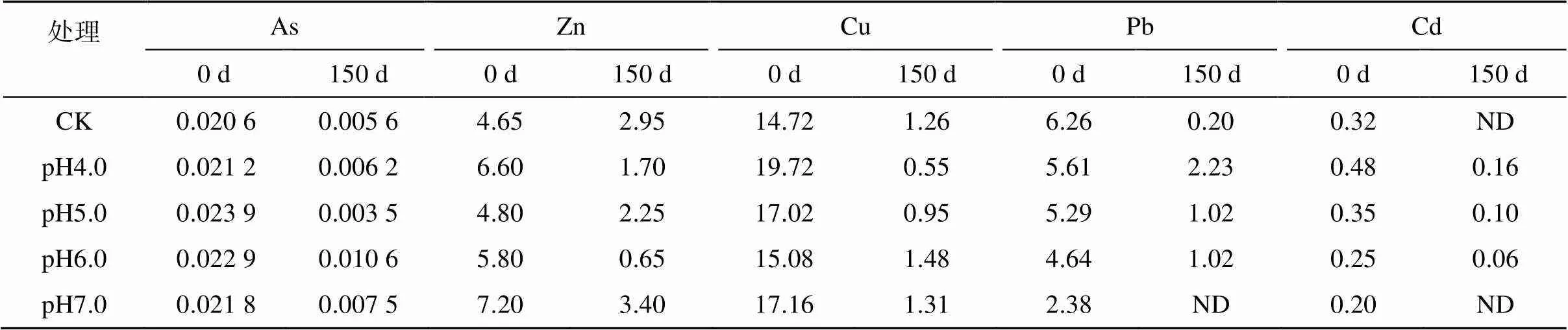
表2 贮存前后猪粪水中重金属浓度变化(mg/L)

表3 农用肥水/液态肥中重金属浓度限定
2.4.2 对种子发芽的影响 各贮存阶段猪粪水处理种子发芽率、根长和茎长的结果见图4。由图4可以看出,未经贮存的猪粪水各处理种子发芽率、根长和茎长均较低,对种子发芽及生长均不利。经贮存后,各处理种子发芽率、根长和茎长均有较大幅度增加,但不同处理的增加幅度不同。贮存150 d后,所有处理种子发芽率均在80% 以上,酸化贮存处理种子发芽率高于CK处理;从根长和茎长看,酸化贮存(pH4.0、pH5.0和pH6.0处理)后的猪粪水根长和茎长均低于CK处理,均以pH7.0处理最好,过低酸化pH贮存后的猪粪水不利于种子根、茎生长,对根的抑制尤其明显,pH越低对根的抑制越明显。丹麦政府规定,酸化猪粪水还田前须用石灰将粪水pH调至中性后方可还田,避免土壤酸化及对种子生长的影响。因此,在选择酸化pH时需尽可能采用接近中性的pH。
综上所述,尽管较低的酸化pH可以更好地减少氮损失,增加贮存后猪粪水中TN、NH3-N、TP和SP浓度,但增加了成本,且贮存后猪粪水EC值、Pb和Cd浓度偏高,发芽种子的根长和茎长均受到抑制。因此,建议酸化贮存pH选择6.0更合适,并结合表面覆盖和贮存装置结构优化等措施,提高酸化贮存的环境友好性。
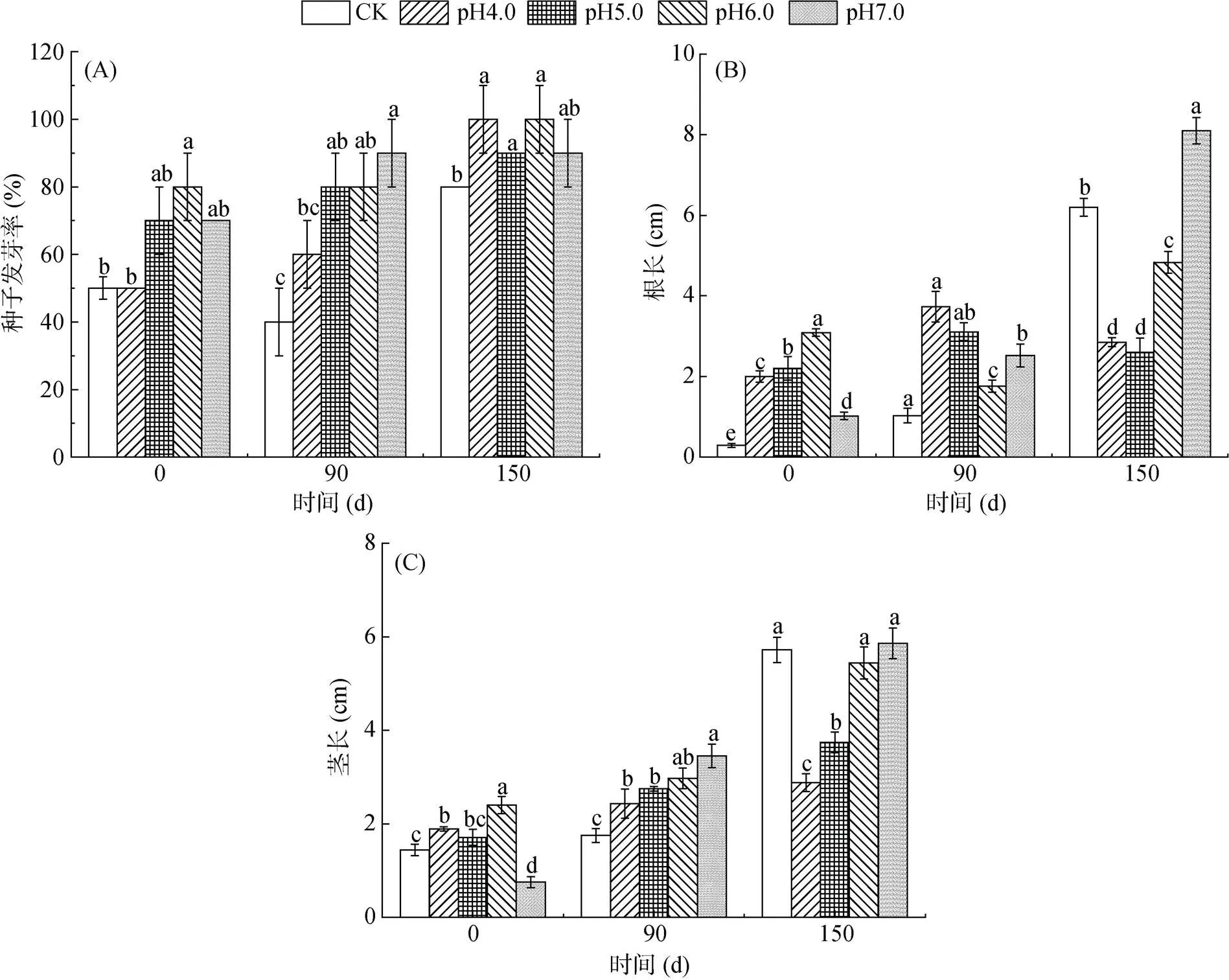
(柱图上方不同的小写字母表示不同处理间差异显著(P<0.05))
3 结论
1)试验用猪粪水中重金属浓度为Cu>Pb>Zn> Cd>As,均符合GB/T 40750—2021《农用沼液》标准,将猪粪水直接贮存180 d氮素损失率达68.55%,贮存后猪粪水中氮素以NH3-N为主,占比达51.73%。
2)酸化减少了猪粪水贮存的氮素损失,氮素损失率较CK降低了5.98 ~ 62.77个百分点,且酸化pH与氮素损失率正相关,猪粪水中NH3-N占比大幅提高了24个百分点以上。
3)猪粪水pH与磷酸用量的相关性公式为:= –3.3113x + 22.999,2=0.985。较低的酸化pH增加了酸化成本,且贮存后猪粪水EC值、Pb和Cd浓度偏高,发芽种子的根长和茎长均受到抑制,且负面效应与pH负相关,不利于猪粪水农田利用。
4)综合保氮效果、酸化剂成本、猪粪水EC值、重金属浓度以及种子生长影响等因素,建议将猪粪水pH调至6.0后贮存,提高猪粪水贮存的环境友好性。
[1] 国家统计局能源统计司. 中国能源统计年鉴-2021[M]. 北京: 中国统计出版社, 2022.
[2] 徐鹏翔, 沈玉君, 丁京涛, 等. 规模化养猪场粪污全量收集及贮存工艺设计[J]. 农业工程学报, 2020, 36(9): 255–262.
[3] 全国畜牧总站, 中国饲料工业协会, 国家畜禽养殖废弃物资源化利用科技创新联盟. 畜禽养殖废弃物资源化利用主推技术模式[N]. 农民日报, 2017-12-06(6).
[4] 孔凡克, 鞠鑫鑫, 杨守军, 等. 种养结合技术在畜禽粪水处理与资源化利用中的应用[J]. 猪业科学, 2017, 34(8): 106–107.
[5] Dexter M, Luo J F, Houlbrooke D, et al. Effects of acidification on nitrogen transformations in stored dairy effluent[C]//27th Annual FLRC Workshop held at Massey University, February 2014 Nutrient Management for the Farm, Catchment and Community. 2014.
[6] 丁京涛, 张朋月, 赵立欣, 等. 养殖粪水长期贮存过程理化特性变化规律[J]. 农业工程学报, 2020, 36(14): 220–225.
[7] 陈广银, 董金竹, 吴佩, 等. 不同贮存方式对猪粪水理化特性的影响[J]. 华南农业大学学报, 2022, 43(4): 38–46.
[8] 姜晨润, 孙靖博, 李华, 等. 规模化养猪场粪便贮存方式及土壤承载力[J]. 农业工程, 2019, 9(1): 35–37.
[9] Frost J P, Stevens R J, Laughlin R J. Effect of separation and acidification of cattle slurry on ammonia volatilization and on the efficiency of slurry nitrogen for herbage production[J]. The Journal of Agricultural Science, 1990, 115(1): 49–56.
[10] Miranda C, Soares A S, Coelho A C, et al. Environmental implications of stored cattle slurry treatment with sulphuric acid and biochar: A life cycle assessment approach[J]. Environmental Research, 2021, 194: 110640.
[11] Molloy S P, Tunney H. A laboratory study of ammonia volatilization from cattle and pig slurry[J]. Irish Journal of Agricultural Research, 1983, 22(1): 37–45.
[12] Stevens R J, Laughlin R J, Frost J P. Effect of acidification with sulphuric acid on the volatilization of ammonia from cow and pig slurries[J]. The Journal of Agricultural Science, 1989, 113(3): 389–395.
[13] Sommer S G, Husted S. The chemical buffer system in raw and digested animal slurry[J]. The Journal of Agricultural Science, 1995, 124(1): 45–53.
[14] Paul J W, Beauchamp E G. Relationship between volatile fatty acids, total ammonia, and pH in manure slurries[J]. Biological Wastes, 1989, 29(4): 313–318.
[15] Rodrigues J, Alvarenga P, Silva A C, et al. Animal slurry sanitization through pH adjustment: Process optimization and impact on slurry characteristics[J]. Agronomy, 2021, 11(3): 517.
[16] Dai X R, Blanes-Vidal V. Emissions of ammonia, carbon dioxide, and hydrogen sulfide from swine wastewater during and after acidification treatment: Effect of pH, mixing and aeration[J]. Journal of Environmental Management, 2013, 115: 147–154.
[17] Park S H, Lee B R, Kim T H. Effects of cattle manure and swine slurry acidification on ammonia emission as estimated by an acid trap system[J]. Journal of the Korean Society of Grassland and Forage Science, 2015, 35(3): 212–216.
[18] Joubin M. Animal slurry acidification: Effects of slurry characteristics, use of different acids, slurry pH buffering[R]. Uppsala, Sweden: RISE Rapport, 2018, 15.
[19] Iria R C, Joao C, David F. Comparison of different approaches for ammonia emissions minimization by acidification of dairy and pig slurries[C]// Ramiran 2013 Recycling of Agricultural and Industrial Residues in Agriculture. 2013.
[20] Fangueiro D, Hjorth M, Gioelli F. Acidification of animal slurry–A review[J]. Journal of Environmental Management, 2015, 149: 46–56.
[21] 国家市场监督管理总局, 国家标准化管理委员会. 农用沼液: GB/T 40750—2021[S]. 北京: 中国标准出版社, 2021.
[22] Regueiro I, Coutinho J, Fangueiro D. Alternatives to sulfuric acid for slurry acidification: Impact on slurry composition and ammonia emissions during storage[J]. Journal of Cleaner Production, 2016, 131: 296–307.
[23] Regueiro I, Pociask M, Coutinho J, et al. Animal slurry acidification affects particle size distribution and improves separation efficiency[J]. Journal of Environmen00tal Quality, 2016, 45(3): 1096–1103.
[24] Fangueiro D, Ribeiro H, Vasconcelos E, et al. Treatment by acidification followed by solid–liquid separation affects slurry and slurry fractions composition and their potential of N mineralization[J]. Bioresource Technology, 2009, 100(20): 4914–4917.
[25] Roboredo M, Fangueiro D, Lage S, et al. Phosphorus dynamics in soils amended with acidified pig slurry and derived solid fraction[J]. Geoderma, 2012, 189/190: 328–333.
[26] 生态环境部, 国家市场监督管理总局. 农田灌溉水质标准: GB 5084—2021[S]. 北京: 中国标准出版社, 2021.
[27] 中华人民共和国农业部. 沼肥: NY/T 2596—2014[S]. 北京: 中国农业出版社, 2014.
Effects of Different Initial pH on Pig Slurry Acidification Storage Progress and Nitrogen Loss
CHEN Guangyin1,2, WU Pei2, DONG Jinzhu2, WANG Enhui2, ZHENG Jiawei2
(1 Anhui Engineering Laboratory of Soil and Water Pollution Control and Remediation, Wuhu, Anhui 241002, China; 2 School of Ecology and Environment, Anhui Normal University, Wuhu, Anhui 241002, China)
In this study, to reduce the nitrogen loss during pig slurry storage and improve the safety of returning pig slurry to the field, acidification storage technology was used and H3PO4was used as acidifier to study the effects of different initial pH on the acidification storage process and nitrogen (N) loss of pig slurry. The results show that the order of contents of heavy metals in pig slurry are Cu > Pb > Zn > Cd > As, and the contents of heavy metals are decreased after 180 days of storage which are below the limited values of GB/T 40750—2021 ‘Agricultural Biogas Liquid’. However, nitrogen in pig slurry is lost after 180 days of storage, and N loss is up to 68.55%. The main nitrogen form in stored pig slurry is ammonia nitrogen (NH3-N), accounting for 51.73% of total nitrogen. The correlation formula between acidification pH and acidifier dosage is= –3.3113+ 22.999,2= 0.985. Compared to CK, N loss of acidified pig slurry is greatly reduced by 5.98–62.77 percentage points, and nitrogen retention effect is inversely proportional to acidification pH. Meanwhile, the proportion of NH3-N to TN in acidified pig slurry is increased up to 24 percentage points. The concentrations of total phosphorus and soluble phosphorus in pig slurry are increased by acidification storage with H3PO4and the increase is positively correlated to the addition amount of H3PO4. After acidification storage, EC, contents of Cd and Pb in pig slurry are high, which inhibit the growth of roots and stems of wheat, and its negative effect is inversely proportional to acidification pH, while Cu content is reduced and is positively correlated to acidification pH. There is no obvious regularity of different acidification pH on As and Zn contents of pig slurry. In conclusion, adjusting pig slurry to pH 6.0 is more appropriate for acidification storage with the acidifier cost of 13.89 yuan per ton.
Acidification storage; Nitrogen loss; pH value; Pig slurry; Ammonia emissions
X713
A
10.13758/j.cnki.tr.2023.03.016
陈广银, 吴佩, 董金竹, 等. 不同初始pH对猪粪水酸化贮存过程及氮素损失的影响. 土壤, 2023, 55(3): 587–595.
安徽省重点研究和开发计划项目(201904a06020044),安徽高校协同创新项目(GXXT-2019-010)和国家重点研发计划项目(2017YFD0801403)资助。
陈广银(1981—),男,江苏盐城人,博士,副研究员,主要从事生物质能和畜禽粪污治理方面的研究。E-mail:xzcf2004@163.com
