薏苡附子散对小鼠心肌缺血和血管内皮功能损伤的保护作用及其机制
2023-07-18马梓珊黄汕梅银帮巧陈枝凡张子谦唐耀平
李 畅, 马梓珊, 黄汕梅, 银帮巧, 陈枝凡, 聂 莎, 张子谦, 李 力, 刘 鹰, 唐耀平,4
(1.广西中医药大学研究生院,广西 南宁 530200;2.广西中医药大学附属瑞康医院心血管内科,广西南宁 530200;3.广西中医药大学科学实验中心;广西 南宁 530200;4.广西壮族自治区高发传染病中西医结合转化医学重点实验室,广西 南宁 530200)
冠状动脉疾病(coronary artery disease,CAD)是目前严重危害人类健康的常见慢性疾病,急性心肌缺血(acute myocardial ischemia,AMI)是CAD的主要类型和致死病因[1-2]。研究[3]表明:一氧化氮(nitric oxide,NO)生物活性降低是导致内皮功能不平衡的关键原因,与线粒体膜电位(mitochondrial membrane potential,MMP)和活性氧(reactive oxygen species,ROS)互相影响,在CAD 的发生发展中起重要作用[3-4]。早在东汉时期,《金匮要略》[5-8]记载薏苡附子散治疗“胸痹缓急”,即冠心病心绞痛,疗效显著。临床上符合此方证者,无论是心脏神经官能症、心绞痛、AMI或心律失常等均可采用薏苡附子散治疗。薏苡附子散参与细胞周期、细胞凋亡和炎症刺激等生物过程,具有强心镇痛、抗炎和调节内分泌等药理作用[9]。但薏苡附子散在心肌缺血中的作用机制尚未完全阐明。本研究观察薏苡附子散对AMI 模型小鼠体内NO 生物活性和心肌组织的影响及其对小鼠离体主动脉舒张作用和人冠脉内皮细胞(human coronary artery endothelial cells,HCAECs)中NO生物活性及内皮细胞线粒体功能的影响,探讨薏苡附子散改善受损的血管内皮功能,保护心肌缺血的作用机制,为薏苡附子散的临床应用提供依据。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器SPF 级C57BL/6J 小鼠100 只,8 周龄,雄性。购自湖南斯莱克景达实验动物有限公司 ,动物生产许可证号:SCXK(湘)2019-0004,本研究所有动物实验操作均获得广西中医药大学实验动物伦理委员会批准(批准号:DW20211109-175)。饲养于广西中医药大学动物中心,动物使用许可证号:SYXK(桂)2019-0001,SPF 级环境(温度25 ℃±1 ℃,湿度55%±5%,12 h∶12 h 光/暗循环),并严格按照3R 原则进行实验。HCAECs 购自美国ATCC 公司。薏苡附子散由薏苡仁和黑顺片2 种中药组成,采用江阴天江药业生产的薏苡仁颗粒剂和黑顺片颗粒剂,由广西中医药大学鉴定为正品。氧气(广西瑞达化工科技有限公司),异氟烷(深圳市瑞沃德生命科技有限公司),单克隆抗体β-肌动蛋白(β-actin)(上海生工生物工程有限公司),单克隆抗体内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)蛋白(美国Cell Signaling 公司),N-硝基-L-精氨酸甲酯(N-nitro-L-arginine methyl ester hydrochloride,L-NAME)、总NO 检测试剂盒、BCA 蛋白浓度测定试剂盒、SDSPAGE 凝胶快速配制试剂盒、彩色预染蛋白质相对分子质量标准、超敏ECL 化学发光试剂盒、SDSPAGE 蛋白上样缓冲液和QuickBlockTMWestern 封闭液(上海碧云天生物科技有限公司),TMRM 和MitoSOXTMRed 试剂(美国赛默飞世尔科技公司),重酒石酸去甲肾上腺素(武汉远大医药有限公司),4%多聚甲醛通用型组织固定液(北京兰杰柯科 技 有限公司),氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)(北京索莱宝科技有限公司)。Tecan Infinite 200Pro 酶标仪(上海迪奥生物科技有限公司),三气培养箱、HM-325E 病理组织切片机和全自动组织脱水机(美国Thermo Fisher Scientific 公司),BX54MRF-S 光学显微镜(日本 Olympus Corporation 公司),DMT620M四通道离体微血管张力测定系统(上海佰晔生物科技中心),557040 型号小动物呼吸机、Table Top 小动物麻醉机、Germinator 500 干式消毒器和小鼠心梗手术器械等(美国Harvard Bioscience公司),全能型成像分析系统、1658033型号电泳和蛋白免疫印迹系统(美国BIO-RAD 公司)。
1.2 薏苡附子散制备薏苡附子散按《金匮要略》中原方配伍薏苡仁∶黑顺片=1∶1,成人用量3 g·d-1。本研究依据普通成人(体质量70 kg)的临床用量和动物与人之间的等效剂量换算公式将颗粒剂制成低、中和高剂量(0.2 g·mL-1、0.4 g·mL-1和0.8 g·mL-1)药液,中剂量薏苡附子散由成人用量换算。将薏苡仁颗粒剂和黑顺片颗粒剂以1∶1 的剂量溶解于超纯水中,3 000 r·min-1离心5 min 后取上清液。
1.3 小鼠AMI 模型制备、分组和给药60 只8 周龄SPF 级雄性C57BL/6J 小鼠适应性喂养7 d 后,随机分为空白组、假手术组、AMI 组和低、中及高剂量薏苡附子散组,每组10 只。空白组小鼠按正常条件饲养,假手术组小鼠行开胸穿线不结扎冠状动脉左前降支(left anterior descending coronary artery,LAD),其余4 组小鼠采用于左心耳下缘1 mm 结扎LAD 的方法建立AMI 模型[10],肉眼观察小鼠心脏结扎处远端心室壁由红润变苍白,采用监测系统监测并记录各组小鼠心电图,心电图显示ST 段抬高,判断为造模成功[10]。除空白组外,其余各组小鼠给药前30 min 均采用腹腔注射L-NAME 抑制小鼠体内eNOS 蛋白表达,剂量为20 mg·kg-1,Western blotting 法检测小鼠心肌组织中eNOS 蛋白表达水平,eNOS 蛋白表达受抑制证明L-精氨酸-NO 通路阻滞[11]。低、中和高剂量薏苡附子散组小鼠分别给予不同浓度薏苡附子散药液,其余各组小鼠给予生理盐水,每只小鼠200 μL·d-1,灌胃给药。AMI 模型小鼠建立成功当天为给药第1 天,总给药时间为28 d。
1.4 含药血清制备、HCAECs培养和分组40只8 周龄的SPF 级雄性C57BL/6J 小鼠随机分为生理盐水组和低、中及高剂量薏苡附子散组,每组10 只。各组分别取5 只小鼠,分别使用生理盐水和低、中及高剂量薏苡附子散灌胃给药干预小鼠28 d,每只小鼠200 μL·d-1。末次给药1 h 后,经异氟烷气体过量麻醉各组小鼠,采用眼眶取血法取各组小鼠血清,灭活除菌备用。
6 次传代后,将HCAECs 以每孔2×105个细胞的密度接种至6 孔细胞培养板中。采用含10%胎牛血清DEME 培养基在37 ℃、5% CO2培养箱中培养。细胞分为空白组、缺氧组、缺氧+低剂量薏苡附子散组、缺氧+中剂量薏苡附子散组和缺氧+高剂量薏苡附子散组,每组设3 个复孔。除空白组外,其余各组HCAECs 于三气培养箱中低氧条件下培养 24 h,建立细胞缺氧模型,并与100 μmol·L-1L-NAME 共同孵育。采用含10% 生理盐水组小鼠血清的DEME 培养基干预空白组和缺氧组细胞,含10% 低、中和高剂量薏苡附子散组小鼠血清的DEME 培养基分别干预“1.3”步骤中培养缺氧+不同剂量薏苡附子散组细胞,空白组在正常条件下培养,其余各组继续在低氧状态下培养24 h。
1.5 动脉张力检测法检测各组小鼠离体胸主动脉血管张力和舒张率采用多通道微血管张力测定仪检测小鼠胸主动脉张力。各组分别取5只小鼠,根据TANG等[12]的方法剥离各组实验小鼠内皮完整的胸主动脉,在含有各组小鼠胸主动脉的浴槽内加入终浓度为100 μmol·L-1L-NAME共同孵育20 min,并加入10-6mol·L-1去甲肾上腺素(norepinephrine,NE)进行预收缩,待收缩稳定后各组分别加入200 μL 生理盐水和200 μL 低、中及高剂量薏苡附子散药液进行干预,记录各组小鼠胸主动脉张力值。待收缩平稳后记录为最大张力值,药液干预后,胸主动脉张力趋于稳定记录为药液张力值。舒张率= (胸主动脉收缩最大张力值-药液张力值)/(胸主动脉收缩最大张力值-基础平衡张力值)×100%。
1.6 总NO 检测试剂盒检测各组小鼠血清中NO水平每50 μL 样本中加入室温状态Griess Reagent Ⅰ和Griess Reagent Ⅱ,37 ℃条件下反应30 min,于波长540 nm 处测定各组小鼠血清中吸光度(A)值。绘制标准品曲线计算各组小鼠血清中NO 水平,单位为μmol·L-1。
1.7 TTC 染色和HE 染色观察各组小鼠心肌组织缺血面积和心肌组织病理形态表现各组随机选取5 份小鼠心脏组织样本,急冻后垂直于心脏长轴将其均匀切分为2~3 mm 切片,将切片浸入2% TTC溶液中。37 ℃中避光反应30 min,期间翻转切片2 次使染色均匀。随即取出切片,放入4%多聚甲醛中室温固定过夜后第2 天取出观察并拍照记录。心肌组织缺血区域呈灰白色,正常组织呈红色,计算各组小鼠心肌组织缺血面积百分率。心肌组织缺血面积百分率=心肌组织缺血面积/心脏切片面积×100%。
各组随机选取5 份心脏组织样本,浸入4%多聚甲醛通用型组织固定液中固定24 h。根据郭玉洪等[13]的方法将固定好的组织放入标记好的包埋框中于自动脱水机中脱水、透明和浸蜡。洗涤过的样品被处理并包埋于石蜡中。切割为4 μm 厚的石蜡切片,HE 染色后置于显微镜下观察并拍照记录,观察各组小鼠心肌组织病理形态表现。
1.8 观察各组小鼠存活情况每天08:00、14:00 和20:00 对所有实验小鼠进行3 次观察,直至观察到小鼠自然死亡或生存至28 d,记录小鼠的一般情况及死亡情况。
1.9 Griess 实验检测各组HCAECs 中NO 水平
取“1.4”步骤中干预处理后的细胞,弃原培养基,对各组细胞进行裂解后取其上清液,采用Griess 反应测定细胞中NO 水平。每组100 μL 细胞上清样品和100 μL Griess 试剂于室温条件下反应30 min 后,采用酶标仪于波长540 nm 处测量各样本A 值。根据NaNO2绘制标准曲线并计算各组细胞中NO 水平,单位为mmol·L-1。
1.10 荧光染色法检测各组HCAECs 中MMP水平取“1.4”步骤中干预处理后的细胞,弃原培养基,采用PBS 缓冲液清洗后制备1×TMRM工作液,避光孵育各组细胞30 min,PBS 缓冲液清洗3 次后加入DAPI 染核常温孵育10 min。采用倒置荧光生物显微镜于波长548 和474 nm 处进行观察并拍照。TMRM 在正常细胞中产生红色荧光,采用Image J 测量红色荧光强度,以红色荧光强度代表各组细胞中MMP 水平。
1.11 荧光染色法检测各组HCAECs中ROS水平取“1.4”步骤中干预处理后的细胞,弃原培养基,采用PBS 缓冲液清洗后制备5 μmol·L-1MitoSOXTMRed 试剂工作液,避光孵育细胞10 min,PBS 缓冲液清洗3 次后DAPI 染核,采用倒置荧光生物显微镜于波长510 和480 nm 处进行观察并拍照,ROS 在缺氧状态的细胞线粒体中产生红色荧光,采用Image J 测量红色荧光强度,以红色荧光强度代表各组细胞中ROS 水平。
1.12 统计学分析采用Graphpad 8.0.2 软件进行统计学分析。各组小鼠心肌组织中eNOS 蛋白表达水平、离体胸主动脉血管张力和舒张率、血清中NO 水平及心肌组织缺血面积百分率,各组HCAECs 中NO 水平、MMP 及ROS 水平均符合正态分布,以±s 表示,采用Graphpad 8.0.2 软件绘制小鼠生存曲线,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 AMI 模型小鼠心电图各组小鼠在建立AMI模型前生命体征均正常,心电图结果显示为正常心电图。建立AMI 模型后小鼠心电图结果显示:ST段较造模前明显抬高。
2.2 各组小鼠心肌组织中eNOS 蛋白表达水平与空白组比较,注射L-NAME 后假手术组、AMI组和低、中及高剂量薏苡附子散组小鼠心肌组织中eNOS 蛋白表达水平降低(P<0.05)。eNOS 抑制剂L-NAME 抑制了体内依赖eNOS 蛋白生成NO 的经典途径。见图1。

图1 各组小鼠心肌组织中eNOS 蛋白表达电泳图(A)和直条图(B)Fig.1 Electrophoregram (A) and histogram (B) of expressions of eNOS protein in myocardium tissue of mice in various groups
2.3 各组小鼠离体胸主动脉血管张力和舒张率与生理盐水组比较,低、中和高剂量薏苡附子散组小鼠胸主动脉血管舒张率升高(P<0.05)。见图2 和3。
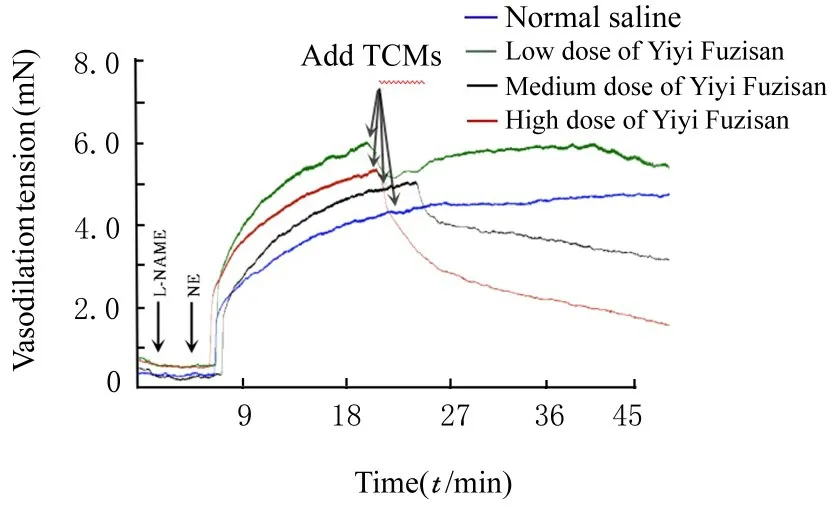
图2 各组小鼠胸主动脉血管张力Fig.2 Vascular tensions of thoracic aorta of mice in various groups

图3 各组小鼠胸主动脉血管舒张率Fig.3 Relaxation rates of thoracic aorta of mice in various groups
2.4 各组小鼠血清中NO水平 与空白组和假手术组比较,AMI 组小鼠血清中NO 水平降低(P<0.05),高剂量薏苡附子散组小鼠血清中NO 水平升高(P<0.05),低和中剂量薏苡附子散组小鼠血清中NO 水平差异无统计学意义(P>0.05)。与AMI 组比较,低、中和高剂量薏苡附子散组小鼠血清中NO 水平升高(P<0.05)。见图4。

图4 各组小鼠血清中NO 水平Fig.4 Levels of NO in serum of mice in various groups
2.5 各组小鼠心肌组织缺血面积和心肌组织病理形态表现TTC 染色结果显示:与空白组和假手术组比较,AMI 组和低、中及高剂量薏苡附子散组小鼠心肌组织均有不同程度的心肌缺血。与AMI 组比较,低、中和高剂量薏苡附子散组小鼠心肌组织缺血面积减少,心肌组织缺血面积百分率降低(P<0.05)。见图5 和6。HE 染色结果显示:在光镜下观察,空白组和假手术组小鼠心肌细胞排列整齐,胞核清晰完整,大小均匀,未见炎性细胞浸润;AMI 组具有明显的心肌组织损伤,心肌细胞排列紊乱、破裂坏死,有炎性细胞浸润;低、中和高剂量薏苡附子散组可见心肌组织病理性损伤恢复。见图7。

图5 TTC 染色观察各组小鼠心肌组织缺血面积Fig.5 Ischemia areas of myocardium tissue of mice in various groups detected by TTC staining

图6 各组小鼠心肌组织缺血面积百分率Fig.6 Percentage of ischemia areas of myocardium tissue of mice in various groups

图7 各组小鼠心肌组织病理形态表现(HE,×300)Fig.7 Pathomorphology of myocardium tissue of mice in various groups(HE,×300)
2.6 各组小鼠术后生存率药物干预第28 天,空白组和假手术组小鼠生存率为100%。与AMI 组比较,低、中和高剂量薏苡附子散组小鼠生存率升高(χ2=15.03,P=0.010 2)。见图8。

图8 各组小鼠术后生存率Fig.8 Survival rates of mice in various groups after operation
2.7 各组HCAECs 中NO 水平与空白组比较,缺氧组和缺氧+低剂量薏苡附子散组HEAECs 中NO 水平降低(P<0.05),缺氧+中剂量薏苡附子散组和缺氧+高剂量薏苡附子散组HEAECs 中NO水平差异无统计学意义(P>0.05)。与缺氧组比较,缺氧+中剂量薏苡附子散组和缺氧+高剂量薏苡附子散组HCAECs 中NO 水平升高(P<0.05)。见图9。
2.8 各组HCAECs 中MMP 水平与空白组比较,缺氧组、缺氧+低剂量薏苡附子散组和缺氧+中剂量薏苡附子散组HCAECs 中MMP 水平降低(P<0.05)。与缺氧组比较,缺氧+中剂量薏苡附子散组和缺氧+高剂量薏苡附子散组HCAECs 中MMP水平升高(P<0.05)。见图10。

图10 各组HCAECs 中 MMP 水平Fig.10 Levels of MMP in HCAECs in various groups
2.9 各组HCAECs 中ROS 水平与空白组比较,缺氧组、缺氧+低剂量薏苡附子散组和缺氧+中剂量薏苡附子散组HCAECs 中ROS 水平升高(P<0.05)。与缺氧组比较,缺氧+低剂量薏苡附子散组、缺氧+中剂量薏苡附子散组和缺氧+高剂量薏苡附子散组HCAECs 中ROS 水平降低(P<0.05)。见图11。

图11 各组HCAECs 中ROS 水平Fig.11 Levels of ROS in HCAECs in various groups
3 讨 论
薏苡附子散药方出自于东汉《金匮要略》[14],由薏苡仁和附子2 味药物组成。薏苡仁具有抗氧化、降血压和调节糖脂代谢等药理作用。附子为“回阳救逆”第一要药,具有清除ROS、抑制心肌细胞凋亡、强心镇痛及舒张血管的药理作用,其舒张血管的作用可能与血管内皮释放NO 有关联[15]。本研究结果显示:薏苡附子散减少了小鼠心肌组织缺血面积,改善小鼠心肌组织损伤,提高小鼠心肌组织缺血后的存活率,可以有效改善小鼠心肌缺血;薏苡附子散可以明显舒张小鼠离体胸主动脉,提示其可以通过舒张血管发挥其治疗心肌缺血的作用。
内皮功能正常是维持血管稳态的重要因素,通过释放NO 和血管紧张素Ⅱ等旁分泌因子参与维持血管稳态[18]。氧化应激导致血管内皮功能障碍,NO 生物利用度下降,引起血管收缩和促血栓形成等不良心血管反应,缺血时会产生大量ROS,引起内皮细胞氧化应激损伤,导致内皮功能失衡[18-19]。线粒体是细胞中产生ROS 的主要细胞器,也是缺血性损伤的主要靶点,MMP 水平降低导致线粒体三磷酸腺苷合成减少,线粒体功能障碍在内皮功能障碍引起的缺血性心血管疾病中也同样起决定性作用[20-22]。研究[22-23]显示:氧化应激失调促进细胞中线粒体凋亡,改善氧化应激状态,维持MMP 水平,减少ROS生成,上调NO水平,可以有效地改善血管内皮功能,治疗缺血性心血管疾病。
研究[9,24]发现:薏苡附子散的主要成分作用于代谢酶-神经酰胺,参与细胞周期、细胞凋亡、抗炎及调节细胞氧化应激,从而发挥治疗心血管疾病的作用。CAD 心肌缺血患者心肌组织处于缺血缺氧状态,在缺氧条件下,体内依赖eNOS 蛋白生成NO 的经典途径L-精氨酸-NO 途径受到抑制[16-17]。本研究结果显示:薏苡附子散升高AMI模型小鼠心肌组织和缺氧HEAECs 中NO 水平,升高HEAECs 中MMP 水平并抑制了ROS 的生成,表明薏苡附子散可以上调NO 水平,改善线粒体功能,调节氧化应激,改善血管内皮功能障碍,这是薏苡附子散治疗心肌缺血的作用机制之一。
综上所述,薏苡附子散可以上调心肌组织中NO 水平,舒张血管,恢复MMP,改善线粒体功能障碍,调节氧化应激,抑制ROS 的生成,改善血管内皮功能障碍,从而发挥治疗心肌缺血的作用。
