山丹茎尖玻璃化超低温保存技术体系的建立1)
2023-07-10王琦朱梦婷刘燕张玲玲
王琦 朱梦婷 刘燕 张玲玲
(北京林业大学,北京,10083) (南京农业大学)
山丹(LiliumpumilumDC.),又称细叶百合,为百合科百合属多年生草本,原产于中国北部、东西伯利亚、朝鲜、韩国和蒙古[1],自然分布于海拔400~2 600 m的山地、草坡或裸露的岩石间[2-3]。其生性强健,适应性强,耐寒、耐热、耐半阴,尤其具有很强的抗旱性,在百合抗性育种中起着重要的作用[4]。
目前,由于过度放牧、采集以及对自然栖息地的破坏,山丹种质资源正面临灭绝的风险[5]。山丹种质资源的保存方法有迁地保存和离体保存2种方式[6]。车飞[7]将陕西秦巴山区的山丹引种到杨陵西北农林科技大学园艺场百合资源圃后进行迁地保存;Zhang et al.[8]对山丹的体细胞胚胎和不定芽进行了组织培养离体保存。然而,迁地保存容易受到外界环境影响,不适用于种质资源长期保存。组培物离体保存需要多次继代,投入大量的人力和物力,同时植物材料存在着遗传变异的风险,因此离体保存也不能实现种质资源的长期保存[9]。本研究旨在建立山丹种质资源的超低温保存体系,实现对其种质资源的长期保存。
超低温保存是1种利用液氮低温(-196 ℃或-165~-190 ℃液氮蒸气)对种质资源进行长期保存的理想方法[10]。在这种极端低温条件下,植物细胞的新陈代谢基本停止,因此植物材料可以被长期保存[11-12]。其中玻璃化法较适合组培物的超低温保存[13]。玻璃化法是指利用高浓度且黏稠的冷冻保护剂对植物细胞进行渗透脱水,当温度降低至极端温度时,植物细胞就会转化为无定形的玻璃化结构,而不会受到冰晶损伤[14]。由于玻璃化法操作简便,冻存率高,适应性广,因此得到了广泛应用[15]。目前已有200多种植物的体细胞胚、愈伤组织、悬浮细胞、原生质体、茎尖等实现了玻璃化法超低温保存[10]。在实现超低温保存的植物材料中,茎尖通常比细胞悬浮液和愈伤组织更适合保存遗传资源,因为茎尖具有更高水平的遗传稳定性,其生长发育成的植株与原始植株完全相同[16-17]。
百合属植物茎尖玻璃化超低温保存研究始于20世纪90年代,Matsumoto et al.[18]首先建立了日本百合(Liliumjaponicum)茎尖的玻璃化超低温保存体系,再生率达到80%,并在5个东方百合(LiliumOriental hybrids)品种中成功应用,再生率为40%~85%。Bouman et al.[19]对3个东方百合品种、2个亚洲百合(LiliumAsiatic hybrids)品种及麝香百合(Liliumlongiflorum)等进行了玻璃化超低温保存,存活率由5%到93%不等。随后,卷丹百合(Liliumlancifolium)[6,20]、东方百合‘西伯利亚’(LiliumOriental hybrids ‘Siberia’)[20-21]等也实现了玻璃化超低温保存。然而,目前实现玻璃化超低温保存的百合属植物种类依然很少,且不同种或品种的百合属植物超低温保存后的存活率和再生率差异很大。因此,对不同百合属植物建立特异性的玻璃化超低温保存体系是很有必要的。
本研究以山丹无菌苗茎尖为试验材料,建立玻璃化超低温保存基本程序。在此基础上,对预培养蔗糖浓度、预培养时间、装载时间、脱水时间等步骤进行优化,建立最佳的超低温保存技术程序,实现其种质资源的长期保存。
1 材料与方法
超低温保存试验材料为继代2~4次的山丹无菌苗茎尖。山丹初代无菌苗由北京林业大学国家花卉工程研究中心提供。以初代无菌苗鳞片为外植体材料进行组织培养,获得第2~4代山丹无菌苗。
山丹无菌苗的组织培养:山丹组织培养参照Zhang et al.[8]的方法,并加以优化。将山丹初代无菌苗鳞片接种于诱导培养基(MS培养基+6-苄氨基嘌呤(6-BA)2.0 mg/L+萘乙酸(NAA)0.2 mg/L+蔗糖3%+琼脂0.6%)上,诱导形成小鳞茎。随后将诱导出的小鳞茎转移至生根培养基(MS培养基+蔗糖3%+琼脂0.6%)中诱导生根,获得第2代山丹组培苗。之后每2个月取山丹组培苗鳞片继代1次,分别获得第3代、第4代山丹组培苗。
山丹茎尖玻璃化超低温保存基本程序:在课题组前期研究基础上,结合相关文献查阅和预试验,设计基本玻璃化超低温保存程序。
(1)预培养:取苗龄2个月左右、继代2次的山丹无菌苗,剥除外层鳞片,仅保留贴近茎尖的1~2层鳞片,接种至含有0.3 mol/L蔗糖的MS培养基上,4 ℃、黑暗条件预培养4 d。
(2)装载处理:在超净台体视显微镜下切取长2 mm左右的山丹茎尖,将其放在装有1 mL装载溶液(MS培养基+蔗糖0.4 mol/L+丙三醇2 mol/L)的1.5 mL离心管中,25 ℃处理20 min。
(3)保护剂溶液处理:吸去装载溶液,加入预冷的保护剂溶液(PVS2溶液:MS培养基+蔗糖0.4 mol/L+丙三醇30%+乙二醇15%+二甲基亚砜(DMSO)15%),0 ℃处理100 min。
(4)冷冻:PVS2溶液处理后,更换新鲜的PVS2溶液,将冷冻离心管迅速投入液氮保存。
(5)化冻:从液氮中取出装有茎尖的离心管,37 ℃水浴快速化冻60 s。
(6)去装载处理:吸去PVS2溶液,25 ℃条件用去装载溶液(MS培养基+蔗糖1.2 mol/L)分2次清洗,每次10 min,共20 min。
(7)存活率测定:采用2,3,5-三苯基氯化四氮唑(TTC)染色法测定细胞活力。将去装载后的茎尖,移入装有4 g/L的TTC溶液的离心管中,37 ℃、黑暗条件水浴处理30 min。
存活率=(被染至红色的茎尖个数/所有经TTC处理的茎尖个数)×100%。
(8)再生率测定:选择存活率最高的处理组,将冻存后的茎尖接种到恢复培养基(MS培养基+蔗糖3%+琼脂0.6%)上,暗培养1周后,茎尖由白色逐渐变为绿色,且长度明显增长,暗培养2周后,转到正常光照条件恢复培养,并统计再生率。
再生率=(再生茎尖数/化冻茎尖总数)×100%。
山丹茎尖玻璃化超低温保存技术程序优化:在已设定的玻璃化超低温保存程序基础上,采用单因素试验的方法对该保存程序进行优化。
(1)预培养时间和蔗糖浓度的筛选:设置预培养时间为1、4、7、10、13 d,共5个处理;预培养基蔗糖浓度为0、0.1、0.3、0.5、0.7 mol/L,共5个处理,其余步骤同“山丹茎尖玻璃化超低温保存基本程序”。
(2)装载溶液处理时间的筛选:设置装载溶液处理时间为0、20、40、60、80 min,共5个处理。预培养时间和蔗糖浓度为步骤(1)筛选出的最佳结果,其余步骤同“山丹茎尖玻璃化超低温保存基本程序”。
(3)PVS2溶液处理时间的筛选:设置PVS2溶液处理时间为40、60、80、100、120 min,共5个处理。预培养时间、预培养蔗糖浓度、装载处理时间为步骤(1)和步骤(2)筛选出的最佳结果,其余步骤同“山丹茎尖玻璃化超低温保存基本程序”。
每个处理取10个茎尖,重复3次。
不同代次组培苗茎尖超低温保存效果对比:对2代、3代、4代山丹组培苗茎尖分别进行玻璃化超低温保存,并对各代茎尖存活率进行比较,保存程序为“山丹茎尖玻璃化超低温保存技术程序优化”筛选出的最佳保存程序。
数据处理:使用Excel软件进行数据整理,用SPSS 26.0数据分析软件进行单因素方差分析和最小显著差异法(LSD)多重比较。
2 结果与分析
2.1 山丹无菌苗组织培养体系的建立
以山丹无菌苗的鳞片(图1A)为外植体材料,接种于诱导培养基(图1B)上。1个月左右,鳞片上有芽点形成(图1C),之后芽点逐渐发育成小鳞茎(图1D),将小鳞茎从鳞片上切取,转移至生根培养基上(图1E),15 d左右生根(图1F)。

A为山丹无菌苗鳞片;B为接种于诱导培养基的山丹鳞片;C为山丹鳞片诱导出芽点;D为不定芽逐渐发育成小鳞茎;E为接种于生根培养基的小鳞茎;F为小鳞茎生根。
2.2 预培养对山丹茎尖玻璃化法超低温保存存活率的影响
预培养是超低温保存的首要步骤,它可以对植物材料进行一段时间的冷锻炼和高糖培养基培养,初步降低植物内部组织的含水量,以增强植物材料的抗冻能力和抗脱水能力,有利于后期玻璃化状态的形成。
由表1可知,经过蔗糖预培养处理过的山丹茎尖超低温保存存活率显著高于对照组(P<0.05),且随着预培养培养基中蔗糖浓度的增加,茎尖存活率逐渐上升。当预培养蔗糖浓度为0.5 mol/L时,茎尖存活率达到最大,为68.89%,之后降低,但预培养蔗糖浓度为0.1、0.3、0.5、0.7 mol/L时,茎尖存活率之间差异不显著。后续试验选用0.5 mol/L蔗糖浓度作为预培养蔗糖浓度。
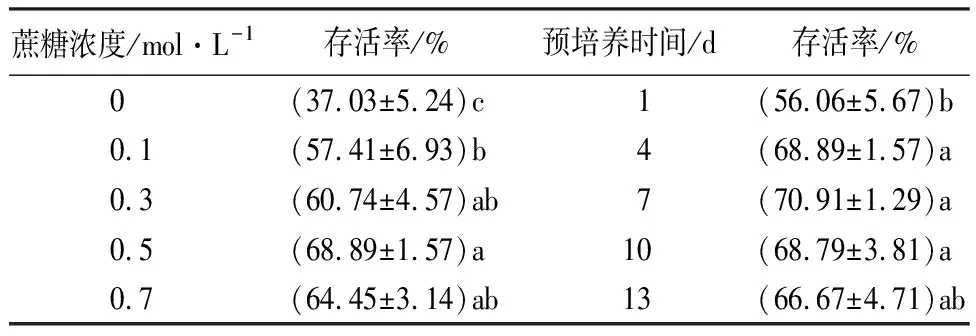
表1 不同预培养条件的山丹茎尖超低温保存后的茎尖存活率
预培养时间也对山丹茎尖超低温保存存活率有较大影响。随着预培养时间的增加,茎尖超低温保存存活率逐渐提高,培养7 d时存活率最高,达70.91%,但预培养4、7、10、13 d,茎尖存活率之间差异不显著。预培养时间选用7 d。
2.3 装载处理时间对山丹茎尖玻璃化法超低温保存存活率的影响
经过预培养的材料需要用装载液进行装载,以实现保护性渗透脱水。由表2可知,当装载时间为20 min时,山丹茎尖超低温保存存活率显著提高(P<0.05),茎尖存活率达到最大值,为70.91%。装载时间超过20 min时,存活率开始下降,装载处理20、40、60、80 min,茎尖存活率无显著差异。试验装载处理适宜时间为20 min。

表2 不同装载时间和脱水时间的山丹茎尖超低温保存后的茎尖存活率
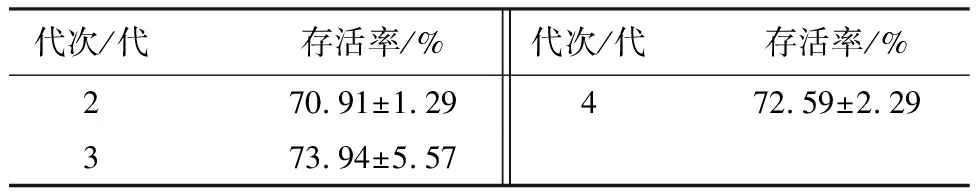
表3 不同代次的山丹茎尖超低温保存后茎尖存活率
2.4 PVS2溶液处理时间对山丹茎尖玻璃化法超低温保存存活率的影响
PVS2溶液处理是超低温保存的关键步骤之一。经过高浓度的PVS2溶液处理,可显著降低植物细胞内自由水的质量分数,当温度快速降低时,植物细胞会形成无定形的玻璃化结构,从而避免冰晶损伤。
由表2可知,PVS2溶液处理时间可以显著影响超低温保存后山丹茎尖的存活率(P<0.05)。PVS2溶液在0 ℃冰浴上处理40和60 min时,茎尖存活率无显著变化;但时间延长至80 min时,茎尖存活率开始显著提高(P<0.05),100 min时达到最高存活率,为71.82%,但与处理80 min时无显著差异。因此,为降低PVS2溶液对山丹茎尖的毒害作用,选择PVS2溶液处理时间为80 min。
2.5 材料代次对山丹茎尖玻璃化法超低温保存存活率的影响
液氮保存材料的生理状态对保存效果有明显影响,不同代次的材料生理活性可能有差异。使用代次2、3、4代的山丹无菌苗茎尖进行超低温保存,其存活率无显著差异,说明代次2、3、4代材料对山丹茎尖超低温保存后的存活率无显著影响。
2.6 茎尖恢复培养与植株再生
经超低温保存后的茎尖接种于恢复培养基上(图2B),暗培养1周后,成活茎尖转为绿色(图2C),死亡茎尖表现为褐色(图2D);暗培养2周后,统计山丹茎尖再生率,可达51.85%,且观察到成活的茎尖有明显的伸长(图2E);将其转瓶至正常光照条件培养,2个月后可发育成完整植株(图2F)。

A为用于超低温保存的山丹茎尖;B为超低温保存后接种于恢复培养基的山丹茎尖;C为超低温保存后存活的山丹茎尖;D为超低温保存后死亡的山丹茎尖;E为超低温保存后暗培养2周的山丹茎尖;F为超低温保存后培养2个月的山丹茎尖。
3 结论与讨论
玻璃化超低温保存技术是目前应用最广泛的植物种质资源长期保存的方法[10],其保存步骤通常包括预培养、装载溶液处理、PVS2溶液脱水处理、液氮冷冻-解冻、洗涤和恢复培养等。因此,其保存效果受到多种因素的影响,如预培养培养基中蔗糖浓度高低、各处理步骤的时间长短等。
预培养是超低温保存过程中的关键步骤,在预培养阶段,对植物材料进行冷锻炼和高糖培养基培养,可以有效增强其对低温和渗透的抗性[22]。预培养培养基中添加的糖类主要为蔗糖,因为蔗糖可以很好地保护膜脂结构,同时在低温条件时稳定蛋白质[13]。已有研究表明,预培养培养基蔗糖浓度为0.3~0.7 mol/L、预培养时间为1~5 d的处理方式对超低温保存是较为有效的,且蔗糖浓度多为0.3 mol/L[23]。已经报道的实现超低温保存的百合属植物卷丹百合[6,20]、麝香百合[20]等,预培养蔗糖适宜浓度均为0.3 mol/L。而Yin et al.[21]将东方百合‘西伯利亚’接种于蔗糖浓度为0.5 mol/L的预培养基中培养1 d,获得了最佳存活率。本研究结果表明,在4 ℃时,将山丹茎尖接种于蔗糖浓度为0.3~0.5 mol/L的MS培养基中预培养,茎尖超低温保存后,存活率无显著差异,预培养蔗糖浓度为0.5 mol/L时,茎尖获得最高存活率。
在用高浓度的PVS2溶液对植物材料进行脱水之前,需要用含有甘油和蔗糖的装载溶液对植物材料进行保护性渗透脱水,否则预培养处理后的植物材料无法忍受高浓度PVS2溶液引起的强烈渗透压冲击[24]。不同物种的装载溶液处理时间不同,大多处理时间为20 min[25]。相关研究表明,装载时间对东方百合茎尖存活率有较大影响,装载20 min可以获得最佳的东方百合茎尖耐脱水和冷冻能力[21];而装载时间为20~40 min时,对麝香百合和卷丹百合的茎尖超低温保存存活率无显著影响[20]。本研究结果表明,装载时间对山丹茎尖冻后存活率有显著影响(P<0.05),装载处理最佳时间为20 min。
玻璃化法超低温保存能否成功主要取决于材料在低温状态时是否变为玻璃化状态,而PVS2脱水处理时间的长短则是材料能否实现玻璃化的关键。处理时间过短,植物材料未充分脱水,无法形成玻璃化状态;处理时间过长,植物材料容易受到化学毒害作用[26]。不同百合属植物超低温保存,PVS2处理时间存在较大差异,如卷丹的PVS2脱水适宜时间为90~120 min[6,20],东方百合则需要3~4 h的PVS2脱水处理,超低温保存效果最佳[21]。本研究中,经过预培养和装载处理后,山丹茎尖需要在PVS2溶液中脱水处理80~100 min,达到最佳冻存效果。为减少PVS2溶液对材料的毒害作用,应尽可能减少材料在PVS2溶液中的处理时间,因此,本研究选择PVS2最佳处理时间为80 min。
组培苗在长期的继代培养过程中,其生理生化水平可能会发生变化,进而对超低温保存效果产生影响。沈琛等[27]研究表明,卷丹继代1~4次的试管苗,茎尖超低温保存存活率具有显著差异,2代试管苗存活率显著高于其他3代。而不同继代次数对扶芳藤(Euonymusfortunei(Turcz.) Hand.-Mazz.)茎尖玻璃化超低温保存的成活率影响不大[28]。本研究结果表明,继代次数为2~4次的山丹茎尖玻璃化法超低温保存的成活率无显著差异。但离体培养时间过长,继代次数过多可能导致遗传变异的发生[9],因此,应避免对继代次数过多的组培物进行超低温保存。
本研究建立了最佳的山丹茎尖玻璃化超低温保存技术程序,该体系可获得70.91%的茎尖存活率和51.85%的再生率,为山丹种质资源提供了简单易行、高效的长期保存方法。
