背外侧前额叶在安慰剂效应中的作用:社会情绪调节研究*
2023-07-08李宜伟张丹丹
王 妹 程 思 李宜伟 李 红 张丹丹,3
背外侧前额叶在安慰剂效应中的作用:社会情绪调节研究*
王 妹1,2程 思2李宜伟1李 红1张丹丹1,3
(1四川师范大学脑与心理科学研究院, 成都 610066) (2深圳大学心理学院/磁共振成像中心, 深圳 518060) (3深港脑科学创新研究院, 深圳 518055)
为考察安慰剂效应在情绪调节中的脑机制, 本研究以社会排斥图片为情绪诱发材料诱发社会疼痛, 采用经颅磁刺激技术(transcranial magnetic stimulation, TMS)激活背外侧前额叶(dorsolateral prefrontal cortex, DLPFC), 并使用事件相关电位观测TMS对安慰剂下调社会疼痛的影响。实验以“TMS组别” (DLPFC组、控制组)为被试间变量, “安慰剂条件” (安慰剂、非安慰剂)为被试内因素。结果发现, DLPFC组(= 50)比控制组(= 50)在安慰剂条件下报告的负性情绪更弱, 反映情绪体验强度的晚正成分的波幅也更低, 上述组间差异在非安慰剂条件不显著。结果还表明, DLPFC组比控制组更相信安慰剂的效果, 愿意花更多的钱来购买安慰剂。此外相关结果发现, 由DLPFC激活导致的安慰剂效应增强可有效降低社交焦虑倾向被试的负性社会情绪。本研究是结合脑调控和脑观测技术探讨安慰剂情绪调节脑机制的首次尝试, 研究发现不但揭示了DLPFC在安慰剂调节情绪过程中的重要因果作用, 还为临床治疗以情绪失调为主要症状的抑郁焦虑等精神障碍患者提供了脑调控干预的可行性脑靶点。
背外侧前额叶, 安慰剂效应, 社会疼痛, 社会排斥, 情绪调节, 经颅磁刺激
1 引言
近年在新冠疫情影响下, 亲友离世或分离、居家隔离、失业等负性社会事件频发, 人们出现焦虑不安、抑郁失落等不良心理反应的频率增高(Brooks et al., 2020; Holt-Lunstad, 2021)。这些负性事件会给我们带来类似于生理疼痛的负性情绪体验, 这种感受被称为“社会疼痛” (social pain)。由人际关系遭到破坏或人际交往问题导致的社会疼痛是抑郁、焦虑等情绪失调和情绪障碍的重要诱发因素(Durodié & Wainwright, 2019; Lau & Waters, 2017; Xiang et al., 2020)。社会疼痛的缓解方式包括主动的情绪调节和自动化的情绪调节。主动情绪调节是指个体根据情绪调节目标有意识地改变情绪, 而自动化情绪调节指个体受到目标驱动对情绪反应进行的无意识地改变(Braunstein et al., 2017)。在主动情绪调节方面, 已经有大量研究积累了较丰富的认知和脑机制知识, 例如先前围绕着认知重评和分心策略进行的社会疼痛情绪调节研究(He et al., 2018, 2020; Li et al.,2022; Zhao et al., 2021)。与主动情绪调节相比, 自动化情绪调节不涉及自上而下的控制过程(Braunstein et al., 2017), 能在较少消耗认知资源的情况下调节负性情绪(Yuan et al., 2022)。然而目前采用自动化方法下调情绪的实证性研究还非常少, 因此这是本研究的考察重点。揭示自动化情绪调节的认知神经机制, 不仅能从理论上丰富情绪调节的理论体系, 还能从临床上指导治疗以情绪调节障碍为核心症状的神经和精神疾病患者, 改善他们的情绪和心境。
安慰剂是一种效果良好的、无副作用的自动化情绪调节方法(Braunstein et al., 2017; Ellingsen et al.,2013; Wager et al., 2004)。安慰剂效应(placebo effect)指:个体接受惰性物质或程序的治疗并对自身状况产生积极预期, 从而使症状得到缓解的过程(Colloca & Barsky, 2020)。根据情绪调节的目标的性质(外显和内隐)以及情绪改变过程的性质(自动化和控制化)这两个维度, 可以将情绪调节分为四类(Braunstein et al., 2017)。安慰剂效应是指个体明确相信“所接受的治疗能有效地改善情绪”的预期, 但情绪调节的过程无需主动控制功能参与(Wager & Atlas, 2015), 因此属于外显、自动化的情绪调节方式。大量的临床研究表明, 安慰剂可节约治疗成本, 缓解临床症状, 尤其在疼痛、帕金森病、焦虑症和抑郁症的治疗中发挥了明显疗效(Price et al., 2008; Wager & Atlas, 2015)。目前最常用的安慰剂效应的诱发方式之一是通过“预期”建立安慰剂镇痛或情绪调节的目标(Colloca & Barsky, 2020)。预期指虽然病患或被试接受的治疗是没有实际治疗效果的, 但医师或实验者却告知他们正在接受的治疗可有效镇痛或者调节负性情绪, 从而使病患或被试建立所接受的治疗(实际是安慰剂)能镇痛或调节情绪的预期信念(Meyer et al., 2015, 2018; Schienle et al., 2014)。例如, 在镇痛领域, Wager等(2004)在实验前告知被试将参与一项新型镇痛药膏(实际上是安慰剂)的脑机制研究, 结果发现, “镇痛药膏”实验组被试的疼痛感受主观评分明显降低。又如在情绪调节领域, Schienle等(2014)让恶心敏感度高的被试在服用了“可减少恶心症状”的口服药丸(实际上是安慰剂)之后再观看厌恶图片, 结果发现与控制条件相比, 被试在对安慰剂产生了预期的条件下, 报告的厌恶图片的恶心程度显著下降。
揭示安慰剂效应的神经机制是利用安慰剂效应的重要基础(Ashar et al., 2017)。目前安慰剂神经机制的研究主要在镇痛领域开展, 因为镇痛是安慰剂应用最广、效果最受认可的领域(Colloca, 2019; Fu et al., 2021; Linnman et al., 2018; Tu et al., 2021)。首项研究来自于Wager等(2004)的功能核磁共振成像(functional magnetic resonance imaging, fMRI)研究, 实验包含疼痛预期(疼痛警告线索出现)以及疼痛体验(电击和热痛的施加)两个阶段。结果发现, 在安慰剂镇痛过程中, 背外侧前额叶(dorsal prefrontal cortex, DLPFC)和眶额叶在疼痛预期阶段的激活水平与被试主观报告的疼痛强度以及疼痛体验阶段丘脑、前扣带回和脑岛等疼痛感知脑区的激活水平均呈负相关关系。该研究还发现, 疼痛预期阶段上述前额叶脑区的激活与负责疼痛下行调控的中脑导水管周围灰质(periaqueductal gray, PAG)的激活呈正相关。另外, Lui等(2010)同样发现与非安慰剂条件相比, 安慰剂条件下DLPFC在疼痛施加前的预期阶段激活增加。目前不少证据表明, 双侧DLPFC均参与了安慰剂镇痛过程(Kong et al., 2013; Krummenacher et al., 2010; 见综述Atlas & Wager, 2014)。但也有学者指出, 右侧DLPFC (right DLPFC,rDLPFC)在安慰剂效应中发挥着更关键的作用。例如有研究发现, rDLPFC比左侧DLPFC (left DLPFC,lDLPFC)在安慰剂条件下的激活水平更高(Kong et al., 2007; Lui et al., 2010; Wager et al., 2004)。更进一步的研究发现, rDLPFC主要参与疼痛预期加工(Amanzio et al., 2013), 该脑区的激活与预期的表征和维持相关(Tu et al., 2021)。
目前对安慰剂效应神经机制的了解大多来自神经影像学研究, 这类研究本质上属于相关研究(Ellingsen et al., 2013; Schienle et al., 2014), 而采用神经调控技术提供因果证据的研究目前非常有限(Egorova et al., 2015; Krummenacher et al., 2010; Tu et al., 2021), 我们仅发现了3项(均为镇痛领域的研究)。一项研究发现, 采用低频经颅磁刺激(transcranial magnetic stimulation, TMS)暂时性地抑制双侧DLPFC, 会阻断由预期诱发的安慰剂镇痛效应(Krummenacher et al., 2010)。另两项研究发现, 采用经颅直流电刺激(transcranial direct current stimulation, tDCS)的阳极激活rDLPFC, 能显著提高安慰剂的镇痛效应(Egorova et al., 2015; Tu et al., 2021)。上述研究均表明, rDLPFC是安慰剂镇痛效应的关键脑区(Amanzio et al., 2013; Ashar et al., 2017; Zunhammer et al., 2021)。
与镇痛领域相比, 情绪调节领域的安慰剂研究相对较少, 针对社会疼痛缓解的研究就更少。据我们所知, 目前仅有一项研究探讨了安慰剂对缓解社会疼痛的作用:Koban等(2017)在实验中要求被试观看前男/女友的照片并回忆交往情境, 从而诱发社会疼痛, 发现安慰剂效应伴随DLPFC、腹内侧前额叶、眶额叶等脑区的激活增加, 且rDLPFC的激活水平与安慰剂组的负性社会情绪体验的改善呈正相关, 这提示了rDLPFC在安慰剂降低社会负性情绪中的重要性。除了该社会情绪调节实验, 研究者们在仅有的几项安慰剂对非社会性情绪的调节效应实验中, 同样发现了DLPFC激活与安慰剂效应之间的正相关关系(Benedetti, 2014; Mayberg et al., 2002; Petrovic et al., 2005; Wager & Atlas, 2015)。
安慰剂效应能否在更加一般性的负性社会情境中(不仅限于恋人分手)发挥作用?rDLPFC是否在此自动化情绪调节过程中起到了核心的因果作用?本研究在Koban等(2017)研究发现的基础上, 使用TMS暂时性地激活rDLPFC, 并采用主观情绪报告和事件相关电位作为指标, 观测rDLPFC在安慰剂调节社会疼痛中的作用。行为层面, 我们收集被试观看每张情绪图片后的负性情绪评分。电生理层面, 我们结合事件相关电位(event-related potential, ERP)技术来观测TMS的效果, 把晚正电位(late positive potential, LPP)作为安慰剂情绪调节效应的指标。LPP反映了人们对情绪性等突显性信息的精细加工, 通常LPP的波幅随着情绪刺激强度的增加而提升(Hajcak & Olvet, 2010; Kennedy & Montreuil, 2021)。在情绪调节研究中, LPP波幅常作为情绪调节效果的指标(Kennedy & Montreuil, 2021)。例如先前的系列研究发现, LPP波幅可客观反映情绪调节的效果, 且被试的LPP波幅与他们主观报告的负性情绪评分存在显著正相关(He et al., 2020; Li et al., 2022; Yuan et al., 2022; Zhao et al., 2021)。同样的, 安慰剂研究也观察到, 安慰剂效应伴随着LPP波幅的降低(Guevarra et al., 2020; Meyer et al., 2015)。基于前述已有发现, 本研究假设:TMS激活DLPFC可增强安慰剂调节社会疼痛的效果。具体表现为:在安慰剂条件下, DLPFC组相比于控制组, 被试报告的负性情绪反应更弱, LPP波幅更低。本研究不但能深化我们对安慰剂调节社会性情绪脑机制的理解, 还能为采用TMS或tDCS等方法治疗各类以情绪失调为核心的精神障碍提供神经调控靶点。
2 方法
2.1 被试
本研究共招募100名大学在校本科生和研究生。所有被试均为右利手, 视力或矫正视力正常。实验前告知被试实验内容及注意事项, 并签署知情同意书。本方案获得了四川师范大学伦理委员会的批准(审查编号:2022LS012)。根据相关研究(Guevarra et al., 2020)报告的效应量大小(η2p= 0.171), 使用G*Power 3.1.7对样本量进行估计(α = 0.05, β = 0.2, 重复测量方差分析, 被试内−被试间交互作用), 两组各含6名被试即可达到80%的统计检验力。因此本研究的样本量满足要求。
实验当天被试填写以下量表:抑郁量表(Beck Depression Inventory Second Edition, BDI-II; Beck et al., 1996)、社交焦虑量表(the Liebowitz Social Anxiety Scale, LSAS; Liebowitz, 1987)、人际反应指针量表(the Interpersonal Reactivity Index, IRI; Davis & Association, 1980)。随机将被试分配到控制组和DLPFC组, 两组的年龄、性别、抑郁水平(BDI-II)、社交焦虑水平(LSAS)、共情能力(IRI)均无显著差异(表1)。
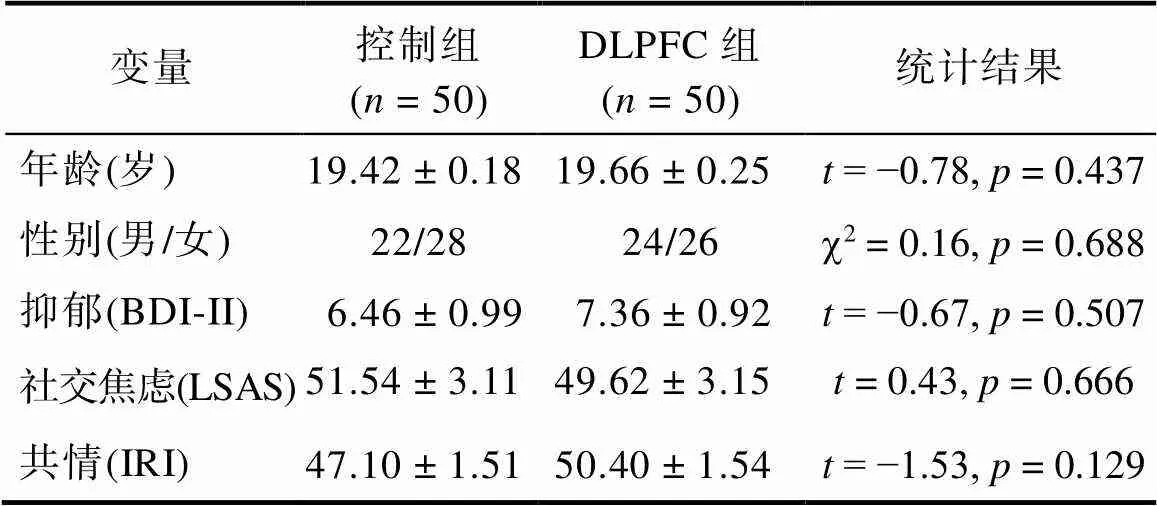
表1 本研究两组被试的人口学特征
注:独立样本检验(双尾)。表中的描述统计量表示为±。
2.2 实验材料及过程
本研究为2 (TMS组别:DLPFC组/控制组)× 2 (安慰剂条件:非安慰剂/安慰剂)的混合实验设计, 其中TMS组别为被试间变量, 安慰剂条件为被试内变量。
实验材料社会排斥图片库中选取, 共采用60张社会排斥图片(Zheng et al., 2021)。每张图片含有一名被排斥者和3~4名排斥者。图片中将被排斥者用红圈圈出, 作为实验任务中被试观察图片时的“主人公”。实验任务分为两个block, 将60张图片随机、平均分配至“非安慰剂block”和“安慰剂block”, 图片的效价((58) = 0.01,= 0.99; 3.34 ± 0.51 vs. 3.33 ± 0.48)和唤醒度((58) = 1.05,= 0.30; 4.61 ± 0.22 vs. 4.56 ± 0.21)在两个条件间无显著差异(均为1~9点评分)。两个block的顺序在被试间平衡。
在安慰剂block开始前, 告知被试以下内容:“百忧解”可抑制中枢神经对5-羟色胺的再吸收, 已被验证可明显缓解负性心境、改善情绪, 因此广泛用于治疗抑郁症、焦虑症、强迫症及暴食症等。目前临床常用的百忧解为固态的白色片剂或胶囊, 该药物虽然能治疗心理疾病, 却具有一定的副作用, 例如有时会引起肠胃道不适、厌食、神经失调、头痛、目眩等。近年科学家研发出了新型的液态百忧解, 初步数据表明, 改进后的百忧解副作用降低了50%且疗效提高了20%。此次实验的目的是深入考察该新型液态百忧解在有效降低焦虑、悲伤、厌恶等负性情绪过程中的大脑认知机制。为保证实验的绝对安全, 我们不会让你口服药剂, 而只是采用“鼻喷”技术, 让你的鼻腔黏膜吸收极微量的药剂。该药量的药效持续时间很短, 一般不超过10分钟。在非安慰剂block开始前, 告知被试以下内容:在这个实验阶段, 我们会给你鼻喷生理盐水, 主要目的是提高脑电信号的敏感性, 以便于后续的数据分析。生理盐水对身体无伤害, 也不会对你的心理产生任何影响。被试并不知道, 他们在整个实验中被鼻喷的都是生理盐水。为避免安慰剂指导语对非安慰剂对照任务的影响, 如被试是先“安慰剂”后“非安慰剂”的任务顺序, 我们会在非安慰剂block开始前跟被试强调, 微量鼻喷百忧解的药效只能持续10分钟, 现在药效已经消失了。
实验的主要流程如图1A所示, 在每个block开始阶段, 被试接受15 min的TMS刺激, 紧接着接受指导语并被鼻喷生理盐水, 此后完成负性图片浏览和评分任务。主要实验任务结束之后, 主试对被试进行事后采访, 以考察其主观感受到的安慰剂效果:1)你认为“液态百忧解”在实验中能多大程度上减轻你的不愉悦感?1~9点评分, 1分代表毫无效果, 9分代表效果非常显著; 2)假设明天我们再邀请你来做相似的图片观看的实验, 你愿意花多少元购买该药品, 减轻自己实验中心理的不适?3)如果你在日常生活中遇到了非常不顺心的事, 你愿意花多少元购买本药品来缓解你的负性情绪?
图片观看任务中单试次的流程如图1B所示, 先呈现200~300 ms的注视点, 随后呈现6 s的社会排斥图片。在此期间被试需要想象自己是图片中被红圈圈出来的被排斥者, 体验自己处于该情境下的情绪状态并在1~9点轴上进行报告(1 = 一点也不难受, 9 = 非常难受)。每张图片都呈现在液晶显示屏的正中央, 视角为3.0 × 3.5°。图片持续呈现直至被试做出情绪评分。在图片观看任务中记录脑电信号。
整个实验结束后, 告知被试真实的实验目的以及实验中的所谓用药均为生理盐水。实验过程中没有被试报告不良反应, 所有被试均完成了实验任务。
2.3 TMS参数设置
为避免由头皮不适、仪器噪声等引起的对心理任务的干扰, 本研究采用离线TMS刺激方案。同时, 离线刺激方案更贴近临床实践, 具有较长时效(Li et al., 2022; Zhao et al., 2021)。
磁刺激采用经典的“8字形”线圈, 连接M-100 Ultimate刺激系统(英智科技有限公司, 深圳)。依据国际脑电10/20系统进行靶点定位, 右侧DLPFC位于F4, 中央顶区位于Cz点(vertex; Li et al., 2022; Zhao et al., 2021)。两组被试在TMS作用下的大脑电流分布见图1C (SimNIBS; Thielscher et al., 2015)。
实验前, 先在右手运动区(C3)测试每个被试的静息运动阈值, 后者定义为在10次刺激中至少5次可以使放松的右手拇指发生抽动所需要的最小刺激强度(Schutter & van Honk, 2006)。实验中采用90%静息运动阈值, 10 Hz重复性脉冲方案(repetitive TMS, rTMS)。每名被试在每个block开始时接受1200个脉冲刺激, 共计15 min。刺激包含30个磁场串(train), 每个串持续4 s, 串间间歇时间为26 s (Raedt et al., 2010)。
2.4 数据采集及分析
采用TMS兼容的32通道脑电放大器(博瑞康, 常州), 采样率250 Hz。参考电极置于左侧耳后乳突(TP9), 接地电极置于前额。原始脑电信号不进行在线滤波。电极头皮阻抗小于10 kΩ。
使用MATLAB (v2020a; The MathWorks, Inc.)对数据进行离线分析。首先对脑电信号进行重参考, 以全脑均值为参考电位。随后进行0.01~30 Hz的带通滤波及50 Hz的陷波。以图片呈现前200 ms到图片呈现后6000 ms作为时间窗进行分段, 前200 ms的平均电位用于基线校正。根据前期系列研究(Li et al., 2022; Zhao et al., 2021), 事前确定LPP的电极点及时间窗:LPP的平均幅度采用Pz附近5个电极点(P3、P4、Pz、CP1、CP2)的均值进行度量, 分析时间窗的开始时间为经典的P3成分结束后, 结束时间为图片呈现结束, 即LPP的时间窗为1000~6000 ms。
2.5 统计方法
统计分析采用SPSS Statistics 20.0 (IBM, Somers, USA)进行。全文的描述性统计量表示为“均值 ± 标准误”。对负性情绪强度评分和LPP幅度进行双因素重复测量方差分析, 被试内因素为“安慰剂条件”, 被试间因素为“TMS组别”。采用独立样本检验分析实验后的采访数据。采用Pearson相关对各因变量和被试的特质性问卷进行探索性的相关分析。
3 结果
3.1 负性情绪评分
安慰剂的主效应显著,(1, 98) = 142.6,< 0.001, η2p= 0.593:安慰剂条件下的负性情绪强度(3.97 ± 0.12)显著低于非安慰剂条件(4.93 ± 0.14), 该结果说明本研究对安慰剂效应的操纵是有效的。TMS组别的主效应不显著,(1, 98) = 2.0,= 0.161, DLPFC组报告的负性情绪强度(4.27 ± 0.18)有低于控制组(4.62 ± 0.18)的趋势, 但不显著。
安慰剂和TMS组别的交互作用显著,(1, 98) = 9.5,= 0.003, η2p= 0.089 (图2A)。简单效应分析表明, 在安慰剂条件下DLPFC组报告的负性情绪强度(3.67 ± 0.18)显著低于控制组(4.27 ± 0.18),(1, 98) = 5.76,0.018, η2p= 0.056; 然而在非安慰剂条件下该组间差异不显著,(1, 98) < 1:DLPFC组(4.87 ± 0.19)和控制组(4.98 ± 0.19)报告的负性情绪相当。

图2 主要结果。A. 被试的负性情绪强度评分。1~9点评分:1代表“一点也不难受”, 9代表“非常难受”。B. 脑电晚正成分(LPP)的幅度。图中的误差条(error bar)代表标准误。小圆圈表示单个被试的数据。*p < 0.05, **p < 0.01。C. LPP波形图。该波形为Pz、P3、P4、CP1和CP2的平均波幅。D. LPP的地形图。该地形图的呈现时间窗为图片出现后的1~6秒的均值。
根据以上结果, 探索性考察被试的抑郁、社交焦虑水平等个体变量对负性情绪评分的影响。结果表明, 在非安慰剂条件下(= 100), 被试的社交焦虑水平越高, 报告的负性情绪越强,= 0.219,= 0.029; 抑郁水平与负性情绪评分的相关不显著,= −0.024,= 0.811。在安慰剂条件下, 总体样本依然存在社交焦虑水平与负性情绪评分的相关,= 0.225,= 0.024 (= 100)。分组分析发现, 总体样本上的相关主要是由控制组贡献的,= 0.284,= 0.045 (= 50); DLPFC组对总体样本相关的贡献较少,= 0.208,= 0.147 (= 50)。此结果提示:依赖于DLPFC的安慰剂效应对缓解社交焦虑被试的负性情绪有所帮助。
3.2 事件相关电位
LPP波幅结果表明, 安慰剂的主效应显著,(1, 98) = 67.0,< 0.001, η2p= 0.406:安慰剂条件下的LPP幅度(0.99 ± 0.18 µV)显著低于非安慰剂条件(2.74 ± 0.16 µV)。TMS组别的主效应显著,(1, 98) = 4.14,= 0.045, η2p= 0.040, DLPFC组的LPP幅度(1.60 ± 0.18 µV)显著低于控制组(2.13 ± 0.18 µV)。
安慰剂和TMS组别的交互作用显著,(1, 98) = 4.02,= 0.048, η2p= 0.039 (图2BCD)。简单效应分析表明, 在安慰剂条件下DLPFC组的LPP幅度(0.51 ± 0.25 µV)显著低于控制组(1.46 ± 0.25 µV),(1, 98) = 7.3,0.008, η2p= 0.070; 然而在非安慰剂条件下该组间差异不显著,(1, 98) < 1:DLPFC组(2.69 ± 0.22 µV)和控制组(2.79 ± 0.22 µV)的LPP幅度相当。
根据以上结果, 探索性考察被试的抑郁、社交焦虑水平等个体变量对LPP幅度的影响。在非安慰剂条件下(= 100), 被试的社交焦虑水平越高, 被图片诱发的LPP幅度越大,= 0.328,= 0.001; 抑郁水平与LPP幅度的相关不显著,= −0.035,= 0.730。在安慰剂条件下, 总体样本依然存在社交焦虑水平与负性情绪评分的弱相关,= 0.197,= 0.049 (= 100)。分组分析发现, 总体样本上的相关是由控制组贡献的,= 0.290,= 0.041 (= 50); DLPFC组的相关不显著,= 0.098,= 0.497 (= 50)。因此, LPP和负性情绪评分的结果均提示:安慰剂可缓解社交焦虑被试的负性情绪。
最后, 我们对研究中的两个主要指标(负性情绪评分和LPP幅度)的相关性进行检验。结果表明, 情绪的主观(负性情绪评分)和客观指标(LPP幅度)在非安慰剂条件,= 0.248,= 0.013, 以及安慰剂条件,= 0.201,= 0.044, 均具有较好的相关性(= 100)。
3.3 实验后采访
两组被试的事后访问结果显示, 几乎所有的被试(98%)都相信实验中所吸入的药品有效果, 而且两组间有显著差异:DLPFC组(与控制组相比)认为, “液态百忧解”在实验中能明显减轻不愉悦感((98) = 2.66,= 0.009; 4.74 ± 0.25 vs. 3.78 ± 0.26), 他们愿意花更多的钱来购买此药品, 以缓解后续实验((98) = 2.61,= 0.010; 28.44 ± 5.96 vs. 11.94 ± 2.10元)及日常生活中的负性情绪((98) = 2.19,= 0.031; 81.50 ± 14.71 vs. 43.52 ± 9.20元)。
4 讨论
本研究采用TMS激活rDLPFC以考察该脑区在安慰剂下调负性情绪时的因果作用。结果与假设和预期一致:使用TMS激活rDLPFC可以提高安慰剂对负性情绪的下调效果。具体来说, 安慰剂能降低个体的负性情绪体验, 同时降低负性图片诱发的LPP波幅, 并且这种安慰剂效应在TMS激活rDLPFC的被试组中更显著。
本研究的主要贡献是揭示了DLPFC在安慰剂调节负性情绪过程中的因果作用。安慰剂和TMS组别的交互作用显示, 与控制组相比, DLPFC组在安慰剂条件(而非基线条件)报告的负性情绪评分更弱、LPP波幅更小。此外, 自我情绪评分和LPP波幅的相关结果表明, 主观(情绪评分)与客观(LPP波幅)情绪指标能一致性地反映情绪调节的效果, 这与已有的情绪调节研究结果(He et al., 2020; Li et al., 2022; Zhao et al., 2021)以及已有的安慰剂研究发现一致(Guevarra et al., 2020; Meyer et al., 2015; Schienle et al., 2022), 并且支持了本研究结果的有效性。已有的少量脑成像研究发现(Koban et al., 2017), 安慰剂调节负性情绪时DLPFC明显激活。DLPFC在目标维持、工作记忆监控、信念建立及维持等方面起着重要作用(Buhle et al., 2014; Kohn et al., 2014); DLPFC激活能增强个体建立和维持“安慰剂能够调节负性情绪”的预期信念, 进而调节社会疼痛等不良情绪反应(Braunstein et al., 2017; Koban et al., 2017)。但已有的脑成像研究提供的仅仅是相关性证据。本研究采用TMS激活DLPFC, 证明该脑区在安慰剂调节情绪时发挥了关键性的因果作用。我们的发现与安慰剂镇痛研究发现一致。在已有的3项镇痛领域的脑调控研究中:Krummenacher等人(2010)采用TMS抑制DLPFC, 发现被试在安慰剂条件下对热痛刺激的疼痛阈限和疼痛忍耐力明显下降; Egorova等人(2015)采用tDCS阳极激活rDLPFC并观察到了增强的安慰剂镇痛效应; 最近, Tu等人(2021)结合tDCS和fMRI发现, 激活rDLPFC能增强安慰剂的镇痛效应, 且此过程中rDLPFC和腹内侧前额叶等脑区的激活增加, 而初级体感皮层的激活减弱。这3项研究均表明, DLPFC是安慰剂镇痛效应的因果性脑区。在此基础上, 本研究采用脑调控技术, 在安慰剂的另一个应用领域, 即情绪调节领域, 提供了安慰剂效应核心脑区的因果性证据。综合已有的镇痛研究和本项情绪调节研究, 我们推测, 安慰剂在不同应用领域发挥作用时的神经机制是高度相似的:DLPFC脑区在其中可能起到了“发动机(engine)”的作用, 即DLPFC的激活会触发腹内侧前额叶等其他前额叶脑区的协同工作, 进而下调初级体感皮层/后脑岛(镇痛时)以及杏仁核/前脑岛(情绪调节时)的神经活动(Eisenberger, 2015)。
其次, 实验后采访的结果表明, 除了能改善情绪, 安慰剂效应还对个体的认知产生了影响, 并且rDLPFC的激活能增强这一影响。实验中, 尽管几乎所有被试都相信了鼻喷药物的有效性, 但DLPFC组比控制组更相信“液态百忧解”能降低不愉悦感受, 因此他们愿意花更多钱来购买该药物以备后用。已有的镇痛研究也发现, 被试在安慰剂条件下对所使用药物的有效性评分高于基线条件(Geuter et al., 2013; Guevarra et al., 2020), 并愿意花更多的钱购买安慰剂条件下使用过的药物(Buhle et al., 2012)。我们的发现一方面证实了实验中安慰剂操纵的有效性, 另一方面表明安慰剂能改变被试对药物疗效的预期和药物价值的评估。这提示安慰剂除了改善情绪还可改变更为广泛的认知过程。例如, 已有研究发现, 安慰剂能降低考试焦虑并提升自我管理能力(Schaefer et al., 2019), 让被试更加相信体育锻炼能带来情感效益(Wang et al., 2022)。在此基础上, 本研究的发现表明, 安慰剂对上述认知过程的影响可以通过激活DLPFC得以增强。但是由于本研究并未匹配两个TMS组别的消费观, 我们建议对本文“花钱买药”的相关指标持谨慎态度。
最后, 本研究的结果提示, 依赖于DLPFC的安慰剂效应可能降低社交焦虑倾向被试的负性社会情绪。尽管基线条件下100名被试的社交焦虑水平与负性情绪强度/LPP波幅呈正比, 但这种相关性在安慰剂条件下因DLPFC的激活而显著减弱。已有研究发现, 社交焦虑水平越高, 个体对社会排斥就越敏感(Heeren et al., 2017), 对社会反馈信息的预期越偏负性(Gu et al., 2020)。更关键的是, 社交焦虑群体对负性情绪的主动调节能力下降(Brühl et al., 2014; Dryman & Heimberg, 2018; Heeren et al., 2017; Kivity & Huppert, 2019)。例如, 研究发现, 与健康对照组相比, 高社交焦虑者更少地使用认知重评缓解负性情绪(Blalock et al., 2016), 且他们使用认知重评策略时情绪调节效果更差(Goldin et al., 2009)。从这个角度讲, 自动化情绪调节方法——安慰剂可能是改善社交焦虑情绪的有效途径。值得注意的是, 本研究仅通过相关的方法得到了这一结论, 未来研究应采用更有效的操控方法、直接比较社交焦虑被试在使用安慰剂(自动化情绪调节)和认知重评策略(主动情绪调节)调节情绪的效果来验证该假设, 同时探索该结果的临床价值。
此外, 后续研究还可以从以下几个方面继续深化我们对安慰剂调节负性情绪的认识。第一, 验证DLPFC激活可否提高“通过条件化建立的”安慰剂的情绪调节效应。诱发安慰剂效应的方式主要包括预期(本研究)和条件化(Colloca & Barsky, 2020)。本研究表明rDLPFC在通过预期建立的安慰剂效应中的作用, 但通过条件化方式建立的安慰剂效应是否也依赖于DLPFC呢?未来可对此加以考察。第二, 探讨TMS增强安慰剂效应的可持续时间。本研究仅测量了单次TMS干预对情绪改善的即时效果。考虑到单次TMS带来的神经可塑性改变仅能维持30 min左右(Valero-Cabré et al., 2017), 未来研究还需进一步考察多次和多疗程TMS方案, 在提升安慰剂疗效的同时减缓安慰剂效应的消退。第三, 增加观测指标来测量安慰剂调节情绪的效应。本研究因变量为自我情绪评分和脑电指标。已有的fMRI研究发现安慰剂调节情绪的过程会伴随情绪体验脑区激活水平的降低, 包括杏仁核、丘脑、脑岛、前扣带回等(Koban, Kross, et al., 2017; Peciña et al., 2015; Petrovic et al., 2005; Schienle et al., 2014, 2017)。另外有研究结合眼动技术发现, 被试使用安慰剂后, 观看恶心图片时的负性情绪降低, 注视次数增多, 即安慰剂增加了观看厌恶刺激的意愿(Schienle et al., 2016)。此外, 已有情绪调节研究也表明, 情绪调节过程会引起瞳孔直径(Robinson et al., 2021)、皮肤电(Raio et al., 2013)等外周生理指标的变化。因此未来研究可结合多种测量手段全面考察安慰剂调节情绪的效果。
5 结论
本研究首次结合神经调控和神经观测技术, 揭示了DLPFC在安慰剂调节负性情绪中的因果作用。我们发现, 采用TMS激活rDLPFC可提高安慰剂调节情绪的效果, 表现为主观负性情绪体验降低, 同时客观情绪强度指标LPP的幅度减小。研究结果表明了DLPFC在安慰剂调节情绪时的核心作用,也为社交焦虑、抑郁、广泛性焦虑障碍等以情绪失调为主要症状的精神障碍的治疗提供了脑干预靶点。
Amanzio, M., Benedetti, F., Porro, C. A., Palermo, S., & Cauda, F. (2013). Activation likelihood estimation meta- analysis of brain correlates of placebo analgesia in human experimental pain.,(3), 738−752. https://doi.org/10.1002/hbm.21471
Ashar, Y. K., Chang, L. J., & Wager, T. D. (2017). Brain mechanisms of the placebo effect: an affective appraisal account.,, 73−89. https://doi.org/10.1146/annurev-clinpsy-021815-093015
Atlas, L. Y., & Wager, T. D. (2014). A meta-analysis of brain mechanisms of placebo analgesia: consistent findings and unanswered questions.,, 37−69. https://doi.org/10.1007/978-3-662-44519-8
Beck, A. T., Steer, R. A., & Brown, G. K. (1996).(2nd ed.). San Antonio, TX: The Psychological Corporation.
Benedetti, F. (2014). Placebo effects: from the neurobiological paradigm to translational implications.,(3), 623−637. https://doi.org/10.1016/j.neuron.2014.10.023
Blalock, D. V., Kashdan, T. B., & Farmer, A. S. (2016). Trait and daily emotion regulation in social anxiety disorder.,(3), 416−425. https:// doi.org/10.1007/s10608-015-9739-8
Braunstein, L. M., Gross, J. J., & Ochsner, K. N. (2017). Explicit and implicit emotion regulation: a multi-level framework.,(10), 1545− 1557. https://doi.org/10.1093/scan/nsx096
Brooks, S. K., Webster, R. K., Smith, L. E., Woodland, L., Wessely, S., Greenberg, N., & Rubin, G. J. (2020). The psychological impact of quarantine and how to reduce it: Rapid review of the evidence.,(10227), 912−920. https://doi.org/10.1016/S0140-6736(20)30460-8
Brühl, A. B., Delsignore, A., Komossa, K., & Weidt, S. (2014). Neuroimaging in social anxiety disorder-a meta-analytic review resulting in a new neurofunctional model.,, 260−280. https://doi.org/10.1016/j.neubiorev.2014.08.003
Buhle, J. T., Stevens, B. L., Friedman, J. J., & Wager, T. D. (2012). Distraction and placebo: Two separate routes to pain control.,(3), 246−253. https: //doi.org/10.1177/0956797611427919
Buhle, J. T., Silvers, J. A., Wage, T. D., Lopez, R., Onyemekwu, C., Kober, H., Webe, J., & Ochsner, K. N. (2014). Cognitive reappraisal of emotion: A meta-analysis of human neuroimaging studies.,(11), 2981−2990. https://doi.org/10.1093/cercor/bht154
Colloca, L. (2019). The placebo effect in pain therapies., 191−211. https://doi.org/10.1146/annurev-pharmtox-010818- 021542
Colloca, L., & Barsky, A. J. (2020). Placebo and nocebo effects.,(6), 554− 561. https://doi.org/10.1056/nejmra1907805
Davis, M. H., & Association, A. P. (1980). A multidimensional approach to individual differences in empathy.,, 85. http://www.uv.es/~friasnav/Davis_1980.pdf
Dryman, M. T., & Heimberg, R. G. (2018). Emotion regulation in social anxiety and depression: A systematic review of expressive suppression and cognitive reappraisal.,, 17−42. https://doi.org/10.1016/j. cpr.2018.07.004
Egorova, N., Yu, R., Kaur, N., Vangel, M., Gollub, R. L., Dougherty, D. D., Kong, J., & Camprodon, J. A. (2015). Neuromodulation of conditioned placebo/nocebo in heat pain: anodal vs cathodal transcranial direct current stimulation to the right dorsolateral prefrontal cortex.,(7), 1342−1347. https://doi.org/10.1097/j.pain.0000000000000163
Eisenberger N. I. (2015). Social pain and the brain: controversies, questions, and where to go from here.,, 601−629. https://doi.org/10.1146/annurev- psych-010213-115146
Ellingsen, D. M., Wessberg, J., Eikemo, M., Liljencrantz, J., Endestad, T., Olausson, H., & Leknes, S. (2013). Placebo improves pleasure and pain through opposite modulation of sensory processing.,(44), 17993−17998. https://doi.org/10.1073/pnas.1305050110
Fu, J., Wu, S., Liu, C., Camilleri, J. A., Eickhoff, S. B., & Yu, R. (2021). Distinct neural networks subserve placebo analgesia and nocebo hyperalgesia.,, 117833. https: //doi.org/10.1016/j.neuroimage.2021.117833
Geuter, S., Eippert, F., Hindi Attar, C., & Büchel, C. (2013). Cortical and subcortical responses to high and low effective placebo treatments.,, 227−236. https://doi. org/10.1016/j.neuroimage.2012.11.029
Goldin, P. R., Manber-Ball, T., Werner, K., Heimberg, R., & Gross, J. J. (2009). Neural mechanisms of cognitive reappraisal of negative self-beliefs in social anxiety disorder.,(12), 1091−1099. https:// doi.org/10.1016/j.biopsych.2009.07.014
Gu, R., Ao, X., Mo, L., & Zhang, D. (2020). Neural correlates of negative expectancy and impaired social feedback processing in social anxiety.,(3), 285−291. https://doi.org/10.1093/scan/nsaa038
Guevarra, D. A., Moser, J. S., Wager, T. D., & Kross, E. (2020). Placebos without deception reduce self-report and neural measures of emotional distress.,(1), 3785. https://doi.org/10.1038/s41467- 020-17654-y
Hajcak, G., Macnamara, A., & Olvet, D. M. (2010). Event- related potentials, emotion and emotion regulation : An integrative review.,5(2), 129−155. https://doi.org/10.1080/87565640903526504
He, Z., Lin, Y., Xia, L., Liu, Z., Zhang, D., & Elliott, R. (2018). Critical role of the right VLPFC in emotional regulation of social exclusion: A tDCS study.,(4), 357−366. https://doi. org/10.1093/scan/nsy026
He, Z., Zhao, J., Shen, J., Muhlert, N., Elliott, R., & Zhang, D. (2020). The right VLPFC and downregulation of social pain: A TMS study.,(5), 1362− 1371. https://doi.org/10.1002/hbm.24881
Heeren, A., Dricot, L., Billieux, J., Philippot, P., Grynberg, D., de Timary, P., & Maurage, P. (2017). Correlates of social exclusion in social anxiety disorder: An fMRI study.,(1), 260. https://doi.org/10.1038/s41598- 017-00310-9
Holt-Lunstad, J. (2021). A pandemic of social isolation?,(1), 55−56. https://doi.org/10.1002/ wps.20839
Kennedy, H., & Montreuil, T. C. (2021). The late positive potential as a reliable neural marker of cognitive reappraisal in children and youth: A brief review of the research literature.,, 608522. https://doi.org/10.3389/fpsyg.2020.608522
Kivity, Y., & Huppert, J. D. (2019). Emotion regulation in social anxiety: A systematic investigation and meta- analysis using self-report, subjective, and event-related potentials measures.,(2), 213−230. https:// doi.org/10.1080/02699931.2018.1446414
Koban, L., Kross, E., Woo, C. W., Ruzic, L., & Wager, T. D. (2017). Frontal-brainstem pathways mediating placebo effects on social rejection.,(13), 3621−3631. https://doi.org/10.1523/JNEUROSCI.2658-16.2017
Kohn, N., Eickhoff, S. B., Scheller, M., Laird, A. R., Fox, P. T., & Habel, U. (2014). Neural network of cognitive emotion regulation -- An ALE meta-analysis and MACM analysis.,, 345−355. https://doi.org/10. 1016/j.neuroimage.2013.11.001
Kong, J., Jensen, K., Loiotile, R., Cheetham, A., Wey, H. Y., Tan, Y., … Gollub, R. L. (2013). Functional connectivity of the frontoparietal network predicts cognitive modulation of pain.,(3), 459−467. https://doi.org/10.1016/ j.pain.2012.12.004
Kong, J., Kaptchuk, T. J., Polich, G., Kirsch, I., & Gollub, R. L. (2007). Placebo analgesia: Findings from brain imaging studies and emerging hypotheses.,(3−4), 173−190. https://doi.org/10.1515/ REVNEURO.2007.18.3-4.173
Krummenacher, P., Candia, V., Folkers, G., Schedlowski, M., & Schönbächler, G. (2010). Prefrontal cortex modulates placebo analgesia.,(3), 368−374. https://doi.org/ 10.1016/j.pain.2009.09.033
Lau, J. Y. F., & Waters, A. M. (2017). Annual research review: An expanded account of information-processing mechanisms in risk for child and adolescent anxiety and depression.,(4), 387−407. https://doi.org/10.1111/jcpp. 12653
Li, S., Xie, H., Zheng, Z., Chen, W., Xu, F., Hu, X., & Zhang, D. (2022). The causal role of the bilateral ventrolateral prefrontal cortices on emotion regulation of social feedback.,(9), 2898−2910. https://doi.org/ 10.1002/hbm.25824
Liebowitz M (1987) Social phobia., 141–173.
Linnman, C., Catana, C., Petkov, M. P., Chonde, D. B., Becerra, L., Hooker, J., & Borsook, D. (2018). Molecular and functional PET-fMRI measures of placebo analgesia in episodic migraine: preliminary findings.,, 680−690. https://doi.org/10.1016/j.nicl.2017. 11.011
Lui, F., Colloca, L., Duzzi, D., Anchisi, D., Benedetti, F., & Porro, C. A. (2010). Neural bases of conditioned placebo analgesia.,(3), 816−824. https://doi.org/10.1016/ j.pain.2010.09.021
Mayberg, H. S., Silva, J. A., Brannan, S. K., Tekell, J. L., Mahurin, R. K., McGinnis, S., & Jerabek, P. A. (2002). The functional neuroanatomy of the placebo effect.,(5), 728−737. https://doi.org/10. 1176/appi.ajp.159.5.728
Meyer, B., Yuen, K. S. L., Ertl, M., Polomac, N., Mulert, C., Büchel, C., & Kalisch, R. (2015). Neural mechanisms of placebo anxiolysis.,(19), 7365−7373. https://doi.org/10.1523/JNEUROSCI.4793-14.2015
Meyer, B., Yuen, K. S. L., Saase, V., & Kalisch, R. (2018). The functional role of large-scale brain network coordination in placebo-induced anxiolysis.,(8), 3201−3210. https://doi.org/10.1093/cercor/ bhy188
Peciña, M., Bohnert, A. S. B., Sikora, M., Avery, E. T., Langenecker, S. A., Mickey, B. J., & Zubieta, J. K. (2015). Association between placebo-activated neural systems and antidepressant responses: neurochemistry of placebo effects in major depression.,(11), 1087−1094. https://doi.org/10.1001/jamapsychiatry.2015.1335
Petrovic, P., Dietrich, T., Fransson, P., Andersson, J., Carlsson, K., & Ingvar, M. (2005). Placebo in emotional processing- induced expectations of anxiety relief activate a generalized modulatory network.,(6), 957−969. https://doi. org/10.1016/j.neuron.2005.05.023
Price, D. D., Finniss, D. G., & Benedetti, F. (2008). A comprehensive review of the placebo effect: Recent advances and current thought.,(1), 565−590. https://doi.org/10.1146/annurev.psych.59.113006. 095941
Raio, C. M., Orederu, T. A., Palazzolo, L., Shurick, A. A., & Phelps, E. A. (2013). Cognitive emotion regulation fails the stress test.,(37), 15139−15144. https://doi.org/10.1073/pnas.1305706110
Robinson, H., Sheen, E., Sliwinski, R., Mu, J., & Compton, R. J. (2021). Find the silver lining or ignore the cloud? Cognitive reappraisal versus visual attention training.,(6), 1204−1212. https://doi.org/10.1037/emo0000983
Schaefer, M., Denke, C., Harke, R., Olk, N., Erkovan, M., & Enge, S. (2019). Open-label placebos reduce test anxiety and improve self-management skills: A randomized- controlled trial.,(1), 13317. https://doi. org/10.1038/s41598-019-49466-6
Schienle, A., Gremsl, A., Übel, S., & Körner, C. (2016). Testing the effects of a disgust placebo with eye tracking.,, 69−75. https://doi.org/10.1016/j.ijpsycho.2016.01.001
Schienle, A., Übel, S., Schöngaßner, F., Ille, R., & Scharmüller, W. (2014). Disgust regulation via placebo: An fMRI study.,(7), 985− 990. https://doi.org/10.1093/scan/nst072
Schienle, A., Übel, S., & Wabnegger, A. (2017). When opposites lead to the same: a direct comparison of explicit and implicit disgust regulation via fMRI.,(3), 445−451. https://doi. org/10.1093/scan/nsw144
Schienle, A., Unger, I., & Schwab, D. (2022). Changes in neural processing and evaluation of negative facial expressions after administration of an open-label placebo.,(1), 6577. https://doi.org/10.1038/s41598-022- 10567-4
Thielscher, A., Antunes, A., & Saturnino, G. B. (2015). Field modeling for transcranial magnetic stimulation: a useful tool to understand the physiological effects of TMS?(pp. 222−225). Milan, Italy. https://doi.org/10.1109/EMBC. 2015.7318340
Tu, Y., Wilson, G., Camprodon, J., Dougherty, D. D., Vangel, M., & Benedetti, F. (2021). Manipulating placebo analgesia and nocebo hyperalgesia by changing brain excitability.(19), e2101273118. https:// doi.org/10.1073/pnas.2101273118
Valero-Cabré, A., Amengual, J. L., Stengel, C., Pascual-Leone, A., & Coubard, O. A. (2017). Transcranial magnetic stimulation in basic and clinical neuroscience: A comprehensive review of fundamental principles and novel insights.,(October), 381−404. https://doi.org/10.1016/j.neubiorev. 2017.10.006
Wager, T. D., & Atlas, L. Y. (2015). The neuroscience of placebo effects: Connecting context, learning and health.,(7), 403−418. https://doi. org/10.1038/nrn3976
Wager, T. D., Rilling, J. K., Smith, E. E., Sokolik, A., Casey, K. L., Davidson, R. J., … Cohen, J. D. (2004). Placebo-induced Changes in fMRI in the anticipation and experience of pain.,(5661), 1162−1167. https:// doi.org/10.1126/science.1093065
Wang, Y., Guo, L., Fan, J., Mao, Z., Wang, Y., Guo, L., Fan, J., & Mao, Z. (2022). Expectations come true: the placebo effect of exercise on affective responses., https://doi.org/10.1080/02701367. 2022.2121372
Xiang, Y. T., Yang, Y., Li, W., Zhang, L., Zhang, Q., Cheung, T., & Ng, C. H. (2020). Timely mental health care for the 2019 novel coronavirus outbreak is urgently needed.,(3), 228−229. https://doi.org/10.1016/ S2215-0366(20)30046-8
Yuan, J., Zhang, Y., Zhao, Y., Gao, K., Tan, S., & Zhang, D. (2022). The emotion-regulation benefits of implicit reappraisal in clinical depression: behavioral and electrophysiological evidence.. https://doi.org/10.1007/ s12264-022-00973-z
Zhao, J., Mo, L., Bi, R., He, Z., Chen, Y., Xu, F., Xie, H., & Zhang, D. (2021). The VLPFC versus the DLPFC in downregulating social pain using reappraisal and distraction strategies.,(6), 1331−1339. https://doi.org/10.1523/JNEUROSCI.1906-20.2020
Zheng, Z., Li, S., Mo, L., Chen, W., & Zhang, D. (2021). ISIEA: an image database of social inclusion and exclusion in young Asian adults.,(5), 2409−2421. https://doi.org/10.3758/s13428-021-01736-w
Zunhammer, M., Spisák, T., Wager, T. D., Bingel, U., & Placebo Imaging Consortium. (2021). Meta-analysis of neural systems underlying placebo analgesia from individualparticipant fMRI data.,(1), 1391. https://doi.org/10.1038/s41467-021-21179-3
The role of dorsolateral prefrontal cortex on placebo effect of regulating social pain: A TMS study
WANG Mei1,2, CHENG Si2, LI Yiwei1, LI Hong1, ZHANG Dandan1,3
(1Institute of Brain and Psychological Sciences, Sichuan Normal University, Chengdu 610066, China) (2School of Psychology/MRI Center, Shenzhen University, Shenzhen 518060, China) (3Shenzhen-Hong Kong Institute of Brain Science, Shenzhen 518055, China)
Under the influence of the novel coronavirus epidemic, some negative social events, such as separation of family or friends and home isolation have increased. These events can cause negative emotion experiences similar to physical pain, thus they are called social pain. Placebo effect refers to the positive response to the inert treatment with no specific therapeutic properties, which has been shown to be one of the effective ways to alleviate social pain. Studies have shown that the dorsolateral prefrontal cortex (DLPFC) plays a key role in placebo effect. Therefore, this study aimed to explore whether activating DLPFC by using transcranial magnetic stimulation (TMS) could improve the ability of placebo effects to regulate social pain. Besides, we also combined neuroimaging and neuromodulation techniques to provide bidirectional evidence for the role of the DLPFC on placebo effects.
We recruited a total of 100 participants to finish the task of negative emotional rating of the social exclusion images. Among them, 50 participants were stimulated by TMS at the right DLPFC (rDLPFC), while the others were assigned to the sham group. This study contained two independent variables. The between- subject variable was(rDLPFC-activated group or sham group) and the within-subject variable was(no-placebo and placebo). All participants received nasal spray in two blocks. In the no-placebo condition, participants were instructed that they would receive a saline nasal spray which helped to improve physiological readings; in placebo block, participants were told to administrate an intranasal fluoxetine spray (saline nasal spray in fact) that could reduce unpleasantness within 10 minutes. To strengthen the expectation of intranasal fluoxetine, participants viewed a professional introduction to fluoxetine’s clinical and academic usage including downregulating negative emotion, such as fear, anxiety, and disgust. Participants who received the placebo block first would be reminded that fluoxetine’s effect was over before the next block to reduce the carry-over for the following block. Self-reported negative emotional and electroencephalogram data were recorded.
There was a significant two-way interaction ofand. Results showed that compared with the sham group, participants in the rDLPFC-activated group reported less negative emotional feeling and had a lower amplitude of the late positive potential (LPP) in placebo condition, a component that reflects the emotional intensity, suggesting that activating rDLPFC can improve the ability of placebo effect to regulate social pain.
The above finding suggested that activating DLPFC can improve the placebo effect of regulating negative emotion. Moreover, this study is the first attempt to investigate the enhancement of placebo effects by using TMS on emotion regulation. The findings not only support the critical role of DLPFC on placebo effect using neuroimaging and neuromodulation techniques, but also provide a potential brain target for treating emotional regulation deficits in patients with psychiatric disorders.
dorsolateral prefrontal cortex, placebo effect, social pain, social exclusion, emotion regulation, transcranial magnetic stimulation
2022-11-23
* 国家自然科学基金项目(33271102; 31970980; 31920103009)、广东省“脑科学与类脑研究”重大科技专项(2018B030335001)、国家社会科学重大项目(20&ZD153)、深港脑科学创新研究院(2023SHIBS0003)支持。
共同第一作者: 王妹、程思。
张丹丹, E-mail: zhangdd05@gmail.com
B845; R395
