阻断PD-L1和MEK对非小细胞肺癌多细胞球体模型的治疗作用
2023-06-27林吉兴云天洋申磊磊陈瑞骥王柏霖王钰琦
林吉兴 云天洋 申磊磊 陈瑞骥 王柏霖 王钰琦
非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的85%,多数患者被确诊时已属晚期;即使接受了根治性手术的患者,也很可能在几年内复发并全身转移[1]。过去的20年中,化疗一直是无基因突变的NSCLC患者唯一的治疗方法[2]。近年来,随着对免疫系统与肿瘤细胞相互作用的进一步认识,免疫制剂抗细胞程序性死亡-配体1(programmed cell death ligand-1,PD-L1)抗体药物的疗效已在多个不同的恶性肿瘤中得到证明[3]。丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)是一种重要的细胞内信号传导通路,可将多种增殖和分化的信号传递到细胞外环境,研究显示,肿瘤细胞中的MAPK活性增强可通过miR-675-5p上调PD-L1表达,而该通路的抑制可以通过抑制丝裂原活化的细胞外信号调节激酶1(mitogen-activated extracellular signal-regulated kinase 1,MEK1)和MEK2获得[4-5]。本研究基于上述理论基础,探讨抗PD-L1抗体阿特珠单抗(Atezolizumab)和MEK抑制剂司美替尼(Selumetinib)在NSCLC多细胞球体(multicellular spheroid,MTS)模型中的抗肿瘤作用。
资料与方法
一、实验材料及设备
收集2019年1月~2020年1月在我院接受手术的NSCLC患者的肿瘤样本,纳入标准:①有明确的NSCLC病理学诊断。②手术前未经过放疗、化疗及其它免疫靶向治疗。③通过酶消化法进行处理,获得体外MTS模型原代细胞培养。本研究方案经医院机构评审委员会批准(S2022-40);患者均于术前签署书面知情同意书。
实验材料:10%优级胎牛血清(GIBCO),司美替尼(AZD6244)和阿特珠单抗(MPDL3280A)均来自Med Chem Express,MEK、MAPK和PD-L1初级抗体(武汉普诺赛),山羊抗兔IgG、兔抗小鼠IgG和单克隆抗β肌动蛋白抗体(武汉艾美捷)。
二、检测指标及实验方法
1 定量实时PCR
使用Trizol试剂(Life Technologies)提取总RNA。按照制造商说明使用SensiFAST(Bioline)通过逆转录酶反应将1μg分离的RNA转化为cDNA。采用定量实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)方法分析PD-L1、IFN-γ、IL-12、IL-1β、TNF-α、IL-6、IL-10、TIM-3、CTLA-4、LAG-3基因的表达水平。利用PRIMER EXPRESS软件(Applied Biosystems),所用引物(见表1)。使用SYBR Green PCR Master Mix(Applied Biosystems)进行扩增。热循环条件为50℃升温2 min(S1),95℃变性10 min(S2),然后在95℃升温15s,60℃升温1 min循环40次(S3)。所有样本一式两份,使用QuantStudio 7 Flex实时荧光定量PCR系统(Applied Biosystems)进行,基因的相对表达量归一至18S,作为内控基因;用2-ΔΔCt方法计算基因相对表达值。通过解离曲线分析和使用非模板对照排除引物二聚体引起的非特异性信号。

表1 引物序列
2 蛋白质印迹分析
溶出物在RIPA缓冲液[0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS),0.5%脱氧胆酸钠,1%NP-40裂解液,100mmol/L NaCl,10mmol/L三羟甲基氨基甲烷盐酸盐(TRIS HYDROCHLORIDE,Tris-HCl)(pH=7.4),0.5 mmol/L二硫三醇,0.5%苯甲基磺酰氟,蛋白酶抑制剂(Hoffmann-La Roche)]中均匀化,离心15000 rpm/4℃,用Bio-Rad法测定蛋白质样品,用增强型化学发光试剂ECL+检测免疫复合物。每个实验一式三份。
3 流式细胞术
流式细胞仪表面染色,用染色缓冲液(staining buffer,SB)(2%FBS;0.1%硝基苯甲酸钠)洗涤细胞,用20%SB+Ab血清阻断10 min后,用小鼠单克隆抗体染色30 min。所用抗体为:抗MEK、MAPK和PD-L1(Miltenyi Biotec)。染色细胞洗涤2次,再悬浮于SB中,然后在FACS ACCURI C6(BD Biosciences)上获得。使用Accuri C6软件(BD Biosciences)进行分析。用佛波醇-12-十四酸酯13-乙酸酯(PMA,10 ng/mL)、放线菌素(500 ng/mL)和Brefeldin A(BFA 10 μg/mL)刺激6 h后,进行细胞内细胞因子产生分析,用小鼠单克隆抗体IFNG(Miltenyi Biotech)培育T细胞。
4 NSCLC MTS模型的制备
根据以往研究中NSCLC MTS模型的培养方案[6],将所有新鲜的肿瘤组织样品保存在冰上,并在收集当天在无菌条件下进行处理。将组织碎片按DeRose所述[7]在37°C摇瓶中以低速至中速(200r/min)消化,培养12h~18h后通过连续离心分离细胞。将细胞接种在基质凝胶中以保留三维结构。
5 细胞生存能力分析
细胞活力采用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)法测定,按照Morgillo所述进行MTS培养[8],MTT染色后用PBS-EDTA冷溶液从基质中提取细胞,根据说明进行裂解。通过剂量-响应曲线插值确定IC50,每次实验均重复四次,使用三次独立实验的中位数作为结果,使用ComboSyn软件计算协同作用。
三、统计分析

结 果
一、MTS模型中的培养
细胞培养共成功建立7个三维培养基,成功率为63.6%(7/11),患者特征及三维培养建立率(见表2),在基质凝胶中接种一周后,最小直径90μm,在接下来的两周内继续生长,以便进行药物测试。通过使用三种不同的过滤器(S1>100μm;S2 30~100μm;S3<30μm)过滤分离细胞,其中S3过滤球体的尺寸为最佳,将这一部分用于后续研究(见图1)。

表2 患者特征及三维培养建立率[n(%)]

图1 每次离心(S1、S2、S3)获得球体模型的代表性图像
二、MTS模型MEK、MAPK和PD-L1表达
对7个MTS模型进行MEK、MAPK和PD-L1的蛋白质印迹分析显示,所有MTS模型MEK、MAPK和PD-L1均呈高表达水平(见图2)。

图2 MTS模型进行PD-L1、MEK和MAPK的蛋白质印迹分析,β-肌动蛋白作为对照
三、MTS模型对阻断PD-L1和MEK的反应
将7种MTS模型分为空白组、阿特珠单抗组、司美替尼组和阿特珠单抗+司美替尼联合应用组,结果阿特珠单抗组和司美替尼组产生中度抗增殖作用,司美替尼组组细胞死亡的中位数约为25%,阿特珠单抗组细胞死亡的中位数约为30%,联合应用组表现出高度抗增殖效果,细胞死亡的中位数约为45%(见图3)。
四、阻断PD-L1和MAPK MTS模型细胞因子表达
通过RT-PCR处理后,联合组IFN-γ、IL-12和IL-6的表达显著增加(P<0.05),IL-10、IL-1β和TNF-α无明显变化(P>0.05),司美替尼和阿特珠单抗组所有细胞因子均无明显升高(P>0.05)(见图4)。
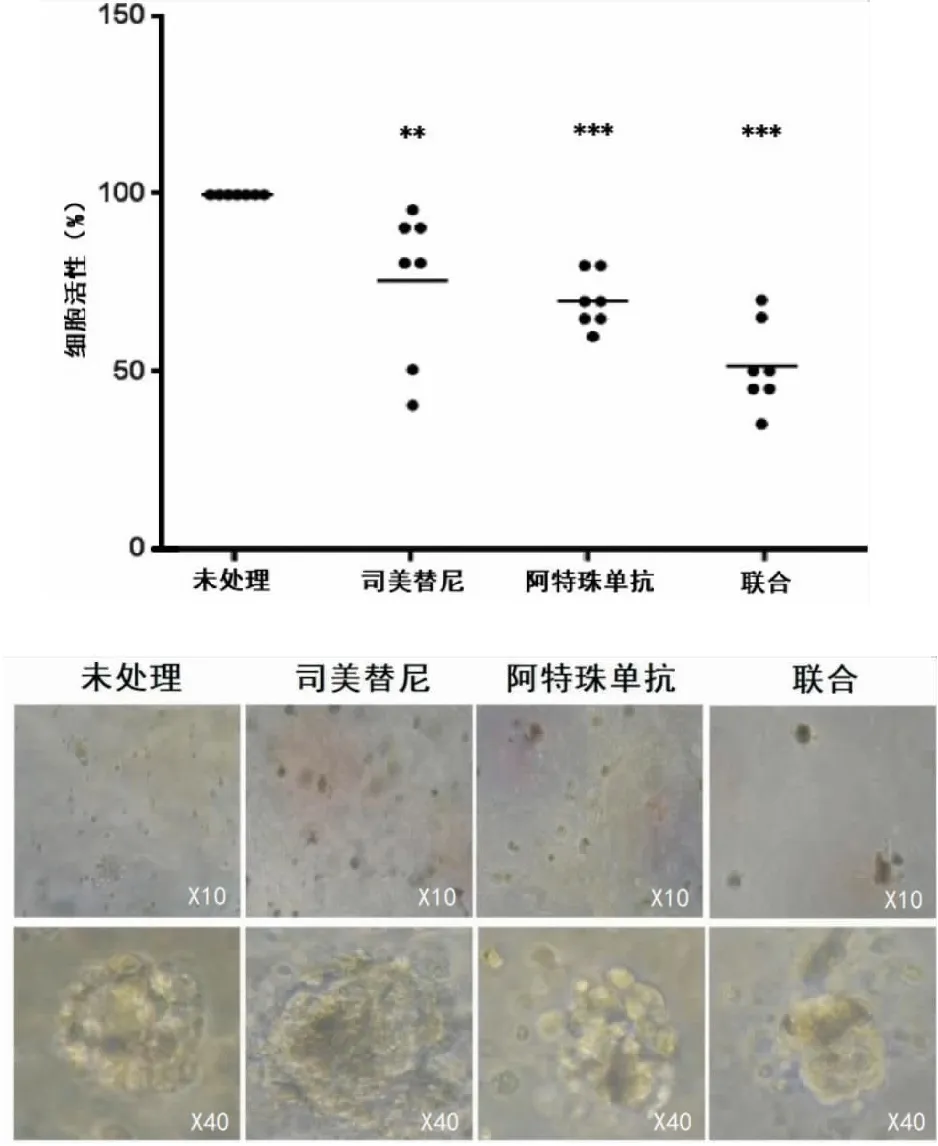
图3 MTS模型对阻断PD-L1和MEK的反应

图4 阻断PD-L1和MAPK MTS模型细胞因子表达注:与未处理组比较,**P<0.01;***P<0.001

图5 阻断PD-L1和MAPKMTS模型免疫检查点基因表达注:与未处理组比较,**P<0.01;***P<0.001
五、阻断PD-L1和MEK的MTS模型免疫检查点基因表达
RT-PCR处理后,联合组PD-L1和CTLA-4表达显著减少(P<0.05),TIM-3和LAG-3无明显变化(P>0.05),司美替尼和阿特珠单抗组PD-L1表达显著减少(P<0.05),CTLA-4、TIM-3和LAG-3表达均无明显下降(P>0.05)(见图5)。
讨 论
针对PD-L1的免疫抑制剂改善了NSCLC患者的生存率,然而PD-L1表达和治疗获益之间的差异也经常出现。有研究表明,肺腺癌细胞中生长因子依赖的MAPK信号在IFN-γ诱导的PD-L1表达中起重要作用,MEK1/2抑制剂可降低IFN-γ诱导的PD-L1表达,增加肺腺癌细胞的免疫原性[6-7]。多项针对不同恶性肿瘤的动物实验显示,抑制MEK可通过防止T细胞凋亡,降低骨髓抑制细胞和调节性T细胞的水平来增强抗肿瘤免疫反应,当与PD-L1/PD-1阻断治疗结合时,可造成持续性的肿瘤抑制[8-9]。
在抗PD-L1药物中,阿特珠单抗是一种工程化IgG抗体,其修饰的FC结构域可防止抗体依赖性细胞介导的细胞毒性,已被FDA批准用于NSCLC的二线治疗[10]。有研究显示[11],阿特珠单抗相比多西他赛化疗延长了治疗组和PD-L1阳性患者的生存率,说明无论PD-L1表达如何,阿特珠单抗均能显示出一定的临床疗效。MAPK通路是一种重要的细胞内信号传导通路,能够将生理上多重增殖和分化的信号传递至细胞外环境。在肿瘤疾病中MAPK常会上调,导致不受控制的增殖、侵袭、转移和血管生成。临床前模型表明,靶向MAPK途径能在更广泛的程度上影响肿瘤生长。抑制MEK1和MEK2可抑制MAPK通路[12],司美替尼是一种强效和高选择性的MEK抑制剂,目前与BRAF抑制剂威罗菲尼联合应用于晚期BRAF突变的黑色素瘤患者[13]。此外,MAPK与免疫抵抗有关,抑制MEK可通过向肿瘤部位召集免疫细胞来转化其它耐药肿瘤[14]。
本研究使用体外多细胞培养物证明MEK抑制剂和抗PD-L1药物在NSCLC细胞死亡方面具有显著的协同作用。这种协同作用是MEK抑制剂对癌细胞的直接作用的结果,以及所有能够维持免疫反应和炎症微环境的细胞因子的诱导作用。有研究证明[15-16],在KRAS突变细胞中PD-L1上升,但对造成这种情况的下游途径没有完全阐明。Gao等[17]通过ERK信号证实KRAS突变背景下PD-L1的上调。有研究发现,STAT 3参与了RAS/MEK引起的PD-L1转录调控,为MEK抑制剂和抗PD-L1抑制剂的结合提供了另一个机制[18]。Liu等[19]研究显示,在KRAS突变的NSCLC中,在蛋白质组和转录谱方面存在不同的亚组,包括对抗PD-1/PD-L1免疫治疗耐药的KRAS/LKB1突变患者,免疫和炎症标志物表达低的KRAS/LKB突变患者,以及对单一免疫治疗更敏感的KRAS/TP53突变患者。我们推测,在抗PD-1/PD-L1的基础上加入MEK抑制剂对KRAS突变的患者也有帮助,也可以提高他们对免疫治疗的敏感性。
使用患者特异性衍生MTS模型可以研究肿瘤细胞和T细胞之间的相互作用,识别概括人类白细胞抗原和T细胞受体的特异性[20],此外,通过类器官模型可对不同细胞成分的蛋白质和mRNA的表达进行研究,鉴定参与治疗敏感性或抗性的分子途径[21]。本研究证实,体外肿瘤类器官培养物可用于建立个体化模型以评估MEK抑制剂和抗PD-L1抗体治疗的效果,说明MTS是一个可重复、简单和廉价的模型,可以复制和预测体内临床数据,用于在临床前环境中测试任何免疫治疗药物的效果。MEK抑制剂和抗PD-L1抗体在全球范围内广泛用于恶性肿瘤的治疗,本研究为今后相似的联合实验提供了思路和理论依据。
综上所述,肿瘤的免疫治疗需要新的组合策略来预防和克服对单一疗法的耐药性,并寻找能够预测其敏感性的肿瘤标记物。本研究确定了抗PD-L1抗体与MEK抑制剂联合应用的基本原理,在NSCLC的MTS模型中,双重阻断MEK与PD-L1具有优于单一抑制的疗效。
