甘肃省武威市荷兰豆根腐病病原菌种类的鉴定
2023-06-22张敏刘永刚李惠霞石明明韩变BoakyeThomasAfriyie乔万强魏雪娟
张敏,刘永刚,李惠霞,石明明,韩变,Boakye Thomas Afriyie,乔万强,魏雪娟
(1. 甘肃农业大学植物保护学院,甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070;2. 甘肃省农业科学院植物保护研究所,甘肃省无公害农药工程实验室,甘肃 兰州 730070)
荷兰豆(Pisum sativumvar.saccharatum)属豆科蝶形花亚科豌豆属,是豌豆的变种,属于软荚豌豆[1],又称食荚豌豆。荷兰豆作为重要的蔬菜种类主要食用嫩荚或嫩茎尖,生育周期短,含有大量的维生素、微量元素、胡萝卜素及果糖等成分[2],具有较高的食用价值和应用前景。武威市具有高海拔、无污染和光照充足等优势,荷兰豆的年种植面积超过1 300 hm2[3],该地区生产的荷兰豆作为高原夏菜的重要品种供应着我国南方的夏季蔬菜市场。
根腐病是豌豆的重要病害,一般造成减产10%~30%,重病地区可以减产60%,甚至绝产[4]。以前荷兰豆根腐病在武威市偶有发生,但由于近年来大面积连作和抗病品种的缺乏,该病有加重的趋势,制约了荷兰豆产业的发展。目前对于荷兰豆根腐病病原的研究尚未见报道,其病原是否与豌豆根腐病病原一致,尚不清楚。
据国外报道,豌豆根腐病病原有尖孢镰孢菌Fusrium oxysporum[5]、燕麦镰孢菌F.avenaceum与丝囊霉Aphanomyces euteiches[6],其中以燕麦镰孢菌引起的根腐病最为严重[7]。国内报道的病原菌有几十种,包括茄病镰孢菌F.solani[8]、尖孢镰孢菌F.oxysporum[9]、木贼镰孢菌F.equiseti、根串珠霉Thielaviopsis basicola、腐霉Pythiumspp.、立枯丝核菌Rhizoctonia solani与豌豆丝囊霉A.euteiches[10]等病原,其中尖孢镰孢菌、茄病镰孢菌与豌豆丝囊霉[10]为优势种类。甘肃省定西、榆中及平凉等地豌豆根腐病病原菌种类有多种[11-12],其中以尖孢镰孢菌、茄病镰孢菌与豌豆丝囊霉为优势病种类[13],但在武威市尚缺乏相关研究。
武威市是甘肃省荷兰豆主要种植区域[14],但尚未见根腐病病原的研究和报道,其病原菌和优势种类尚不明确。针对这一现状,本研究拟通过病原菌的分离和鉴定,以期明确武威市荷兰豆根腐病病原及其优势种类,为该病害的及时有效防治提供科学依据。
1 材料与方法
1.1 材料
供试材料:2020~2021年,根腐病样采集自甘肃省武威市天祝藏族自治县荷兰豆种植地。致病性测定用荷兰豆品种为珍绿。
培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、蒸馏水1 L;水琼脂培养基(Water Agar,WA):琼脂15 g、自来水1 L;康乃馨叶片水琼脂培养基(carnation leaves agar,CLA):琼脂15 g、蒸馏水1 L,在培养皿倒入培养基前加入10~15片灭菌康乃馨叶片(3~4 mm2)。
试剂:真菌基因组DNA提取试剂盒,无水乙醇、葡萄糖、琼脂糖,均购于西安擎科生物技术有限公司(西安)。
1.2 试验方法
1.2.1 荷兰豆根腐病病原菌的分离纯化 采用组织分离法分离荷兰豆根腐病病原物。从植株病健交界处剪取约0.5 cm2病组织,用75%酒精浸30 s,无菌水冲洗3次后,用灭菌滤纸吸干,放置于PDA 上,于(25±1)℃培养箱中培养。采用单孢分离法纯化病原菌:将孢子悬浮液稀释至10倍镜视野下有5~8个孢子,用1 mL无菌注射器将悬浮液转移至WA培养基上,于(25±1)℃培养箱中培养。12 h后,用无菌针头挑取萌发的孢子,于WA培养基培养。待纯化后,于4 ℃冰箱保存备用。
1.2.2 荷兰豆根腐病病原菌的形态学鉴定 将纯化的菌株接种于PDA 与CLA 培养基上,置于(25±1)℃下全黑暗培养,7 d 后观察其在PDA 培养基上的菌丝形状和色素产生情况,并拍照记录。在CLA 中放入灭菌的盖玻片,15 d 后于显微镜下观察CLA 培养基上分生孢子形态。形态学鉴定参考John.F Leslie 等[15]和王拱辰等[16]的方法,进行初步鉴定。
1.2.3 荷兰豆根腐菌株基因组DNA 的提取 采用真菌基因组DNA试剂盒提取病原菌DNA。PDA培养基培养7 d后将菌丝刮下,在灭菌的研钵中加液氮研磨成粉末,具体试验步骤参照试剂盒说明书进行。供试菌株的基因组DNA于-20 ℃保存,备用。
1.2.4 PCR 扩增和序列测定 利用rDNA-ITS序列引物ITS1(5'TCCGTAGGTGAACCTGCGG3')和ITS4(5'TCCTCCGCTTATTGATATGC3')与翻译延长因子TEF-1α 序列扩增引物EF-1H(5'ATGGGTAAGGAGGACAAGAC3')和EF-2T(5'GGAAGTACCAGTGATCATGTT3')进行PCR扩增,所用引物由西安擎科生物技术有限公司合成。
以供试菌株DNA为模板,用ITS1和ITS4引物对目标菌株ITS进行PCR扩增。扩增条件为:94 ℃预变性3 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸10 min,4 ℃保存。以dd H2O为阴性对照。扩增体系为25 μL(表1),扩增产物在1.0 %琼脂糖凝胶上电泳20 min,凝胶成像系统中确认目的片段后,将PCR产物送西安擎科生物技术有限公司(西安)进行测序。测序结果于NCBI(https://www.ncbi.nlm.nih.gov/)BLAST 比对,下载相似度较高的序列,使用BioEdit 7.0.5 进行比对分析,以Gibberella zeae(DQ459820)和Plectosphaerella cucumerina(EU594566)为外群,用MEGA 6.06以邻近相接法(Neighbor-joining,NJ)构建系统发育树,以确定病原菌的种类。

表1 目的基因序列PCR反应体系Table 1 DNA sequencing PCR reaction system
1.2.5 病原菌致病性测定 在甘肃农业大学温室内进行致病性测定,试验采用根部刺伤接种法。5%的次氯酸钠浸泡后50 ℃水浴锅中烫种15 min,30 ℃的温水浸种4 h,将种子平铺在托盘中催芽7 d,种子露白后种入花盆,待荷兰豆苗子长至6 cm 左右进行致病性试验。病原菌加无菌水洗脱孢子制成1×106个/mL的孢子悬浮液,组培瓶中装入50 mL孢子悬浮液,以无菌水为对照。无菌针头刺伤荷兰豆根部,孢子悬浮液中浸泡12 h后,移栽至小花盆。每盆种植1 株,共16 个处理,1 个对照,每个处理重复3次。置于人工气候箱中培养(18~25 ℃、16/8 光周期、3 000 lx),1 周后观察发病情况。参考张丽娟等[17]的荷兰豆根腐分级标准分级(表2),统计病原菌对荷兰豆的发病率与病情指数。
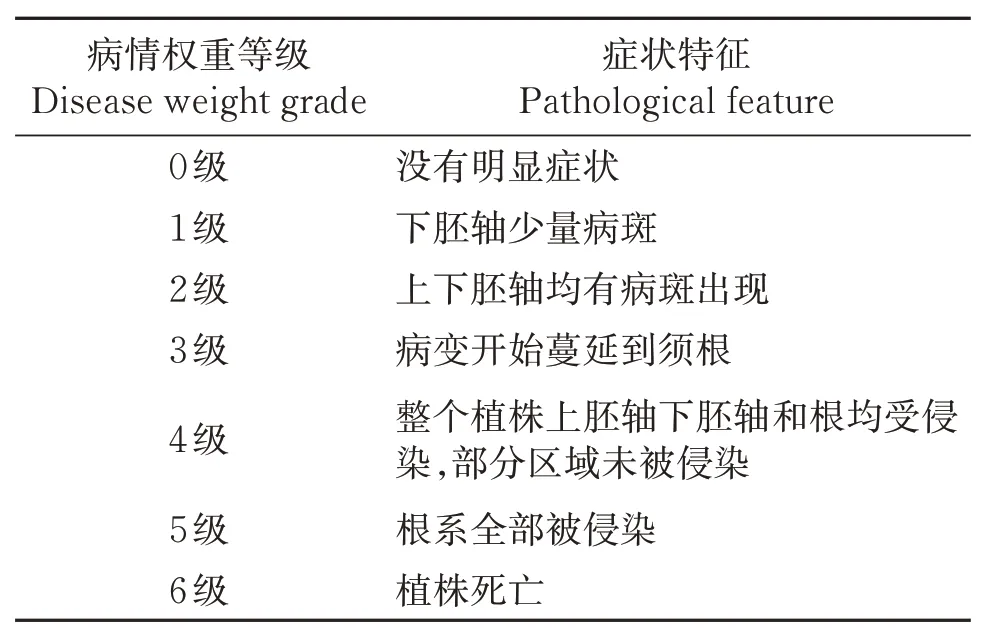
表2 荷兰豆根腐的病情分级标准Table 2 Disease classification standard of snow pea root rot
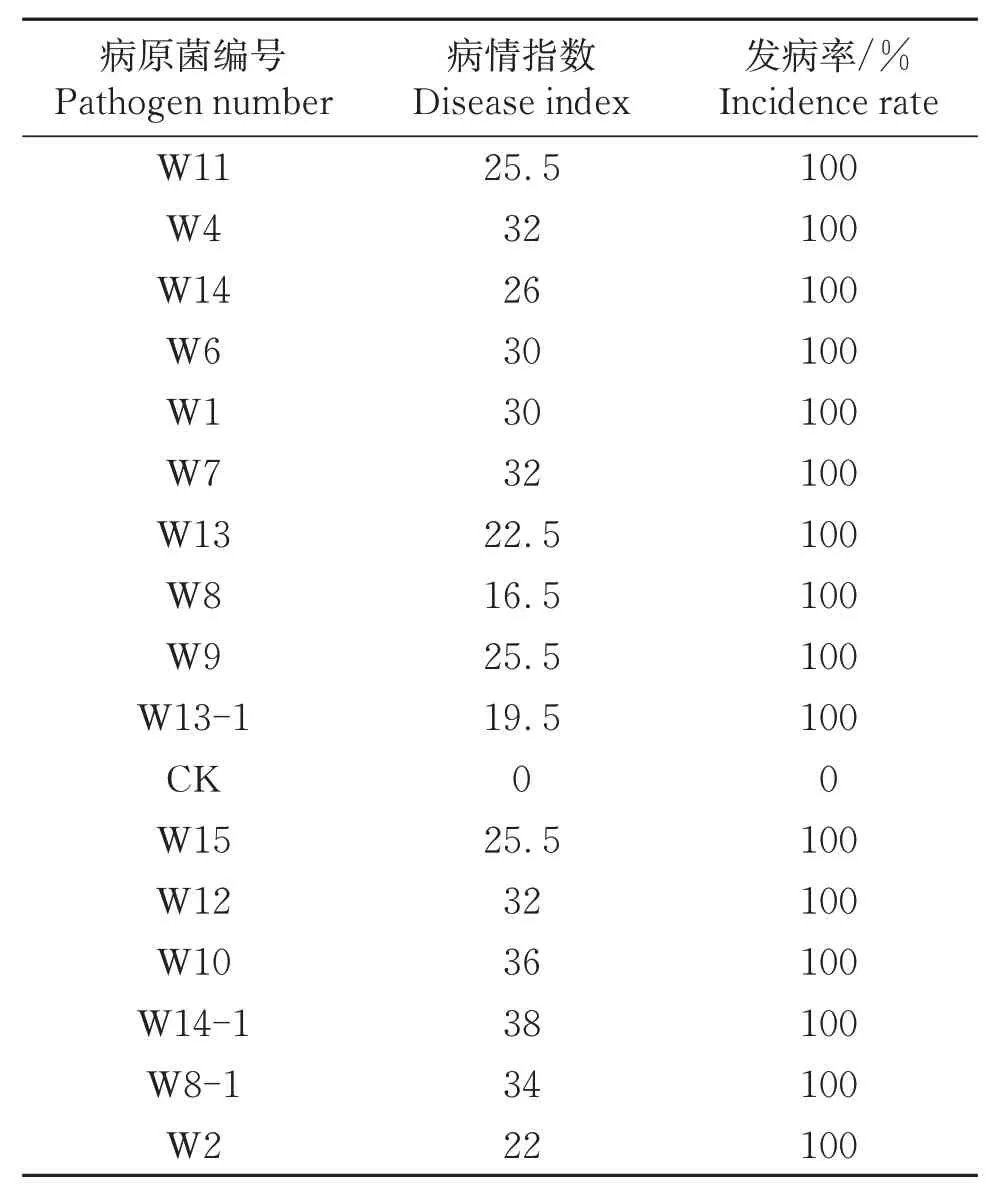
表3 16株镰孢菌对荷兰豆幼苗的致病性测定Table 3 Pathogenicity test of 16 strains of Fusarium spp.on snow pea seedlings
待植株发病后,按照1.2.1中的方法再次分离病原,观察菌落、孢子形态,同时提取其DNA,PCR 扩增后测序后比对分析。
1.3 数据分析
试验数据采用Excel 2007 与SPSS 19.0 软件进行统计分析,应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 荷兰豆根腐病症状描述
荷兰豆根腐病在田间零星分布。症状表现为病株生长缓慢,矮小,整个根系变褐,叶片发黄,越靠近地面叶片发黄愈加明显。地上茎部表现枯黄,茎基部为红褐色,根部逐渐变色,发病轻的植株仍可开花结荚,但籽粒不饱满,严重植株地下茎及根部全部变成褐色至腐烂(图1)。

图1 武威市荷兰豆根腐病田间症状Figure 1 Field symptoms of snow pea root rot in Wuwei City
2.2 荷兰豆根腐病病原的分离结果
经分离纯化,获得16株镰孢菌。根据菌落形态和色素、菌丝生长状态及孢子形态,将镰孢菌菌株初步归为2组。
2.3 形态学鉴定
以菌株W2 为代表组,在PDA 平板上培养4 d后,菌落直径为38.2~38.5 mm。菌落分布均匀,菌丝白色,稀疏,光滑有隔膜、分支。在CLA培养基上大型分生孢子单瓶梗产孢,无色纺锤形或镰刀型,较宽、粗壮、直或弯曲,多数3 个隔膜,大小(24.15~33.08)μm×(3.51~5.27)μm。小型分生孢子呈假头状,卵圆形、椭圆形或肾形,有隔或无隔,大小(6.207~11.212)μm×(2.079~3.881)μm;厚垣孢子无色,球形单生,多在菌丝中间或者短的侧枝上形成(图2)。依据上述形态特征,将W2、W4、W6、W1、W7、W13、W11、W9、W13-1、W12、W10、W8-1 与W8归为一组,初步鉴定为茄病镰孢菌F.solani。
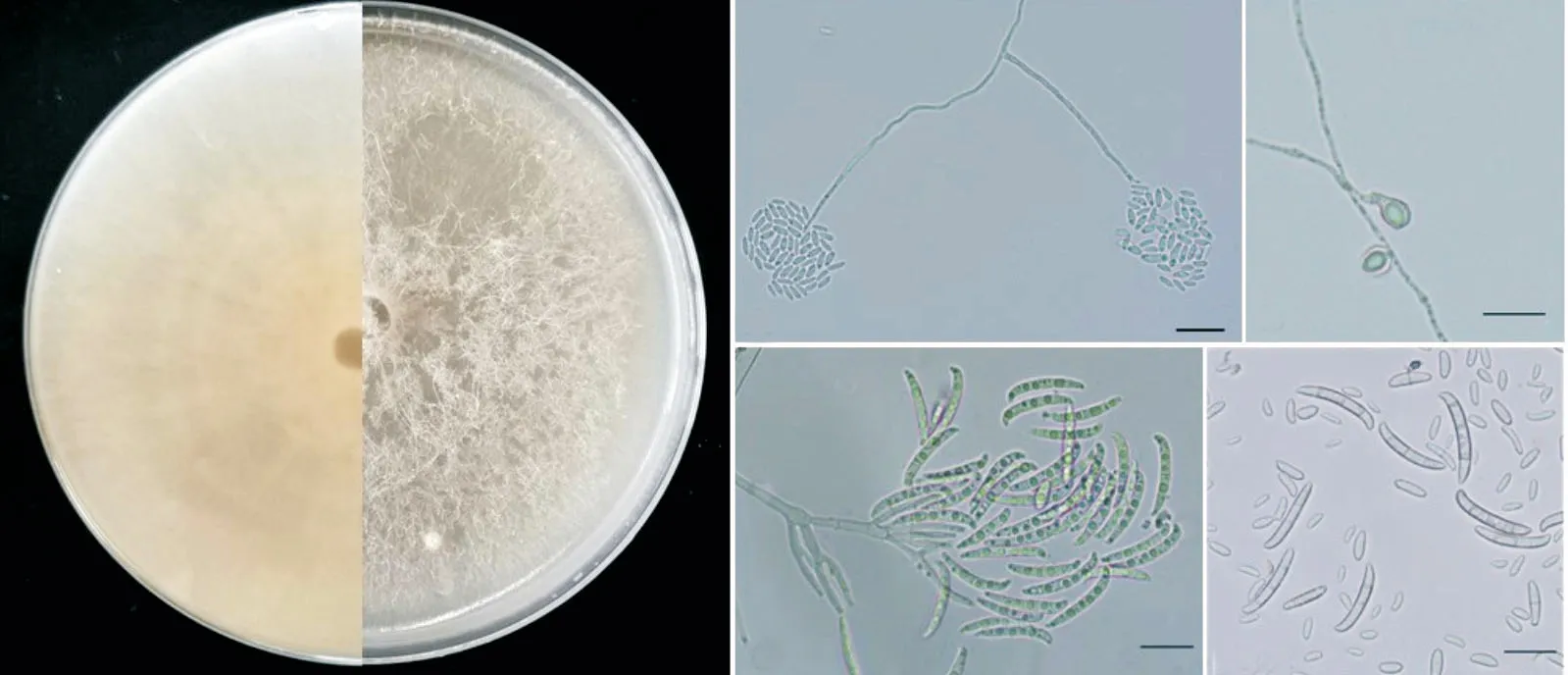
图2 茄镰孢菌W8培养性状与形态特征Figure 2 Cultural and morphological characteristics of Fusarium solani W8
以菌株W15 为代表组,在PDA 培养基上培养4 d 后,菌落直径为34.7~35.7 mm。菌落中间土黄色,边缘紫红色,有明显的同心轮纹。在CLA 培养基上,单瓶梗产孢,大型分生孢子鳗鱼形,细长,顶细胞和足细胞明显,多数5 个隔膜,大小(47.31~68.51)×(3.14~4.19) μm。小型分生孢子呈卵形或棍棒形,0~1 隔,大小(11.072~19.60)μm×(2.83~4.50) μm。依据上述形态特征将W15、W14与W14-1 归为一组,初步将该组病菌鉴定为燕麦镰孢菌F.avenaceum(图3)。

图3 燕麦镰孢菌W14培养性状与形态特征Figure 3 Cultural and morphological characteristics of Fusarium avenaceum W14
2.4 代表菌株分子生物学鉴定
2.4.1 rDNA-ITS 序列分析 采用通用引物ITS1/ITS4 扩增后测序,经GenBank 数据库中BLAST 比对和MEGA 系统发育树分析。结果表明,3个株菌的ITS序列聚为2支。第I组包括W1与W2 菌株,位于系统发育树的同一支,该类菌与茄镰孢菌F.solani的ITS 序列聚为一支,同源性最近,遗传距离为0,登录号分别为MK110648、EU263916、MH855484和MW710931,将其鉴定为茄病镰孢菌。第II 组代表菌株W15 与燕麦镰孢菌F.avenaceumOK331346 和MW016665 的ITS 序列聚为一支,与燕麦镰孢菌的遗传近距离为0,相似性为100%,故将其鉴定为燕麦镰孢菌(图4)。
2.4.2 基于EF-1α 序列的系统发育树 以3 株代表菌株的DNA为模板,采用TEF-1α基因特异性引物EF-1H/EF-2T 扩增得到600 bp 左右的目的片段。经NCBI中比对分析,代表菌株与燕麦镰孢菌与茄病镰孢菌的相似度高达99%以上。利用MEGA构建系统发育树与rDNA-ITS序列的系统发育树结果相似。病原物聚为2类,第I类代表菌株W1和W2与茄镰孢菌的TEF 序列聚为一个分支,同源性达99%,登录号分别为MG857318 与MH822037,将其鉴定为茄病镰孢菌。第II类代表菌株W15与燕麦镰孢菌聚在一起,同源性为100%,登录号分别为MK572748、MN958288、MK937121,与形态鉴定结果相符,将其鉴定为燕麦镰孢菌(图5)。

图5 基于EF-1α序列构建荷兰豆根腐病2种病菌与相关菌株的系统发育树Figure 5 Phylogenetic tree of two pathogens and other related strains based on the EF-1α sequences
2.5 荷兰豆根腐致病性测定
致病性试验与根腐病田间症状基本一致(图6)。从病株重新分离的病原菌经形态学和分子生物学鉴定,与接种的病原菌相同,符合柯赫氏法则。表明这16 株菌是荷兰豆根腐致病菌,其病情指数为16.5~38,其中菌株W14-1病情指数最高为38,菌株W8病情指数最低为16.5。接种16 株病菌后,发病率为100%,而对照未发病。

图6 16株镰孢菌对荷兰豆幼苗的致病性测定结果Figure 6 Results of pathogenicity test of 16 strains of Fusarium spp.on snow pea
3 讨论
豌豆可分为软荚豌豆和硬荚豌豆,硬荚豌豆即为豌豆,也叫粮用豌豆,以生产豌豆粒为主,但其嫩荚也可作蔬菜食用[1]。软荚豌豆就是荷兰豆,也叫食荚豌豆,主要以嫩荚作为蔬菜食用,一般不用于生产豌豆粒[18]。荷兰豆与豌豆在外形上有明显的差异,豌豆豆荚厚籽粒饱满,颜色偏浅,豌豆花冠颜色多样,多为紫色或红色。荷兰豆豆荚皮较薄,籽粒很小,外形呈扁平状,豆荚颜色偏深绿,花冠颜色主要为白色,生育期较短,且收获时间早于豌豆[19]。
目前,虽然有关豌豆根腐病病原的研究较多,但关于荷兰豆根腐病病原种类尚未见报道。引起荷兰豆根腐病的病原有多种,不同的地区病原和优势种类不尽相同。国外报道籽用豌豆根腐病病原有尖孢镰孢菌[20]、燕麦镰孢菌与丝囊霉Aphanomyces euteiches[21],以燕麦镰孢菌为重要病原。目前国内已报道有数十种病原菌可以导致豌豆根腐病的发生,茄病镰孢菌F.solani和尖孢镰孢菌F.oxysporum是北京地区的优势病原[9],在青海茄病镰孢菌和豌豆丝囊霉Aphanomyces euteiches具有较强致病力[10],福建省豌豆根腐病由多种病原复合侵染,茄病镰孢菌和丝囊霉致病力最强[22]。本研究在甘肃省武威市分离得到的荷兰豆根腐病原为茄病镰孢菌和燕麦镰孢菌,以茄病镰孢菌为优势种类,这一结果与豌豆根腐病的病原不完全一致。甘肃省豌豆根腐病病原菌种类较多[23-24],定西、榆中及平凉地区以茄病镰孢菌、尖孢镰孢菌与豌豆丝囊霉为豌豆根腐病优势病原菌[12]。据孙顺娣等[25]早期报道,甘肃省籽粒豌豆根腐病病原优势种类为茄病镰孢菌,说明茄病镰孢菌分布较广,既是豌豆根腐病,也是荷兰豆根腐病的优势病原。本研究发现燕麦镰孢菌是引起武威市荷兰豆根腐病病原之一,甘肃其他地区尚未见报道其是否为豌豆根腐病病原。试验还发现,虽然燕麦镰孢菌分离频率较低,为18.75%,但个别菌株如W14-1 致病力较强,病情指数最高,为38.0。武威市是甘肃省燕麦主产区,而燕麦镰孢菌是燕麦根腐病的主要病原菌[26],推测该地区燕麦和荷兰豆轮作可能是造成这一结果的原因之一。关于该地区荷兰豆根腐病发生危害和造成的损失,病害的发生规律,及其病原种类与种植制度的关系还需要进一步调查研究。
镰孢菌的形态复杂,在生长过程中形态变异较大,形态鉴定很难准确地将其鉴定到种[27]。随着分子生物学的发展,将内转录间隔区ITS、线粒体小亚基核糖体mtSSU、β微管蛋白和翻译延长因子TEF-1α 逐渐用于镰孢菌的鉴定[28],尤其以利用ITS 和TEF-1α 更为普遍[29]。TEF-1α 序列中EF-1α 位点核苷酸的替换率高,较ITS序列有较多的种间变异,对亲缘关系较近的镰孢菌有较高分辨力,是镰孢菌属真菌鉴定的有效方法[30]。目前,镰孢菌的鉴定均采用在形态学观察的基础上,选择特异基因片段对其进行鉴定,但对于镰孢菌亲缘关系较近的种和复合种,单一片段很难准确鉴定,还需挖掘更多的基因片段或多基因联合才能更准确地鉴定[27]。本试验利用形态学鉴定,ITS和TEF序列联合分析的方法,鉴定了甘肃省武威市荷兰豆根腐病的病原。其他研究者[31]也利用ITS和TEF序列联合分析,鉴定辣椒根腐病原菌。
4 结论
本研究明确了甘肃省武威市荷兰豆根腐病病原为茄病镰孢菌与燕麦镰孢菌,其中茄病镰孢菌为优势种类,分离频率81.25%;燕麦镰孢菌分离频率为18.75%。室内致病性测定发病率为100%,病情指数为16.5~38.0,其中菌株W14-1 病情指数最高为38.0,菌株W8病情指数最低为16.5。
