丽江百合组织培养及再生体系建立
2023-05-29刘晶荣代思奇刘才磊向元芬李意峰潘远智贾茵
刘晶荣 代思奇 刘才磊 向元芬 李意峰 潘远智 贾茵

摘要 为我国特有易危种丽江百合(Lilium lijiangense)的种质资源保护、快速繁殖及园林应用奠定基础,以野生丽江百合鳞片为外植体,探究其最佳灭菌方法,鳞茎不同部位诱导不定芽的能力,以及不同植物生长调节剂对丽江百合愈伤组织及不定芽诱导、不定芽增殖、生根结鳞茎的影响。结果表明,丽江百合鳞片最佳灭菌方案为5% NaClO 8 min+75%乙醇30 s;鳞片分化能力为基部>中部>上部;愈伤组织和不定芽诱导最佳培养基配方为MS+2.0 mg/L 6-BA+0.1 mg/L NAA;不定芽增殖最佳培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA;最佳生根结鳞茎培养基为1/2MS+0.1 mg/L NAA+0.01 mg/L IBA。该研究成功建立了一套适宜丽江百合的组织培养和再生体系。
关键词 丽江百合;组织培养;再生体系;鳞片;快速繁殖
中图分类号 S682.2+65 文献标识码 A 文章编号 0517-6611(2023)09-0038-04
doi:10.3969/j.issn.0517-6611.2023.09.010
Abstract In order to lay a foundation for the germplasm protection,rapid propagation and garden application of Lilium lijiangense,an endemic vulnerable species in China,this paper took the scales of wild L.lijiangense as explants,the best sterilization method,the ability of inducing adventitious buds in different scale parts,and the effects of different plant growth regulators on callus and adventitious bud induction,bud proliferation,rooting and buld proliferation of L.lijiangense were studied.The results were as follows:The best sterilization scheme was 5% NaClO 8 min+75% alcohol 30 s;The differentiation ability of scales was base>middle>upper; The best medium for callus and adventitious bud induction was MS+2.0 mg/L 6-BA+0.1 mg/L NAA; The best medium for adventitious bud proliferation was MS +1.0 mg/L 6-BA+0.2 mg/L NAA;The best rooting and bulb proliferation medium was 1/2MS+0.1mg/L NAA+0.01 mg/L IBA.Overall,a set of tissue culture and regeneration system suitable for L.lijiangense is successfully established.
Key words Lilium lijiangense;Tissue culture;Regeneration system;Scale;Rapid propagation
基金項目 大学生创新训练计划项目(2121998000);国家自然科学基金(32001356)。
作者简介 刘晶荣(1999—),女,四川自贡人,从事园林植物资源与应用研究。*通信作者,副教授,博士,从事园林植物资源与应用研究。
百合(Lilium spp.)即百合科(Liliaceae)百合属(Lilium)植物的统称。百合花大姿丽,有色有香,具有很高的观赏价值,适宜作切花、盆花、花坛、花境等,还具有食用和药用价值[1]。百合属原产于中国,主要分布在北半球的温带地区,如东亚、欧洲和北美。该属植物约109种,中国有55种。丽江百合(L.lijiangense)为多年生球根花卉,分布于我国四川西部及云南西北部海拔3 300~3 400 m林下。其花序总状,花漏斗形,花被片反卷,黄色,有紫色斑点,先端红色,有极高的观赏价值[2]。由于自然灾害和人为破坏的影响,丽江百合自然条件下更新困难,野生资源十分稀少,已被列入《世界自然保护联盟濒危物种红色名录》(IUCN)中[3],属易危种。因此对丽江百合资源开展保护和繁育研究迫在眉睫。
百合传统的繁殖方法有分球繁殖、鳞片扦插和珠芽繁殖等[4],存在繁殖系数较低、时间长、耗费劳动力、受限于当地的气候条件和地理位置等缺点[5],这在一定程度上限制了丽江百合资源的保护和利用。植物组织培养技术与传统技术相比具有繁殖系数高、周期短、不受季节和自然条件限制、便于大规模生产等优点被广泛运用于百合的离体快速繁殖中[6]。目前,尚未见丽江百合离体再生和快繁体系构建的报道。
笔者以野生丽江百合鳞片不同部位为外植体,选用不同的培养基,采用不同灭菌时间,通过培养基中加入不同浓度的植物生长调节剂,探究丽江百合鳞片最佳的灭菌时间组合;外植体最佳部位;培养基中6-BA、2,4-D、NAA等激素不同配比方式以及不同浓度对丽江百合不定芽和愈伤组织的影响;无菌苗继代扩繁的最佳激素配比;丽江百合最佳生根培养基。最终利用组培快繁技术获得丽江百合组培苗,建立完善的丽江百合再生体系,为该种质的资源保护、育种及开发提供了有利的参考价值。
1 材料与方法
1.1 试验材料和培养环境
以原产于四川省阿坝藏族羌族自治州汶川县的野生丽江百合种球为材料,存放在湿润的木屑中,放置于(4±1)℃冰箱中低温保存。选取种球鳞片为外植体。
试验于2020年10月至2021年10月在四川农业大学成都校区(103°51′E,30°42′N)组织培养室进行。光照条件为2 000 lx,光照10 h/d,温度控制在(25±1)℃,空气相对湿度70%~80%。
1.2 培養基配方
启动培养基为MS及1/2MS培养基,培养基中均添加30 g/L 蔗糖和6.5 g/L 琼脂,pH 5.8~6.0。预培养基以MS为基本培养基,添加1.0 mg/L 6-BA和0.1 mg/L NAA。愈伤组织和不定芽诱导培养基以MS为基本培养基,添加1~2 mg/L 6-BA、0.1~0.5 mg/L NAA和1~2 mg/L 2,4-D。不定芽继代增殖培养基以MS为基本培养基,添加1~3 mg/L 6-BA和0.2 mg/L NAA。生根结鳞茎培养基以1/2MS为基本培养基,添加0.1 mg/L 6-BA和0~0.05 mg/L IBA。在121 ℃下高压灭菌20 min。试验设置3次生物学重复。
1.3 外植体消毒及接种
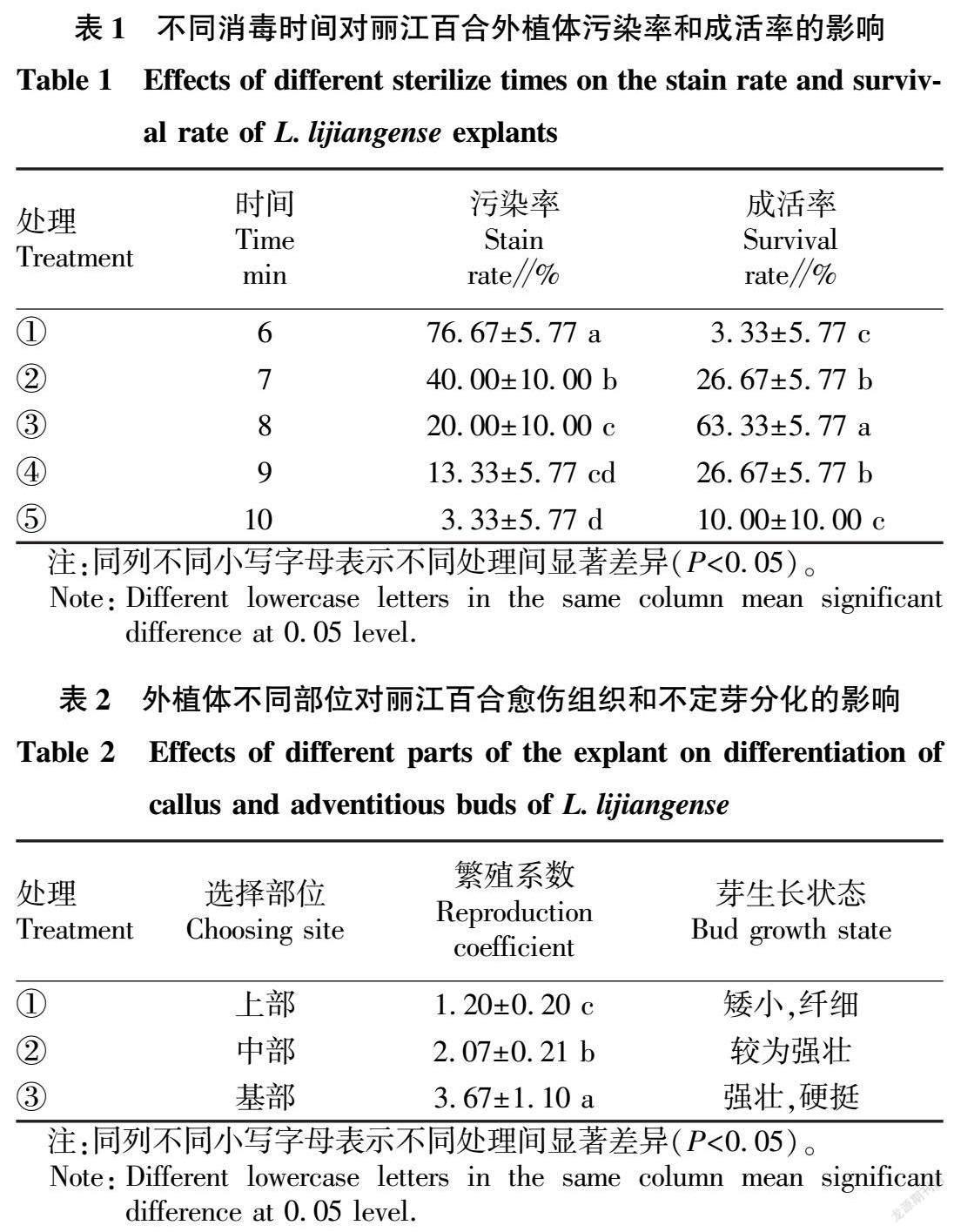
选取生长情况良好、健康、无病的鳞片,用洗洁精洗去表面污渍后置于烧杯中,用纱布封口,流水下冲洗3 h。在超净工作台上将鳞片用75%乙醇浸泡30 s,再用5% NaClO溶液处理6~10 min(表1),无菌水冲洗3~5次。消毒完毕后,将鳞片分割为0.5 cm×0.5cm小块,接种于预培养基上。20 d后统计污染率。
1.4 鳞片不同部位外植体再生能力比较
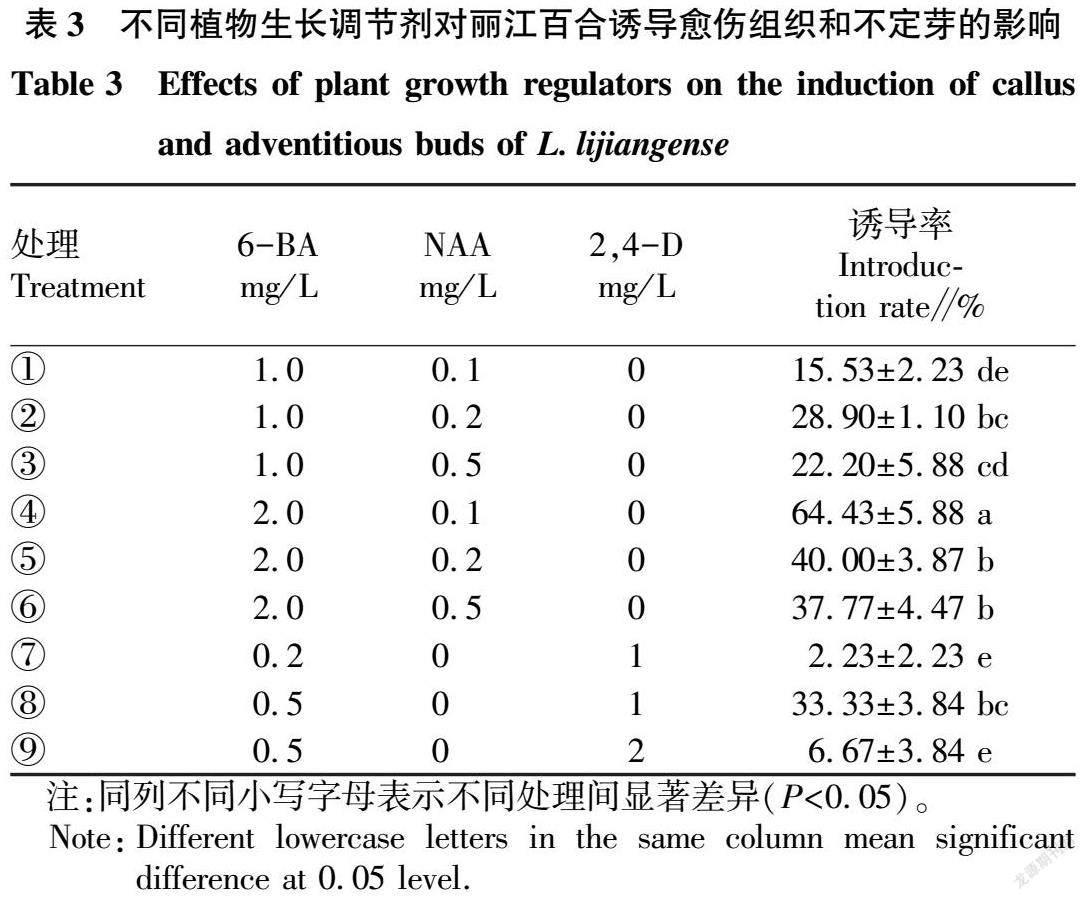
取种球接近中心部位的鳞片按照约0.5 cm×0.5 cm的规格分割为上部、中部、基部3部分,分别接种在预培养基上(表2),进行鳞片不同部位不定芽诱导率的对比。25 d后统计鳞片再生情况。
1.5 愈伤组织和不定芽的诱导
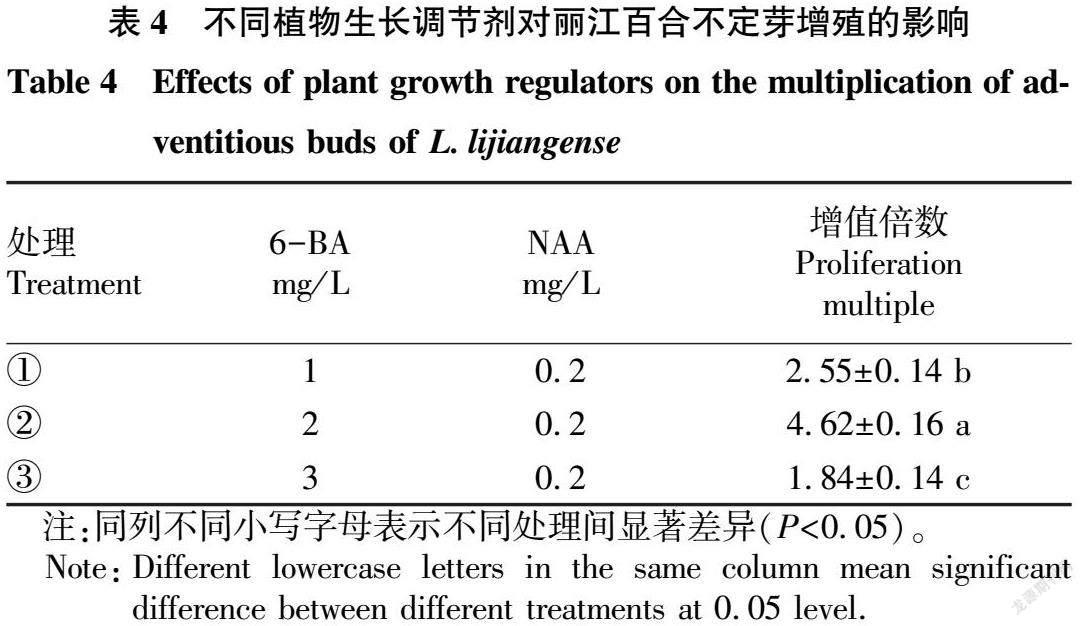
将上述试验所得最佳外植体部位接种在诱导培养基中。共设置9个处理(表3),30 d后统计诱导率。
1.6 不定芽的继代增殖
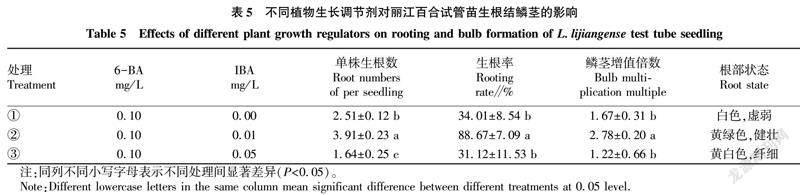
将诱导得到的不定芽切割成单芽,接种于增殖培养基中(表4)。观察30 d记录生长情况。
1.7 生根结鳞茎培养 将株高3~4 cm生长健壮的丽江百合不定芽幼芽单个切下,接种于生根结鳞茎培养基中(表5)。30 d后对组培苗的生根结鳞茎情况进行统计。
1.8 炼苗与移栽
当苗高5~6 cm、根长2~3 cm、根为乳白色至黄绿色时,将培养瓶置于室温下,逐渐将封口膜打开,炼苗4~5 d。然后将苗小心取出,用自来水将根上培养基冲洗干净,擦干。移栽到经过50%赴美双可湿性粉剂1∶500喷雾消毒的基质中,基质成分配比为珍珠岩∶营养土∶蛭石=1∶1∶1 (V/V/V)。移栽60盆,每盆1株。移栽后浇透水,置于有散射光的阴凉处。7 d后进行正常光照和常规水肥管理,观察40 d其生长情况。
1.9 数据分析
采用Microsoft Office Excel 2010软件整理数据与绘图;SPSS 22.0软件进行One-Way ANOVA统计分析,采用Duncan方法进行多重比较及差异显著性检验。
污染率=染菌数/接种总数×100%
成活率=成活数/接种总数×100%
繁殖系数=丛生芽数/接种总数
诱导率=出芽外植体数/接种外植体总数×100%
增殖倍数=增殖芽数/接种总芽数
生根率=生根组培苗数/接种组培苗数×100%
2 结果与分析
2.1 不同灭菌时间对外植体成活率及污染率的影响
由表1可知,使用5% NaClO不同灭菌时间处理下的外植体污染率和成活率有显著差异。随着灭菌时间的增加,外植体污染率逐渐下降,成活率则呈先增加后下降的趋势。灭菌时间最短为6 min时,污染率最高,达76.67%;灭菌时间最长为10 min时,污染率最低,但成活率仅为10.00%;灭菌时间为8 min时,成活率最高,达63.33%,此时污染率为20.00%。因此,综合外植体污染率与成活率,灭菌时间8 min最宜,在相对较少的染菌情况下,保证外植体最大的成活率和分化可能性。
2.2 鳞片不同部位外植体再生能力比较 由表2可知,丽江百合的同一种球鳞片上、中、基部分化能力不同,差异显著。分化能力从上到下依次增强,基部的分化能力最强,其繁殖系数为3.67;上部的分化能力最弱,繁殖系数为1.20。进一步观察发现,鳞片基部和中部所分化不定芽较上部更为粗壮、硬挺,鳞片上部分化不定芽植株矮小纤细、脆而易碎。
2.3 植物生长调节剂对丽江百合诱导愈伤组织和不定芽的影响
丽江百合种球鳞片接种后4 d,鳞片渐渐由白色转变为紫色(图1A)。19 d后,鳞片边缘出现嫩绿色小凸起或黄白色愈伤组织。24 d后,原有凸起和愈伤组织的小凸起逐渐形成不定芽。由表3可知,处理④(2.0 mg/L 6-BA+0.1 mg/L NAA)不定芽诱导率最高,为64.43%(图1B),显著高于其他处理;处理⑦(0.2 mg/L 6-BA+1 mg/L 2,4-D)不定芽诱导率最低,仅为2.23%(图1C)。当NAA浓度不变时,改变6-BA(1~2 mg/L)浓度,诱导率随着6-BA浓度的增加而上升。但当6-BA浓度为2 mg/L时,诱导率反而随着NAA浓度的增加而下降。在进行丽江百合的组培时,可以适当增加6-BA浓度,相对减少2,4-D浓度,这样更有利于愈伤组织和不定芽的诱导。
2.4 不同植物生长调节剂对丽江百合不定芽增殖的影响
单芽移栽到增殖培养基一段时间后,丛生芽增殖逐渐趋于平稳(图1D)。由表4可知,不同处理之间差异显著,处理②(2.0 mg/L 6-BA+0.2 mg/L NAA)增殖倍数最大(图1E),为4.62;处理③(3.0 mg/L 6-BA+0.2 mg/L NAA)增殖倍数最小(图1F),为1.84。由此可见,6-BA浓度变化对不定芽增殖影响很大,当6BA浓度为2.0 mg/L时不定芽增殖效果最佳。另外,过高的6-BA浓度(3.0 mg/L)会造成不定芽的干枯,长势減弱。
2.5 不同植物生长调节剂对丽江百合组培苗生根结鳞茎的影响
不定芽接种10 d左右逐渐形成小鳞茎,15 d后开始生根并伴有鳞茎增殖。由表5可知,处理②(0.10 mg/L 6-BA+0.01 mg/L IBA)生根率(88.67%)和鳞茎增殖倍数(2.78)显著高于其他处理,且鳞茎根部长势也最佳,根茎粗壮,呈黄绿色(图1G);处理③(0.10 mg/L 6-BA+0.05 mg/L IBA)鳞茎增殖倍数和生根情况最差,鳞茎增值倍数仅为处理②的0.44倍,生根率仅为处理②的0.35倍。表明丽江百合小鳞茎生根结鳞茎对IBA敏感,在一定范围增加IBA浓度能够促进生根数量和长势,过量则会起到抑制作用。
2.6 试管苗移栽
将生根苗进行移栽,7 d后植株抽发新叶(图1I),成活率可达95%。
3 结论与讨论
研究表明,外植体生理状态对组织培养起着关键作用,即便是同一百合种球的鳞片分化能力也存在差异,其鳞片产生愈伤组织或不定芽的能力从高到低依次为内层、中层、外层[7]。该研究采用丽江百合内层鳞片为外植体,避免了外层鳞片因衰老或损伤带来的影响,有效地增加丽江百合分化可能性。该研究发现,丽江百合的鳞片上部、中部、基部分化能力也有差异,其中基部分化能力最强。外植体的部位与小鳞茎的发生之间有某种联系,即肥厚的基部鳞片容易分化出小鳞茎,且繁殖系数显著高于其他部位,这与王爱勤等[8]关于百合鳞片的研究结果一致。
在消毒过程中,NaClO的使用时间是关键。该研究采用5个不同消毒时间进行对比,当消毒时间为6 min时,污染率达76.67%,而当消毒时间为10 min时,污染率仅为3.33%。在污染率高的处理中,丽江百合鳞片几乎不能存活。这说明微生物在培养基中繁殖生长会严重影响离体培养材料的生长甚至存活,这与柯义强等[5]在兰州百合(L.davidii var.willmottiae)中的研究结果一致。当消毒时间超过8 min时(8~10 min),虽然污染率大大下降,但同时鳞片成活率以及产生不定芽的能力也随之而降低。这证明NaClO在一定时间范围对丽江百合的消毒有效,当超过时间限度时,便会对鳞片和不定芽产生毒害作用,这与Luis等[9]在洋葱(Allium cepa)组培中的研究结果一致。
在进行不定芽诱导时,通常将生长素类(NAA和2,4-D)与细胞分裂素类(6-BA)搭配使用[10]。但进行不同的百合组培时,浓度比例有较大差别[11-14]。当6-BA浓度为2 mg/L时,诱导率随着NAA浓度的增加而下降,从64.43%(0.1 mg/L NAA)下降到37.77%(0.5 mg/L NAA)。即在6-BA处于较高浓度时,低浓度NAA有利于不定芽诱导。这可能是过量生长素会引起乙烯生成,从而抑制了不定芽的诱导[15]。该研究中6-BA与2,4-D搭配也具有诱导效果,但没有前者显著,所以不予考虑。丽江百合的鳞片诱导过程中,鳞片易直接生长不定芽,较少部分先产生愈伤组织,再由愈伤组织进一步分化得到不定芽和小鳞茎,这与张文婷等[16]在金黄花滇百合(L.bakerianum var.aureum)组培中结果相反。这可能是鳞片周围的愈伤组织导致输导组织运输不畅,影响组培苗生长[17]。由此可知,丽江百合的再生可直接采用鳞片进行不定芽分化,此途径较使用愈伤组织进行分化更为方便快捷。
在生根和鳞茎增殖阶段,一定浓度范围内的IBA对鳞茎生根具有促进作用,但当浓度超过一定限度时,IBA会加快百合根部老化,根的生长便受到了抑制,这与张彦妮等[18]研究结果一致。此外,与韦海忠等[19]关于不同生根培养基对野生百合生根影响的研究有所不同的是,在丽江百合生根培养基中未添加活性炭。该研究的预试验发现,添加活性炭的试管苗皆出现叶片发白及植株枯萎的现象。活性炭不仅不能促进生根,反而明显地抑制生根,分析原因可能是活性炭吸附了培养基中的生长素[20]。
该研究以丽江百合鳞片为外植体,120 d可完成不定芽及愈伤组织诱导、增殖、生根、炼苗、移栽等过程,最终成功实现丽江百合组织培养以及再生体系的建立,获得大量健康的组培苗。与自然繁殖相比,该研究大大提高了其繁殖系数,为丽江百合种质资源保护、遗传育种及园林应用奠定基础。
参考文献
[1] AZERI F N,ZTRK G.Microbulb and plantlet formation of a native bulbous flower,Lilium monodelphum M.Bieb,var.Armenum,through tissue culture propagation[J/OL].Biotechnology reports,2021,32[2022-02-15].https://doi.org/10.1016/j.btre.2021.e00665.
[2] 彭隆金.云南百合一新种[J].云南植物研究,1984,6(2):189-191.
[3] 中国珍稀濒危植物信息系统(ISCREP)[DB/OL].[2022-02-15].http://www.iplant.cn/rep/prot/Lilium%20lijiangense.
[4] 朱立,储蓉,周艳,等.贵阳地区几种百合引种栽培试验研究[J].种子,2010,29(8):120-121.
[5] 柯义强,郭鹏辉,马洪鑫,等.兰州百合组培快繁体系的构建[J].浙江农业学报,2020,32(6):1000-1008.
[6] BAKHSHAIE M,KHOSRAVI S,AZADI P,et al.Biotechnological advances in Lilium[J].Plant cell reports,2016,35(9):1799-1826.
[7] 王刚,杜捷,李桂英,等.兰州百合和野百合组织培养及快速繁殖研究[J].西北师范大学学报(自然科学版),2002,38(1):69-71.
[8] 王爱勤,何龙飞,温庆兰,等.百合组培中鳞片处理及其颜色变化与鳞茎形成的关系[J].园艺学报,2004,31(1):117-119.
[9] LUIS A C V,JOS L C G,LUIS F V M,et al.Cytotoxic effect of sodium hypochlorite (NaClO) in apical cells of onion roots (Allium cepa L.)[J].Revista colombiana de ciencias hortícolas,2017,11(1):97-104.
[10] 张旭红,王頔,梁振旭,等.欧洲百合愈伤组织诱导及植株再生体系的建立[J].植物学报,2018,53(6):840-847.
[11] 孙君社,方晓华.植物激素对百合鳞片愈伤组织生长的影响[J].中国农业大学学报,2001,6(2):58-61.
[12] 李莺,李星,李生玲,等.‘黄天霸’百合花器官愈伤组织诱导及植株再生[J].热带作物学报,2013,34(8):1507-1512.
[13] 田山君,裴芸,牛力立,等.卷丹百合脱毒与快繁技术研究[J].种子,2020,39(5):157-162.
[14] 潘理云,张海洋.宜兴百合组培快繁技术的研究[J].安徽农业科学,2012,40(10):5748-5750.
[15] VAN AARTRIJK J,BLOMBARNHOORN G J,BRUINSMA J.Adventitious bud formation from bulbscale explants of Lilium speciosum Thunb.in vitro effects of aminoethoxyvinyl-glycine,1aminocyclopropane1carboxylic acid,and ethylene[J].Journal of plant physiology,1985,117(5):401-410.
[16] 張文婷,何燕红,舒宁,等.金黄花滇百合植株再生与离体快繁技术体系的建立[J].植物学报,2019,54(6):773-778.
[17] 崔祺,贾桂霞.3种百合组培快繁体系的优化[J].湖南农业大学学报(自然科学版),2014,40(6):621-626.
[18] 张彦妮,李文英.百合属‘普瑞头’的组织培养和快速繁殖[J].草业科学,2012,29(7):1077-1083.
[19] 韦海忠,潘丽芹,任欢,等.不同生根培养基对野生百合生根影响的研究[J].分子植物育种,2017,15(12):5148-5154.
[20] 王乔春.影响梨砧木BP10030试管苗生根的因素[J].国外农学(果树),1991(4):7-8.
