鲜地黄提取物UPLC 特征图谱与化学模式识别方法研究
2023-05-25黄梦婷谢明晏彭邦贵程学仁孙冬梅
鲁 云,黄梦婷,徐 杰,谢明晏,彭邦贵,程学仁,孙冬梅
(广东一方制药有限公司,广东省中药配方颗粒企业重点实验室,广东 佛山 528244)
鲜地黄为玄参科植物地黄Rehmannia glutinosaLibosch.的新鲜块根,味甘、苦,性寒,具有清热生津、凉血、止血的功效[1]。鲜地黄始载于《神农本草经》,列为上品,以其与鲜石解(防己)、鲜沙参(或鲜大青叶、鲜薄荷、鲜青蒿)组方,用于治疗高热急证和血热妄行、吐血衄血[2]。现代研究表明,鲜地黄在消炎抗菌、止血和免疫作用等方面疗效显著[3]。然而,由于传统的“前店后厂”的供药模式已不适应现代社会的需求,临床上常用干品(生地黄)取代鲜地黄,这不仅与中医传统用药理论不符,同时也不能发挥鲜地黄特殊的药效作用[4]。
如果利用现代技术将鲜地黄制备成现代化的鲜地黄制剂,就可以解决鲜地黄保鲜贮藏困难、临床调剂不便等问题,使传统以鲜地黄治病的宝贵经验得以继承。《金匮要略》以百合与鲜地黄汁组方,治百合病不经吐下发汗,病形如初者[5];《肘后备急方》以鲜地黄加水煎服,治伤寒及时气温病及头痛,壮热脉大[6]。说明鲜地黄的传统用法有榨汁和水煎两种,但两者化学成分的差异鲜有文献报道。为了使鲜地黄现代制剂的物质基础与传统的鲜地黄汁或鲜地黄汤剂保持一致,本研究以鲜地黄为原料,采用水提和榨汁两种工艺制备鲜地黄提取物。同时建立基于多元统计学分析、OPLS-DA、PCA、CA 等化学模式识别的鲜地黄提取物的UPLC 特征图谱检测方法,以期为鲜地黄现代制剂的制备以及临床使用提供理论和技术基础。
1 仪器与材料
1.1 仪器
Waters ACQUITY 型超高效液相色谱系统(美国Waters 公司);ME204E 型分析天平(瑞士梅特勒-托利多公司);KQ-500DE 型数控超声清洗器(昆山市超声仪器有限公司);SHZ-DШ 型循环水真空泵(巩义市予华仪器有限公司);DLSB-5/20 型低温冷却液循环水泵(郑州长城科工贸有限公司);TRL-0.5 型真空冷冻干燥机(大连双瑞科技有限公司)。
1.2 材料
梓醇对照品(批号:110808-201711,纯度:99.60%,中国食品药品检定研究院);地黄苷D 对照品(批号:ST11190120,纯度:98.0%,上海诗丹德标准技术服务有限公司);益母草苷对照品(批号:17122601,纯度:99.62%,成都普菲德生物技术有限公司);乙腈、磷酸为色谱纯,水为超纯水,其它试剂为分析纯。11 批鲜地黄药材经广东一方制药有限公司孙冬梅主任中药师鉴定为玄参科植物地黄Rehmannia glutinosaLibosch.的新鲜块根,来源信息见表1。
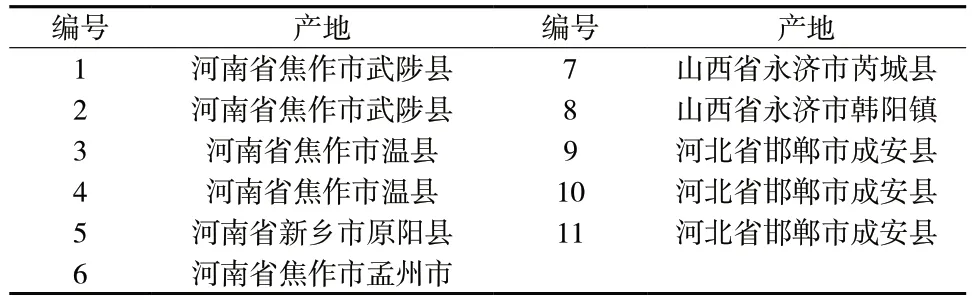
表1 11 批鲜地黄药材来源信息表Tab.1 Source information of 11 batches of fresh R. glutinosa
2 方法与结果
2.1 鲜地黄提取物的制备
2.1.1 水提提取物的制备 取鲜地黄药材,除去芦头、须根及泥沙,切片,得鲜地黄饮片。取鲜地黄饮片100 g,置圆底烧瓶中,加水提取两次,第一次加9倍量水,回流提取30 min,滤过;第二次加7 倍量水,回流提取30 min,滤过,合并两次滤液,低温减压浓缩,喷雾干燥,即得鲜地黄水提提取物,编号为P1 ~ P11。
2.1.2 榨汁提取物的制备 取鲜地黄药材,除去芦头、须根及泥沙,切片,得鲜地黄饮片。取鲜地黄饮片100 g,置于榨汁机中,加1 倍量水进行榨汁,滤过;药渣置于压滤器中,压滤,合并两次滤液,喷雾干燥,即得鲜地黄榨汁提取物,编号为Z1 ~ Z11。
2.2 特征图谱的建立
2.2.1 供试品溶液的制备 取鲜地黄提取物约0.2 g,精密称定,置具塞锥形瓶中,精密加入60%甲醇25 mL,称定重量,超声处理(功率:250 W,频率:45 kHz)60 min,放冷,再称定重量,用60%甲醇补足失重,摇匀,滤过,精密量取续滤液10 mL,浓缩至近干,残渣加0.1%磷酸-水溶液溶解,转移至10 mL 容量瓶中,加0.1%磷酸-水溶液至刻度,摇匀,滤过,取续滤液,即得。
2.2.2 对照品溶液的制备 精密称取梓醇、地黄苷D、益母草苷对照品适量,精密称定,加0.1%磷酸-水溶解并定容,制成混合对照品溶液。
2.2.3 色谱条件 采用Waters ACQUITY HSS T3(100 mm×2.1 mm,1.8 mm)色谱柱,以乙腈(A)-0.1%磷酸水溶液(B)为流动相,梯度洗脱(0 ~ 5 min,0 A;5 ~ 7 min,0→ 5%A;7 ~ 10 min,5%A;10 ~ 16 min,5% → 11%A;16 ~ 18 min,11% → 16%A;18 ~ 35 min,16% → 30%A);柱温:30℃;检测波长:203 nm;流速:0.3 mL/min;进样量:2 μL。
2.2.4 方法学考察 取鲜地黄提取物供试品溶液,按“2.2.3”项下色谱条件,连续进样6 次,以地黄苷D 参照物峰相应的峰为S 峰,计算各特征峰与S峰的相对保留时间RSD 范围为0 ~ 0.90%,相对峰面积RSD 范围为1.55% ~ 3.05%,表明仪器的精密度良好。取鲜地黄提取物供试品溶液,按“2.2.3”项下色谱条件,分别在样品制备后的0、2、4、8、16、24 h 进样检测,计算各特征峰与S 峰的相对保留时间RSD 范围为0 ~ 0.46%,相对峰面积RSD 范围为0.94% ~ 2.95%,表明供试品溶液在24 h 内稳定性良好。取鲜地黄提取物适量,按“2.2.1”项下方法制备供试品溶液,平行6 份,按“2.2.3”项下色谱条件进样测定,计算各特征峰与S 峰的相对保留时间RSD范围为0 ~ 0.95%,相对峰面积RSD 范围为1.27% ~3.12%,表明该方法重复性良好。
2.2.5 特征图谱的建立及共有峰的确定 取11 批鲜地黄水提提取物和11 批鲜地黄榨汁提取物,按照“2.2.1”项下方法制备供试品溶液,按照“2.2.3”项下色谱条件进样检测,记录各特征峰“峰面积/称样量”值,结果见表2;利用“中药色谱指纹图谱相似度评价系统(2012 版)”软件对各批次样品特征图谱数据进行处理,建立鲜地黄提取物特征图谱。共标定了10 个共有特征峰,并通过对照品比对,指认了其中3 个特征峰,分别为峰3(梓醇)、峰4(地黄苷D)、峰6(益母草苷),结果见图1、图2。
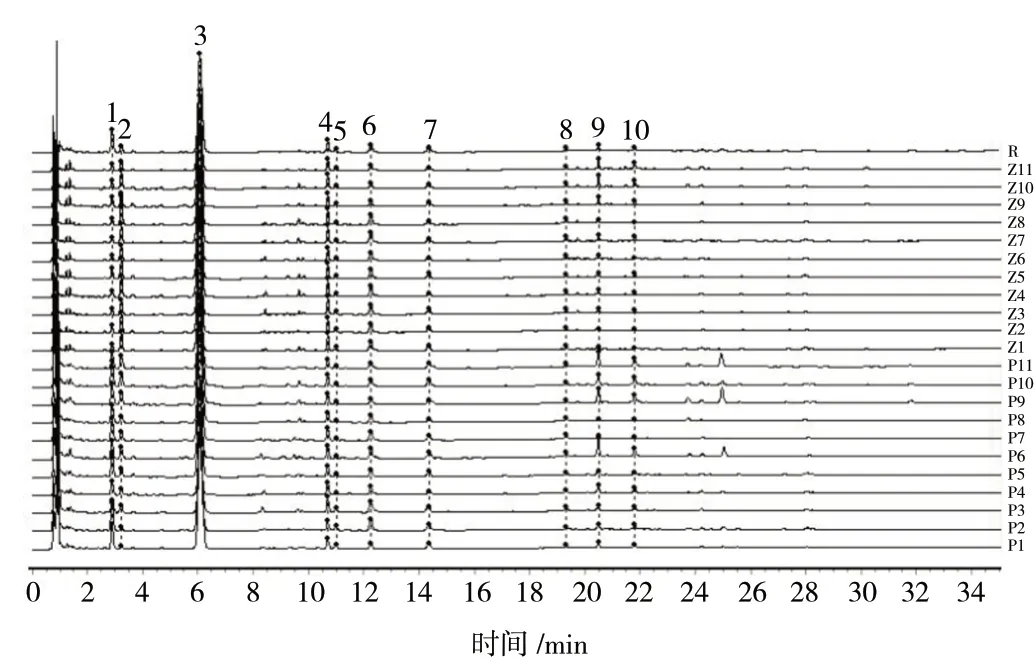
图1 11 批鲜地黄水提与榨汁提取物UPLC 特征图谱Fig.1 UPLC characteristic atlas of 11 batches of the fresh R. glutinosa extract powders prepared by decocting and juicing
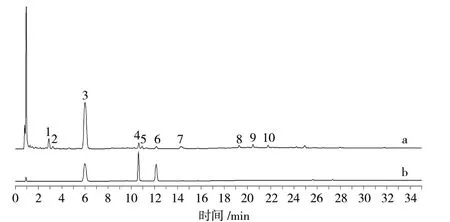
图2 鲜地黄对照特征图谱Fig.2 Characteristic atlas of fresh R. glutinosa
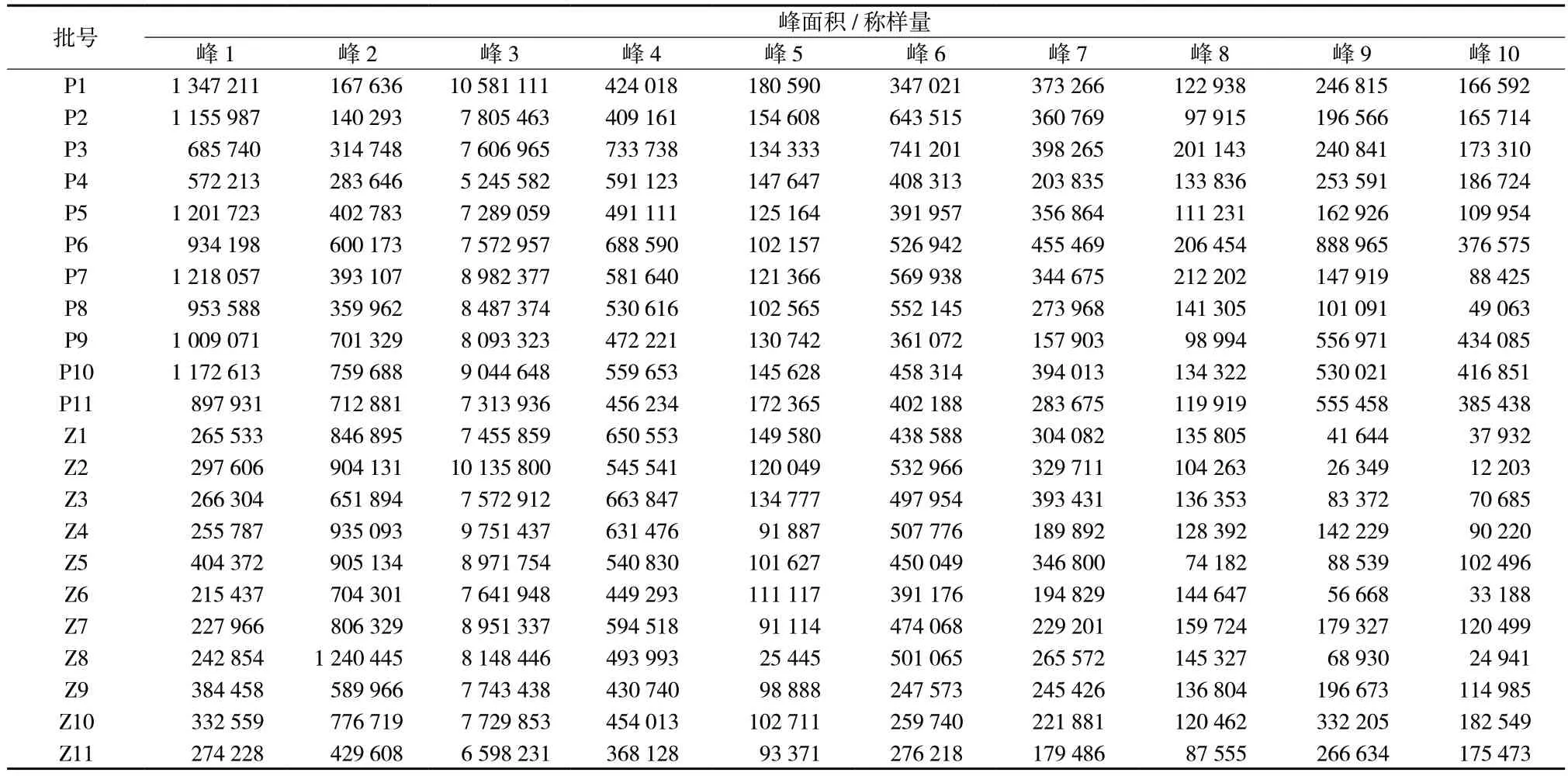
表2 各批次样品共有峰“峰面积/称样量”值Tab.2 "Peak area/sample weight" value of characteristic peak of each batch of samples
2.3 鲜地黄水提与榨汁提取物的差异
2.3.1 统计学差异分析 利用SPSS 20.0 软件对鲜地黄水提提取物与鲜地黄榨汁提取物特征峰的峰面积/称样量值进行方差分析,结果见表3。结果显示,鲜地黄水提提取物特征图谱中峰1、峰5、峰7、峰9、峰10 的峰面积大于鲜地黄榨汁提取物(P<0.05),峰2 的峰面积小于鲜地黄榨汁提取物(P<0.05),其它共有峰的峰面积间差异无统计学意义(P>0.05)。
表3 鲜地黄水提与榨汁提取物“峰面积/称样量”差异分析(±s,n = 11)Tab.3 Difference analysis of "peak area/sample weight" between the fresh R. glutinosa extract powders prepared by decocting and juicing(±s,n = 11)

表3 鲜地黄水提与榨汁提取物“峰面积/称样量”差异分析(±s,n = 11)Tab.3 Difference analysis of "peak area/sample weight" between the fresh R. glutinosa extract powders prepared by decocting and juicing(±s,n = 11)
峰号 水提提取物 榨汁提取物 t P 1 1 013 485±236 573* 287 919±61 672 9.843 0.000 2 439 659±220 169* 799 138±211 969 3.901 0.001 3 8 002 072±1 337 995 8 245 547±1 074 606 0.471 0.643 4 539 828±104 406 529 357±98 439 0.242 0.811 5 137 924±25 436* 101 870±31 485 2.954 0.008 6 491 146±126 624 416 106±106 788 1.502 0.149 7 327 518±88 887* 263 665±70 911 1.863 0.077 8 143 660±42 740 124 865±26 147 1.244 0.228 9 352 833±245 161* 134 779±98 936 2.736 0.013 10 232 066±142 336* 87 743±58 424 3.111 0.006
2.3.2 偏最小二乘法分析(OPLS-DA)将各批次鲜地黄提取物10 个共有峰的“峰面积/称样量”值作为变量,采用SIMCA 14.1 软件对鲜地黄提取物进行偏最小二乘法分析,得分图见图3。结果显示,鲜地黄水提(GT)与榨汁(ZZ)提取物在OPLS-DA 模型中呈现明显的分类聚集现象。分析OPLS-DA 模型中的变量投影重要度(VIP),结果见图4。对鲜地黄提取物各特征峰的VIP 值大小进行排列,选择VIP值大于1 的指标作为区分鲜地黄水提与榨汁提取物的主要差异性成分。结果显示,峰1(VIP 值1.577 0)、峰5(VIP 值1.229 0)、峰2(VIP 值1.225 1)、峰10(VIP 值1.196 6)、峰9(VIP 值1.161 9)、峰7(VIP值1.029 4)均大于1,说明峰1、峰2、峰5、峰7、峰9、峰10 对鲜地黄水提和榨汁提取物的质量差异影响显著,与统计学差异分析的结果一致。
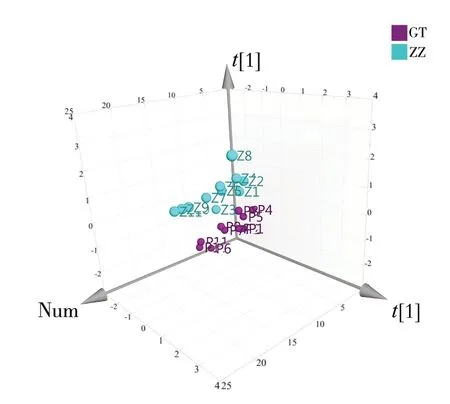
图3 OPLS-DA 得分散点图Fig.3 OPLS-DA score plot
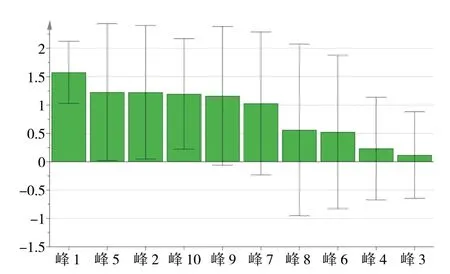
图4 OPLS-DA VIP 值图Fig.4 VIP plot of OPLS-DA
2.3.3 主成分分析(PCA)将各批次鲜地黄提取物10 个共有峰的“峰面积/称样量”值作为变量,采用SIMCA 14.1 软件对鲜地黄提取物进行主成分分析,以特征值大于1 为判断标准,共提取4 个主成分,特征根值及方差贡献率结果见表4。结果表明,前4 个主成分可反映鲜地黄水提和榨汁提取物特征图谱整体81%以上的信息。提取方差贡献率最高的主成分PC1、PC2 绘制鲜地黄提取物的二维得分散点图,见图5。结果显示,鲜地黄水提提取物与榨汁提取物有明显的分类聚集现象,鲜地黄水提提取物(P1 ~P11)聚为一类,鲜地黄榨汁提取物(Z1 ~ Z11)聚为一类。表明水提与榨汁制备的鲜地黄提取物差异明显。
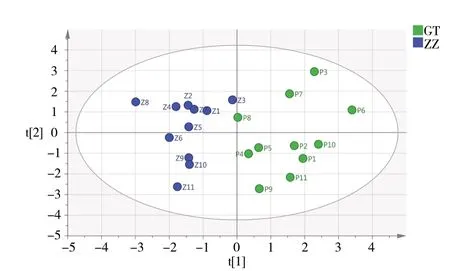
图5 PCA-DA 得分散点图Fig.5 PCA-DA score plot

表4 主成分因子特征根值与方差贡献率Tab.4 The principal component value and variance contribution rate
2.3.4 聚类分析(CA)将各批次鲜地黄提取物10个共有峰的“峰面积/称样量”值作为变量,采用SPSS 20.0 软件对鲜地黄对鲜地黄水提与榨汁提取物进行聚类分析,聚类方法选择Ward 法,测量区间选择平方Euclidean 距离,结果见图6。结果显示,当距离大于15 时,鲜地黄提取物明显聚为两类,鲜地黄水提提取物(P1 ~ P11)聚为一类,鲜地黄榨汁提取物(Z1 ~ Z11)聚为一类。结果与主成分分析结果一致,说明水提与榨汁制备的鲜地黄提取物有明显差异。
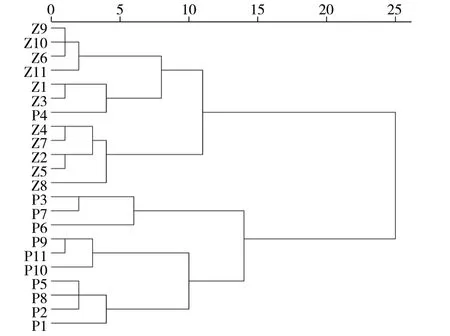
图6 聚类分析树状图Fig.6 Dendrogram of cluster analysis
3 讨论
本研究分别考察了不同提取溶剂、提取方式以及提取时间对鲜地黄提取物特征图谱的影响,结果表明,加入60%甲醇超声提取60 min,提取效率高、效果好。研究还考察了不同流动相系统、不同波长对鲜地黄提取物特征图谱的影响,结果表明,采用乙腈-0.1%磷酸水溶液为流动相,在203 nm 波长下进行采集,色谱峰峰形好,且主要色谱峰吸收强度高。
通过对中医古籍的检索发现,针对不同的病症,鲜地黄的用法不同,传统最为常见的内服用法包括榨汁服和水煎服两种。本研究模拟榨汁服和水煎服两种用法,采用水提和榨汁两种工艺制备鲜地黄提取物,并结合多元统计分析和化学模式识别方法,对鲜地黄水提和榨汁提取物UPLC 特征图谱进行差异分析。多元统计分析结果表明,10 个共有峰中,鲜地黄水提提取物中有5 个共有峰峰面积值大于榨汁提取物,1个共有峰峰面积值小于榨汁提取物,其它4 个共有峰峰面积值差异无统计学意义,可见水提提取物峰1、峰5、峰7、峰9、峰10 所表征的化学成分提取更为充分,而峰2 所表征的化学成分可能存在一定热敏性,其在榨汁提取物中的含量更高;OPLS-DA 结果表明,峰1、峰2、峰5、峰7、峰9、峰10 的峰面积是导致鲜地黄水提和榨汁提取物质量差异最主要的因素;PCA 和CA 均能将鲜地黄水提和榨汁提取物单独聚为两类。因此,采用水提和榨汁工艺制备的鲜地黄提取物的整体化学物质存在本质区别。相比于榨汁,采用水提的方式可有效保持药材与溶媒间的浓度差,且加热可加剧体系中的分子运动,使鲜地黄中的物质成分提取更为充分,这可能是水提提取物峰1、峰5、峰7、峰9、峰10 所表征的化学成分的含量高于榨汁提取物的原因。此外,研究表明,鲜地黄在受热后,其主要的环烯醚萜苷类成分易降解脱去糖基,生成非苷类环烯醚萜化合物,且降解程度与连接糖基的数目有关[7]。推测峰2 所表征的化学成分为环烯醚萜单糖苷,受热易降解,故而榨汁提取物中峰2 的峰面积值大于水提提取物。
4 结论
本研究建立了鲜地黄提取物UPLC 特征图谱,方法重复性、稳定性良好。通过比较特征图谱中10 个共有峰的峰面积值,结合多元统计学分析,证实了鲜地黄水提和榨汁提取物存在明显差异,生产上应根据临床适应症制定对应的制备工艺,保证与传统用法一致,发挥鲜地黄应对不同病症的特殊疗效。本研究可为鲜地黄现代制剂的制备工艺、质量控制以及临床使用提供参考。
