褪黑素的生理功能及应用研究进展
2023-05-23李佳佳门海涛高丽美
李佳佳 门海涛 高丽美
摘要:褪黑素(N-乙酰基-5甲氧基色胺)属于一类常见的吲哚杂环类小分子物质,是生物体内重要的内源性激素信号分子,在动、植物细胞生长发育和各种生理生化代谢过程中起着积极的调控作用。褪黑素最初在动物体中被发现,具有调节昼夜节律、清除自由基、改善机体睡眠质量、提高免疫力等多种生理功能。随后人们在植物各类组织或器官中也检测到了植物褪黑素。近年来,随着对植物褪黑素研究认识的不断深入,褪黑素在植物体内的具体合成途径及生理作用也越来越清晰,特别是褪黑素在参与缓解植物生物胁迫或非生物胁迫方面的作用及调控机制受到了广泛关注。本文从理化性质、生物合成途径、生理作用以及调控有机体生物胁迫和非生物胁迫响应等多个方面系统阐述了褪黑素的分子结构特点、生物学功能及其在生活生产领域中的应用现状,并展望了未来关于褪黑素信号分子感知环境信号及其作用机制是一个非常有趣的研究领域。本文将为深入探究褪黑素与有机体细胞互作的分子机制,促进褪黑素在工农业生产和人类生活中的推广应用提供理论参考。
关键词:褪黑素;自由基清除剂;抗氧化代谢;生物胁迫;非生物胁迫
中图分类号:Q42;S184 文献标志码:A
文章编号:1002-1302(2023)08-0017-09
基金项目:山西省青年科技基金(编号:201801D221260)。
作者简介:李佳佳(1997—),女,山西忻州人,硕士研究生,主要从事植物细胞生物学研究。E-mail:1845999496@qq.com。
通信作者:高丽美,博士,硕士生导师,主要从事植物细胞生物学研究。E-mail:limeigao1122@126.com。
褪黑素(melatonin,MT)属于一类吲哚杂环类激素小分子,广泛分布于从藻类到高等哺乳动物等众多生物体内[1-2]。1917年天然褪黑素分子最早被发现于动物松果体中,故又被称为松果体素或松果腺素,关于褪黑素早期的研究也主要集中在动物体内[3-4]。人们发现褪黑素分子可以改善动物睡眠、调节机体时差、增强机体免疫力、延缓组织衰老以及具有抗肿瘤功效等一系列功能[5-6]。1995年人们又首次在维管植物组织中分离鉴定出了植物褪黑素,随后的研究很快发现褪黑素几乎存在于所有的植物体中,而且在根、茎、叶等多种植物器官中普遍分布[7-12]。在不同植物组织或器官中,天然褪黑素浓度从0.1 pg/鲜质量(g)至30.0 μg/鲜质量(g)不等[13]。作为植物重要的内源性激素分子之一,褪黑素具有类似生长素的功能,在调控种子萌发、细胞增殖、植物生长发育以及延缓叶片衰老等方面均发挥着积极作用。同时,作为一种重要的自由基清除剂,褪黑素还具有抵抗氧化应激反应的作用,因此在缓解植物生物胁迫或非生物胁迫引起的氧化胁迫损伤中也具有重要地位[14-17]。
1 褪黑素的理化性质
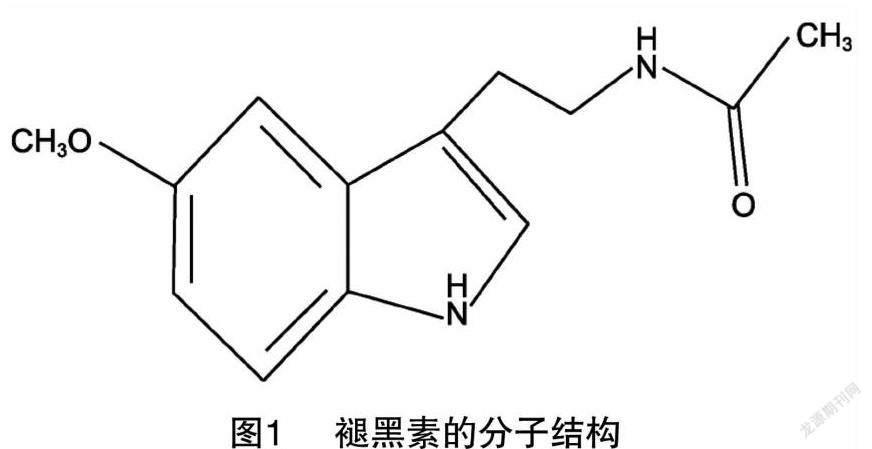
褪黑素,别称抑黑素、褪黑激素、松果腺素,外观呈白色或类白色结晶粉末,化学名称为N-乙酰基-5甲氧基色胺(N-acetyl-5-methoxytryptamine),分子量232.278 3,熔点116~118 ℃,分子式C13H16N2O2,分子結构如图1所示。褪黑素具有良好的热稳定性,但是见光易分解,易溶于热水和乙醇,几乎不溶于水,最大紫外吸收波长为278 nm。褪黑素分子结构中的乙酰基和5-甲氧基官能团决定了该激素既具有亲脂性和亲水性特点,同时也表现出与受体结合的高度特异性。
2 褪黑素的生物合成
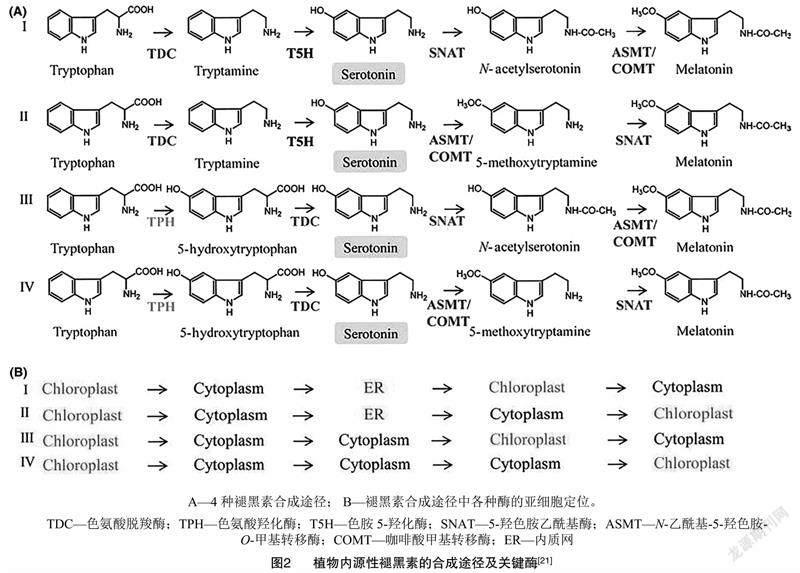
天然褪黑素在生物细胞中的含量很低,通常以皮克(1 pg=1×10-12 g)级水平存在。在高等动物体中,褪黑素由松果体中的松果体细胞合成,在人体内也是由位于大脑深处的松果体分泌产生[18]。动物细胞的5-羟色胺(血清素)在N-乙酰转移酶催化作用下可与乙酰辅酶A反应转化为N-乙酰-5-羟色胺,然后N-乙酰-5-羟色胺再在乙酰血清素O-甲基转移酶催化作用下,被S-腺苷甲硫氨酸(SAM)甲基化,形成了褪黑素[19]。高等植物褪黑素的合成主要有4条连续的酶促反应途径,均是以色氨酸为起始原料[20],在不同关键酶的催化作用下合成一系列中间体(图2),最终产生褪黑素信号分子。其中,途径Ⅰ和途径Ⅱ是植物内源褪黑素合成的主要路径,通过酶促动力学反应试验证实,当植株处于正常生长环境中时通过途径Ⅰ合成褪黑素分子;而当植物处于胁迫环境中时,则会通过途径Ⅱ合成大量的褪黑素物质。4条途径中共同的中间产物是5-羟色胺,因此5-羟色胺是植物内源褪黑素合成的重要底物[21],其浓度大小也是决定褪黑素合成速率的关键因素[22]。当植物组织中将色氨酸转换为5-羟色胺的速率大于将5-羟色胺转化为褪黑素的速率时,植物内会合成少量的褪黑素;反之,植物内褪黑素合成量会大大提高。此外,各种褪黑素合成途径的中间体会产生并积累于不同的亚细胞区室,如细胞质(cytoplasm)、内质网(ER)和叶绿体(chloroplast)等中(图2),这些中间体的浓度也在一定程度上调控着合成途径中酶促反应的发生。褪黑素合成途径中的一些关键酶也是其合成速率的限速酶,如5-羟色胺乙酰基酶(SNAT)、咖啡酸甲基转移酶(COMT)和N-乙酰基-5-羟色胺-O-甲基转移酶(ASMT)等。同时,环境胁迫对植物产生的特异效应物也可能会影响褪黑素的生物合成过程[21,23-25]。
生物有机体内源褪黑素的合成具有三大生理特点:首先褪黑素的合成具有明显的昼夜节律性,这就造成08:00机体内褪黑素浓度降至最低,直到20:00左右又开始合成,此后浓度逐渐上升,23:00左右迅速升高,至次日02:00—03:00达到峰值,然后又开始逐渐下降,直到次日08:00分泌终止[26]。所以,褪黑素是一种内源性生物睡眠调节器,而不是睡眠促进器。其次,褪黑素的合成还会受到环境中光照条件的控制,通常白天光照较强抑制了内源褪黑素的合成,夜晚无光照时褪黑素合成会增多,但不管白天或晚上只要机体频繁接受光照就会影响体内褪黑素的分泌量[27]。这应该也是导致机体内褪黑素合成具有节律性特征的根本原因。总之,褪黑素分泌与视网膜、眼部晶状体、胃肠道及脑部松果体细胞均有密切关系[28-30]。最后,褪黑素的合成还与生物体的年龄有关。年幼个体褪黑素的分泌通常是充足的,而随着年龄的不断增长,褪黑素分泌量会减少,并呈现平均每10年以10%~15%的趋势降低。因此,老年人尤其是老年睡眠障碍患者体内褪黑素合成下降会愈加明显,最终导致了睡眠节律和多个系统功能紊乱[31]。
3 褪黑素的生物学作用
尽管天然褪黑素在生物有机体内分泌水平极低,但其生理调控功能却是极高效的。褪黑素的生理功能非常广泛,涉及到生物有机体生长、发育、生殖、免疫等多个方面,在不同动、植物体内的作用也不尽相同。
3.1 动物褪黑素的作用
动物褪黑素是一种内源性生物时钟调节剂,在动物细胞内的分泌具有严格的昼夜节律性特点。通常情况下,天然褪黑素分子在黑暗条件下才会生成,在光亮时即使是很微弱的灯光都会明显抑制褪黑素的分泌。因此,褪黑素可调节动物睡眠,提高睡眠质量,具有安神、安眠的作用[32]。褪黑素也是一种高效的自由基清除剂,可以明显抑制生物分子的过氧化反应,保护细胞结构,防止遗传物质DNA氧化损伤,降低过氧化物浓度,具有延缓机体组织衰老的生物保护效应。研究发现,褪黑素对由于外源性因素造成的过氧化反应,以及诱发产生自由基而引起的细胞损伤具有一定的拮抗作用。褪黑素还可以有效激活动物细胞的免疫应激反应,提高机体免疫力[33],甚至表现出抗肿瘤和抗炎症、防治心血管疾病、控制血压以及预防老年痴呆等抗御疾病的医疗功效[32]。此外,褪黑素又和人的视力有着密切关系,实验证实适当补充褪黑素有利于预防白内障、青光眼及黄斑退化等眼部疾病发生[34]。
3.2 植物褪黑素的作用
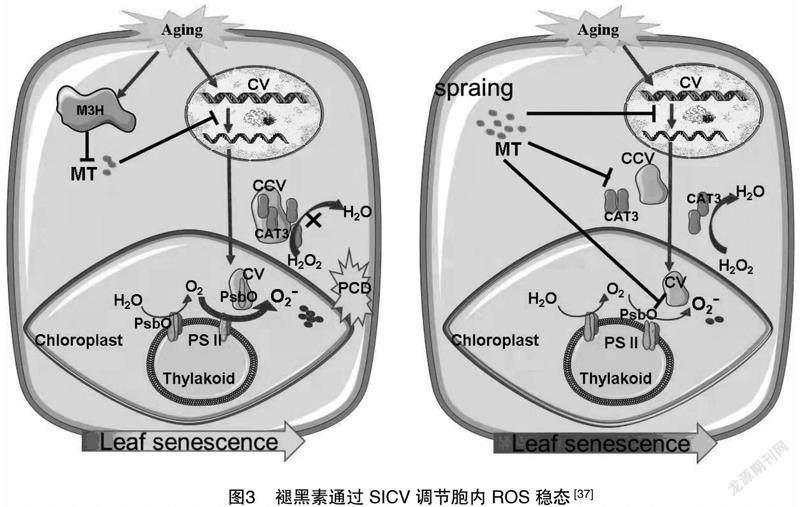
植物褪黑素几乎合成于所有的植物组织器官中,在植物生长发育中起着一定的作用[35]。褪黑素也是植物体内一类高效的自由基清除剂,参与调控着植物体内的氧化/抗氧化代谢平衡。植物褪黑素可以及时清除植物体内过量的活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)等自由基成分,保护组织免受其氧化毒害作用,防止细胞结构与DNA分子氧化损伤,延缓叶片衰老进程。作为公认的内源性自由基清除剂之一,褪黑素不仅可以直接与多种自由基、活性氧和活性氮相互作用解除其对细胞的毒害作用,而且还可以通过激发自由基清除的抗氧化酶系统间接清除ROS或RNS[36]。褪黑素能直接与具有高毒性的羟基自由基物质反应,有效地降低羟基自由基的积累;也可以与过氧化氢(H2O2)、单线态氧分子(1O2)、过氧亚硝基阴离子(ONOO—)、氧化氮(NO)和次氯酸(HClO)等物质反应,进而中和其对植物细胞的氧化伤害。褪黑素的2种主要代谢产物 N1-乙酰基-N2-甲酰基-5-甲氧基犬尿氨酸(AFMK)和N1-乙酰基-5-甲氧基犬尿氨酸(AMK)等都具有很强的减缓自由基损伤的能力,从而进一步增强了褪黑素的抗氧化能力,该现象被称为褪黑素与自由基相互作用的级联反应。最近研究指出,植物褪黑素会显著抑制叶绿体囊泡化蛋白SICV的表达,SICV既可以囊泡化光系统Ⅱ(PSⅡ)复合体的一个亚基(PsbO),加速ROS的产生;又能囊泡化胞质中的过氧化氢酶3(CAT3),减弱ROS的清除,造成ROS积累,诱导细胞程序性死亡。因此,植物褪黑素可以通过调节SICV-SIPsbO/SICAT3(叶绿体囊泡化蛋白SICV与番茄PsbO或CAT3相互作用)模块,影响细胞内ROS代谢稳态,延缓植物叶片衰老(图3)[37]。
大量研究指出,褪黑素还能显著解除由非生物或生物胁迫诱导的植物氧化胁迫,抵御不利环境因素导致的胁迫损伤,甚至提高植物的抗逆性。ROS和RNS是调节植物免疫应答的重要信号分子。研究发现不利环境胁迫下ROS和RNS会在胞内积累,进而促进机体内源褪黑素合成,但有趣的是在胁迫初期,褪黑素分子又可以反过来进一步诱导ROS和RNS积累,而在胁迫后期,褪黑素则可通过激活抗氧化酶和抗氧化物负调控胞内ROS的积累。因此,环境胁迫触发的褪黑素-ROS-RNS调控环路对于维持植物抗逆性与发育之间的平衡至关重要[38]。
4 褪黑素与环境胁迫
各种植物生长于自然环境中,不可避免地会受到来自环境中的各种胁迫因子的影响,包括非生物胁迫(abiotic stress),如紫外线B(UV-B)辐射、干旱、高温、重金属、盐胁迫等,以及生物胁迫(biotic stress),如病原微生物浸染、病虫害侵袭等。
4.1 褪黑素与非生物胁迫
非生物胁迫是对植物生长发育影响最为广泛的一类胁迫因子。当前全球气候环境的异常多变导致植物面临多重不利环境因素的影响。极端环境会使植物的生长发育发生改变,引起表型发育异常,品质产量下降,甚至降低植株存活率或产生变异株系。非生物胁迫因子种类众多,与植物生长最为密切,影响最大的包括光质、温度、水分、射线、重金属以及化学污染物等[39]。
在长期的适应演化过程中,植物体内演化形成了一系列积极应对环境因子尤其是不利胁迫因子的免疫防御策略。绿色植物叶片表面形成的蜡质层就是一种典型的防御性保护结构,蜡质层可有效阻止某些病原菌的侵袭[40]。植物体内的次生代谢产物也是重要的自我保护物质,这些物质通常具有一定的抑菌活性,可以及时阻断病原菌的传播,如木质素、胼胝质等;有些代谢物可吸收来自环境中的有害射线辐射,降低辐射损伤,如类黄酮、多酚化合物等;还有一些代谢产物可以通过特定的信号途径刺激植物细胞释放出特定化学物质进行自我保护,如水杨酸信号途径、茉莉酸信号途径等。植物受到胁迫时,还可以激活体内某些免疫系统,如病原菌相關的分子反应模式(PTI反应)或R基因主导的识别反应模式(ETI反应),激发植物感知病原菌并引发免疫反应。此外,大部分植物都可以通过激活抗氧化代谢反应,提高抗氧化性能来抵御不利环境胁迫的影响[41]。随着科技的不断发展和进步,人们也相继发现很多参与改善植物抗逆性的生物小分子,如激素分子、生长因子等。褪黑素作为普遍公认的重要的植物体内源信号调节分子,近年来它也被报道参与调控了植物的多种抗逆代谢过程。
4.1.1 温度胁迫
由于近年来剧烈的气候变化,温度波动已成为全球影响植物生长、产量和分布的关键限制因素之一。尤其重要的是,植物体内最重要的生理化学过程光合作用对温度表现很敏感,导致植物生长非常容易受到极端气候变化的影响[42]。长期暴露在极端温度下的植物叶片光合作用能力会降低,光合色素合成量会减少[43-45]。极端温度也会迅速耗尽叶片中的水分,降低膜的硬度进而影响光合作用进程[46]。
高等植物核酮糖-1,5-二磷酸羧化酶(Rubisco)等多种光合酶活性易受高温影响,而且1,5-二磷酸核酮糖(RuBP)的合成速率和Rubisco的羧化位点也都会受到温度变化而改变[47]。高温胁迫会改变叶绿体类囊体膜的完整性,并破坏PSⅠ和PSⅡ,PSⅠ和PSⅡ是公认的ROS释放的主要位点,类囊体反应中心叶绿素的过度还原会导致过量ROS的产生[48-50]。在高温胁迫下,植物体内的叶绿体结构被破坏,CO2的溶解度会降低,叶绿素合成受到抑制,还降低了Rubisco对于CO2的亲和力与光合系统组分的热稳定性,从而导致植物光合速率发生变化。极端高温环境一方面会使植物体细胞膜的膜脂组成发生改变,即内质网、线粒体、高尔基体等的内膜结构发生改变,导致细胞膜的选择性吸收功能受损,电解质渗漏和电导率增大。另一方面高温胁迫也会使细胞中的丙二醛(MDA)过量堆积,进而造成质膜氧化受损[51]。前期研究结果显示,黄瓜幼苗在高温胁迫过程中过氧化氢和丙二醛含量升高,说明高温胁迫会使植株体内活性氧大量积累,导致膜脂过氧化发生,膜的结构和功能受到损伤,外源施加褪黑素能有效抑制高温胁迫过程中黄瓜幼苗叶片过氧化氢的积累,减轻ROS对细胞膜造成的伤害[52]。此外,Jahan等的研究表明,100 μmol/L 外源褪黑素处理通过降低ROS的产生,提高抗氧化酶活性,调节抗坏血酸-谷胱甘肽(ASA-GSH)代谢循环,上调抗氧化酶相关基因的表达,提高了番茄幼苗的耐热性,并且褪黑素也可以通过上调多胺(polyamines,PAs)生物合成基因表达来提高内源PAs和 NO含量,从而有利于解除过量积累ROS的细胞毒性[44]。Jahan等的研究还表明,褪黑素处理可以提高植物叶片的叶绿素含量,并使高温诱导的叶片退化受到抑制[53]。
低温胁迫不仅会使植物的形态改变,如叶片失水、叶面积减小、植物发生萎蔫等;也会影响植物的生殖生长,如发育期延迟、开花数量减少、落花落果等[54]。低温胁迫还会使植物光合气体交换受到限制,并且造成光合速率、呼吸代谢能力和叶绿素荧光参数下降,植物中活性氧大量增加,最终导致植物的结构和功能受到破坏[55]。娄慧等的研究采用20 μmol/L的褪黑素处理棉花种子,结果表明棉花种子萌发后胚根生长发育状况最好,接近正常萌发水平,检测到棉花的抗氧化酶活性较好,并且施加褪黑素后抑制了膜脂过氧化现象的产生,降低了丙二醛和过氧化氢的含量,最终降低了低温条件下对棉花种子所带来的伤害,提高了棉花种子萌发期的耐低温特性[56]。此外,Li等前期的研究表明,局部应用褪黑素可以通过长距离信号途径诱导植物器官的耐冷性[57]。另外,Li等的研究表明,外源褪黑素的使用一方面可以激活茶树组织中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)等抗氧化酶的活性;另一方面也可通过诱导谷胱甘肽合成酶(glutathione synthetase,GS)、谷胱甘肽还原酶(glutathione reductase,GR)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)编码基因的转录表达,从而提高还原型谷胱甘肽酶(glutathione,GSH)、氧化型谷胱甘肽酶(glutathione oxidized,GSSG)的催化活性,从而抑制ROS的过量积累,减轻生物膜系统损伤,从而缓解低温胁迫对茶树生长发育的伤害[58]。
4.1.2 干旱胁迫
水分是植物正常生存和代谢的基础。在干旱胁迫下,植物的正常生长会发生变化,其中包括植物的形态、组织结构等会发生不同程度的变化,在生理、生态方面会产生影响,导致植物光合作用受抑、呼吸作用紊乱、代谢异常,生长受到抑制,甚至死亡[59-62]。施加外源褪黑素能够调控植物气孔的关闭,从而减少水分散失,缓解干旱胁迫对植物生长所产生的影响[63]。褪黑素主要可以通过调节丝裂原活化蛋白激酶 (MAPK) 信号通路和抗坏血酸-谷胱甘肽循环途径,激活抗氧化酶活性,保护光合系统和调节激素代谢来增强植物的耐旱性[64]。Zou等研究发现,外源喷施100 mmol/L 褪黑素可提高氨基酸和氮代谢化合物的合成,进而提高大豆植株的耐旱性[65]。邹京南等用聚乙二醇(PEG-6000)对春大豆进行处理,同时对植株叶片喷施100 μmol/L的褪黑素,试验结果显示褪黑素提高了春大豆的光合色素、干物质和脯氨酸等的含量,并提高了植物光合速率和抗氧化酶活性,缓解了干旱环境对春大豆的抑制效应[66]。古咸彬等的试验也表明,在干旱条件下褪黑素能提高桃苗的根系活力、相对叶绿素含量和相对含水量,从而对根系和叶片起到了保护作用。此外,褪黑素通过提高SOD、POD和CAT的活性,抑制了H2O2、MDA的生成,以此来缓解干旱胁迫对桃树幼苗造成的氧化损伤[67]。佟莉蓉等的试验表明,施加适宜浓度的外源褪黑素可显著提高达乌里胡枝子的鲜质量、叶片鲜质量干质量比,以及叶片相对含水量,进而提高植物的抗旱性[68]。
干旱条件下,施加外源褪黑素可以降低脯氨酸、MDA、H2O2的浓度以及提高叶片糖代谢活力和抗氧化活性来抑制棉铃脱落,从而提高棉花的耐旱性,保证生产性能[69]。此外,100 μmol/L褪黑素處理可通过抑制细胞膜损伤和降低H2O2浓度,调节超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和抗坏血酸过氧化物酶的活性及相关基因的表达,从而减小大豆植株的氧化损伤,使植物保持较高的叶绿素含量,进而显著促进了大豆植株的生长发育[70]。
4.1.3 盐胁迫
盐胁迫对植物生长的危害主要体现在抑制种子萌发、影响植株生长发育和降低植株结实率等多个方面。此外,盐胁迫还会导致植物体内产生大量活性氧自由基,过量活性氧积累更进一步加剧了盐胁迫给植物带来的伤害[71]。孙浩月等的试验表明,施加褪黑素显著提高了叶片抗氧化酶活性,增加了叶片可溶性糖和可溶性蛋白含量,降低了MDA含量和相对电导率,从而促进了芸豆幼苗生物量积累。因此证明褪黑素可以有效缓解NaCl胁迫对芸豆幼苗的抑制效应,提高芸豆幼苗的耐盐性[72]。还有一些研究表明,褪黑素主要是通过清除由盐胁迫形成的活性氧来使细胞膜保持完整,最终促进黄瓜种子萌发[73]。2015年,Liang等的研究报道显示,添加10~20 μmol/L褪黑素可延缓水稻叶片的衰老和细胞死亡,并通过直接或间接地对抗细胞内过氧化氢的积累来增强水稻的耐盐性[74]。Wei等的试验通过在盐胁迫下对植物叶面喷施 200 μmol/L 褪黑素,也证明了褪黑素可显著提高抗氧化酶的活性,清除过量ROS分子,减轻细胞膜脂分子和细胞其他结构的过氧化损伤,并且施用褪黑素还可以促进植物对氮、钾、硅的吸收和运输,减少钠的吸收和运输,改善植物体内离子的动态平衡和渗透调节,增加地上部分和根系统的生物量。因此,施用褪黑素处理显著提高了水稻幼苗的耐盐性[75]。Yan等利用转录组测序和病毒诱导的基因沉默(VIGS)方法鉴定褪黑素诱导番茄耐盐碱胁迫的关键下游转录因子DREB1α和IAA3,表明褪黑素可通过激活DREB1α和IAA3转录因子的表达进一步调控盐胁迫下幼苗体内的离子平衡、气孔关闭、水分平衡、酸碱平衡和氧化还原平衡,从而提高番茄耐盐碱能力[76]。中国农业科学院棉花研究所研究发现,褪黑素合成基因COMT被抑制后,棉花植株对盐胁迫表现更敏感,外源使用褪黑素处理可减轻COMT沉默植株的盐胁迫敏感性[77];同时,外源褪黑素作用于正常植株,可通过激活活性氧清除系统和Ca2+信号传递途径提高棉花的耐盐性[77]。外源施用或提高内源褪黑素的合成,均可通过诱导乙烯合成途径的关键基因(如MYB108A和ACS1)转录,促进葡萄乙烯的生物合成和植株的耐盐性[78]。
4.1.4 重金属胁迫
在工业化和城镇化的发展过程中,工业生产、交通运输、污水排放、堆肥、农药和化肥的施用都可以引起重金属污染,导致土壤重金属污染问题日益严重[79]。重金属在土壤中难以降解,积累在土壤中,部分重金属会与植物蛋白结合,使其失去活性,最终对植物的生理生化和生长发育造成影响[80]。此外,重金属通过引发自由基介导的连锁反应,导致脂质、蛋白质和核酸被氧化,从而对主要的生物大分子造成氧化损伤[81]。研究表明,在镉胁迫下,施加外源褪黑素会对紫花苜蓿的抗氧化酶活性产生影响[82]。Hodzic等通过比较柠檬香油根和叶的抗氧化防御系统和ROS积累水平,研究褪黑素对重金属胁迫下柠檬香油根和叶的保护作用,结果表明外源褪黑素可以通过激活植物体内的抗氧化防御系统,减轻Cd和Zn对植物的伤害,提高植物的耐受性[83]。Xu等使用miRNA和转录组联合分析发现,萝卜在受到Cd胁迫后,使用褪黑素处理萝卜幼苗可诱导RsMT1基因的上调表达,从而增强萝卜对Cd的耐受性[84]。此外,外源褪黑素还可以提高光化学效率进而提高硒胁迫下油菜生物量的积累[85]。Nawaz等的研究表明,褪黑素预处理后不仅可以减少钒从根部到茎的转运,降低叶和茎的钒含量,还可以通过调节褪黑素的生物合成及超氧化物歧化酶、过氧化物酶和抗坏血酸的基因表达,增强西瓜幼苗超氧化物歧化酶和过氧化氢酶的活性,降低了过氧化氢和丙二醛的含量从而提高西瓜幼苗在钒胁迫下的叶绿素相对含量、光合作用能力和生长量[86]。
4.1.5 射线辐射
近年来,随着工业的发展和人类活动的增加,大气中臭氧的含量逐渐减少。臭氧减少导致到达地面的UV-B辐射增加,进而会对地面的植物产生影响,UV-B辐射增强可以使植物发生矮化、叶面积减少、叶面积指数降低、发育迟缓、光合作用和蒸腾作用下降,还会影响各种酶的活性、使作物的产量降低、品质发生变化甚至影响整个植物生态系统[87]。有试验结果表明,UV-B辐射增强会降低马铃薯植株的高度,外源褪黑素处理可以在一定程度内提高株高,且使1,5-二磷酸核酮糖羧化酶和磷酸烯醇式丙酮酸羧化酶(PEPC)的活性提高,光合能力增强[88]。马征在研究拟南芥褪黑素在UV-B 胁迫中的作用时发现,UV-B辐射处理可使褪黑素合成酶基因5-羟色胺乙酰转移酶、咖啡酸甲基转移酶和N-乙酰基-5-羟色胺-O-甲基转移酶的表达量升高,以此来抵抗UV-B胁迫给拟南芥幼苗造成的伤害[3]。2021年Yao等的研究也报道拟南芥褪黑素调节了UV-B信号转导途径相关基因的转录,激活了拟南芥植株的抗氧化代谢,增强了其UV-B胁迫抗性[4]。
综上所述,褪黑素是植物体内重要的内源激素分子之一,在植物响应各类非生物胁迫中起着积极的作用,同时也在一定程度上可以增强植物对非生物胁迫因子的抗逆性。尽管关于褪黑素与植物非生物胁迫的互作关系研究已经较多,但对褪黑素参与调控非生物胁迫的分子机制却知之甚少,因此该领域今后的研究重点还应该在此方面有所突破。
4.2 褪黑素与生物胁迫
褪黑素对植物应对生物胁迫的影响主要表现为在减缓植物和采后果实的细菌、真菌和病毒病害等方面发挥着重要作用。2022年海南大学施海涛团队系统阐述了褪黑素在该领域的相关研究进展[38]。该报道指出:(1)病原体侵染可触发褪黑素-ROS-RNS调控环路,从而维持植物抗病和发育之间的平衡。(2)褪黑素还可能与其他植物激素互作调节植物的抗病性。例如,人们发现褪黑素在病原体浸染时会作用于水杨酸(SA)上游并正调控其积累,激活依赖于MAPK信号级联反应介导植物免疫应答;褪黑素也可影响生长素与茉莉酸(JA)信号通路提高植物对病原菌的抗性。(3)褪黑素处理也会直接抑制病原体(如多种细菌、真菌等)的活性,以及下调与病原体毒性相关基因的表达,从而减轻其对植物的致病性。然而,目前褪黑素对病原体防御的研究仍处于早期阶段,其介导植物免疫反应中的具体机制仍有待将来深入阐明。
5 结语与展望
关于植物褪黑素的研究有很多,主要集中在生物合成途徑、生理功能及非生物胁迫应答等方面。虽然褪黑素在植物各器官、组织中广泛分布,但有关褪黑素在植物体内的运输途径及作用机制还有待进一步研究。此外,褪黑素被认为可以作为激素信号分子在逆境胁迫应答中发挥重要作用,然而对于植物如何感受褪黑素及如何进行信号调控仍不清楚,这也将是今后对植物褪黑素生物学功能进行深入研究的一个重要方向。
参考文献:
[1]汪俊峰,余敏芬,李东宾,等. 褪黑素对模拟干旱胁迫下北美红栎幼树光合性能及抗氧化酶系统的影响[J]. 生态科学,2021,40(2):167-174.
[2]Hardeland R. Melatonin in plants-diversity of levels and multiplicity of functions[J]. Frontiers in Plant Science,2016,7:198.
[3]马 征. 拟南芥褪黑素响应UV-B胁迫的功能和其合成酶表达研究[D]. 西安:西北大学,2019.
[4]Yao J W,Ma Z,Ma Y Q,et al. Role of melatonin in UV-B signaling pathway and UV-B stress resistance in Arabidopsis thaliana[J]. Plant,Cell & Environment,2021,44(1):114-129.
[5]Arnao M B,Hernández-Ruiz J. Melatonin:a new plant hormone and/or a plant master regulator?[J]. Trends in Plant Science,2019,24(1):38-48.
[6]Bose S K,Howlader P. Melatonin plays multifunctional role in horticultural crops against environmental stresses:a review[J]. Environmental and Experimental Botany,2020,176:104063.
[7]KolárˇJ,Machácˇková I,Eder J,et al. Melatonin:occurrence and daily rhythm in Chenopodium rubrum[J]. Phytochemistry,1997,44(8):1407-1413.
[8]Murch S J,Simmons C B,Saxena P K. Melatonin in feverfew and other medicinal plants[J]. The Lancet,1997,350(9091):1598-1599.
[9]Manchester L C,Tan D X,Reiter R J,et al. High levels of melatonin in the seeds of edible plants:possible function in germ tissue protection[J]. Life Sciences,2000,67(25):3023-3029.
[10]Burkhardt S,Tan D X,Manchester L C,et al. Detection and quantification of the antioxidant melatonin in Montmorency and Balaton tart cherries (Prunus cerasus)[J]. Journal of Agricultural and Food Chemistry,2001,49(10):4898-4902.
[11]Tan D X,Manchester L C,Reiter R J,et al. Significance of melatonin in antioxidative defense system:reactions and products[J]. Biological Signals and Receptors,2000,9(3/4):137-159.
[12]Murch S J,Krishnaraj S,Saxena P K. Tryptophan is a precursor for melatonin and serotonin biosynthesis in in vitro regenerated St.Johns wort (Hypericum perforatum L.cv. Anthos) plants[J]. Plant Cell Reports,2000,19(7):698-704.
[13]劉德帅,姚 磊,徐伟荣,等. 褪黑素参与植物抗逆功能研究进展[J]. 植物学报,2022,57(1):111-126.
[14]Hattori A,Migitaka H,Iigo M,et al. Identification of melatonin in plants and its effects on plasma melatonin levels and binding to melatonin receptors in vertebrates[J]. Biochemistry and Molecular Biology International,1995,35(3):627-634.
[15]Moustafa-Farag M,Almoneafy A,Mahmoud A,et al. Melatonin and its protective role against biotic stress impacts on plants[J]. Biomolecules,2019,10(1):54.
[16]Dubbels R,Reiter R J,Klenke E,et al. Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectrometry[J]. Journal of Pineal Research,1995,18(1):28-31.
[17]Sharif R,Xie C,Zhang H,et al. Melatonin and its effects on plant systems[J]. Molecules,2018,23(9):2352.
[18]Tan D X. Melatonin and brain[J]. Current Neuropharmacology,2010,8(3):161.
[19]Tan D X,Hardeland R,Back K,et al. On the significance of an alternate pathway of melatonin synthesis via 5-methoxytryptamine:comparisons across species[J]. Journal of Pineal Research,2016,61(1):27-40.
[20]Murch S J,Alan A R,Cao J,et al. Melatonin and serotonin in flowers and fruits of Datura metel L.[J]. Journal of Pineal Research,2009,47(3):277-283.
[21]Back K,Tan D X,Reiter R J. Melatonin biosynthesis in plants:multiple pathways catalyze tryptophan to melatonin in the cytoplasm or chloroplasts[J]. Journal of Pineal Research,2016,61(4):426-437.
[22]王睿劼. 植物褪黑素合成关键酶的生物信息学分析暨转mgfp-5基因烟草的愈伤诱导[D]. 西安:西北大学,2017.
[23]Tan D X,Hardeland R,Manchester L C,et al. The changing biological roles of melatonin during evolution:from an antioxidant to signals of darkness,sexual selection and fitness[J]. Biological Reviews,2010,85(3):607-623.
[24]王 萌. 外源褪黑素对NaCl胁迫下北美豆梨和杜梨生理特性的影响[D]. 保定:河北农业大学,2021.
[25]Tan D X,Manchester L C,di Mascio P,et al. Novel rhythms of N1-acetyl-N2-formyl-5-methoxykynuramine and its precursor melatonin in water hyacinth:importance for phytoremediation[J]. The FASEB Journal,2007,21(8):1724-1729.
[26]Tilden A R,Rasmussen P,Awantang R M,et al. Melatonin cycle in the fiddler crab Uca pugilator and influence of melatonin on limb regeneration[J]. Journal of Pineal Research,1997,23(3):142-147.
[27]冯佳倩,王天明,杨靜文. 海洋动物中褪黑素信号系统的研究进展[J]. 海洋科学,2021,45(11):144-155.
[28]Sheng W L,Weng S J,Li F,et al. Immunohistological localization of Mel1a melatonin receptor in pigeon retina[J]. Nature and Science of Sleep,2021,13:113-121.
[29]Kinker G S,Ostrowski L H,Ribeiro P A C,et al. MT1 and MT2 melatonin receptors play opposite roles in brain cancer progression[J]. Journal of Molecular Medicine,2021,99(2):289-301.
[30]Yasmin F,Sutradhar S,Das P,et al. Gut melatonin:a potent candidate in the diversified journey of melatonin research[J]. General and Comparative Endocrinology,2021,303:113693.
[31]刘扬华,刘诗翔. 睡眠障碍的诊断及治疗概述[J]. 神经损伤与功能重建,2012,7(2):143-146.
[32]刘建忠,朱艳君,周丽芳. 褪黑素生理及药理作用研究进展[J]. 武汉科技大学学报(自然科学版),2004,27(2):198-201.
[33]Calvo J R,González-Yanes C,Maldonado M D. The role of melatonin in the cells of the innate immunity:a review[J]. Journal of Pineal Research,2013,55(2):103-120.
[34]谢爱萍,彭立核,李灵梅,等. 人体中内源性褪黑素作用及检测技术现状[J]. 中国卫生检验杂志,2019,29(22):2814-2816.
[35]Arnao M B,Hernández-Ruiz J. Functions of melatonin in plants:a review[J]. Journal of Pineal Research,2015,59(2):133-150.
[36]Tan D X,Manchester L C,Terron M P,et al. One molecule,many derivatives:a never-ending interaction of melatonin with reactive oxygen and nitrogen species? [J]. Journal of Pineal Research,2007,42(1):28-42.
[37]Yu J C,Lu J Z,Cui X Y,et al. Melatonin mediates reactive oxygen species homeostasis via SlCV to regulate leaf senescence in tomato plants[J]. Journal of Pineal Research,2022,73(2):e12810.
[38]Zeng H Q,Bai Y J,Wei Y X,et al. Phytomelatonin as a central molecule in plant disease resistance[J]. Journal of Experimental Botany,2022,73(17):5874-5885.
[39]Zhu J K. Abiotic stress signaling and responses in plants[J]. Cell,2016,167(2):313-324.
[40]Zhu L,Guo J S,Zhu J,et al. Enhanced expression of EsWAX1 improves drought tolerance with increased accumulation of cuticular wax and ascorbic acid in transgenic Arabidopsis[J]. Plant Physiology and Biochemistry,2014,75:24-35.
[41]贾学静,董立花,丁春邦,等. 干旱胁迫对金心吊兰叶片活性氧及其清除系统的影响[J]. 草业学报,2013,22(5):248-255.
[42]Tan W,Meng Q W,Brestic M,et al. Photosynthesis is improved by exogenous calcium in heat-stressed tobacco plants[J]. Journal of Plant Physiology,2011,168(17):2063-2071.
[43]Shah Jahan M,Wang Y,Shu S,et al. Exogenous salicylic acid increases the heat tolerance in tomato (Solanum lycopersicum L.) by enhancing photosynthesis efficiency and improving antioxidant defense system through scavenging of reactive oxygen species[J]. Scientia Horticulturae,2019,247:421-429.
[44]Jahan M S,Shu S,Wang Y,et al. Melatonin alleviates heat-induced damage of tomato seedlings by balancing redox homeostasis and modulating polyamine and nitric oxide biosynthesis[J]. BMC Plant Biology,2019,19(1):414.
[45]Shanmugam S,Kjaer K H,Ottosen C O,et al. The alleviating effect of elevated CO2 on heat stress susceptibility of two wheat (Triticum aestivum L.) cultivars[J]. Journal of Agronomy and Crop Science,2013,199(5):340-350.
[46]Berry J,Bjrkman O. Photosynthetic response and adaptation to temperature in higher plants[J]. Annual Review of Plant Physiology,1980,31:491-543.
[47]Kattge J,Knorr W. Temperature acclimation in a biochemical model of photosynthesis:a reanalysis of data from 36 species[J]. Plant,Cell & Environment,2007,30(9):1176-1190.
[48]Rexroth S,Mullineaux C W,Ellinger D,et al. The plasma membrane of the cyanobacterium Gloeobacter violaceus contains segregated bioenergetic domains[J]. The Plant Cell,2011,23(6):2379-2390.
[49]Müller P,Li X P,Niyogi K K. Non-photochemical quenching. A response to excess light energy[J]. Plant Physiology,2001,125(4):1558-1566.
[50]Takagi D,Takumi S,Hashiguchi M,et al. Superoxide and singlet oxygen produced within the thylakoid membranes both cause photosystem Ⅰ photoinhibition[J]. Plant Physiology,2016,171(3):1626-1634.
[51]解玉玲. 高溫胁迫对植物生理影响的研究进展[J]. 吉林农业,2019(8):107-108.
[52]徐向东,孙 艳,郭晓芹,等. 褪黑素对高温胁迫下黄瓜幼苗抗坏血酸代谢系统的影响[J]. 应用生态学报,2010,21(10):2580-2586.
[53]Jahan M S,Shu S,Wang Y,et al. Melatonin pretreatment confers heat tolerance and repression of heat-induced senescence in tomato through the modulation of ABA-and GA-mediated pathways[J]. Frontiers in Plant Science,2021,12:650955.
[54]丁红映,王 明,谢 洁,等. 植物低温胁迫响应及研究方法进展[J]. 江苏农业科学,2019,47(14):31-36.
[55]李 贺. 褪黑素对大豆苗期低温胁迫抗性的调控作用[D]. 大庆:黑龙江八一农垦大学,2021.
[56]娄 慧,赵曾强,朱金成,等. 褪黑素对低温胁迫下棉花种子萌发特性的影响[J]. 中国农学通报,2021,37(35):13-19.
[57]Li H,Chang J J,Zheng J X,et al. Local melatonin application induces cold tolerance in distant organs of Citrullus lanatus L. via long distance transport[J]. Scientific Reports,2017,7:40858.
[58]Li J H,Arkorful E,Cheng S Y,et al. Alleviation of cold damage by exogenous application of melatonin in vegetatively propagated tea plant [Camellia sinensis (L.) O.Kuntze][J]. Scientia Horticulturae,2018,238:356-362.
[59]羅会英,金 杰,赵琼玲,等. 辣木干旱胁迫研究进展[J]. 中国热带农业,2021(4):21-23,72.
[60]何小三,徐林初,龚 春,等. 干旱胁迫对‘赣无12苗期光合特性的影响[J]. 中南林业科技大学学报,2018,38(12):52-61.
[61]邓辉茗,龙聪颖,蔡仕珍,等. 不同水分胁迫对绵毛水苏幼苗形态和生理特性的影响[J]. 西北植物学报,2018,38(6):1099-1108.
[62]郑鹏丽,黄晓蓉,费永俊,等. 水分胁迫对桢楠幼树光合生理特性的影响[J]. 中南林业科技大学学报,2019,39(10):64-70.
[63]Campos C N,vila R G,de Souza K R D. Melatonin reduces oxidative stress and promotes drought tolerance in young Coffea arabica L. plants[J]. Agricultural Water Management,2019,211:37-47.
[64]Meng J F,Xu T F,Wang Z Z,et al. The ameliorative effects of exogenous melatonin on grape cuttings under water-deficient stress:antioxidant metabolites,leaf anatomy,and chloroplast morphology[J]. Journal of Pineal Research,2014,57(2):200-212.
[65]Zou J N,Yu H,Yu Q,et al. Physiological and UPLC-MS/MS widely targeted metabolites mechanisms of alleviation of drought stress-induced soybean growth inhibition by melatonin[J]. Industrial Crops and Products,2021,163:113323.
[66]邹京南,曹 亮,王梦雪,等. 外源褪黑素对干旱胁迫下大豆结荚期光合及生理的影响[J]. 生态学杂志,2019,38(9):2709-2718.
[67]古咸彬,陆玲鸿,宋根华,等. 外源褪黑素预处理对干旱胁迫下桃苗生长的缓解效应[J]. 植物生理学报,2022,58(2):309-318.
[68]佟莉蓉,倪顺刚,任星远,等. 褪黑素对干旱胁迫下达乌里胡枝子幼苗生长及叶片水分生理的影响[J]. 草地学报,2021,29(8):1682-1688.
[69]Khattak W A,He J Q,Abdalmegeed D,et al. Foliar melatonin stimulates cotton boll distribution characteristics by modifying leaf sugar metabolism and antioxidant activities during drought conditions[J]. Physiologia Plantarum,2022,174(1):e13526.
[70]Imran M,Latif Khan A,Shahzad R,et al. Exogenous melatonin induces drought stress tolerance by promoting plant growth and antioxidant defence system of soybean plants[J]. AoB Plants,2021,13(4):plab026.
[71]Choudhary S,Wani K I,Naeem M,et al. Cellular responses,osmotic adjustments,and role of osmolytes in providing salt stress resilience in higher plants:polyamines and nitric oxide crosstalk[J]. Journal of Plant Growth Regulation,2023,42:539-553.
[72]孫浩月,吴洪斌,李 明,等. 褪黑素浸种对盐胁迫下芸豆幼苗生长及生理特性的影响[J]. 河南农业科学,2021,50(12):111-120.
[73]Zhang H J,Zhang N,Yang R C,et al. Melatonin promotes seed germination under high salinity by regulating antioxidant systems,ABA and GA4 interaction in cucumber (Cucumis sativus L.)[J]. Journal of Pineal Research,2014,57(3):269-279.
[74]Liang C Z,Zheng G Y,Li W Z,et al. Melatonin delays leaf senescence and enhances salt stress tolerance in rice[J]. Journal of Pineal Research,2015,59(1):91-101.
[75]Wei L,Zhao H Y,Wang B X,et al. Exogenous melatonin improves the growth of rice seedlings by regulating redox balance and ion homeostasis under salt stress[J]. Journal of Plant Growth Regulation,2022,41(6):2108-2121.
[76]Yan Y Y,Jing X,Tang H M,et al. Using transcriptome to discover a novel melatonin-induced sodic alkaline stress resistant pathway in Solanum lycopersicum L.[J]. Plant and Cell Physiology,2019,60(9):2051-2064.
[77]Zhang Y X,Fan Y P,Rui C,et al. Melatonin improves cotton salt tolerance by regulating ROS scavenging system and Ca2+ signal transduction[J]. Frontiers in Plant Science,2021,12:693690.
[78]Xu L L,Xiang G Q,Sun Q H,et al. Melatonin enhances salt tolerance by promoting MYB108A[WTBZ][STBZ]-mediated ethylene biosynthesis in grapevines[J]. Horticulture Research,2019,6:114.
[79]Li Z Y,Ma Z W,van der Kuijp T J,et al. A review of soil heavy metal pollution from mines in China:pollution and health risk assessment[J]. Science of The Total Environment,2014,468/469:843-853.
[80]Figlioli F,Sorrentino M C,Memoli V,et al. Overall plant responses to Cd and Pb metal stress in maize:growth pattern,ultrastructure,and photosynthetic activity[J]. Environmental Science and Pollution Research,2019,26(2):1781-1790.
[81]Yadav S K. Heavy metals toxicity in plants:an overview on the role of glutathione and phytochelatins in heavy metal stress tolerance of plants[J]. South African Journal of Botany,2010,76(2):167-179.
[82]Gu Q,Chen Z P,Yu X L,et al. Melatonin confers plant tolerance against cadmium stress via the decrease of cadmium accumulation and reestablishment of microRNA-mediated redox homeostasis[J]. Plant Science,2017,261:28-37.
[83]Hodzic E,Galijasevic S,Balaban M,et al. The protective role of melatonin under heavy metal-induced stress in Melissa officinalis L.[J]. Turkish Journal of Chemistry,2021,45(3):737-748.
[84]Xu L,Zhang F,Tang M J,et al. Melatonin confers cadmium tolerance by modulating critical heavy metal chelators and transporters in radish plants[J]. Journal of Pineal Research,2020,69(1):e12659.
[85]Ulhassan Z,Huang Q,Gill R A,et al. Protective mechanisms of melatonin against selenium toxicity in Brassica napus:insights into physiological traits,thiol biosynthesis and antioxidant machinery[J]. BMC Plant Biology,2019,19(1):507.
[86]Nawaz M A,Jiao Y Y,Chen C,et al. Melatonin pretreatment improves vanadium stress tolerance of watermelon seedlings by reducing vanadium concentration in the leaves and regulating melatonin biosynthesis and antioxidant-related gene expression[J]. Journal of Plant Physiology,2018,220:115-127.
[87]Vanhaelewyn L,van der Straeten D,de Coninck B,et al. Ultraviolet radiation from a plant perspective:the plant-microorganism context[J]. Frontiers in plant science,2020,11:597642.
[88]萬丽嫱,李光达,和秋兰,等. 外源褪黑素对UV-B辐射下马铃薯光合、荧光特性的影响[J]. 华北农学报,2021,36(4):116-123.
