PPDO/可降解铁混合编织血管支架的结构设计及力学性能
2023-05-16张慧媛汪梦娇李超婧王富军
张慧媛,汪梦娇,李超婧,张 斌,王富军,王 璐
(东华大学 a.纺织学院, b.纺织面料技术教育部重点实验室, 上海 201620)
下肢动脉硬化闭塞症(low arteriosclerosis obliterans, LASO)是指下肢动脉血管发生狭窄甚至闭塞的一类疾病。发病原因是血管壁受损、脂质斑块的沉积等因素致使血管壁逐渐增厚,导致血管腔内狭窄、闭塞[1]。LASO患者以中老年人居多[2-4],我国70岁以上老年人群中,LASO患病率高达15%~20%[5]。下肢动脉狭窄疾病的主要治疗方法有药物治疗和血管支架植入。其中血管支架配合微创手术植入是目前治疗血管类疾病的主要手段[6]。植入的支架能为病变部位提供足够的力学性能并保持动脉管腔畅通,从而有效改善血管局部狭窄问题[7]。临床上使用镍钛合金材料的血管支架[8-9]进行微创治疗,已取得良好的早期治疗效果,但是永久性植入的金属材料在植入后期会引发内膜过度增生等问题[10-11]。生物可降解血管支架是目前血管支架研究的热门方向[12-16]。
Abbott公司采用可降解聚合物——聚乳酸(PLA)制备的Absorb支架和Biotronik公司采用镁合金制备的Magmaris支架,在临床试验中都存在降解速度过快的问题[17-20]。使用可降解高分子制备的血管支架,如PPDO编织型血管支架具有良好的支撑能力和生物相容性,植入后能够有效缓解内膜增生,但同样存在降解速度过快,支架植入后期难以提供足够径向支撑力的问题[21-23]。采用可降解金属铁制备的药物洗脱支架,虽然可以提供足够的支撑性能,但是降解速度过慢,2年左右支架仍未完全降解,容易导致晚期血栓,从而引发血管再狭窄问题[15]。理想的血管支架应该是生物可降解吸收的。血管支架植入人体6个月后,自体血管重构基本完成,因此支架应在6个月内逐步降解[24],以避免限制自体血管的进一步生长。随着支架逐渐降解,自体血管内膜均匀重建,可有效避免支架长期留在体内产生的远期并发症。同时,轴向柔顺的血管支架还可以减少支架植入后对自体血管的伤害,降低支架再狭窄率。
聚对二氧环己酮(PPDO)经美国食品药品管理局(FDA)认证,适用于心血管修复,熔点为105 ℃,易于加工成纤维状态进行支架编织,完全降解周期为180 d,比血管重塑周期略短[25]。可降解金属铁(Fe)是人体必不可少的元素,参与人体基础代谢、电子传导等活动,在体内完全降解时间约为2年,具有良好的生物相容性,降解产物Fe2+离子对血管平滑肌细胞的增殖有一定抑制作用,可促进内皮细胞的增殖。同时Fe具有较高的密度,方便植入后通过X射线对支架植入情况进行观察[26-27]。
本文拟构建PPDO与可降解金属Fe混合编织的血管支架,以增强纯PPDO支架支撑性能。设计两种方法改进编织结构:一是在规则编织的基础上引入轴纱制备三向编织血管支架,以提高混合编织血管支架的支撑性能;二是采用聚己内酯(PCL)包覆可降解金属Fe,熔融形成黏合交织点以提高两种材料在外力作用下的一致性,从而增强支架的力学性能。此外,探究不同编织结构参数对血管支架压缩性能、弯曲性能、降解特性的影响,为编织型可降解血管支架的设计及性能优化提供参考。
1 材料与制备
1.1 材料
PPDO单丝,直径为(3.00±0.01)mm,苏州迈缇康医疗科技有限公司;PCL复丝,线密度为15 tex,苏州迈缇康医疗科技有限公司;铁丝,直径为(2.00±0.01)mm,清河县利胜金属材料有限公司。
1.2 PCL包覆可降解铁丝的设计和制备
为提高金属/聚合物血管支架的力学性能并延长血管支架支撑时间,采用编织工艺制备皮芯结构的聚合物-金属包覆纱(见图1),将包覆纱与PPDO单丝进行混合编织,用于增强编织结构金属/聚合物血管支架的力学性能。
以铁丝为芯纱,结合4组PCL复丝,在8锭编织机上制备PCL/铁丝编织包覆铁芯纱,如图1(b)所示。编织包覆纱表层的PCL纤维在后续的热定型工艺中融化,从而在铁丝表面形成光滑的PCL层,紧密包裹铁丝芯纱(见图1(c))。
1.3 PPDO/可降解铁混合编织血管支架的制备
采用东华大学生物医用纺织品实验室自主研发设计的32锭编织机,以直径为8 mm的不锈钢棒为芯棒,将不同类型的编织包覆纱和PPDO单丝按照一定规律排列,编织成管状结构。最终得到4种编织型血管支架:32根PPDO单丝的规则编织支架(PS)、2根铁丝+30根PPDO单丝的规则编织支架(FPS)、2根铁丝+30根PPDO单丝+1根PPDO单丝(轴纱)的三向编织支架(tFPS)、2根Fe/PCL编织包覆纱+30根PPDO单丝的规则编织支架(hFPS)。其中,hFPS样品利用PPDO和PCL熔点的差异性,在电热鼓风干燥箱中于90 ℃热处理1 h,使得编织支架的纱线交织点处的纱线黏结在一起。

图1 编织包覆纱的制备示意图Fig.1 Preparation of braided coated yarn
2 测试方法
2.1 血管支架的结构表征
血管支架的编织角和节距。使用PXS8-T型体式显微镜(上海测维广电优先科技公司)观测血管支架的表观结构,根据显微镜拍摄的光学照片,使用MB-ruler软件分析血管支架的编织角及节距。使用游标卡尺测量血管支架的内外径,计算得到支架壁厚。
Fe的质量分数。分别截取长度10 mm PS、FPS、hFPS、tFPS支架的样品,用镊子将PPDO单丝与铁丝分开,称取两者的质量,计算得到血管支架中铁的质量分数。每种样品重复测量3次,取平均值。
2.2 血管支架的径向支撑性能测试
血管支架在体内经受反复的径向压缩,足够的径向支撑性能使支架抵抗血管支架蠕动。参照ISO 25539—2012,采用平板压缩法评价支架的径向支撑性能。采用YG061型径向压缩仪(莱州电子仪器有限公司)进行定距离压缩试验,压缩距离为血管支架外径的50%。用径向支撑力(血管支架压缩到外径50%的载荷)表征血管支架的径向支撑性能。压缩曲线如图2所示。
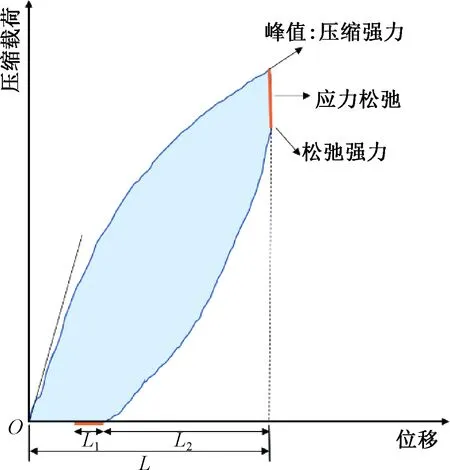
图2 血管支架的压缩曲线Fig.2 The compression curve of vascular stent
压缩参数:初始隔距9 mm,压缩距离4.5 mm;压缩速度15 mm/min,压缩停滞时间30 s;恢复速度15 mm/min,恢复停滞时间30 s。每种样品测试3个样本,通过径向支撑力、弹性回复率Rer、应力松弛率Rss评价血管支架的径向支撑性能。Rer和Rss的计算如式(1)和(2)所示。
式中:L1为缓弹性形变;L2为急弹性形变;L为总形变;f1为压缩强力;f2为松弛强力。
2.3 血管支架的弯曲性能测试
目前暂无评价支架弯曲性能的统一标准,本文从定性和定量两方面评价编织血管支架的轴向弯曲性能。对于支架轴向弯曲性能的定性评价:截取40 mm长度的血管支架,在距离支架两端各15 mm处用金属棒握持,使支架弯曲直至与两端的金属棒保持平行,观察弯曲处支架的管腔形态。采用悬臂梁法定量测量血管支架的抗弯刚度,即固定支架一端,使另一端压脚中心线与支架自由端相距12 mm,缓慢向下压2 mm,自动生成压缩载荷-位移曲线,支架弯曲受力与弯曲形变符合线性回归模型。支架抗弯刚度K按式(3)计算。
式中:F为支架弯曲受力;Lx为悬臂梁长度,本文取12mm;δ为弯曲形变,本文取2mm。
2.4 血管支架的体外降解试验
将所有编织型血管支架用去离子水清洗干净,置于冷冻干燥机中充分干燥,干燥后的试样放入盛有pH=7.4的磷酸缓冲盐(PBS)溶液的密闭容器内,要求样品完全浸没在PBS溶液中。再将装有样品的密闭容器放入50 ℃恒温水浴锅中加速降解[21]。降解过程中,每星期更换1次PBS溶液。在10、20、30、40、50 d时取样,样品用去离子水清洗干净后,放入冷冻干燥机中干燥12 h,收集有效结构支架进行质量测试。质量损失率Wt按式(4)计算,其中m1、m2分别为支架降解前、后的质量。
2.5 数据分析
本文所有定量结果至少从3个样品中获得,数据均采用平均值±标准偏差形式表示。统计结果使用Graphpad Prism 7软件进行显著性分析,p<0.05表示统计结果具有显著性。“****”表示p<0.000 1,“***”表示p<0.001,“**”表示p<0.01,“*”表示p<0.05。
3 结果与讨论
3.1 血管支架的结构参数
编织型血管支架的实物如图3所示,制备得到的4种支架均具有规整的结构,纱线规则排列。

图3 4种结构血管支架的立体显微镜照片Fig.3 Stereoscopic photos of four structural vascular stents
血管支架交织点处的微观结构如图4所示,其中:图4(a)~(c)分别为两根PPDO单丝交织点、PCL未包覆的两根铁丝交织点、PPDO与PCL未包覆的铁丝交织点;图4(d)是PCL组分熔融之后PCL包覆的两根铁丝交织点;图4(e)、(f)是PPDO与PCL包覆的铁丝交织点。由图4可知,加热后熔点较低的PCL组分融化,形成熔融固结点。热处理不仅可以提高支架的稳定性,还可以使材料进一步结晶化,从而提高支架的力学性能。
4种血管支架的结构参数如表1所示,其内径均为8.00 mm,外径为8.62~8.92 mm,所有外径均无显著性差异,厚度为0.62~0.92 mm。热定型后血管支架均保持规律稳定的外观结构,各组纱线之间相互交织,纱线无屈曲变形。三向编织结构血管支架tFPS由于引入了轴向纱线,其厚度最大。hFPS组厚度略大于对照组。P为血管支架轴向单位长度的纱线交织点数量。由表1可知,4种血管支架的P基本相等。所有组的编织角度保持在60.23°~62.96°,节距控制在15.09~17.49 mm。

图4 血管支架交织点处的微观结构Fig.4 Microstructure at the interweaving point of the vascular stents
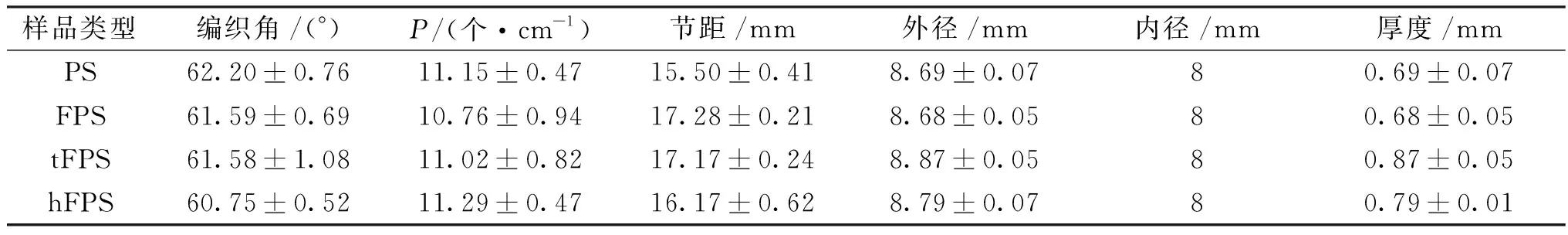
表1 4种编织血管支架的结构表征Table 1 Structural characterization of four braided vascular stents
3.2 血管支架的径向支撑性能
3.2.1 编织结构对血管支架径向支撑力的影响
4种血管支架的平板径向支撑力测试结果如图5所示。血管支架PS、FPS、tFPS、hFPS的平板压缩负荷分别为260.24、299.66、544.40、516.11 cN。结构优化后的血管支架FPS、tFPS、hFPS组径向支撑力均得到一定程度的提高,其中tFPS、hFPS组径向支撑力相比PS组提高了2倍左右。这是因为:三向编织是在二维编织的基础上添加1根或多根轴向纱线,且轴向纱线不参与编织运动,轴向纱线的引入能够减少纱线的滑移,从而提高支架的径向支撑力;hFPS组在编织型包覆纱热定型后,熔点较低的PCL组分融化,使得部分交织点固结(见图4(d)),径向支撑力增强。hFPS组径向支撑力略低于tFPS组支架,这是因为三向编织结构中纱线交织密度更大,更难滑移。
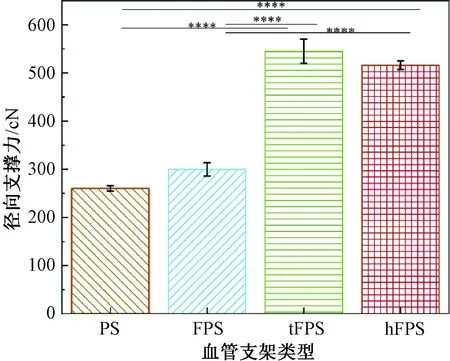
图5 4种血管支架的径向支撑力Fig.5 Radial support strength of four kinds of vascular stents
3.2.2 编织结构对血管支架弹性回复率的影响
4种血管支架的弹性回复率如图6所示。由图6可知,血管支架PS、FPS、tFPS、hFPS的平板压缩弹性回复率分别为94.80%、80.47%、73.20%、74.82%。PS组弹性回复率最高,随着铁丝的引入,血管支架的弹性回复率降低。tFPS组弹性回复率低于hFPS组,这可能是因为第三组轴向纱线的引入导致更多纱线交织点被固定。tFPS和hFPS组略低于FPS组,这是因为轴纱和熔融固结点导致纱线难以滑移,从而塑性形变增加。由此可见,相比引入轴纱的方法,用热熔纱线固定交织点能够在提高支架的抗压强度的同时,减少支架弹性回复率性能的损失。
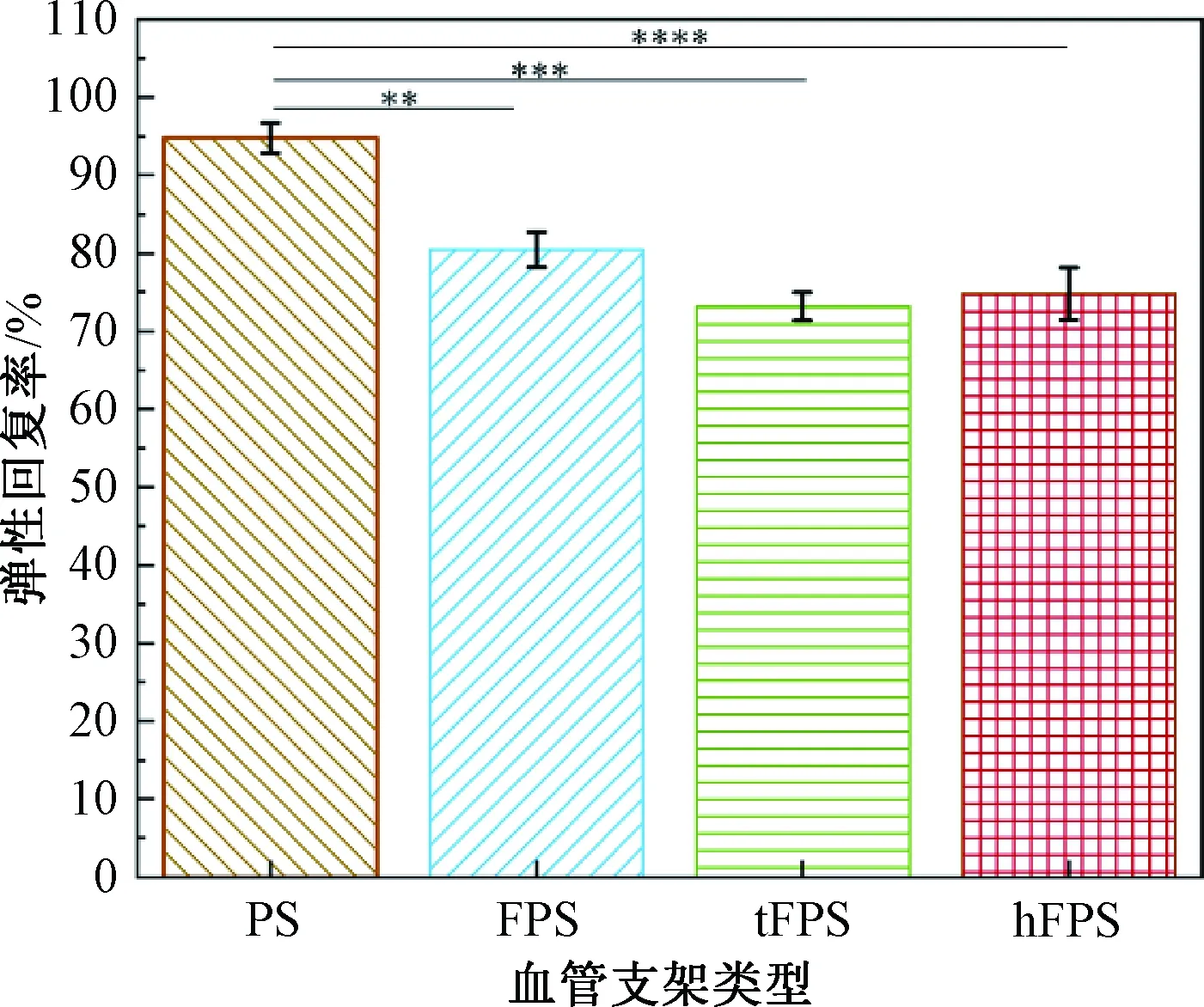
图6 径向压缩时4种血管支架的弹性回复率Fig.6 Elastic recovery rates of four kinds of vascular stents under radial compression
3.2.3 不同编织结构对应力松弛率的影响
4种血管支架压缩至直径的50%保持一定时间,支架的应力松弛率如图7所示。血管支架PS、FPS、tFPS、hFPS的平板压缩应力松弛率分别为8.61%、11.54%、11.57%、9.53%。平板压缩中,编织结构对应力松弛有一定影响,引入铁丝后,应力松弛率小幅度增大。hFPS组应力松弛率小于tFPS组,表现出更小的黏弹性,说明hFPS组支架抵抗外力变形的能力更优秀。这可能是因为tFPS组交织点更多,变形过程中纱线的弯曲变形更大。
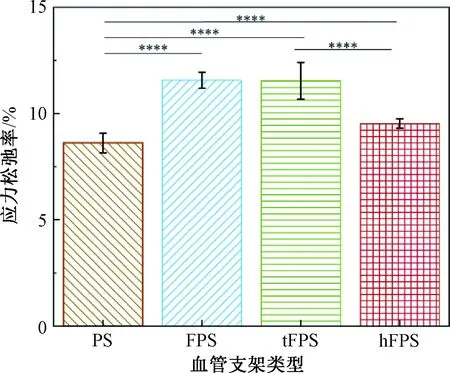
图7 4种血管支架径向压缩的应力松弛率Fig.7 Stress relaxation rate of four kinds of vascular stents under radial compression
3.3 血管支架的弯曲性能
血管支架的弯曲性能定性和定量表征结果如图8所示。血管支架受到弯曲作用时,管腔的直径变化直接反映支架的柔顺性能。由图8(a)可以看出,加入铁丝后,管腔的通畅程度略低于PS支架,三向编织支架tFPS表现得尤为明显,管腔外侧出现变形。这是因为第三组纱线的引入阻止了纱线的滑移。总体而言,4种编织型血管支架在弯曲后仍然可以保持管腔畅通,管径无明显变化,均表现出良好的柔顺性。这对适应血管内的弯曲作用力,减少损害自体血管等都是非常有益的。
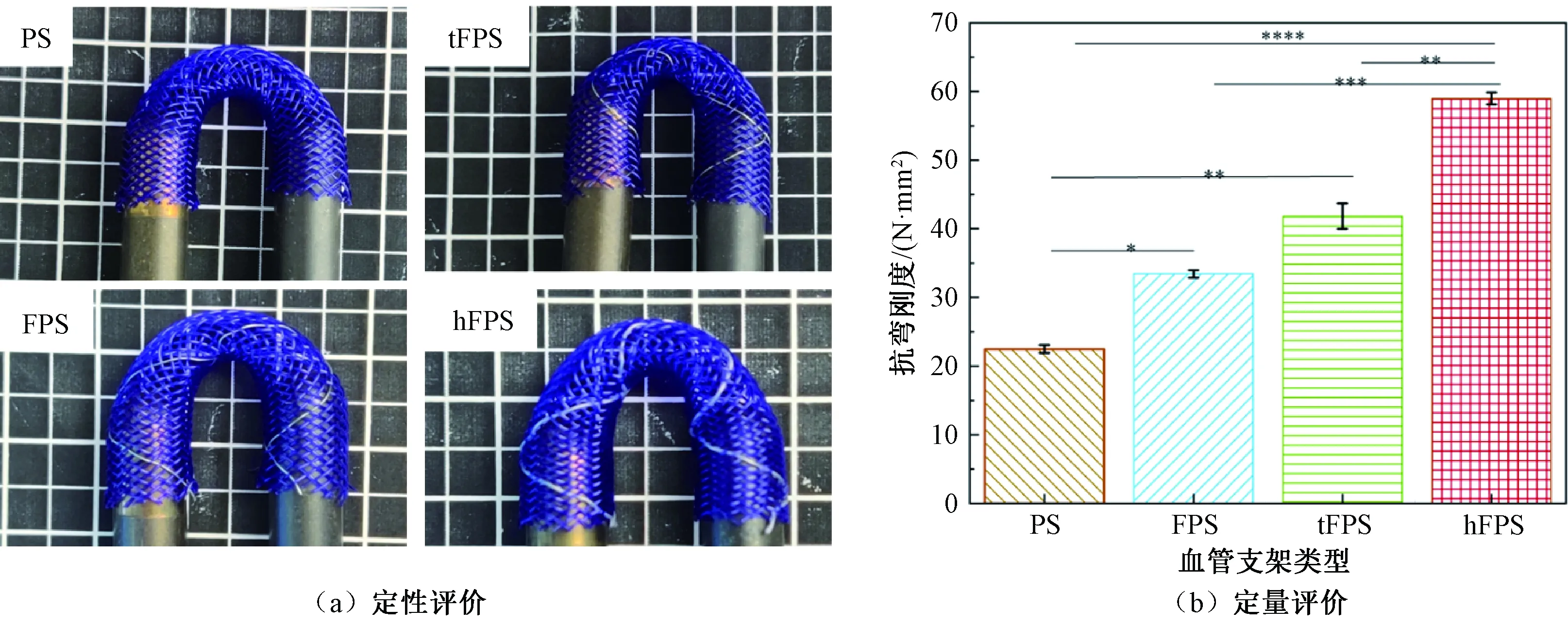
图8 4种血管支架的弯曲性能定性和定量评价Fig.8 Qualitative and quantitative evaluation of bending performance of four kinds of vascular stents
抗弯刚度可定量评价血管支架的轴向柔顺性。相同试验条件下,抗弯刚度小的样品具有更好的纵向柔顺性。由图8(b)可知,血管支架PS、FPS、tFPS、hFPS的抗弯刚度分别为22.49、33.43、41.85、58.99 cN。可见引入铁丝后3种血管支架的抗弯刚度有所增大。这是由铁丝较大的模量、第三组轴向纱线的引入以及纱线交织点的固结综合作用所导致的。
3.4 血管支架的体外降解研究
通过体外降解试验初步考察血管支架的降解规律。由于可降解金属Fe的降解周期约为2年,本文采用加速降解试验模拟血管支架的体内自然降解。根据时温等效原理,通过50 ℃加速降解20 d模拟体外静态降解3个月,加速降解40 d模拟体外静态降解6个月[21]。降解过程中支架的表观形貌变化如图9所示。

图9 不同降解时期4种编织血管支架的形貌变化Fig.9 Morphological changes of four braided vascular stents in different degraded periods
由图9可知,4种支架在体外静态降解30 d内表现出相似的缓慢降解趋势。降解30 d时,血管支架出现明显的纱线断裂现象,支架结构开始解体;降解40 d后支架中的纱线材料变得脆硬,极易断裂,逐渐断裂为粉末即颗粒状,较多成分溶解在降解液中,难以收集;降解50 d时PPDO组分从支架中完全脱落。PPDO降解时颜色逐渐变浅,因此降解过程中的颜色变化也能反映血管支架的降解速度[21]。降解30 d后,FPS、tFPS、hFPS组的PPDO组分颜色明显比PS组浅,表明引入铁丝后PPDO的降解速度加快。FPS、tFPS组中PPDO组分降解后剩余铁丝无法保持结构稳定,hFPS组中皮芯结构的纱线通过交织点的黏结固定仍然保持具有一定力学性能的管状结构。由此可见,FPS、tFPS、hFPS组表现出明显的两级降解趋势,即PPDO组分先降解,在PPDO组分完全降解前金属Fe和皮芯结构热黏合铁丝组分保持稳定,随着降解过程的继续,支架材料进一步降解,直至第二组分(Fe)完全降解。
降解过程中4种血管支架的质量损失率和径向支撑力变化趋势如图10所示。由图10(a)可知:4种血管支架在降解30 d内质量保持稳定,质量损失率不超过10%,FPS、tFPS、hFPS组质量损失率略高于PS组,表明铁丝能够加速PPDO的降解。降解30 d后,血管支架的质量出现明显损失。在聚合物降解早期大分子链在水解作用下酯键发生断裂,但是仍然具有不溶性,随着水解程度的增加,大分子链逐渐断裂为可溶性的小分子链段并随水分子进入降解液中[28]。降解40 d后,PS组支架结构失效,溶解在降解液中,FPS、tFPS、hFPS组质量损失率达80%以上,这是因为仅剩下金属组分。hFPS组质量损失率较小,因为其中的PCL和Fe成分均未降解。
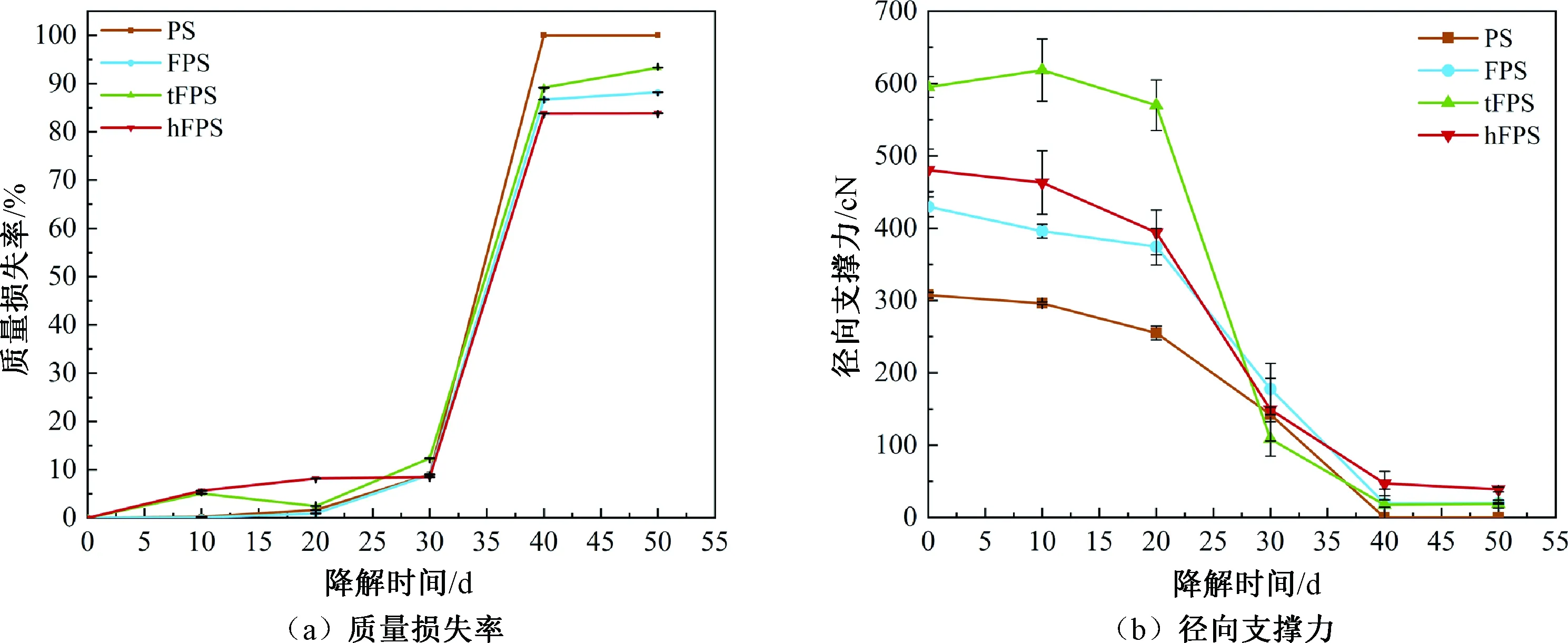
图10 血管支架降解过程中的质量损失率和径向支撑力Fig.10 Mass loss rate and radial support strength during degradation of vascular stents
由图10(b)可知:血管支架降解前20 d的径向支撑力变化较小。降解20 d时,tFPS组径向支撑力最大(570.15 cN),hFPS组略高于FPS组。降解20~40 d时,径向支撑力发生突变,这是由于支架主体PPDO组分发生脆性断裂。降解40 d时:PS组中PPDO脆性断裂,支架结构失效,径向支撑力为0;FPS、tFPS、hFPS组的径向支撑力分别为19.73、18.72、38.94 cN,可以看出hFPS组明显高于FPS、tFPS组。这是因为hFPS组中热黏合加固点仍保持作用,而三向编织中起加强径向支撑力作用的PPDO纱线已经降解,FPS、tFPS组剩余的铁丝组分脱散,难以维持支撑性能。由此可见,hFPS血管支架与人自身血管重构周期较为匹配。
4 结 论
(1)在可降解PPDO支架中加入可降解铁丝能够有效提高血管支架的支撑性能。引入轴向纱线、增加黏合编织点可提高编织型血管支架的径向支撑性能,但会降低血管支架的弹性回复率。
(2)采用引入轴纱和增加热熔黏合编织点分别改进编织结构时,增加热熔黏合编织点的改进方法具有更优异的支撑性能增强作用,且血管支架的柔顺性更好。
(3)在体外降解过程中,血管支架有超过30 d的力学稳定性和质量稳定性,之后PPDO组分逐渐降解。相对而言,hFPS支架在降解过程中具有更稳定的支撑性能,与人自身血管重构周期较为匹配。
