红蓝光对设施‘红地球’葡萄花芽分化的影响
2023-05-05张亚红
刘 鑫,张亚红,袁 苗,刘 帅,葛 静,周 娟
(1.宁夏大学农学院,银川 750021;2.宁夏大学食品与葡萄酒学院,银川 750021)
【研究意义】我国是葡萄(VitisviniferaL.)最大生产国,近年来设施葡萄迅速发展,成为推动葡萄产业繁荣的新动力[1]。但设施中的弱光环境导致设施‘红地球’葡萄栽培连续形成花芽能力差、分化数量少,成为设施葡萄栽培生产中的突出问题[2]。因此,花芽分化不良已成为阻碍设施‘红地球’葡萄产业健康发展的瓶颈,能否形成量多质优的花芽已成为设施葡萄栽培取得成功的关键。【前人研究进展】‘红地球’葡萄对光反应敏感,设施弱光环境下的花芽更多形成卷须,导致成花率下降,目前主要通过选用一些耐弱光品种[3]或采取更新修剪措施[4],但两种措施都存在局限性,前者缺乏适合西北地区的优质耐弱光品种,后者对设施‘红地球’葡萄萌发新梢成花规律尚未展开研究。光照作为必不可少的环境因子,影响园艺作物生长发育[5],也是最容易调控的设施环境因素。光照强度直接影响植物的生长发育和形态特征[6];光照周期影响植物的生育进程和营养生长[7];光质调节激素平衡、光合产物累积等改变植物内部因子,从而调控成花基因的表达[8-9],是花芽分化的重要影响因素。不同光质对园艺植物成花的影响不同[10]。蓝光通过改变叶片中营养物质积累,抑制了苹果开花,而红光对苹果开花影响不大[11]。红光处理可促使茉莉花提前开花且增加花蕾数量,而蓝光延迟茉莉开花但花蕾数量减少[12]。因此,不同光质对长日照植物成花诱导的影响取决于所涉及的物种,而红光与蓝光的结合可形成适合植物光合作用和形态发生的光谱吸收峰,激活植物中复杂的光系统,启动生理和生化反应,形成完全发育的花芽[13-14]。【本研究切入点】LED能精准提供植物所需波长的光质、光强和光长,在设施园艺光环境调控中具有重要意义和作用[15]。目前,使用不同光质LED提高产量和品质在花卉和蔬菜[16-18]上已有广泛应用,在果树上也有一些研究[19-20]。但利用LED光照措施提升设施内的光环境,改善设施葡萄花芽分化的研究较少,且对设施葡萄花芽分化过程中内源物质变化及基因层面的研究还较欠缺,因此,深入研究LED光质对调控葡萄花芽分化具有重要意义。【拟解决的关键问题】本研究通过不同红蓝光处理,对花芽分化进程进行组织学、生理指标和成花相关基因研究,进而了解红蓝光对‘红地球’葡萄花芽分化的调控机理,为设施‘红地球’葡萄连年优质稳产提供理论依据和解决方案。
1 材料与方法
1.1 试验材料
试验于2020年4—10月在银川市贺兰县园艺产业园15号阴阳结合型日光温室的阴棚内进行(106°16′ E,38°20′ N),属中温带大陆性气候。阴棚坐南朝北,东西走向,东西长度90 m,南北跨度9 m,脊高4.5 m,覆盖材料为聚氯乙烯薄膜(PVC),年平均日照时数2800~3000 h,年平均气温9.7 ℃。试验材料为日光温室9年生的‘红地球’(Vitisviniferacv.‘Red Globe’)葡萄,主干倾斜L树形,株行距为0.8 m×1.5 m。
1.2 试验设计
试验设计5种不同比例红蓝光,红光波长620 nm,蓝光波长435 nm。分别为红(R)、蓝(B)、红蓝2∶1(R2B1)、红蓝4∶1(R4B1)、红蓝6∶1(R6B1)的LED植物灯,以温室自然光作为对照(CK),不同处理间以遮光膜相隔。共72株树,分6个小区,每个小区12株,3次重复,在每组试验行树体上方30 cm安置灯管,叶面光照强度300 μmol/(m2·s),时长14 h/d,光照时段为8:00—22:00。选取健康、长势相同的葡萄植株挂牌标记,观察试验植株情况,新梢长至10叶时进行摘心,副梢留1叶摘心,进行常规水肥管理。
1.3 生理指标测量
‘红地球’葡萄从萌发开始光照,到果实成熟(2020年9月15日)采收结束光照。新梢展叶时(2020年4月15日)开始采集长势相近、基部粗度一致的枝条,随机取样,每个处理采集20只枝条。选择4~6节花芽和叶片,用锋利刀片取下,剥去外部鳞片,取下主芽放入FAA液(90 mL 70%乙醇+5 mL 38%甲醛+5 mL冰乙酸)固定液中,用于制作花芽切片。
花芽石蜡切片和花芽分化进程划分参照朱维等[21]的方法;将不同节位叶片混匀,可溶性糖和淀粉含量采用蒽酮-硫酸比色法测定,可溶性蛋白含量采用考马斯亮蓝G-250染色法测定,类黄酮含量采用分光光度法测定,所有测量指标3次重复,具体步骤参考王学奎等[22]的方法。
1.4 成花相关基因的表达分析
选择成熟期(2020年9月15日)9:00 取各处理第5节花芽,以减少由于昼夜节律而导致基因表达差异的可能性。将取下的花芽立即置于液氮中,用OminiPlant RNA Kit(DNase I)试剂盒(北京康为世纪生物科技有限公司)提取样品的RNA,利用Nanodrop 2000检测RNA的浓度和纯度,琼脂糖凝胶电泳检测RNA完整性,使用Agilent 2100测定RIN值。根据Genbank发表的葡萄基因序列,利用Primer 6.0软件设计成花基因特异性引物(表1)[23],由生物工程(上海)股份有限公司合成,选用VvACTIN1(GenBank:XP_008654957.1)为内参基因,采用2-ΔΔCt法计算基因相对表达量。qRT-PCR使用ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技有限公司),PCR反应体系为20 μL:one step RT-qPCR Master Mix 10 μL,上游引物和下游引物各0.4 μL,Template(RNA)1 μL,RT enzyme Mix 0.65 μL,ddH2O 7.55 μL。反应程序为50 ℃反转录5 min,95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火延伸30 s,40次循环,3次重复。

表1 实时荧光定量PCR基因引物序列Table 1 Primer sequences for the quantification of transcripts by real-time PCR
1.5 数据统计与分析
采用SPSS 25.0进行单因素方差分析(One-way ANOVA),Duncan法进行多重比较(α=0.05),Origin Pro 2021软件进行制图,数据为平均值±标准差。采用Cytoscape 3.8.0软件,选取相关性大于0.6的基因,构建基因间相互作用网络,使用CytoHubba工具(Method:MNC),找出节点基因,并将基因按总关联度大小进行排序。
2 结果与分析
2.1 ‘红地球’葡萄花芽分化进程划分
通过对不同处理下‘红地球’葡萄各节位花芽分化观察,将花芽分化进程分为未分化期、始分化期、花原始体发育期、花序主轴发育期和花序二级轴发育期5个阶段(图1)。

a.未分化期;b.始分化期;c.花原始体发育期;d.花序主轴发育期;e.花序二级轴发育期。A.生长点;LP.叶原基;IP.花序原基;BR.苞片;BP.分枝原基。a.Undifferentiated stage; b.Beginning of differentiation; c.Flower anlagen development; d.Formation of main cob of inflorescene; e.Formation of second cob of inflorescene; A.Apex; LP.Leaf primordium; IP.Inflorescence primordium; BR.Bracts; BP.Branching primordium.图1 ‘红地球’葡萄花芽分化进程切片Fig.1 Paraffin section of flower bud differentiation process of ‘Red Globe’ grape
2.2 不同比例红蓝光对‘红地球’葡萄第4节花芽分化进程的影响
‘红地球’葡萄的花芽分化是一个循序渐进的过程,且各阶段持续时间长。从图2可以看出,对照和红蓝光处理下的第4节花芽于5月15日开始进入始分化期,并且同期R4B1和R6B1处理已有花芽进入花原始体发育期。6月15日,所有处理进入花序主轴发育期,6月30日,R4B1和R6B处理已经进入花序二级轴发育期,7月15日所有处理进入花序二级轴发育期,其中,R4B1和R6B1处理所占比例为40%和35%,对照为10%,而R和B处理仅为5%。所有处理于7月30日通过始分化期,8月30日通过花原始体发育期。

图2 不同比例红蓝光对‘红地球’葡萄第4节花芽分化进程的影响Fig.2 Effect of different proportions of red and blue light on flower bud differentiation process in section 4 of ‘Red Globe’grape
2.3 不同比例红蓝光对‘红地球’葡萄第5节花芽分化进程的影响
由图3可以看出,红蓝光处理下‘红地球’葡萄第5节花芽分化速度差异明显。4月30日,所有处理均没有进入分化期,R4B1和R6B1处理在5月15日已有花芽进入花原始体发育期,而其他处理在5月30日才开始有花芽进入花原始体发育期。R2B1、R4B1和R6B1处理在6月30日开始进入花序二级轴发育期,进入分化期的花芽分别占比为75%、90%和90%,而CK、R和B处理进入分化期的花芽占比为75%、65%和55%。7月15日,所有处理均进入花序二级轴发育期,并在8月30日通过花原始体发育期。

图3 不同比例红蓝光对‘红地球’葡萄第5节花芽分化进程的影响Fig.3 Effect of different proportions of red and blue light on flower bud differentiation process in section 5 of ‘Red Globe’ grape
2.4 不同比例红蓝光对‘红地球’葡萄第6节花芽分化进程的影响
由图4可以看出,红蓝光处理下的‘红地球’葡萄第6节花芽在5月15日全部进入始分化期,5月30日进入花原始体发育期,6月15日进入花序主轴发育期。其中,R4B1和R6B1处理分化速度大于其他处理,6月15日时,R和B处理仍有部分花芽未进入分化期。7月15日,所有处理均进入花芽分化期,且R2B1、R4B1和R6B1处理全部通过始分化期。7月30日,全部处理均通过始分化期,进入花序二级轴发育期,R4B1和R6B1处理进入花序二级轴发育期的花芽占比分别为55%和45%,CK为20%,而B处理仅为10%。8月15日,R4B1处理全部进入花序主轴发育期和花序二级轴发育期。

图4 不同比例红蓝光对‘红地球’葡萄第6节花芽分化进程的影响Fig.4 Effect of different proportions of red and blue light on flower bud differentiation process in section 6 of ‘Red Globe’ grape
2.5 不同比例红蓝光对‘红地球’葡萄成花率的影响
不同红蓝光处理下‘红地球’葡萄各节位成花率差异显著(图5),单一红、蓝光补光处理下成花率降低,红蓝光组合补光处理下成花率升高,第5节成花率高于第4和第6节。不同处理下,第5节以单一蓝光成花率最低,为38%,R2B1处理和CK成花率相等,为50%,R6B1和R4B1处理均显著高于CK,分别为62%和66%,表明R4B1和R6B1处理能显著提高‘红地球’葡萄成花率。

图5 不同比例红蓝光对‘红地球’葡萄成花率的影响Fig.5 Effect of different proportions of red and blue light on flowering rate of ‘Red Globe’ grape
2.6 不同比例红蓝光对‘红地球’葡萄叶片可溶性糖和淀粉含量的影响
从图6可以看出,CK叶片可溶性糖含量在花芽未分化时上升,花芽分化前期含量持续下降,进入花序二级轴发育期后开始上升,直到花芽分化末期;不同红蓝光处理下叶片可溶性糖含量变化趋势基本相同,花芽分化前期可溶性糖含量持续上升,进入花原始体发育期后含量开始下降,进入花序二级轴发育期后开始上升。不同处理下叶片的淀粉含量变化趋势相同,在花芽分化前期淀粉含量持续上升,进入花原始体分化期后迅速下降,随后在花序二级轴发育期开始上升。进入花序原基分化期后,消耗了大量的糖和淀粉,R4B1和R6B1处理下的可溶性糖和淀粉含量高于其他处理,这些较高水平的碳水化合物为前期花芽分化提供了能量。
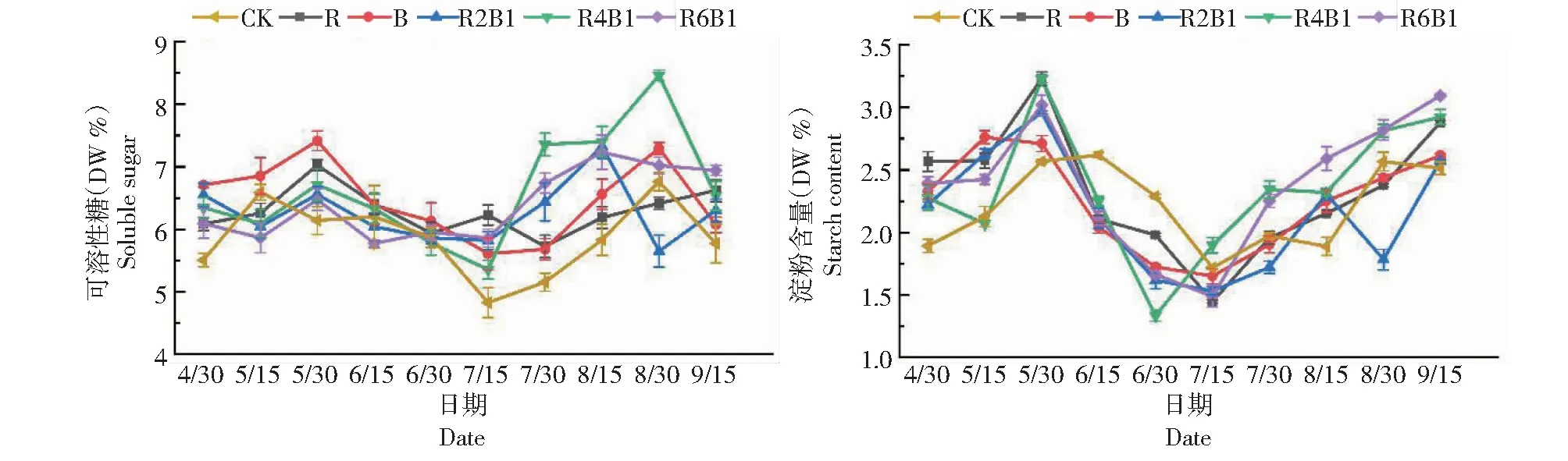
图6 不同比例红蓝光对‘红地球’葡萄叶片可溶性糖和淀粉含量的影响Fig.6 Effect of different proportions of red and blue light on soluble sugar and starch content of ‘Red Globe’ grape leaves
2.7 不同比例红蓝光对‘红地球’葡萄叶片可溶性蛋白和类黄酮含量的影响
由图7可以看出,不同处理后叶片可溶性蛋白含量变化趋势相同,花芽分化前期至花序二级轴分化期叶片可溶性蛋白含量不断上升,在花芽分化后期下降后趋于稳定,整个过程中R4B1和R6B1处理含量高于其他处理,CK和R处理含量最低。叶片类黄酮含量在花芽分化开始前水平较低,在花芽始分化期迅速上升,进入花原始体发育期后含量开始下降,最高点分别为:R处理在花原始体发育期、R2B1处理在花序主轴发育期,其他处理在花序二级轴发育期。

图7 不同比例红蓝光对‘红地球’葡萄叶片可溶性蛋白和类黄酮含量的影响Fig.7 Effect of different proportions of red and blue light on soluble protein and flavonoid contents of ‘Red Globe’ grape leaves
2.8 不同比例红蓝光对‘红地球’葡萄成花基因表达量的影响
以CK成花基因表达量为对照,对不同补光组合下花芽成花基因表达进行了实时荧光定量PCR分析(图8)。在不同补光组合处理下,花芽中VvAP2、VvSOC1表达量均显著提高,VvLFY表达量显著降低。在R和B处理下,花芽中VvAP2和VvAP3表达量最高;在R2B1处理下,花芽中VvAP1表达量最高;在R4B1处理下,花芽中VvFT、VvAG、VvAP2和VvSOC1表达量最高;在R6B1处理下,花芽中VvFUL、VvFT和VvSPL10表达量最高。

图8 不同比例红蓝光对‘红地球’葡萄花芽成花基因表达量的影响Fig.8 Effects of different proportions of red and blue light on flowering gene expression of ‘Red Globe’ grape
2.9 不同比例红蓝光下‘红地球’葡萄成花基因间的相关性分析及相互作用
对不同补光组合下的成花率和10个成花相关基因的表达量进行相关性分析(表2)。CK的成花率与VvAP2表达量呈显著正相关,与VvSOC1表达量呈负相关;R处理的成花率与VvFT表达量呈显著正相关,与VvAP1表达量呈显著负相关;B处理的成花率与VvSOC1表达量呈显著正相关,与VvAG表达量呈负相关;R2B1处理的成花率与VvAP2表达量呈负相关;R4B1处理的成花率与VvFUL、VvFT和VvSPL10表达量呈显著正相关;R6B1处理的成花率与VvFUL、VvFT、VvAG和VvSPL10表达量呈正相关。

表2 不同比例红蓝光下‘红地球’葡萄成花基因与成花率的相关性分析Table 2 The correlation analysis between flowering gene and flowering rate of ‘Red Globe’ grape under different proportions of red and blue light

续表2 Continuedtable 2
R4B1和R6B1处理下成花率显著提高,因此,对R4B1和R6B1处理下相关性大于0.6的成花基因进一步的相互作用进行网络分析(图9)。可以看出,R4B1和R6B1处理下,VvAP1、VvAP2和VvSOC1的相对表达量较高。此外,在R4B1处理下,VvAP1、VvAP2、VvAP3和VvLFY为节点基因。其中,VvAP1与VvFT呈正相关,与VvAP2、VvAP3呈负相关;VvFLC和VvAG呈负相关,VvFT与VvAP2、VvSOC1和VvSPL10呈正相关。在R6B1处理下,VvAP1、VvAP2、VvSOC1和VvLFY为节点基因。其中,VvAP1与VvAP2、VvLFY呈负相关;VvAP2与VvLFY、VvFT和VvSOC1呈正相关;VvFLC与VvSOC1和VvAG呈负相关。

圆代表基因,圆的大小与基因表达水平呈正相关,圆的颜色深浅与总关联度正相关,粗框圆为节点基因。连接线粗细与基因间的相关性大小呈正相关,红色为正相关,蓝色为负相关。The circle represents genes.The size of the circle is positively correlated with the relative expression level of the gene.The colour depth of the circle is positively correlated with the total correlation degree.The coarse frame circle is the node gene.The thickness of the connecting line is positively correlated with the correlation between genes, and red is positively associated, and blue is negatively correlated.图9 R4B1和R6B1处理下成花基因相互作用网络图Fig.9 Interaction network of flowering genes under R4B1 and R6B1 treatments
3 讨 论
光照是花芽形成的必需条件,光质影响植物内部营养物质积累,进而调节枝梢营养和生殖平衡[24]。众所周知,碳水化合物代谢涉及淀粉和糖的合成、分解代谢和相互转化,在多个成花途径中具有重要的信号和能量作用[25]。可溶性糖是花芽分化过程中的营养基础,与甜樱桃[26]、骏枣[27]等果树的花芽分化显著正相关;淀粉是碳水化合物中最重要的部分,代表着植物体有机营养水平,并根据植物需要进行调动或积累,叶片中较高的淀粉含量促进苹果树花芽形成[28]。本研究中,可溶性糖和淀粉含量在花芽分化前期持续上升,进入花序原基分化期后下降,在花序二级轴发育期开始上升。不同光照处理下的碳水化合物含量均高于CK,其中,R4B1和R6B1处理下碳水化合物含量最高。表明在‘红地球’葡萄花芽分化中期消耗了大量的碳水化合物,而补光处理下叶片较高的碳水化合物水平促进了花芽分化。
可溶性蛋白作为花芽分化的重要生理指标,与植物性状表达密切相关,在植物花芽转变过程中是不可或缺的营养物质[29]。黄酮类化合物在植物体内合成代谢起源于光合产物,遍布植物体的各个组织,对植物生殖生长起着重要作用[30]。本研究发现,不同补光处理叶片蛋白含量显著提高,与刘帅等[31]的研究结果一致,并在花芽未分化期开始上升至花序二级轴发育期达到最大值;叶片类黄酮含量在花序原基分化期迅速上升,并在花芽分化中后期保持较高水平,表明良好的花芽分化需要积累大量的可溶性蛋白和类黄酮。
控制花芽分化的基因需要特定的外界刺激和内部各种生理调节后进行表达,成花基因的相关研究有助于从根本上了解光环境对花芽分化的影响。FT蛋白作为开花素,促使花分生组织特异性基因的表达,促进开花[32]。R4B1和R6B1处理下VvFT基因的表达水平显著上调,说明植物光受体在受到红蓝光刺激后,通过信号传递调控相关基因表达,进而影响花芽分化[33]。此外,FT还可以激活花整合基因SOC1和花分生组织基因AP1,启动拟南芥的花转换和花芽分化,然后,SOC1激活花分生组织识别基因LFY,控制花的诱导[34]。SOC1既作为信号通路的响应因子,又作为开花信号整合因子调节拟南芥开花[35];AP1和FUL是花分生组织特征基因,调控花序分生组织向花分生组织的转变[36];LFY通过整合环境和内源信号,控制植物花的生长发育[37]。本研究中R4B1处理下VvFT和VvAP1、VvSOC1表达呈正相关。AP2、AP3和AG是花器官特征基因,参与植物花芽分化,FLC是调控春化作用的关键基因,对成花基因FT和SOC1有抑制作用[38],SPL10是成花网络中赤霉素途径调控基因,对成花有正向调控作用[39]。成花率较高的R4B1和R6B1处理下成花基因与成花率相关性分析表明,成花率与VvFUL、VvFT、VvAG和VvSPL10表达量呈正相关,与VvLFY、VvAP3和VvFLC表达量呈负相关,进一步的网络互作图表明,VvAP1、VAP2和VvSOC1表达量和总关联度较高,VvAP1、VvAP2、VvSOC1和VvLFY是成花基因相互作用关键节点。
4 结 论
不同比例红蓝光对设施‘红地球’葡萄的花芽分化和成花基因表达有显著影响。其中,R4B1处理下叶片可溶性糖、淀粉、可溶性蛋白、类黄酮含量显著提高,成花基因VvFUL、VvFT、VvAG、VvAP1、VvAP2、VvSOC1和VvSPL10上调表达,VvLFY和VvFLC下调表达,促进了‘红地球’葡萄的花芽分化。成花率与VvFUL、VvFT、VvAG和VvSPL10表达量呈正相关,VvAP1、VvAP2、VvSOC1和VvLFY是成花基因相互作用关键节点,但光质是如何影响植物体内营养物质合成转运以及成花基因的调控机制仍需进一步研究。
