白蛋白结合型紫杉醇联合用药治疗中晚期宫颈癌的临床效果
2023-05-05郏柯张萍周霜霜
郏柯,张萍,周霜霜
宫颈癌是一种妇科恶性肿瘤,在临床较为常见[1]。近年来,随着医疗技术的不断进步与宫颈细胞筛查的广泛应用,宫颈癌患者多得到了及时治疗,总体病死率有所降低,但中晚期宫颈癌患者病死率仍居高不下[2]。目前,临床治疗宫颈癌的方案以紫杉醇联合铂类同步放化疗较为常用,但有一定的不良反应发生风险[3]。本研究观察白蛋白结合型紫杉醇联合用药治疗中晚期宫颈癌治疗的临床效果,总结报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2018年1月—2020年12月苏州大学附属张家港市第一人民医院收治的80例中晚期宫颈癌患者临床资料,所纳入患者均符合宫颈癌的诊断标准[4]。排除标准:合并心肺疾病;与上次放化疗间隔时间<3周及存在认知障碍的患者。根据用药方案不同分为紫杉醇组与白蛋白结合型紫杉醇组,各40例。紫杉醇组年龄37~62(52.26±8.47)岁;体质量:40~55 kg 12例,56~70 kg 28例;病程:1~3年25例,4~6年15例;肿瘤直径:4~5 cm 22例,6~7 cm 18例;病理分期:Ⅱb期 16例,Ⅲa期4例,Ⅲ期 20例;病理类型:鳞癌31例,腺癌5例,腺鳞癌4例;病程发展情况:首次治疗18例,病程进展中13例,复发型6例,难治型3例。白蛋白结合型紫杉醇组年龄36~61(52.03±8.63)岁;体质量:40~55 kg 11例,56~70 kg 29例;病程:1~3年26例,4~6年14例;肿瘤直径:4~5 cm 23例,6~7 cm 17例;病理分期:Ⅱb期15例,Ⅲa期3例,Ⅲ期 22例;病理类型:鳞癌32例,腺癌6例,腺鳞癌2例;病程发展情况:首次治疗19例,病程进展中14例,复发型5例,难治型2例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会核准开展。
1.2 方法 紫杉醇组予紫杉醇+顺铂+同步放疗方案治疗:(1)化疗前准备:紫杉醇化疗前12 h予患者地塞米松10 mg口服,化疗前30 min予患者西咪替丁0.4 mg+格拉司琼3 mg+地塞米松5 mg静脉注射,并予患者异丙嗪25 mg肌内注射,同时予患者预防性升白细胞、止吐等对症支持治疗。(2)化疗:化疗第1天予患者紫杉醇注射液(南京思科药业有限公司生产)175 mg/m2静脉注射,化疗第2天予患者注射用顺铂[齐鲁制药(海南)有限公司生产]75 mg/m2静脉注射,3周为1个化疗周期,共治疗3个化疗周期。(3)同步放疗:采用体外盆腔照射治疗,控制外照射总剂量≤40 Gy,每次6 Gy,每周2次。白蛋白结合型紫杉醇组予白蛋白结合型紫杉醇+顺铂+同步放疗方案治疗,化疗第1天予患者注射用紫杉醇(白蛋白结合型,江苏恒瑞医药股份有限公司生产)170 mg/m2静脉注射,化疗第2天予患者注射用顺铂75 mg/m2静脉注射,3周为1个化疗周期,共治疗2~4个化疗周期。余治疗同紫杉醇组。
1.3 观察指标与方法 比较2组患者近期疗效,治疗前、治疗结束后肿瘤最大直径、体力、生活质量、免疫相关细胞因子[CD3+、CD4+、CD8+、CD4+/CD8+、自然杀伤(NK)细胞、IgA、IgM、IgG]水平,不良反应(恶心呕吐、腹泻、皮疹、血小板减少、白细胞减少)发生情况、6个月与1年生存情况及满意度。采用Kamofsky评分评估体力,总分0~100分,总分越高表示体力越好[5]。采用肿瘤患者生活质量(QOL)评分评估生活质量,总分0~60分,总分越高表示生活质量越好[6]。采用流式细胞仪检测免疫相关细胞因子,计算CD4+/CD8+。满意度评估分为非常满意、基本满意、一般、不满意4项,总满意度=(非常满意+基本满意)/总例数×100%。
1.4 近期疗效评定标准[7]完全缓解(CR):可见的肿瘤病变完全消失,维持>4周。部分缓解(PR):肿瘤病灶的最大直径及其最大垂直横经的乘积缩小≥50%,其他病灶无增大,无新病灶出现,维持>4周。稳定(SD):肿瘤病灶的最大直径及其最大垂直横经的乘积缩小<50%,或增大≤25%,无新病灶出现,维持>4周。进展(PD):肿瘤病灶的最大直径及其最大垂直横经的乘积增大>25% 或新病灶出现。客观缓解率(ORR)=(CR+PR)/总例数×100%。
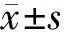
2 结 果
2.1 近期疗效比较 白蛋白结合型紫杉醇组患者ORR为75.00%,高于紫杉醇组的35.00%(χ2=12.929,P<0.001),见表1。

表1 紫杉醇组与白蛋白结合型紫杉醇组近期疗效比较 [例(%)]
2.2 肿瘤最大直径、体力、生活质量比较 治疗前,2组肿瘤最大直径、Kamofsky评分与QOL评分比较差异无统计学意义(P>0.05);治疗后,2组肿瘤最大直径较治疗前减小,Kamofsky评分与QOL评分均较治疗前提高,且白蛋白结合型紫杉醇组减小或提高的程度大于紫杉醇组(P均<0.01),见表2。
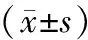
表2 紫杉醇组与白蛋白结合型紫杉醇组治疗前后肿瘤最大直径、体力、生活质量比较
2.3 免疫相关细胞因子比较 治疗前,2组CD3+、CD4+、CD8+、CD4+/CD8+、NK细胞、IgA、IgM、IgG水平比较差异无统计学意义(P>0.05);治疗后,2组CD3+、CD4+、CD4+/CD8+、NK细胞、IgA、IgM、IgG水平均较治疗前降低(P<0.01),CD8+水平上升(P<0.01),但2组间CD3+、CD4+、CD4+/CD8+、NK细胞水平降低及CD8+水平上升的程度无明显差异(P>0.05);白蛋白结合型紫杉醇组IgA、IgM、IgG水平降低程度小于紫杉醇组(P均<0.01),见表3。
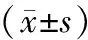
表3 紫杉醇组与白蛋白结合型紫杉醇组治疗前后免疫相关细胞因子比较
2.4 不良反应比较 白蛋白结合型紫杉醇组和紫杉醇组患者恶心呕吐、腹泻、皮疹、血小板减少、白细胞减少等不良反应发生率比较差异均无统计学意义(P均>0.05),见表4。

表4 紫杉醇组与白蛋白结合型紫杉醇组不良反应比较 [例(%)]
2.5 6个月与1年生存情况比较 白蛋白结合型紫杉醇组患者6个月生存率与1年生存率各为97.50%与90.00%,分别高于紫杉醇组的85.00%与70.00%(P均<0.05),见表5。
2.6 满意度比较 白蛋白结合型紫杉醇组患者总满意度为85.00%,高于紫杉醇组的47.50%(χ2=12.579,P<0.001),见表6。

表6 紫杉醇组与白蛋白结合型紫杉醇组满意度比较 [例(%)]
3 讨 论
紫杉醇是一种广谱抗癌药,临床应用率较高,能有效治疗多种肿瘤,作用机制可能为抑制微管蛋白二聚体分解等,维持微管稳定,从而控制肿瘤发展。白蛋白结合型紫杉醇是一种130 nm颗粒制剂,组成成分为人血白蛋白+紫杉醇,促进其抗肿瘤活性的提升。此外,白蛋白结合型紫杉醇还具有较小的不良反应发生风险[8]。有研究表明,白蛋白结合型紫杉醇联合顺铂及放疗具有良好的临床疗效,不会增加不良反应,具有较低的成本—效果比,应用前景极为广阔[9-10]。
本研究结果显示,白蛋白结合型紫杉醇组患者ORR高于紫杉醇组;治疗后,2组肿瘤最大直径较治疗前减小,Kamofsky评分与QOL评分均较治疗前提高,且白蛋白结合型紫杉醇组减小或提高的程度大于紫杉醇组;治疗后,2组CD3+、CD4+、CD4+/CD8+、NK细胞、IgA、IgM、IgG水平均较治疗前降低,CD8+水平上升,但2组间CD3+、CD4+、CD4+/CD8+、NK细胞水平降低及CD8+水平上升的程度无明显差异;白蛋白结合型紫杉醇组IgA、IgM、IgG水平降低程度小于紫杉醇组;白蛋白结合型紫杉醇组和紫杉醇组患者恶心呕吐、腹泻、皮疹、血小板减少、白细胞减少等不良反应发生率比较差异均无统计学意义;白蛋白结合型紫杉醇组患者6个月生存率与1年生存率均高于紫杉醇组;白蛋白结合型紫杉醇组患者总满意度高于紫杉醇组。分析原因为普通的紫杉醇药物具有较差的水溶性,在治疗过程中需添加增溶剂,使患者的过敏等不良反应发生率提升,严重的情况下须中止治疗。而白蛋白结合型紫杉醇则具有较强的水溶性,不需要添加增溶剂,也不需要给予患者激素、抗过敏治疗等,能够降低患者不良反应发生风险,提升安全性,同时还能够将人体内紫杉醇吸收扩大,促进药物利用率的提升、临床疗效的增强[11-12]。
综上所述,白蛋白结合型紫杉醇联合用药治疗中晚期宫颈癌的临床效果更佳,治疗后各项相关指标的变化表现积极,且不良反应发生风险更小,患者预后更良好且满意度高,故此方案值得临床推广应用。
利益冲突:所有作者声明无利益冲突。
