镉胁迫对山苍子幼苗光合特性变化的影响
2023-04-06崔仕杰何介南薛佑明肖佐钰
崔仕杰, 何介南, 曾 谛,薛佑明,肖佐钰,杨 航
(中南林业科技大学,湖南 长沙 41004)
1 引言
土壤环境是自然环境的组成部分,是地球生物体赖以生存的基础。重金属在自然界中广泛存在,不易被降解,易沉积于土壤、水体中,在生态系统中循环,不仅对生态系统以及生物多样性造成严重危害,且最终在植物,或鱼类等富集,后通过食物链进入人体,对人体健康造成威胁。进入21世纪以来,伴随工业化进程加速以及城市化面积扩张,工业污水排放,大面积化肥农药的使用,汽车尾气排放,矿区污染等因素,加剧了土壤重金属污染。
土壤中主要的重金属污染物为镉、镍、铜、砷、汞、铅等,其中镉为毒性最强的重金属元素之一,其通过占用植物体内其他必需元素金属离子的运输通道,进而导致植物对营养元素的吸收及代谢活性降低,抑制植物的生长发育[1~3]。根据此前已公布的《全国土壤污染状况调查公报》,我国约有7%的土壤存在不同程度的 Cd 污染[4]。据环保部门估算,全国每年因重金属污染的粮食高达1200万t,造成的直接经济损失超过200亿元[5]。镉污染耕地修复技术主要有化学钝化技术[6]、物理修复技术、植物修复技术、微生物修复技术[7,8]。化学钝化技术修复效果好,成本低,该类修复技术主要是通过改变重金属镉的赋存形态和生物可利用性,减少镉向农作物迁移,但随着环境条件的变化,土壤中镉的有效性可能会发生变化[9~11]。物理修复技术涉及工程量大,费用高,而且容易引起耕层破坏,农田肥力减弱[12]。植物修复技术直接利用植物对重金属的转化、提取和挥发等机制来修复重金属污染土壤[13];植物修复技术是利用自然生长的超富集植物对土壤中镉进行吸收、富集,转运到植物地上部,最后通过将其收获、安全处置等过程减少土壤中镉含量[14],是相对安全的绿色修复技术,具有良好的应用前景。植物修复技术有效实施的关键是筛选出生物量大、生长速度快且能富集一种或多种重金属的植物。植物修复技术有效实施的关键是筛选出生物量大、生长速度快且能富集一种或多种重金属的植物[15]。植物提取修复技术最终收获的是富集或超富集植物的地上部,所以植物地上部重金属积累量的大小是植物修复过程中最具有实际意义的指标之一,表征了植物的修复潜力,决定了植物提取修复技术效率的高低[16]。
山苍子(Litseacubeba( Lour.) Pers.),又名山鸡椒、山胡椒、木姜子、荜澄茄等,为樟科,樟属落叶小乔木,树高3~10 m。其树皮为灰白色,幼枝黄绿色,被柔毛,老枝为黑褐色,无毛。顶芽呈圆锥形,鳞片无毛。叶互生,伞状花序生于叶腋短枝上,先叶开放。山苍子的花期在3~5月份,7~9月份结果实。其果实近球形,成熟时为蓝黑色[17]。从植物修复的角度来看,山苍子具有生物量大、生长迅速、适应性强的优点,主要分布于我国长江以南、西南直至西藏等区域,生长于丘陵、山地的荒山、荒地、灌丛、疏林地、林缘和路边等[18]。此前,胡文俐已提出山苍子对铅、锌有较强的耐受性,并在后续进行了铅锌胁迫对山苍子生长的影响[19]。本实验以此为基础,探究山苍子对镉胁迫的抗性以及浓度,测定其光合指标和特性,镉胁迫下山苍子光合特性的变化,后期可结合其生长指标,进一步探究镉胁迫对山苍子生长的影响。
2 材料与方法
2.1 实验材料
供试材料为山苍子1年生实生幼苗,采自湖南省浏阳苗圃,移栽前用去离子水将植株根部洗净。
2.2 实验设计
将长势基本相同的幼苗预培养 20 d,再将其移至盆中(275 mm×240 mm×280 mm),每盆土壤重10 kg。镉以CdCl2的形态加入。每盆栽种 1 株幼苗,30个重复,共计120株。以未经重金属处理的个体为对照(CK),试验质量分数设计见表 1,质量分数梯度设计依据我国土壤环境质量标准设计。

表1 胁迫浓度实验设计
2.3 测定方法
(1)光合气体测量。光合气体交换参数测定净光合速率(Pn) 、蒸腾速率(Tr) 、气孔导度(Gs)和胞间CO2浓度(Ci)使用 Li-6400XT便携式光合测定仪,于 2022 年 8 月一个晴天上午 9:00~11:00 进行测定,叶片均选用同方位成熟的功能叶,每个处理重复测定3株,每株测定3个叶片。
(2)光合-光响应曲线测定。使用 Li-6400xt进行测定,测定时间为2022年8月多个晴天上午(8:30~11:30) ,叶片选择标准与数量同上。光强梯度设定为1600、1500、1200、1000、800、600、400、200、100、50、20、0 μmol/(m2·s)。设定参比室CO2浓度为400 μmol/mol。
2.4 数据处理
使用 Excel 2016 软件( Microsoft Office,USA) 进行数据处理,采用SPSS22.0对数据进行单因素方差分析 ( One-way ANOVA) ,用Duncan's 法进行多重比较,最后用origin2019进行绘图。光响应参数则结合二项式曲线拟合和Li-COR公司提供的光合助手( Photosynthesis) 软件分析而得[20],同时获得最大净光合( Pmax )、光补偿点( LCP)、光饱和点( LSP) 和暗呼吸速率(Rd) 等光合特征参数。
3 结果与讨论
3.1 不同浓度Cd2+胁迫下山苍子光合生理指标的变化
如图1所示,对照组与C1、C2两个处理间的叶片气孔导度并无显著性差异,Cd2+胁迫浓度达到C3时,C3与C4两个处理组的叶片气孔导度与对照组存在极显著差异,且C3与C4处理组间不存在显著性差异,气孔导度较为接近。C3和C4处理组的气孔导度较对照组、C1和C2处理组降低了50%左右。
如图2所示,对照组与C1、C2处理组间相比较,其叶片的净光合速率不存在极显著性差异,但C1与C2处理组间存在显著性差异,且C2处理组的净光合速率略高于C1。C3和C4处理组的叶片净光合速率出现大幅度下降,与对照组间存在极显著性差异,且C3与C4处理组间也存在极显著性差异,但差异较对照组小,净光合速率的整体变化趋势为,伴随胁迫浓度的升高,出现小幅度的上升后呈现下降趋势,且下降幅度缓慢变小。

图1 不同浓度Cd2+胁迫下山苍子叶片气孔导度变化

图2 不同浓度Cd2+胁迫下山苍子叶片净光合速率变化
如图3所示,通过分析可知,较低浓度的镉离子胁迫对于山苍子叶片的胞间二氧化碳浓度存在一定的影响,C1处理组较对照组,其浓度下降,且存在显著性差异,当浓度达到C2时,甚至可以提高其浓度。此外,与气孔导度、净光合速率一致,当镉离子胁迫浓度继续升高后,山苍子叶片的胞间二氧化碳浓度呈现下降趋势,C3与C4处理组与对照组相比均出现极显著性差异,表明胁迫浓度升高后,山苍子受到了严重的毒害作用。
如图4所示,通过分析可知,对照组的叶片蒸腾速率与4个处理组间均存在极显著性差异,叶片蒸腾速率的整体变化趋势为先下降后上升,再下降。C1处理下,叶蒸腾速率出现下降,当胁迫浓度达到C2时,其蒸腾速率上升,高于对照组,且存在显著性差异。胁迫浓度继续升高,C3与C4处理组的叶片蒸腾速率骤降,与其他指标变化趋势一致。
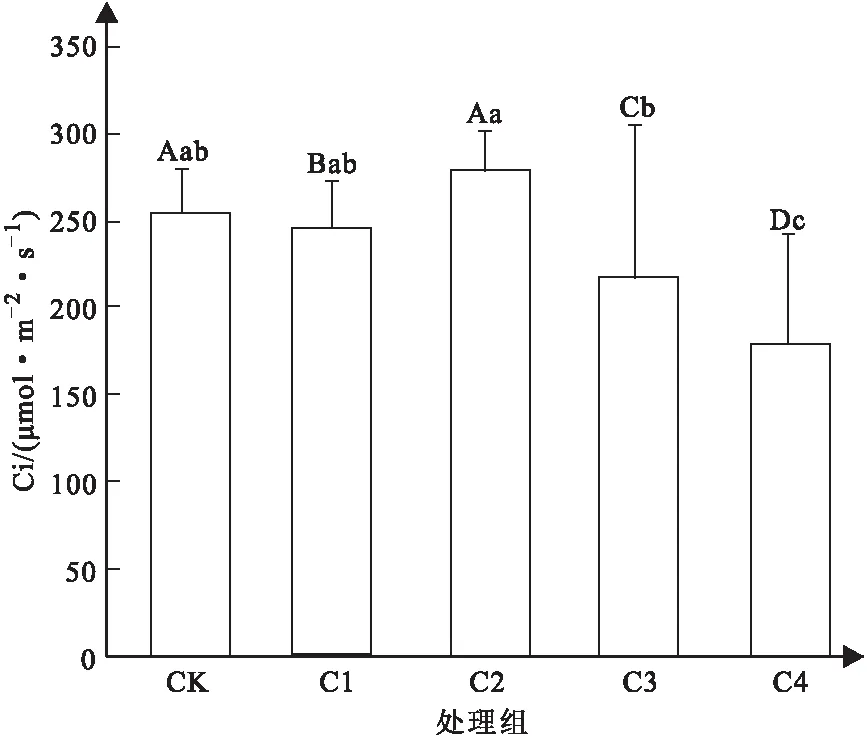
图3 不同浓度Cd2+胁迫下山苍子叶片胞间 二氧化碳浓度变化
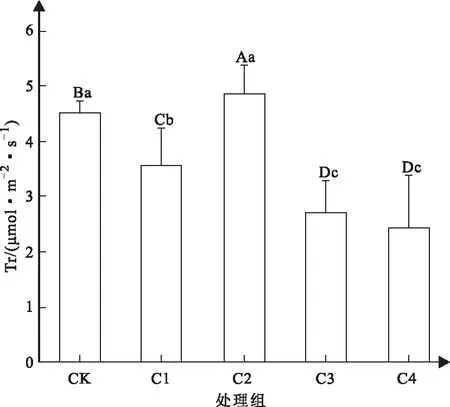
图4 不同浓度Cd2+胁迫下山苍子叶片蒸腾速率变化
3.2 不同浓度Cd2+胁迫下山苍子光响应曲线的变化
如图5与图6所示,山苍子幼苗不同浓度镉胁迫处理组的光响应曲线在光合有效辐射(PAR)低于200 μmol/(m2·s)时均近似线性直线,之后均呈抛物线趋势,即缓慢上升后呈现急剧下降的变化趋势,因此选取各光响应曲线在PAR低于200 μmol/(m2·s)时的数据作线性拟合,取一元二次方程组的斜率为表观量子效率(AQY),而表示此方程组的直线与横轴的交点为光补偿点(LCP),与纵轴的交点为暗呼吸速率,高于200 μmol/(m2·s)时的数据作二项式拟合,二项式曲线顶点的纵坐标即为拟合最高净光合速率,横坐标为光饱和点(LSP)。
由图5分析可知,当PAR低于200 μmol/(m2·s)时,各组的净光合速率伴随PAR的上升而逐渐增大,其中C2处理组的净光合速率最大,这与此前测定的各项光合生理指标结果相对应,其他三个处理组的净光合速率均低于对照组,表明过高的镉离子胁迫会降低山苍子的净光合速率,影响植株正常的发育生长和代谢。
由图6分析可知,当PAR高于200 μmol/(m2·s)后,对照组、C1、C2、C3处理组的净光合速率均呈现先上升后下降的变化趋势,当PAR大于各自的光饱和点后,各处理组的净光合速率开始呈现下降趋势,其中C1和C2处理组的净光合速率均大于对照组,且其拟合曲线在上升和下降过程中的斜率均大于对照组;但出现峰值的位置或区间较为一致,表明镉离子胁迫对于山苍子植株的光饱和点影响不大。C3和C4处理组的净光合速率基本全程低于対照组,2个处理组的拟合曲线斜率均减小,C4处理组的净光合速山苍子叶片的光合作用,进一步的影响山苍子植株的发育生长。

图5 不同浓度Cd2+胁迫对快速光响曲线的影响(低PAR)
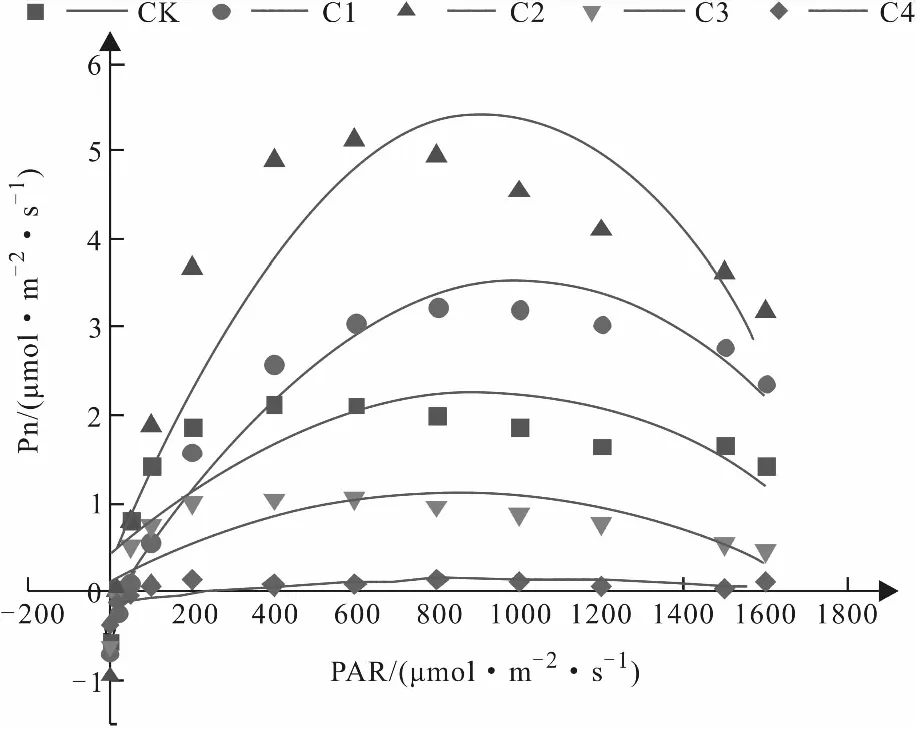
图6 不同浓度Cd2+胁迫对快速光响曲线的影响
由表1分析可知,对照组与4个处理组的表观量子效率(AQY)相比较,C1、C3和C4的AQY均出现不同程度的降低,C1处理组的下降较小,C3和C4处理组的下降较为显著;而C2处理组的AQY则较对照组上升近一倍。结合图6与表1共同分析,C1与C2处理组的最大净光合速率均大于对照组,且C2的最大净光合速率为对照组的两倍多,C3处理组的最大净光合速率较对照组降低50%左右,C4处理组较对照组降低了将近2 μmol/(m2·s),以上结果表明当土壤中镉离子胁迫浓度达到100 mg/kg或更高时,镉离子的毒害作用会严重影响山苍子植株的光合作用。
由表2可知,对照组山苍子植株的光饱和点(LSP)为898.76 μmol/(m2·s),其中C1、C2、C3 3个处理组的LSP均较对照组有不同程度的上升,其中C1处理组的光饱和点最高,为1003.69 μmol/(m2·s);C3处理组的LSP与对照组相比降低了57.5 μmol/(m2·s),以上结果表明适量的镉离子会提高山苍子植株的LSP,而过高浓度的镉离子胁迫会降低其LSP。对照组的光补偿点(LCP)仅为11.78 μmol/(m2·s),4个处理组的LCP较对照组均有不同成对的升高,其中C4处理组的LCP最高,为108.25,上升了将近10倍,表明不同浓度的镉离子胁迫均会影响山苍子植株对于光能的利用和吸收,进而影响其光合作用。从表2可知,对照组山苍子植株的暗呼吸速率(Rd)约为0.14 μmol/(m2·s),4个处理组的Rd均大于对照组,其中C1与C2处理组二者较为接近,0.55 μmol/(m2·s)左右;C3与C4处理组二者较为接近,0.22 μmol/(m2·s)左右。以上结果表明土壤中镉离子胁迫会提高山苍子植株的暗呼吸速率,较低浓度时,山苍子植株可能需要更多的消耗光合作用产物,以作为能量补充维持正常的生长与代谢,但当胁迫浓度进一步升高时,镉离子的毒害作用太大,已经威胁到山苍子的生长与生命力,所以此时其暗呼吸速率上升的较少,表明当胁迫浓度等于或大于100 mg/kg时,已经超过了山苍子对于镉离子的耐受度。

表2 不同浓度Cd2+胁迫下山苍子叶片光合生理指标变化
4 结论
实验表明,当山苍子植株受到镉离子胁迫时,镉的毒害作用会影响山苍子植株的光合作用以及生理代谢,当镉离子胁迫浓度为25、50 mg/kg时,镉离子对山苍子植株的毒害作用不显著,且山苍子植株的各项光合生理指标,如叶片气孔导度、净光合速率、胞间二氧化碳浓度、以及蒸腾速率均出现一定程度的上升,这可能是植物应激反应造成的,当植物受到胁迫时,会需要更多的养分和能量来抵抗胁迫[21],当胁迫浓度达到100 mg/kg时,已经超过山苍子植株对镉离子的耐受度,其气孔导度、净光合速率、胞间二氧化碳浓度、以及蒸腾速率等均出现不同程度的下降,此前已有研究表明,在 Cd2+胁迫下,滇杨叶片净光合速率随着胁迫浓度的升高而降低,而胞间 CO2浓度随着胁迫浓度的升高呈先降低后增加的趋势[22],这与本研究中的结果存在不一致的地方,这可能与胁迫浓度不一致有关。本文中,当胁迫浓度为25、50 mg/kg时,山苍子植株的净光合速率均有所上调,而后才呈现出下降的变化趋势,而郑武扬等[22]的最低胁迫浓度与本文不一致。结合快速光响应曲线的分析结果,山苍子植株的最大净光合速率、光饱和点、光补偿点、以及暗呼吸速率均受到了镉胁迫的影响,另有研究表明,高浓度的重金属离子会抑制植物体内某些酶活性,而这些酶与叶绿素生物合成密切相关,进而导致叶绿素含量下降[23],推测以上指标的变化与其体内叶绿素的变化有关,通过以上分析,就目前的实验结果表明,山苍子植株在镉浓度为50~100 mg/kg耐受性最强,在200 mg/kg其耐受性最弱,且生长发育受到严重的毒害作用,此外,陈卫军等[24]对不同年龄阶段山苍子植株的光合生理特性进行了相关研究[24],结合起来,本文可为镉胁迫下山苍子植株的光合生理特性以及其对抗镉胁迫方面研究提供一定的参考。
