“四步法”书写电极反应式
2023-03-18韩建丰高凌蕊
韩建丰 高凌蕊
(1.北京市广渠门中学 2.首都师范大学第二附属中学)
电化学是化学高考必考点中的难点,通过解读新课程标准和电化学高考题可以得出电化学解题的核心是电极反应式的书写.“四步法”是突破电极反应式书写这一难点的关键方法.
1 电化学中的电极反应考查背景
基于《普通高中化学课程标准(2017年版2020年修订)》的分析发现,有关电化学内容的化学核心素养落点为:1)理解原电池和电解池的原理、装置、应用.2)理解金属的电化学腐蚀原理及金属腐蚀的危害和防治.3)能够熟练书写电极反应式和总反应方程式.在新高考背景下通过分析近年全国各地高考化学试题,发现电化学知识一般以综合型考题出现,其中以电极反应式的书写为解题核心,考查内容主要为:1)教材中出现过的电极反应式;2)由电化学装置示意图或总反应推断陌生的正负、阴阳极电极反应式;3)由给定的电极反应式反推电化学装置工作原理.
基于以上思考,发现考生在电化学部分取得高分的关键是:能够熟练书写电极反应式.电极反应式书写的考查方式:1)由装置示意图的提示直接写出陌生电极反应式;2)由总反应推出电极反应式;3)由课本熟悉情境直接写出电极反应式.
2 目前电极反应式书写方法存在的问题
学生目前对电极反应式书写存在两大问题:
1)不理解课本的电极反应式,依靠背诵进行书写,这在高三复习阶段极容易造成阶段性遗忘和混淆.
例如,书写电解氢氧化钠(Ⅰ)或硫酸(Ⅱ)溶液的阳极反应式,在人教版新教材要求下,Ⅰ应为4OH--4e-=O2+2H2O;Ⅱ应为2H2O-4e-=O2+4H+,这两种写法是在掌握放电离子顺序并结合离子浓度考虑下确定的,需要学生思路清晰才能正确处理.
2)未掌握陌生电极反应式的直接书写方法,依旧依靠“总反应减去某一极电极反应得到另一电极反应”.
在高三阶段,依旧有学生在书写铅蓄电池正极反应式时采用“减”的方法,即先写出总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O,再写出较为简单的负极:,两式相减得到的正极电极反应式.学生如此处理无疑加大了背诵的压力,这与高考导向不符,且出现错误的概率和解题时间明显增加.如果是复杂情境,学生也可能无法找到总反应和另一简单的电极反应式,从而无法应用“减”法.
3 “四步法”电极反应式的书写方法和示例
不管是熟悉的电极反应式还是陌生的电极反应式都可以应用“四步法”进行书写,且可以提高书写的准确率,并能提升学生对电化学核心概念的理解.
例如,书写CH4|KOH|O2(甲烷碱性燃料电池)的负极电极反应式,应用“四步法”,流程如图1所示.
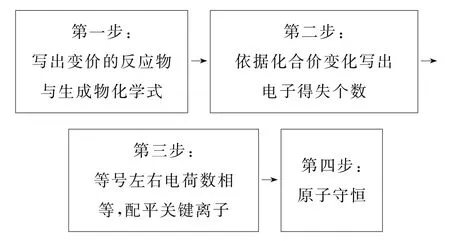
图1
第一步:依据总反应化学方程式或图示写出变价的反应物与生成物,以上燃料电池的负极在第一步写为.说明:该燃料电池中甲烷为原电池的负极反应物,燃料电池的生成物为CO2和H2O,涉及变价的元素为C,因而第一步的“=”左右两侧应为CH4和CO2,一定要考虑电解质环境对变价生成物造成的影响,在KOH 存在下原本的生成物CO2会与KOH 反应生成K2CO3,因而“=”左右两侧应为CH4和.
第二步:依据第一步写出的反应物与生成物,确定得失电子个数.以上燃料电池的负极为CH4+待补充=+待补充,甲烷为有机物,而有机物中各元素化合价判断方法是:H 为+1价、O 为-2价、C 为变价,由此可以得出甲烷中C 元素的化合价为-4价,中C元素的化合价为+4价,从而判断失去8个电子,因而在第二步应继续补充为CH4-8e-+待补充=+待补充.
第三步:利用电荷守恒(离子方程式等号两侧离子所具有的电荷数相等)进行第三步书写.选出合适的离子进行电荷守恒配平(例如酸性H+、熔融碳酸盐、熔融氧化物O2-等),这里的关键问题是要充分考虑电解质溶液环境,因本题为甲烷的碱性燃料电池,故应采用OH-进行电荷守恒配平.依据第二步进行电荷守恒配平:等号左侧-8e-代表8 个正电荷(电子带负电,减去电子则代表为正电荷),右侧1个代表2个负电荷,目前电荷情况为左侧+8,右侧-2,计算得出应将OH-放置在等号左侧且个数为10,即
第四步:最后一步为原子守恒,即化学反应前后原子种类、数目不变.依据第三步(CH4-8e-+10OH-=+待补充)判断,等号右侧还应有14个H 原子、7个O 原子,即+7H2O 才能达成原子守恒.则负极电极反应式为.至此,电极反应式的完整书写流程结束.
4 “四步法”书写电极反应式应用的关键突破
4.1 电解质环境和关键离子的判断及应用
电解质环境和关键离子的判断及应用是解题的重点.通过示例可知“四步法”应用的关键:第一步能够依据条件(总反应、电解质环境、图示等)书写正确的生成物,第三步能够正确且熟练地应用电荷守恒配平.
2组非小细胞肺癌患者近期疗效见表1。2组近期疗效差异有统计学意义(Z=-3.578,P=0.000)。联合用药组对肺癌的控制率为74.44%,显著高于吉西他滨组的46.67%(χ2=15.253,P=0.000)。
例如,甲烷固体氧化物燃料电池CH4|Y2O3-ZrO2|O2,正负极电极反应式的书写结果受电解质环境的影响.首先Y2O3-ZrO2(固体氧化物电解质)为中性环境,关键离子为O2-,应用“四步法”书写该电池负极反应的第一步:变价反应物为CH4,变价生成物为CO2.第二步:电子得失为-8e-.第三步:根据电荷守恒,应用O2-进行配平,需左侧补4O2-.第四步:根据原子守恒可知右侧补2H2O,则最终结果为CH4-8e-+4O2-=CO2+2H2O.同理正极的电极反应式应用“四步法”后得出的结果为O2+4e-=2O2-.关键是:判断出甲烷的变价生成物为CO2、参与配平的离子为O2-,这些结论由电解质环境推导得出,可见电解质环境及关键离子的准确判断对“四步法”的应用极其重要,这是学生书写电极反应式的解题核心.
4.2 放电顺序
电解池的电极反应式书写对很多学生来说都是难点,放电顺序是电解池电极反应书写的重点.出现这一问题的原因是:学生不关注电极(特别是阳极)材质,不熟悉阴阳极放电顺序.活性阳极电极本身放电问题是学生最容易出错的一点,可利用对比法进行思维进阶.
例如,电池Ⅰ:(阳极)C|NaCl饱和溶液|C(阴极)和电池Ⅱ:(阳极)Fe|NaCl饱和溶液|Fe(阴极).
电池的电极材质不同,Fe电极作阴极无法得电子,因而是电解质溶液中的阳离子在阴极放电,顺序可以简单记忆为“反金属活动顺序”+“加塞儿的Fe3+”,阳离子在阴极放电顺序的本质为金属离子的氧化性强弱关系(氧化性强的金属离子先放电),而金属离子的氧化性与其单质的还原性成反比:Na+<Mg2+<…<H+<Cu2+<Fe3+<Hg2+<Ag+<…,因而Ⅰ和Ⅱ的阴极反应都为2H2O+2e-=H2+2OH-(阳离子有Na+和H+,放电顺序为Na+<H+,氢离子浓度小因而写为H2O 放电).阳极电极反应式则不同,阳极放电应先判断电极材质.Fe为活性电极(只有C和Pt为惰性电极)优先于电解质溶液中的阴离子放电,因而Ⅱ中阳极反应为Fe-2e-=Fe2+.Ⅰ中阳极材质为惰性C电极,需要学生理解阳极的阴离子放电顺序,可以简单叙述为“硫碘氯氧”,即S2->等一般酸根(通过高考题考点归纳,此处不需要扩充),本质为阴离子的还原性大小关系,而阴离子的还原性强弱又与其单质的氧化性成反比.通过分析可知Ⅰ中阴离子在阳极的放电顺序为Cl->OH-,阳极反应为2Cl--2e-=Cl2↑.基于以上分析可以较为简单地书写出Ⅰ和Ⅱ的电极反应式,也就得到了Ⅰ的总反应为氯碱工业原理(电解饱和食盐水),生成物为氢气、氢氧化钠和氯气;Ⅱ的最终生成物为氢氧化亚铁(白色沉淀,高中化学重点制备物质,需覆盖油膜)和氢气.
5 电极反应式书写创新题示例与练习
5.1 基于陌生电池总反应的电极反应式书写
通常这类题目会给出原电池和电解池的总反应或装置示意图,这些内容将提示:反应物和生成物是什么,装置类型(原电池还是电解池),阴、阳极或正、负极的位置,电解质环境(其中的关键离子是什么),学生分析清楚这些提示后将“四步法”应用熟练即可解决相应问题.
例1已知反应2H2O2=2H2O+O2↑能自发进行,若电解则可实现逆反应自发进行从而实现由H2O和O2为原料制备H2O2,如图2所示.请写出a极的电极反应式.
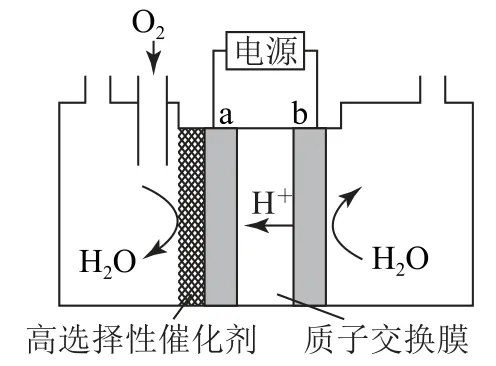
图2
分析通过装置图和总反应可知,反应物为O2,生成物为H2O2,O 元素化合价由0价变为-1价,化合价降低,得电子,则a为阴极,依据“四步法”可以书写a极的电极反应式:①变价的反应物与生成物为O2+待补充=H2O2+待补充;②电子得失为O2+2e-+待补充=H2O2+待补充;③电荷守恒,由图2可知为H+环境,需左侧补2H+,即O2+2e-+2H+=H2O2+待补充;④原子守恒,因已守恒则答案为O2+2e-+2H+=H2O2.
5.2 基于装置示意图的电极反应式书写
解决这类问题需要关注装置示意图中的生成物及环境,应用“四步法”可以轻松完成电极反应式书写.
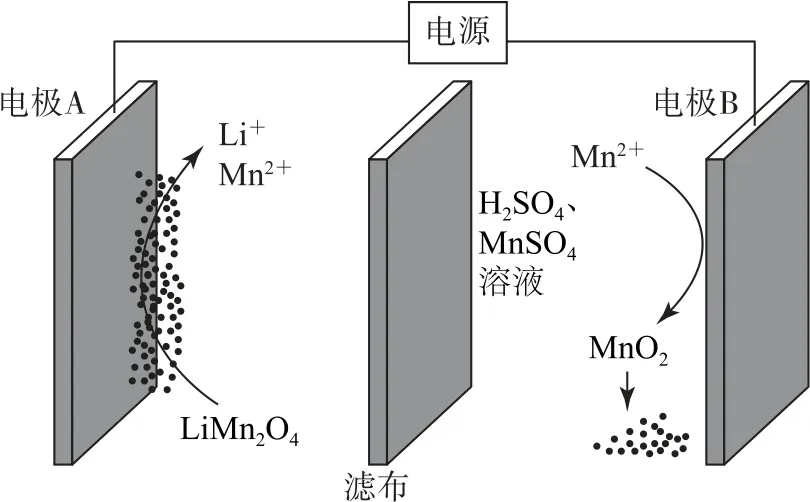
图3
分析由电解示意图判断,电极B 上Mn2+失去电子转化为MnO2,B电极为电解池阳极.电解质为硫酸和硫酸锰溶液,由于电解质环境为酸性,所以H+参与电荷守恒配平.“四步法”电极反应式的书写流程为①变价的反应物与生成物:Mn2++待补充=MnO2+待补充.② 电子得失:Mn2+-2e-+待补充=MnO2+待补充.③电荷守恒:由图2 可知为H+环境,需右侧补4H+,即Mn2+-2e-+待补充=MnO2+4H+.④原子守恒:需左侧补2H2O,因而答案为Mn2+-2e-+2H2O=MnO2+4H+.
5.3 基于电极反应式书写的电化学问题解决
电化学的考查除了电极反应式书写,还有多种形式,但都以电极反应式为核心来解决其他电化学问题.
例3利用太阳能光伏电池电解水制高纯氢,如图4所示.请说明电极3的作用.
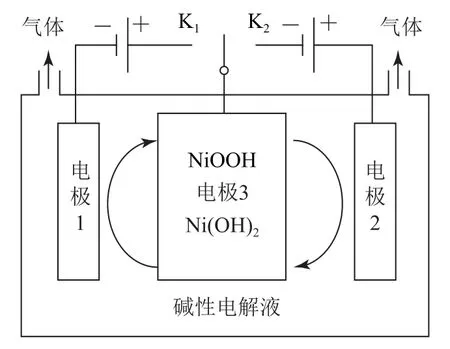
图4
分析首先要分析出电解水生成氢气和氧气,氢气在阴极生成,则应连接K1,由“四步法”得出电极方程式为2H2O+2e-=H2↑+2OH-;氧气在阳极生成,则应连接K2,由“四步法”得出电极方程式为4OH--4e-=O2↑+2H2O.清楚电极反应后再去分析电极3的作用就非常清晰了,电极3的作用是“交替连接”后利用装置进行高纯氢气和氧气的获取并使整个电解质溶液中的氢氧根离子循环起来.因而答案为连接K1:电极3 做阳极,电极反应为Ni(OH)2-e-+OH-=NiOOH+H2O;连接K2,电极3做阴极,电极反应为NiOOH+H2O+e-=Ni(OH)2+OH-,电极3的作用为循环OH-,并分别产生纯度更高的氢气和氧气.
综上所述,目前新高考的化学试题中有关电化学的考查非常注重学生对电化学基础知识的掌握情况,及应用分析、解决实际问题(化学电源、电解工业、电化学腐蚀与防腐)的综合能力,对学生在电化学知识体系建构中形成的关键能力和必备品格的要求不断提高.因而在备考中,学生需要强化基础、把握重点、突破难点,特别是对各极电极反应式的书写需要着重理解,并以此为核心进行电化学结构化知识体系的建构.而“四步法”就是突破电极反应式书写这一难点的关键方法.学生通过掌握电极反应式书写的“四步法”,可形成电化学解题的一般思路与方法.
链接练习
1.Mg|NaOH 浓溶液|Al,开始Mg作负极,则负极电极反应为________;一段时间后,电极转换,请写出原因:_______;之后Al作负极,则负极电极反应为_________.
2.某电池以KOH 为电解质溶液,K2FeO4和Zn为电极材料.则正极电极反应为_________.
3.全固态锂硫电池为优秀新型Li电池,已知电池总反应为16Li+xS8=8Li2Sx,正极为掺有石墨烯的S8材料,电解质为传导Li+的固体材料.写出正极电极反应:_______.
4.某电解池:Al作阳极,C作阴极,NaHCO3溶液作电解质,电解现象为生成沉淀和气体.写出电解池总反应:_______.
5.由不参与电极反应的有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液(离子液体为非水体系下的室温熔融盐).用于钢制品上电镀铝,且电镀过程不产生新离子,写出阴极、阳极的电极反应:_______.
链接练习参考答案
1.Mg-2e-+2OH-=Mg(OH)2;生成的Mg(OH)2沉淀附着在Mg电极表面,阻止放电或当Mg作负极放电时,正极放电物质为O2,原电池本质为Mg的吸氧腐蚀,随着反应进行溶液中溶解氧气浓度下降,正极反应停止;Al-3e-+4OH-=AlO-2+2H2O.
(完)
