狂犬病病毒核衣壳蛋白的原核表达与鉴定
2023-03-14谷志鹏向梦玲凌洪权吴胜昔董春霞
谷志鹏,向梦玲,凌洪权,骆 璐,吴胜昔,董春霞,冉 皑,郭 宇
(1.重庆理工大学 药学与生物工程学院, 重庆 400054;2.重庆市动物疫病预防控制中心, 重庆 401120)
0 引言
狂犬病(Rabies)是由狂犬病病毒(rabies virus,RV)引起的人兽共患致死性传染病,发病后病死率几乎100%[1]。目前患者尚无有效的治疗方法,是世界上传播最广、影响和危害最为惨重的烈性疾病,会在发病3~6 d后出现呼吸功能和循环功能衰竭而死亡[2-3]。根据世界卫生组织报告,1986—2020年中,每年约6万多人死于狂犬病[4],主要在亚洲和非洲等一些不发达国家流行,特别是在 20 世纪中叶,狂犬病在世界各地爆发并造成了许多人死亡[5-6]。近年来,随着狗、猫以及城市和农村地区饲养宠物的家庭快速增加,野生犬和猫的数量明显增多,使狂犬病的发病率明显上升,给人类和动物生命安全造成了威胁。
RV 属弹状病毒科、狂犬病毒属,呈典型的子弹状,表面具有包膜[7],基因组为大约12 000 bp 的单链RNA[8]。编码5种结构蛋白,依次为核蛋白(nucleoprotein,N)、衣壳蛋白(Phosphoprotein PP)、膜蛋白(M atrix protein MP)、糖蛋白(Glycoprotein GP)和聚合酶蛋白(Large protein LP)[9]。与其他蛋白相比,N蛋白比较稳定,碱基易位、缺失较少,是 RV 基因分型判断的检测标准。N蛋白作为主要抗原,在刺激机体产生抗体的同时,对疫苗的研制、诊断、流行病学有重要价值[10]。
本次研究在不改变RV N蛋白基因序列下,对密码子优化,通过化学合成RV N基因,并将其克隆至pET28a(+)原核表达载体,构建pET28a-RV N重组质粒,再转化至 BL21 (DE3)感受态细胞中,利用His-tag镍柱纯化出了RV N蛋白,并对其进行生物特性鉴定,为后续疫苗的研制与狂犬病的诊断奠定了基础。
1 材料
1.1 菌株和质粒
原核表达载体pET28a(+),由重庆理工大学基因工程实验室赠予,pET28a-RV N/BL21(DE3) 由上海生工生物工程有限公司构建。
1.2 主要试剂及仪器
Tris、Imidazole购自Genview公司;Glycine购自Beyotime公司;10×QuickCut Green buffer、限制性内切酶NdeⅠ和XhoⅠ购自TaKaRa公司;NGCTM层析系统、His-tag镍柱购自购美国Bio-Rad公司。
2 方法
2.1 RV N基因合成
根据NCBI数据库对应的RV N 基因序列(1489853),将此序列委托上海生物生工有限公司进行密码子优化,并在上下游引物中引入酶切位点NdeI和XhoI,插入His标签进行合成。
2.2 pET28a-RV N重组质粒的双酶切鉴定与测序
将公司合成的甘油菌进行平板划线培养,选取单菌落到试管中活化过夜,锥形瓶扩大培养,得到大量菌株。将得到的菌液取3~4 mL用小型质粒试剂盒提取RV N蛋白基因的质粒。用NdeI、XhoI、酶切缓冲液、质粒、超纯水配制双酶切体系,将制备的体系置于37 ℃水浴锅中进行 0.5~1 h双酶切,经电泳鉴定正确后,送上海生工进行测序鉴定。
2.3 RV N重组蛋白诱导表达
从-80 ℃冰箱中取出甘油菌,进行平板划线培养,选取单菌落到试管中活化过夜,通过锥形瓶进行扩大培养,当菌液OD600nm 值在 0.6~0.8 时,加入一定量的 IPTG,30 ℃下诱导8 h。4 500 r/min 离心13 min,离心后倒掉上清,按照菌重的1∶20或1∶30加入裂解液,超声破碎35 min后,11 000 r/min离心13 min后,进行SDS-PAGE电泳鉴定。
2.4 RV N重组蛋白诱导表达条件优化
将pET28a-RV N/BL21(DE3)重组菌平板划线在含卡那霉素的LB固体培养基,次日选取单菌落接种于试管中37 ℃培养过夜,用移液枪从试管中取1~2 mL菌液于锥形瓶中37 ℃、180 r/min 摇床震荡培养至OD600nm值达到0.6~0.8。分别进行诱导温度(20、25、30、37 ℃)、诱导剂IPTG终浓度(0.1 、0.5 、1 、1.4 mmol/L)、诱导时间(2、4、6、8、10 h)的筛选。将菌液5 500 r/min离心14 min后,加入裂解液和1%菌重的PMSF 用35 W的功率超声破碎,12 000 r/min离心11 min,沉淀按菌重1∶20的体积加入PBS,用涡旋振荡器进行混匀,取20 μL 混悬液和上清,进行SDS-PAGE电泳鉴定。
2.5 RV N重组蛋白的纯化
根据2.4筛选得到的最佳条件,对pET28a-RV N/BL21菌液扩大培养,将菌液配平8 000 r/min离心12 min后,倒掉上清按照菌重1∶30加入PBS重悬后,再按照之前步骤重复一次后,加入裂解液超声破碎30 min,倒掉上清加入溶解液和1%菌重的PMSF后,放入4 ℃冰柜搅拌过夜。11 000 r/min离心13 min,收集上清液,用0.22 μm滤头过滤,打开电脑、启动蛋白纯化仪、收集器,滤液上样于His-tag镍柱,用NGCTM层析系统对RV N 重组蛋白进行纯化,具体操作步骤见文献[11],并收集280 nm紫外吸收峰下的洗脱液。
2.6 RV N重组蛋白的SDS-PAGE鉴定
将原液上清、沉淀、空载体、流穿液不同浓度咪唑液在280 nm紫外吸收峰下的洗脱液各取 20 μL,加入上样缓冲液5 μL,混匀,100 ℃煮沸10 min,使其变性,进行SDS-PAGE电泳鉴定,取出凝胶倒入考马斯亮蓝染色液,放在摇床震荡30 min,倒入脱色液脱色过夜,次日进行成像。
2.7 RV N重组蛋白的Western Blot 鉴定
将纯化后得到的RV N 蛋白样品进行 SDS-PAGE电泳,待电泳完毕后,将电泳凝胶进行只留mark和目的条带的切胶处理,将切好的电泳凝胶转印至PVDF膜上,待转膜完成后,将膜用含5%脱脂奶粉的TBST在水平摇床上室温封闭1 h。以RV N蛋白标准抗体作为一抗(1∶5 000稀释)放在4 ℃冰箱中过夜,次日取出膜放在盒子里用TBST洗3次。以羊抗鼠IgG抗体为二抗(1∶4 000),水平摇床孵育1 h。加入按照等量A液和B液混合的显色液,静置3 min,将膜的正面放在成像仪中进行显影。
3 结果与分析
3.1 pET28a(+)-RV N重组质粒酶切鉴定及测序
将重组质粒pET28a( + )RV-N双酶切凝胶电泳,在1 359 bp目的基因与5 369 bp处有明显条带,与预期目的片段及空载体大小基本一致(见图1)。将狂犬病重组N蛋白进行测序,显示连接位点均正确。
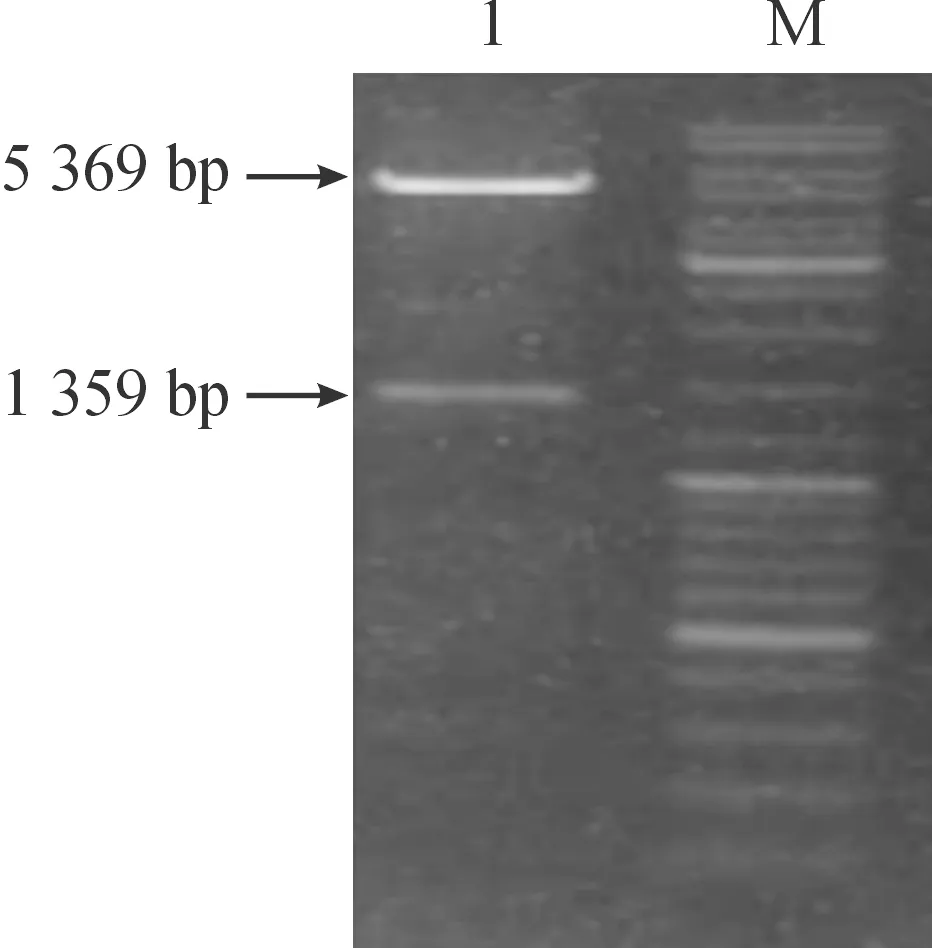
M:标准酶切MARKER; 1;狂犬病双酶切鉴定
3.2 RV N重组N蛋白表达鉴定
将公司合成的pET28a(+)-RV N菌株和BL21空载体在相同条件下进行诱导表达后进行 SDS-PAGE 电泳鉴定。结果显示:BL21空载体不表达目的蛋白,重组菌株经在一定条件下,沉淀在51KD处表达出大量的目的蛋白,而超声破碎后的上清中没有(见图2)。这与预期分子量大小相符,说明pET28a( + )RV -N重组菌株构建成功。
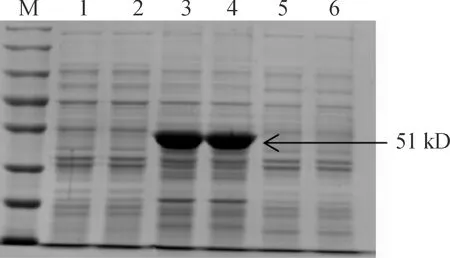
M:蛋白分子质量标准;1:pET28a(+)上清2:pET28a(+)沉淀;3-4:经诱导pET28a(+)-RV N沉淀,5-6:经诱导pET28a(+)-RV N上清
3.3 RV N重组N蛋白诱导表达条件优化
为探究RV N重组蛋白表达的影响因素,选取温度(20、25、30、37 ℃)、IPTG浓度(0.1、0.5、1.0、1.5 mmol/L)、时间(2、4、6、8、10 h)3个因素对蛋白表达进行优化,经过SDS-PAGE电泳鉴定。结果见图3—5。在诱导温度为30 ℃、IPTG终浓度为0.1 mmol /L、诱导时间为8 h时,51 kD处出现最大蛋白表达量。

M:蛋白分子质量标准;1.pET28a(+)沉淀;3、5、7、9:20、25、30、37 ℃(0.5 mmol·L-1 IPTG,7 h)诱导条件下RV N重组蛋白超声破碎后沉淀;2、4、6、8:20、25、30、37 ℃(0.5 mmol·L-1 IPTG,7 h)诱导条件下RV N重组蛋白超声破碎后上清
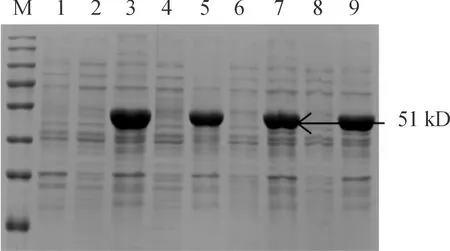
M:蛋白分子质量标准;1.pET28a(+)沉淀;3、5、7、9:0.1、0.5、1、1.5 mmol/L IPTG(30 ℃,7 h)诱导条件下 RV N重组蛋白超声破碎后沉淀 2、4、6、8:0.1、0.5、1、1.5 mmol/L IPTG(30 ℃,7 h)诱导条件下 RV N重组蛋白诱导表达上清
M:蛋白分子质量标准 1:pET28a(+)空载体沉淀;2-6:狂犬病时间分别在2、4、6、8、10 h (0.1 mmol·L-1 IPTG,30 ℃)RV N重组蛋白超声破碎后沉淀
3.4 RV N重组N蛋白的纯化
将pET28a(+)-RV N重组菌株平板划线培养,在最佳条件下进行大量培养,菌液离心超声破碎溶解过夜,使用蛋白纯化仪进行纯化,设置了不同浓度的咪唑对 RV N 蛋白进行洗脱。结果显示:RV N 蛋白在300 mM咪唑浓度下有280 nm 紫外吸收峰,结果如图6所示。
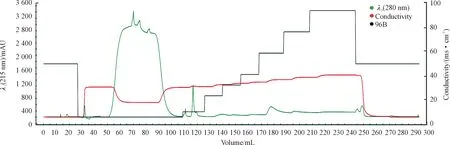
图6 NGCTM层析系统纯化RV N重组蛋白图谱
3.5 RV N重组蛋白的SDS-PAGE鉴定
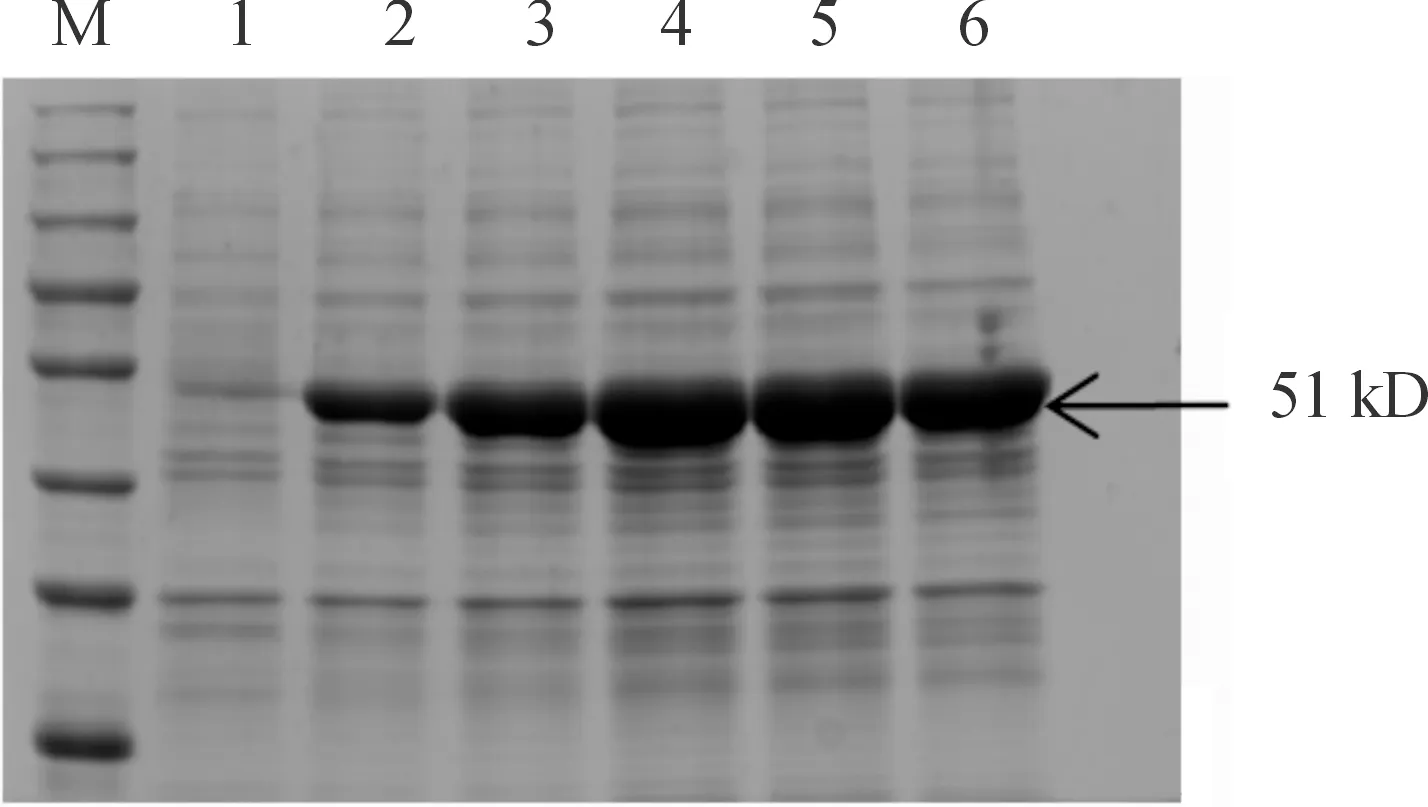
取超声破碎后蛋白溶解原液、流穿液、不同浓度咪唑洗脱下的280 nm紫外吸收峰进行SDS-PAGE电泳鉴定,结果(见图7)表明,300 mM洗脱下来的蛋白液即为纯化后的RV N重组蛋白,且纯度较高,杂蛋白较少。
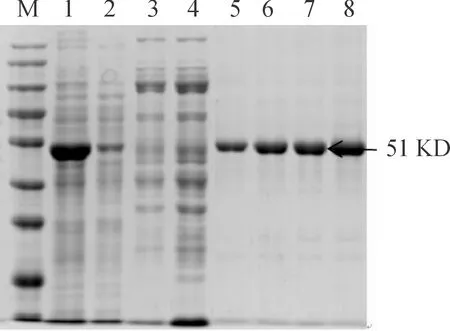
M:蛋白分子质量标准;1:包涵体提取液;2:流穿液;3-4:5%洗下杂蛋白;5-8:纯化后N蛋白
3.6 RV N重组蛋白的Western Blot 鉴定
Western Blot鉴定结果表明(图8),在51 kD处出现明显特异性蛋白印迹条带,而空载体转化的DE3菌液对照没有任何条带,与预期结果相同。说明表达已成功表达 RV N蛋白。
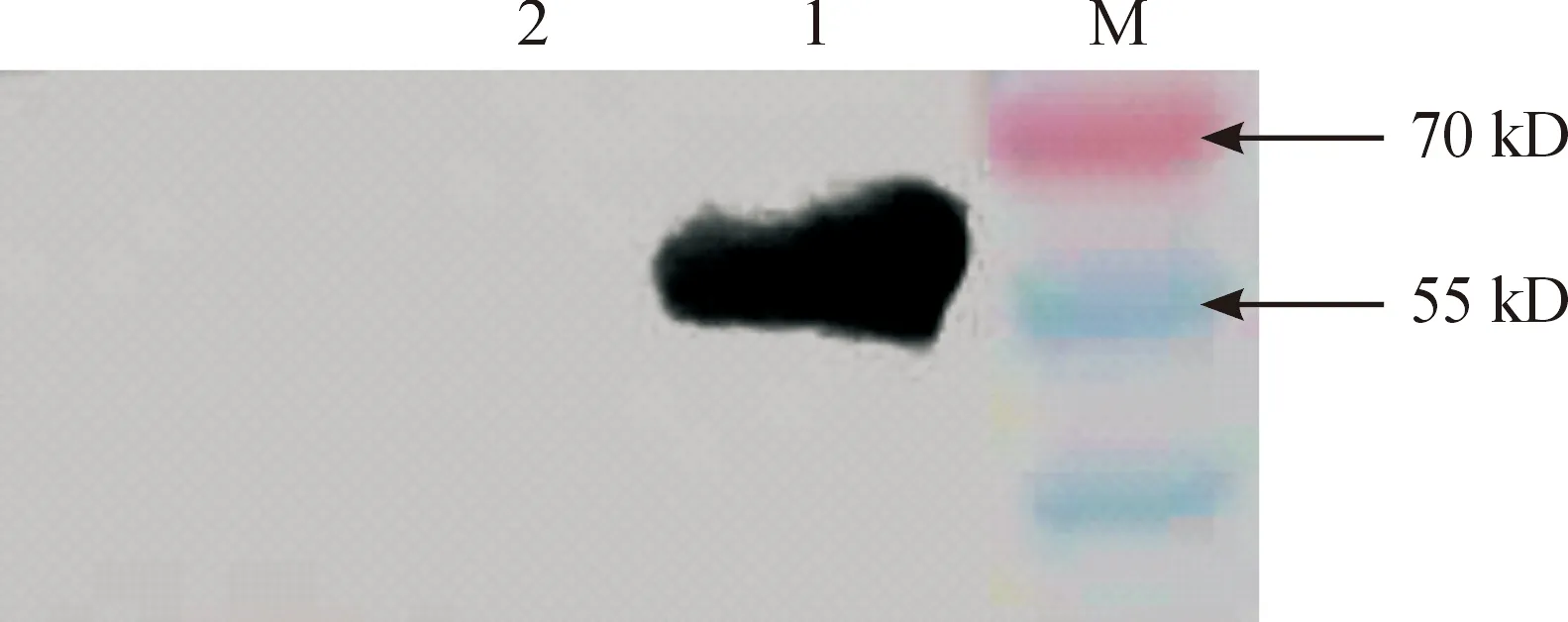
M:蛋白质分子质量标准;1:RV N 重组蛋白 2:pET28a(+)空载体转化的DE3菌液
4 讨论
狂犬病是一种致死性疾病,在中国2000多年前就有人被感染,一旦发病,死亡率几乎 100%[12-13]。在狂犬病的预防与控制中,狂犬病的检测尤为重要,目前在临床实践中对狂犬病的诊断方法主要是通过流行病学和临床症状,缺乏对狂犬病特异性诊断[14],而狂犬病N蛋白基因序列相对稳定,点突变少,常用作于病毒的分型与诊断,随着对N蛋白基因序列的进一步研究发现,在发现病毒菌株的来源和遗传联系以及致病力的变化方面有着重要意义[15]。
RV N是机体防止病毒感染的关键蛋白,它是一种T细胞(Th)调节抗原能诱导不同基因型RV 产生特异性保护,在开发新型狂犬病疫苗发挥着决定作用[16]。
本研究在RV N蛋白基因序列起始密码子N端与C端分别加入His-tag,并选择pET28a(+)作为表达载体进行RV N重组蛋白的表达,在筛选温度、IPTG浓度、时间这3个因素对RV核蛋白表达影响中,发现IPTG浓度 0.1 mmol/L,6 h,30 ℃时 RV 重组蛋白表达量最高。本研究前几次蛋白纯化中没能洗脱出目的蛋白,在后续数次实验中,添加了不同浓度的咪唑并延长了洗脱时间,发现在300 mM 咪唑浓度下洗脱出目的蛋白。在纯化中发现蛋白不易溶解且与镍柱结合难度高,不易洗脱,之后加入一定量脱氧胆酸钠、DTT、提高溶解液pH值至8.0,增加蛋白溶解时间来提高蛋白的可溶性,经过电泳发现溶解度增加。经SDS-PAGE发现,RV N 重组蛋白在菌体内形成包涵体,这可能是因为蛋白聚合酶的功能太强,蛋白没有时间折叠致使过多的蛋白质的非特异性结合[17]。其次,在大肠杆菌原核表达载体没有糖基化功能,导致中间体的大量积累和不溶性包涵体蛋白形成。本次研究成功制备出RV N蛋白,纯度浓度较高,具有良好的生物活性,为后续单克隆抗体以及疫苗的制备奠定了基础。
