贵州本土半野生番茄砧木介导ABA生物合成信号通路调控植株耐旱性的机理研究
2023-03-09韦建明张大龙李云洲
韦建明 黄 鑫 张大龙 李云洲 ,*
(1贵州大学农学院,贵州 贵阳 550025;2山东农业大学园艺科学与工程学院,山东 泰安 271018)
番茄(Solanum lycopersicumL.)是我国重要的蔬菜作物,具有很高的营养与经济价值[1]。随着全球气候变暖,干旱已成为限制番茄生产的重要因素[2]。培育抗旱番茄新品种是应对干旱胁迫的一种有效途径,但是常规育种耗时长,育种效率不高;转基因技术虽然可以快速提高番茄抗旱性,但是转基因农产品仍未被消费者广泛接纳;而嫁接技术可将砧木中抗逆基因传递至上部接穗中,提高作物产量与商品性,有效提高植株抗旱性[3]。
嫁接是一种简单、普遍、环保的技术。通过嫁接可以将两种不同性状的植物连接在一起,其中一种作为根系,称为砧木;另一种形成地上部分,称为接穗[4]。嫁接技术可用于不同的目标,例如提高植物对生物或非生物胁迫的抗性、增加农作物产量以及无性繁殖。野生植株抗性好,但产量低,而半野生番茄材料不仅携带野生材料中的抗性基因,而且产量优于普通材料,因此半野生材料或中间材料更受育种者喜爱[5]。先前已有研究表明,嫁接抗逆性砧木可以提高接穗植株的抗逆性[4,6]。
盐胁迫早期阶段会诱导番茄接穗的气孔关闭,从而导致蒸腾速率降低,水分流失减缓[7]。在瓜类砧木嫁接研究中发现,南瓜砧木能比嫁接黄瓜更敏锐地响应盐胁迫,诱导根部过氧化氢(hydrogen peroxide,H2O2)信号和脱落酸(abscisic acid,ABA)积累,导致气孔关闭,从而减少植物体内水分的损失[8]。同样,丝瓜砧木也可以增加嫁接黄瓜植株对ABA和土壤水分的敏感性,诱导气孔关闭,从而提高水分利用效率和干旱抗性[9]。
植物气孔的保卫细胞先天免疫系统通过细胞表面定位的模式识别受体(pattern-recognition receptors,PRR)感应微生物相关分子模式(microbe-associated molecular patterns,MAMP),然后激活植物体自身的模式触发免疫(pattern-triggered immunity,PTI)反应。PTI反应过程首先是Ca2+进入细胞质和细胞核,然后伴随活性氧(reactive oxygen species,ROS)的产生、脂质过氧化和膜损伤以及植物激素介导的信号传导,从而激活下游转录重编程和激素应答等免疫反应[10]。气孔运动受许多环境因素以及植物激素的调节[11],其中ABA 是植物应答干旱胁迫的主要激素,被认为可以调控气孔开闭来介导植物对土壤干旱的早期反应,从而防止水分蒸发[12-13]。近年来,ABA 信号转导的分子机制方面研究取得了重大进展[14]。ABA 合成通路中的关键酶是9-顺式-环氧类胡萝卜素双加氧酶(9-cisepoxycarotenoid dioxygenase,NCED),影响ABA的生物合成,最终影响植株抗旱性;在番茄中,9-顺式-环氧类胡萝卜素双加氧酶基因2(9-cis-epoxycarotenoid dioxygenase 2,NCED2)是调控番茄细胞中ABA 合成与代谢的关键基因[15-17];AbaminSG 是ABA 生物合成抑制剂,可以抑制NCED基因表达从而抑制ABA 的合成[18]。ABA 信号通路起始于受体PYR/PYL/RCAR 与共受体2C 型植物蛋白磷酸酶(protein phosphatase 2C,PP2C)的结合,从而解除PP2C 对其核心信号组分蔗糖非酵解型蛋白激酶(sucrose non-fermenting-1 protein kinase,SnRK2s)的抑制[19-20],自磷酸化活化后的SnRK2s可以磷酸化调节ABA 信号通路下游的转录因子,如脱落酸不敏感蛋白3(abscisic acid-insensitive 3,ABI3)、脱落酸不敏感蛋白4(abscisic acid-insensitive 4,ABI4)和脱落酸不敏感蛋白5(abscisic acid-insensitive 5,ABI5)等,以调控植物应答外界环境胁迫[19-21]。贵州大学植物病理教研室番茄抗病抗逆研究课题组前期研究发现干旱胁迫可以诱导贵州本土半野生番茄GZ-01 ABA 关键基因NCED2的高表达,然而关于GZ-01 的抗旱分子机制仍不清楚。
因此,本研究选择贵州本土半野生番茄GZ-01 作为砧木,红果番茄R作为接穗,研究贵州本土半野生番茄GZ-01砧木嫁接对植株干旱胁迫的影响。通过施用ABA 抑制剂AbaminSG,研究GZ-01 抗旱分子机制,以期为开发利用贵州本土半野生番茄资源奠定基础。
1 材料与方法
1.1 植物材料与生长环境
红果番茄R和贵州本土半野生番茄GZ-01来自贵州大学农学院植物病理教研室番茄抗病抗逆研究课题组。挑选饱满种子经温汤浸种后,在人工气候箱进行催芽,催芽温度为(28±2)℃,黑暗条件下催芽3 d 后露白,播种于育苗托盘(5.0 cm×5.0 cm×10 cm),放置在贵州大学农学院植物病理教研室人工气候室进行基质培养生长,生长条件(25±2)℃,光/暗比为16 h/8 h,待幼苗长至3~4片真叶时进行嫁接。
以GZ-01 作为砧木,R 作为接穗,嫁接苗标记为GZ-01/R,自嫁接作为对照R/R。黑暗放置24 h,并用透明的保鲜膜覆盖保湿,以便嫁接苗伤口愈合。每天上午8:00 和下午17:00 轻轻打开塑料保鲜膜,以降低相对湿度,并在嫁接7 d后转移至贵州大学农学院植物病理教研室人工培养室进行正常培养,培养条件:温度(25±1)℃,光/暗比16 h/8 h。每天给番茄植株浇200 mL Hoagland's,植株生长3~5片真叶期进行试验。
1.2 水分利用率测定
对嫁接和自嫁接番茄植株进行正常浇灌作为对照,而干旱胁迫为完全停水持续9 d。每天进行失水量测定。叶面积通过拍照使用Photoshop 2019 软件进行像素换算。水分利用率(water use efficiency,WUE)计算公式如下[22]:
1.3 ABA参与气孔灵敏度
取嫁接苗GZ-01/R 和对照自嫁接苗R/R 植物的完整叶子进行气孔测量。用镊子从叶片背面剥离完全膨胀的叶子表皮,置于载玻片上,用VHX-7000高景深显微镜[基恩士(中国)有限公司]观察气孔开闭状态,试验进行3次重复,每次10个叶片。
1.4 ABA抑制剂AbamineSG的施用
将盆中二月苗龄的GZ-01/R 和R/R 植物浇水至50%基质含水量(substrate water content,SWC),然后完全停止浇水进行干旱处理,直到第9 天。在干旱处理开始后的第2 和第5 天,分别用50 μmol·L-1ABA 抑制剂AbamineSG(每株5 mL)喷洒接穗叶片,用5 μmol·L-1AbamineSG(每株 50 mL)处理植株根部,用10 μmol·L-1ABA(每株5 mL)处理植株根部,等量的水处理作为对照。
1.5 离体叶片失水率测定
每个处理取完全展开的成熟真叶12 片,取样叶片均匀一致,迅速称量重量,之后每隔1 h称量1次,直到9 h。称量环境在温度受控的生长室中,温度恒定为25 ℃,湿度为60%。每次叶片的水分损失计算为初始鲜重的百分比,每个处理3次技术重复,4个生物学重复。
1.6 H2O2、O2.-化学染色和REL检测
叶片中过氧化氢(H2O2)和超氧阴离子(O2.-)的积累分别使用3,3'-二氨基联苯胺(diaminobezidin,DAB)和硝基蓝四唑(nitroblue tetrazolium,NBT)染色进行,定位染色后再进行脱色、脱水,上述具体方法参考文献[23],最后将脱色后的叶片进行拍照。叶片相对电解质渗漏率(relative electric conductivity,REL)通过外渗电导法测量:使用打孔器将叶盘放入管中,每管放入10 个,装满20 mL蒸馏水后置于真空干燥器中20 min。静置1 h后,测量蒸馏水和初始叶片溶液的电解质渗漏率,分别记为S0和S1。然后,将试管置于100 ℃沸水浴中10 min。冷却后,测定叶片溶液的电解质渗漏率S2。REL 计算公式如下:
还真是报应,我在前一秒对那个女孩表示了鄙视之后,下一秒就看到那个和她眉目传情的家伙就是,我的男朋友,秦明。不过已经无所谓,因为下一刻,他就会被我称作,前男友。我在最后一刻还是犯了所有小女人都犯的矫情的毛病——我要和他在我们最初见面的地方说分手。
1.7 叶片体气交换
使用LI-6400 便携式光合作用系统(美国LI-COR公司)测定完全膨胀叶片中的气体交换,包括净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)和气孔导度(stomatal conductance,Gs)。在1 000 μmol·m-2·s-1的光合光子通量密度(photosynthetic photon flux density,PPFD)水平、25 ℃、相对湿度85%和380 μmol·mol-1的环境CO2浓度下测量气体交换。
1.8 ABA含量测定
使用手术刀在接穗和砧木之间的交界处上方5 cm处切割茎干,将砧木暴露于0.5 MPa 的压力室中,收集木质部汁液分泌物。丢弃前两滴汁液以避免切割表面时对其他部位造成污染。使用1.5 mL离心管收集汁液后,放入液氮速冻,并保存于-80 ℃备用。ABA 的提取和测定按照Xia等[24]的方法。
1.9 RNA提取和实时荧光定量(quantitative real-time PCR, qRT-PCR)检测
使用RNA提取试剂盒(R401-01,南京诺维赞生物科技有限公司),从嫁接的番茄叶中提取总RNA。采用HiScript ΙΙ 1st Strand cDNA Synthesis Kit 反转录试剂盒(R211-01,南京诺维赞生物科技有限公司)反转录合成cDNA。利用CFX96TMReal-time System 荧光定量PCR 仪(美国Bio-Rad 公司)进行qRT-PCR 反应。以β-actin(登录号:AB695290.1)作为内参基因,对不同番茄植株的基因表达水平进行归一化处理。检测到的所有基因特异性引物如表1 所示。qRT-PCR 程序:95 ℃预变性2 min;94℃变性30 s,60 ℃退火15 s,72 ℃延伸15 s,40 个循环。每个样品中每个基因的循环阈值(cycles threshold,CT)通过β-actin标准化并根据2-ΔΔCT法计算[25]。

表1 qRT-PCR分析所用的引物Table 1 Primers used in qRT-PCR analysis
1.10 统计分析
利用Excel 2019 进行数据整理,SPSS 24.0 软件进行数据分析,GraphPad Prism 8 进行作图,数据表示平均值±标准误差,差异显著性采用Duncan’s 新复极差法比较(P<0.05)。
2 结果与分析
2.1 干旱胁迫对GZ-01 砧木嫁接番茄植株叶片损伤的影响
为了检测植株对干旱的耐受性是否被砧木或接穗改变,在半野生番茄(GZ-01)和红果番茄(R)幼苗之间进行嫁接。在干旱胁迫下,R/R DAB 和NBT 染色颜色更深,暗示其H2O2和O2.-积累更多,而GZ-01/R DAB 和NBT 染色颜色相对较浅,暗示GZ-01/R 抗氧化能力更强(图1-A);此外,在干旱胁迫下,与R/R 植株叶片相比,GZ-01/R叶片的REL减少,叶面积和净干重显著增加(图1-B~D),然而在正常灌溉条件下,GZ-01/R和R/R不同处理植物叶片的REL、净干重和叶面积无显著差异(图1-B~D)。上述结果表明,番茄对干旱的耐受性主要依赖于砧木GZ-01,而GZ-01 具有增强耐旱性的潜力。
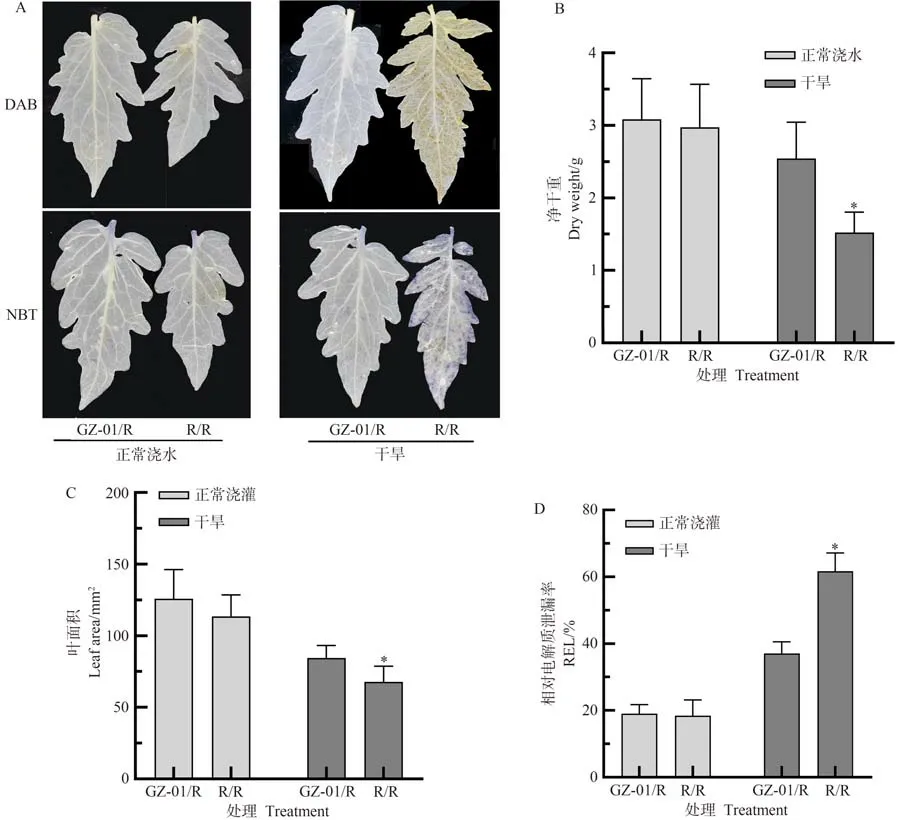
图1 GZ-01砧木和红果番茄对干旱胁迫的响应Fig.1 Response of GZ-01 rootstock and red fruit tomato to drought stress
在干旱胁迫第6和第9天,GZ-01/R 接穗植株的净光合速率(Pn)高于对照植株R/R,而气孔导度(Gs)和蒸腾速率(Tr)低于对照R/R(图2-A、C、E)。在干旱处理第9 天,GZ-01/R 和R/R 番茄的Pn 分别比正常浇水植物的Pn低89.7%和57.3%(图2-A)。对植株失水率进行分析,发现GZ-01/R 植株在干旱处理后第2~第9 天的失水率低于对照植株R/R(图2-B)。此外,干旱处理第9天,GZ-01/R的综合水分利用率同样显著高于对照植株R/R(约92.7%)。上述结果表明,GZ-01/R嫁接植株对干旱胁迫的耐受性更强,水分利用效率更高。

图2 GZ-01砧木植株光合作用和水分利用效率Fig.2 Photosynthesis and water use efficiency of GZ-01 rootstock
2.2 干旱胁迫对GZ-01 砧木嫁接番茄植株叶片气孔开闭敏感性的影响
气孔开闭影响植株的失水率和蒸腾作用。为了明确砧木嫁接对植株气孔的影响,首先比较了嫁接植株GZ-01 与自嫁接植株R/R 在正常浇水条件下气孔开闭的情况(图3-A)。结果显示,GZ-01/R与R/R植株叶片在正常浇水条件下气孔孔径无显著差异(图3-B)。随着干旱胁迫时间的延长,GZ-01/R与R/R植株叶片气孔张开度差异逐步明显。在停止浇水第3天,GZ-01/R植株叶片气孔处于开放、关闭、半开闭状态的气孔比例并无明显差异(图3-D),但与正常浇水GZ-01/R和R/R植株相比,关闭、半开闭状态的气孔比例增加,开放气孔比例下降(图3-C、D)。在停止浇水第6和第9天,GZ-01/R与R/R植株叶片气孔处于关闭、半开闭状的比例高于正常浇水植株(图3-C、D),但是GZ-01/R植株叶片气孔处于闭合状态比例高于R/R(图3-C、D),暗示GZ-01/R嫁接植株在干旱胁迫下调控气孔开闭的敏感性更强。
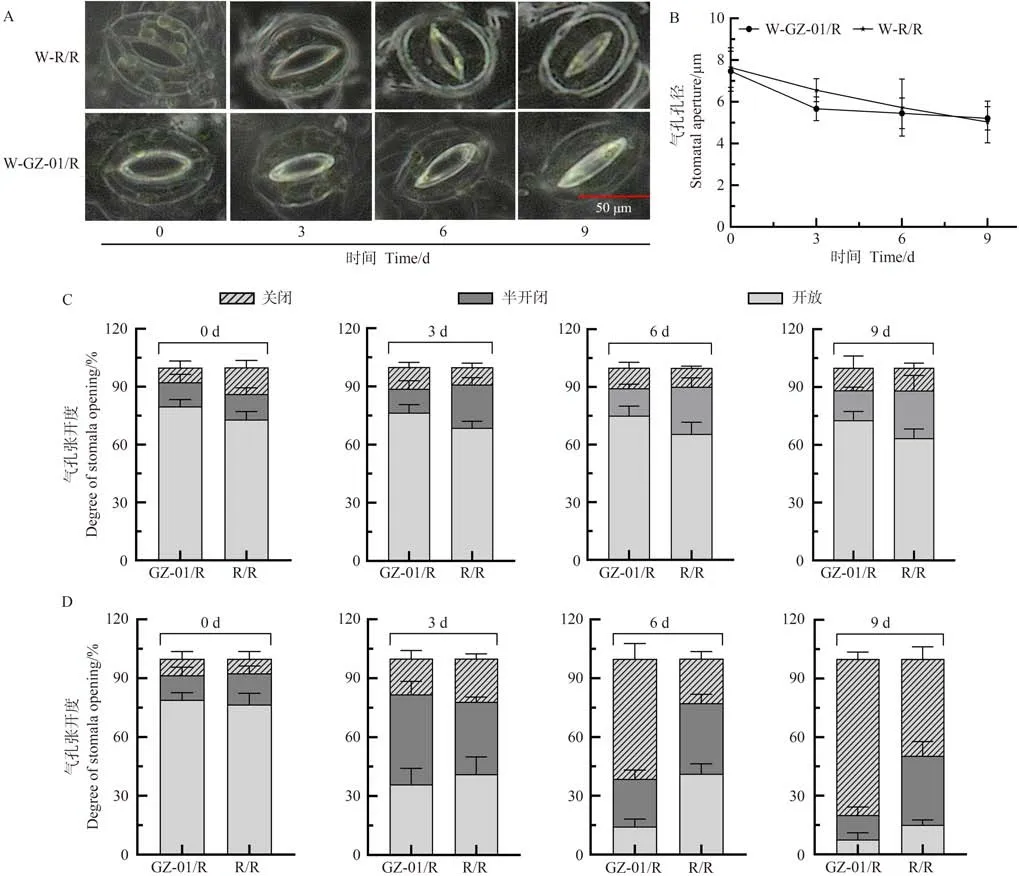
图3 干旱胁迫影响砧木接穗叶片气孔变化Fig.3 Drought stress affects the stomatal changes of scion leaves of double rootstocks
2.3 干旱胁迫对GZ-01 砧木嫁接番茄植株叶、根和木质部汁液中ABA 相关基因表达和ABA 含量积累的影响
ABA 是调控植株抗旱和气孔开闭的关键激素。为了明确干旱胁迫下嫁接植株GZ-01/R中气孔敏感性变化的原因,本研究首先分析不同处理植株叶片中ABA 合成相关基因9-顺式环氧类胡萝卜素双加氧酶2(NCED2)基因的表达情况,然后分析了干旱胁迫下,不同处理植株根、韧皮部和叶片中ABA 含量的变化。结果显示,从干旱胁迫的第3天开始,GZ-01/R和R/R番茄株叶片NCED2基因的表达水平逐渐增加(图4-A)。干旱胁迫第6、第9 天,NCED2在GZ-01/R 番茄植株叶片中的相对表达量显著高于对照植株R/R;在正常浇水条件下,不同处理植株叶片、根系和韧皮部中ABA含量并无显著差异(图4-B~D),但是在干旱胁迫后,嫁接番茄GZ-01/R 叶片、根和韧皮部中的ABA 含量逐渐增加(图4-B~D)。如图4-B~D 所示,干旱胁迫第3 天,GZ-01/R 和R/R 植株叶片、根系和韧皮部中ABA含量有所增加,但与对照植株相比并不显著。随着干旱胁迫持续至第3、6、9 天,GZ-01/R 和R/R 植株叶片ABA 含量逐步增加,显著高于正常浇水条件下的植株W-GZ-01/R 和W-R/R(图4-B)。但是,在干旱胁迫第6 天,嫁接植株GZ-01/R 根部ABA 含量突然降低(图4-C)。从干旱胁迫第3 天后,R/R 和GZ-01/R 韧皮部中ABA 含量显著高于植株W-GZ-01/R 和W-R/R(图4-D)。
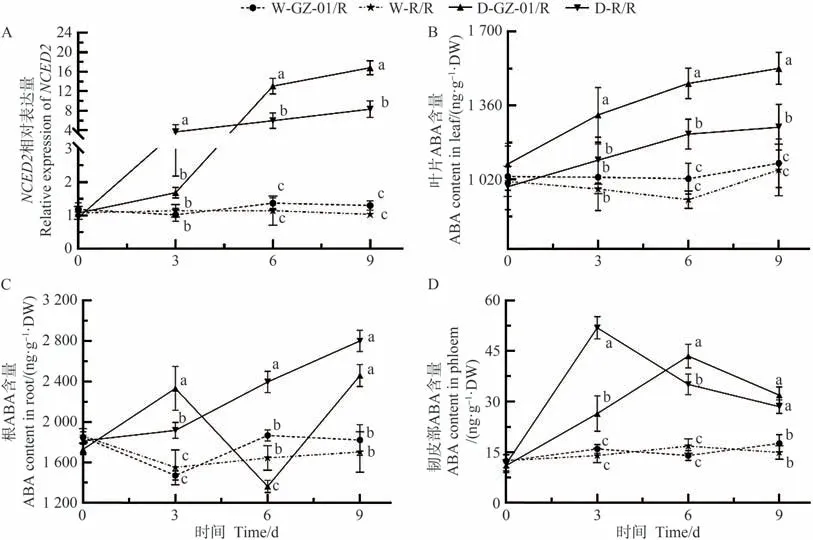
图4 干旱胁迫下砧木对叶片ABA生物合成基因表达及叶片、根系和木质部液中ABA含量的影响Fig.4 Effects of rootstocks on gene expression of ABA biosynthesis and ABA content in leaves,roots and xylem sap under drought stress
2.4 ABA抑制剂施用对GZ-01/R砧木嫁接番茄植株耐旱性的影响
本研究还统计了干旱胁迫后,不同处理植株干物质积累、叶面积、WUE、REL等指标。结果显示,干旱胁迫下,GZ-01/R叶片REL显著低于对植株R/R(图5-I),但是ABA抑制剂在植株根部施用后,GZ-01/R叶片REL与对照植株R/R 的差异不显著(图5-E);当叶片喷施ABA 抑制剂,GZ-01/R 叶片REL 与对照植株R/R 的差异表现显著(图5-I)。干旱胁迫后,GZ-01/R 植株叶面积显著高于对照植植株R/R,而正常浇水情况下,GZ-01/R与R/R叶片面积并无显著差异,但当根部施用ABA抑制剂后,正常浇水处理下GZ-01/R与R/R 叶片面积仍无显著差异,而干旱处理下的GZ-01/R与R/R叶片面积差异显著(图5-J)。
值得注意的是,这些影响在GZ-01/R 接穗和根部施用AbaminSG 的植株中更为明显。然而,在干旱胁迫下,用AbaminSG 处理根部和叶面不影响嫁接中植物的吸水率(用AbaminSG 灌溉的GZ-01/R 植株除外)(图5-K)。同时,根系施用ABA 显著改善了植物生长和耐旱性,这与Tr、Gs 和REL 降低以及干物质积累和WUE增加有关。
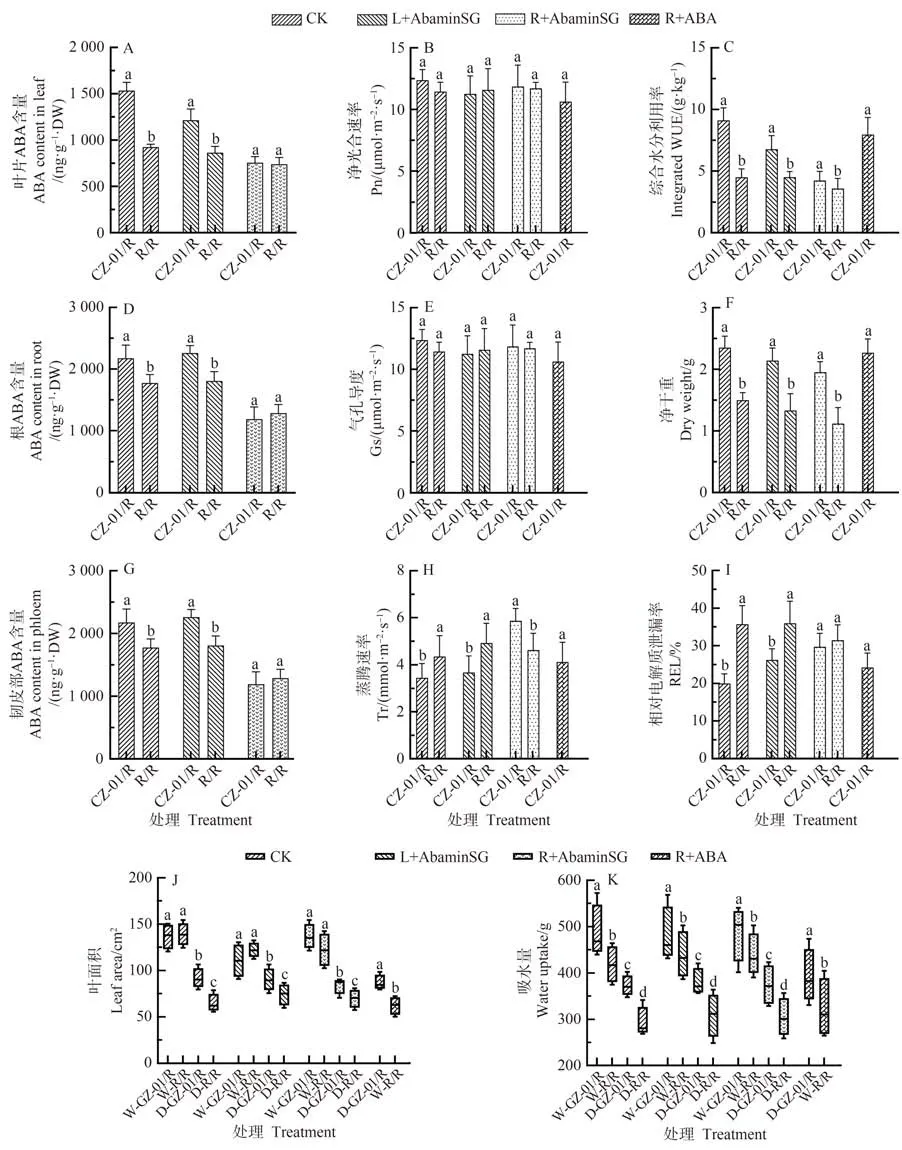
图5 ABA抑制剂AbamineSG 对嫁接植株叶片、抗旱性、水分利用效率以及根部ABA的累积的影响Fig.5 The ABA biosynthesis inhibitor AbamineSG affects the accumulation of ABA in leaves and roots,and the changes in drought tolerance and water use efficiency
2.5 GZ-01/R砧木嫁接番茄对ABA敏感性的影响
为了测试砧木诱导的气孔运动是否与不同嫁接植株对ABA 的敏感性有关,比较R/R 和GZ-01/R 植物离体叶片的水分流失,结果表明,干旱胁迫1 d后,自嫁接R/R的叶片与GZ-01/R接穗叶片的水分缺失率存在显著差异(图6-A)。同时,浓度低至10 μmol·L-1的外源ABA可以诱导GZ-01/R 植株叶片气孔关闭,而诱导对照植株R/R叶片气孔关闭的浓度为50 μmol·L-1(图6-B、D)。另外,GZ-01/R 叶片中的气孔在5 min 内关闭以响应50 μmol·L-1ABA 处理,而在R/R 叶片中诱导气孔关闭的时间均超过5 min(图6-C、E)。上述结果表明,GZ-01/R植株对ABA的敏感性高于对照R/R植株。
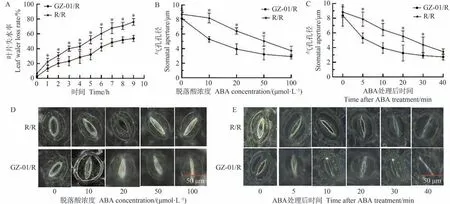
图6 砧木对叶片水分流失和气孔孔径对ABA的敏感性影响Fig.6 Sensitivity of rootstocks to leaf water loss and stomatal diameter to ABA
2.6 耐旱指数和ABA信号级联对不同干旱水平的响应
为了阐明GZ-01 砧木对干旱胁迫的耐旱指数,将嫁接植株暴露于不同的SWC。随着GZ-01/R和R/R番茄植株的SWC 降低,植物生长受到抑制,并影响植株的生长发育(图7-A、B)。然而,与对照R/R 相比,GZ-01/R 在30%、20%和10% SWC 条件下植株生长未受影响,并维持较高的净光合速率(Pn),而R/R 在30%、20%和10% SWC 条件下,植物的生长被严重抑制,尤其在10% SWC 时最为严重(图7-A~C);在50%、40%、30%和20% SWC条件下,GZ-01/R植株的蒸腾速率(Tr)、气孔导度(Gs)和气孔孔径低于R/R 植株(图7-D~F)。表明GZ-01 砧木能够增强土壤中的水分利用率,间接诱导气孔运动的敏感性,从而增强植株的耐旱性。
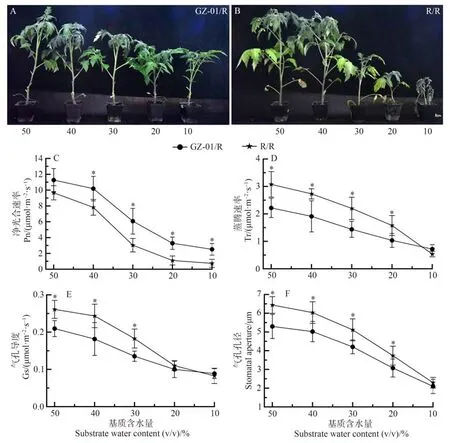
图7 不同生长基质含水量砧木对接穗耐旱性的影响Fig.7 Effects of rootstocks with different growth substrate water contents on the drought tolerance of scions
为了进一步确定砧木诱导的ABA 信号在嫁接植物中响应不同SWC 的变化,在嫁接番茄植物暴露于缺水后分析了6 个参与ABA 和/或干旱胁迫响应基因的表达(图8)。相对基因的表达随着GZ-01/R 和R/R 植株中SWC 的降低而增加,而在GZ-01/R 接穗叶片中显著增加。然而,与自嫁接R/R 植株相比,GZ-01/R 接穗叶片ABA 受体基因(PYL1、PYL2)和ABA 转运蛋白基因ABCG22在干旱胁迫过程中被诱导高表达。与R/R植物相比,在10% SWC 条件下,两种ABA 信号相关基因SnRK2 在GZ-01/R 接穗中被诱导。在轻度缺水条件下(40%和30% SWC),GZ-01/R 植物中典型ABA 依赖基因RAB18的相对表达显著高于R/R 植物中的相对表达,但在极度缺水(20%、10%)条件下,R/R 植株RAB18基因的相对表达量高于GZ-01/R 植株,且在10% SWC 条件下存在显著差异。相反,除了10%和20% SWC 条件下的R/R 植株外,ABA 信号的负调节因子基因PP2C1表达随着干旱的持续而降低,并且在GZ-01/R接穗中比R/R植株低。上述结果表明,GZ-01砧木能够通过调节ABA 依赖性信号级联在干旱胁迫下中发挥积极作用。
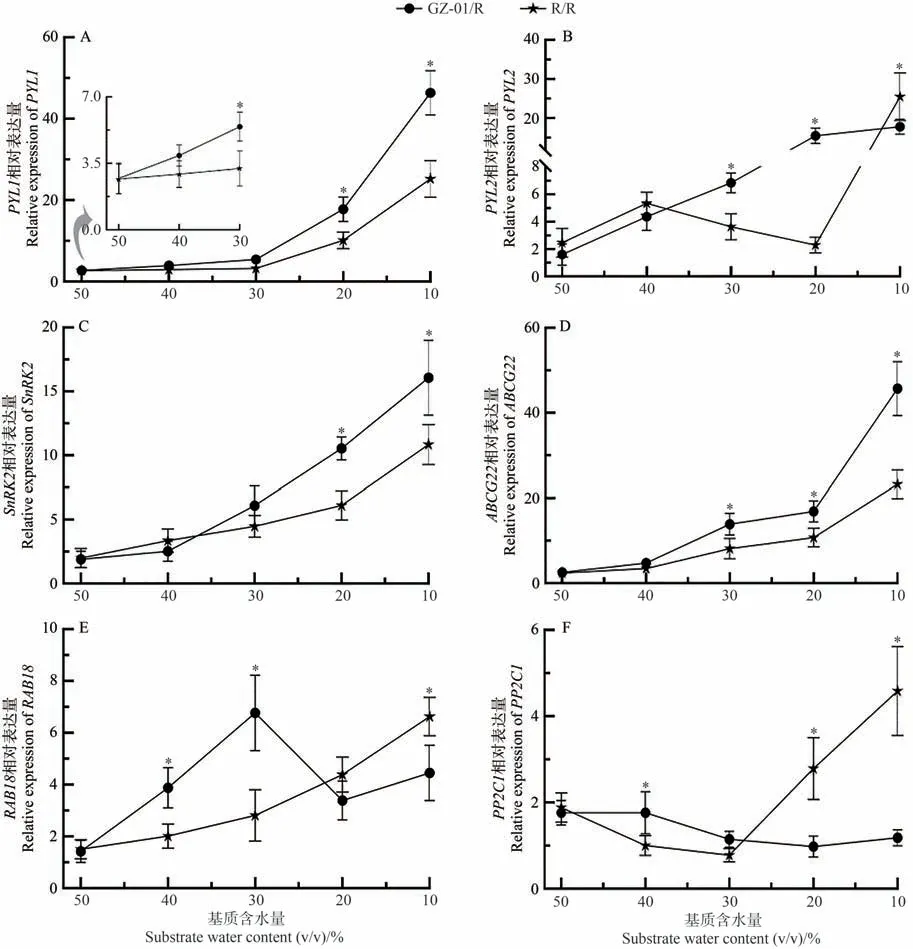
图8 不同干旱胁迫水平下砧木对ABA信号基因相对表达量的影响Fig.8 Effects of rootstocks on the relative expression of ABA signaling genes under different drought stress levels
3 讨论
作物野生资源普遍抗病抗逆性较强,因此利用野生资源砧木提高农作物抗病抗逆性是一种有效措施与方法。本试验选用贵州本土半野生番茄GZ-01作为砧木进行嫁接,发现该方法可以提高植株抗旱性。为了明确GZ-01 提高植株抗旱性的分子机制,本试验比较了不同嫁接植株在干旱胁迫下的叶片抗氧化能力、气孔开闭比例、光合速率和蒸腾速率以及ABA 合成相关基因的表达和ABA 含量。结果显示,与对照植株R/R相比,干旱胁迫下GZ-01/R 嫁接植株气孔的开闭更灵敏,ABA 含量更高。Niu 等[26]以南瓜作为砧木,黄瓜作为接穗,发现盐胁迫可以增加ABA 的敏感性,从而促进早期气孔的关闭。另外,Zhang 等[27]报道ABA 可以通过调控植株叶片气孔开闭来抵御生物和非生物胁迫。结合上述结果,推测GZ-01 砧木可能通过调控ABA 的敏感性,从而调控气孔开闭,影响蒸腾作用,提高水分利用率,提高植株的抗旱性。
本试验还发现,干旱胁迫下嫁接植株GZ-01/R 的净光合速率高于自嫁接植株R/R,当施用ABA 抑制剂后,嫁接植株GZ-01/R 和自嫁接植株R/R 的净光合速率并无显著差异,表明嫁接植株可能通过调控ABA 合成,从而影响植株的净光合速率。影响光合速率的因素有很多,尤其蒸腾速率决定气孔CO2的交换速率,进而影响叶片光合速率[28]。而根压和蒸腾拉力共同影响蒸腾速率[29]。因此推测,GZ-01 可能通过嫁接方式影响植株的根压和蒸腾拉力,从而影响植株叶片的CO2同化率和光合作用。
根部是合成ABA 的场所[30]。本试验测定干旱下嫁接植株GZ-01/R 和自嫁接植株R/R 叶片、根部的ABA 含量,发现随着干旱胁迫的进行,植株3个不同部位的ABA逐渐增加,但是在干旱胁迫第6天,根部ABA含量出现异常。推测在干旱早期,随着ABA 含量逐渐升高,植株对根部出现过高ABA 含量而表现出反馈调节,具体原因仍需进一步研究。
植物在逆境环境下,叶片会累积过氧化物。本试验检测了干旱胁迫下,嫁接植株GZ-01/R 和自嫁接植株R/R 叶片NBT 和DAB 染色深浅反应出的H2O2和O2.-含量,结果显示嫁接植株GZ-01/R 在干旱胁迫下抗氧化能力更强,累积干物质更多(图1-A)。前人研究表明嫁接抗逆砧木能够提高植株耐旱性,可能与植株活性氧清除能力有关[31-32]。本研究同样发现,干旱胁迫下的嫁接植株GZ-01/R 叶片NBT 和DAB 染色更浅(图1),间接反应其H2O2和O2.-积累较少,抗氧化能力更强。
前人研究表明ABA 可以调节植物中的抗氧化酶积极参与调控植株抗氧化反应[33-37],这与本试验研究结果一致,即GZ-01/R 叶片中ABA 积累更多,ABA 合成基因NCED2表达更高。推测ABA 信号通路参与调控植物抗旱性,ABA 可能在减少细胞内ROS 积累以及增加抗氧化酶活性方面发挥部分功能。
先前报道在砧木和接穗之间可能存在miRNA的传递现象[38]。Bhogale等[39]通过马铃薯(Solanum tuberosum)嫁接试验表明,miR156是调节马铃薯发育的韧皮部移动信号物质之一,影响马铃薯的植物结构和块茎形成。Khaldun 等[40]通过枸杞(Lycium chinenseMill.)为砧木与番茄进行远缘嫁接,发现远缘嫁接植物砧木与接穗之间存在miRNA 移动,从而影响植株抗病抗逆性。表明嫁接技术不仅可以改变植株抗病抗逆性,而且可以改变嫁接接穗的生长状态、果实大小、形状、重量,以及某些营养物质含量。Li等[41]报道Small RNA 在嫁接组织细胞之间存在局部移动,因此推测本试验所用GZ-01 砧木材料能够增强植株抗旱性,可能是通过介导miRNA或 small RNA通过根、茎、叶长距离运输至接穗组织细胞,参与调控接穗组织抗病抗逆性,但具体证据仍需进一步研究。
气孔的开闭程度对蒸腾作用、光合作用具有重要的调控作用,关系到作物的水分消耗和产量的形成[42]。Lawson等[43]认为,气孔导度的降低通常伴随着叶片中净光合速率的降低,从而导致WUE 降低或增加,这种变化主要取决于干旱胁迫的严重程度和不同物种间的差异。本研究中,GZ-01/R 番茄接穗在干旱胁迫下始终表现出较低的气孔导度,但是净光合速率和综合WUE较高(图7)。因此气孔导度的适度降低可以减少水分流失,不会影响用于碳同化的CO2供应,从而导致植物中综合WUE更高。
4 结论
贵州本土半野生番茄GZ-01砧木能够提高嫁接植株ABA 合成基因表达和ABA 含量,影响气孔开闭,调节叶片水分蒸腾速率和净光合速率,最终影响植株抗旱性。
